Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mesoscopic Fluoreszenz-Tomographie für In-vivo Imaging der Entwicklungsländer Drosophila
In diesem Artikel
Zusammenfassung
Mesoscopic Fluoreszenz-Tomographie arbeitet darüber hinaus das Eindringen Grenzen der Gewebe-Schnitte Fluoreszenzmikroskopie. Die Technik basiert auf Multi-Projektion Beleuchtung und ein Photon Transport Beschreibung basiert. Wir zeigen in-vivo Ganzkörper-3D-Visualisierung der Morphogenese von GFP-exprimierenden Flügel Imaginalscheiben in Drosophila melanogaster.
Zusammenfassung
Visualisierung der Entwicklung Organbildung sowie Progression und Behandlung von Krankheiten oft in hohem Maße von der Fähigkeit, optisch verhören molekulare und funktionelle Veränderungen in intakten lebenden Organismen. Die meisten existierenden Verfahren der optischen Bildgebung sind unzureichend für die Bildgebung bei Dimensionen, die zwischen dem Eindringen Grenzen der modernen Lichtmikroskopie (0,5-1mm) und die Verbreitung auferlegten Grenzen der optischen Makroskopie liegen (> 1cm) [1]. So viele wichtige Modellorganismen, zB Insekten-, Tier-Embryonen oder Kleintier Extremitäten, bleiben unzugänglich für in-vivo optische Bildgebung.
Zwar gibt es zunehmendes Interesse an der Entwicklung von Nanometer-Auflösung optische bildgebende Verfahren gibt es nicht viele erfolgreiche Anstrengungen bei der Verbesserung der bildgebenden Eindringtiefe worden. Die Fähigkeit zur in-vivo-Bildgebung über Mikroskopie Grenzen durchzuführen, ist in der Tat mit den Schwierigkeiten mit Photonenstreuung im Gewebe verbunden erfüllt. Die jüngsten Bemühungen zur Bild gesamten Embryos zum Beispiel [2,3] erfordern spezielle chemische Behandlung der Probe, um sie von Streuung klar, ein Verfahren, das sie sich nur für Post-mortem-Bildgebung ermöglicht. Diese Methoden jedoch Beweise, dass für die Bildgebung größere Exemplare als die, die in der Regel durch Zwei-Photonen-oder konfokalen Mikroskopie, vor allem in der Entwicklungsbiologie und in der Wirkstoffforschung erlaubt.
Wir haben einen neuen optischen Bildgebungsverfahren namens Mesoscopic Fluoreszenz-Tomographie entwickelt [4], die geeignet für non-invasive In-vivo-Bildgebung bei Abmessungen von 1mm-5mm. Die Methode Austausch Auflösung für Eindringtiefe, sondern bietet eine beispiellose tomographischen Imaging-Leistung und es wurde entwickelt, um die Zeit als neue Dimension in der Entwicklungsbiologie Beobachtungen (und möglicherweise auch in anderen Bereichen der biologischen Forschung) hinzufügen, indem Sie die Vermittlung der Fähigkeit zur Abbildung der Entwicklung der Fluoreszenz- getaggt Reaktionen im Laufe der Zeit. Als solche kann sie beschleunigen Studien der morphologischen oder funktionellen Abhängigkeiten von Gen-Mutationen oder äußere Reize und können wichtiger ist, fangen die vollständigen Überblick über die Entwicklung oder die Gewebe-Funktion, indem sie Längs-Zeitraffer-Visualisierung der gleichen, sich entwickelnden Organismus.
Die Technik nutzt eine modifizierte Labormikroskop und Multi-Projektion Beleuchtung, Daten mit 360-Grad-Projektionen zu sammeln. Es gilt das Fermi Vereinfachung Fokker-Plank-Lösung des Photons Transport Gleichung, mit der geometrischen Optik Prinzipien kombiniert, um eine realistische Inversionsschema für mesoskopischen Bereich zu bauen. Dies ermöglicht in-vivo Ganzkörper-Visualisierung von nicht-transparenten dreidimensionale Strukturen in Proben bis zu einigen Millimetern Größe.
Wir haben die in-vivo-Leistung der Technik durch bildgebende dreidimensionale Strukturen gezeigt, die Entwicklung Drosophila Gewebe in-vivo und nach der Morphogenese der Flügel in der undurchsichtigen Drosophila Puppen in Echtzeit über sechs Stunden hintereinander.
Protokoll
Die Drosophila melanogaster Aktien in diesem Experiment verwendet, sind folgende:
- Elav-Gal4 (FBti0002575)
- ap-Gal4md544 (FBal0051787)
- UAS-srcEGFP (FBti0013990)
- w1118 (FBal0018186)
Für alle Versuche wurde die UAS-Gal4-System zu überexprimieren GFP in das Gewebe von Interesse (dh der Speicheldrüsen oder der Flügel-Discs) verwendet. Genauer gesagt wurden weibliche Fliegen transgenen mit der entsprechenden Gal4 zu UAS-EGFP transgenen Kameraden gekreuzt. Die Kreuze wurden bei 25 ° C in einem befeuchteten Inkubator aufgezogen. Wenn Puppen bevölkern die Fläschchen (ca. 5-6 Tage nach Beginn des Kreuzes) zu starten, wurden sie für GFP-Fluoreszenz auf die weiße prepupal Bühne (0-1 Stunden nach Puparium Bildung) ausgewählt und gesammelt für Tomographie.
- Richten Sie geeignete Kreuzungen und hinten bei 25 ° C
- 5-6 Tage nach der Einweihung des Kreuzes, wählen fluoreszierenden Nachkommen für die Bildgebung. Verwenden Sie einen feuchten Pinsel für die schonende Entfernung der weißen prepupae von den Seiten des Fläschchens.
- Put prepupae in einem Tropfen Wasser oder PBS in eine Petrischale Speisereste und der Leim, der das Puppenstadium Cover und macht die Probe autofluoreszierenden entfernen. Reinigen Sie mit einem Pinsel. Wenn die Alterung der Puppen ist notwendig, statt weiß prepupae in einer Petrischale mit einem feuchten Papiertuch (einer feuchten Kammer) oder an den Seiten eine saubere Flasche mit fliegen Lebensmittel ausgewählt. Dadurch wird sichergestellt, dass genügend Feuchtigkeit, um die ordnungsgemäße Entwicklung des Tieres zu ermöglichen.
Drosophila Montage
- Kleben Sie den unteren Teil der Puppenhülle in eine Glaskapillare (800 Mikrometer Durchmesser), so dass die Fliege anterior / posterior Achse parallel zur Röhre.
- Fix die Kapillare vertikal auf einem Rotations-Bühne.
- Passen Sie die Kippachse des Rotations-Bühne, um für die Drehachse parallel zu der Pixel-Spalten der bildgebenden CCD.
Bestimmung Vorwärts-Modell
- Fix eine Puppe in eine Kapillare aus Glas und Montage wie zuvor beschrieben
- Füllen Sie eine Silica-Kapillare (100 Mikron, OD) mit einem fluoreszierenden Farbstoff (Cy5.5)
- Legen Sie die Kapillare im Inneren der Puppe bei 45 Grad in Bezug auf den vorderen / hinteren Achse
- Illuminate die Puppe mit einer Anregung Laserstrahl mit geringer numerischer Apertur Linse. Sammeln Fluoreszenz Transilluminationsbilder über 360 Grad drehbare die Puppe um seine Hochachse.
- Fit der experimentellen Daten mit einem geeigneten Vorwärtsmodell
Imaging Speicheldrüsen
- Montieren Sie eine Puppe, die GFP in den Speicheldrüsen, wie zuvor beschrieben
- Illuminate mit einem Anregungsstrahl und sammeln sich in Durchleuchtung der GFP-Fluoreszenz-Signal über 360 Grad drehbare die Puppe um seine Hochachse.
- Rekonstruieren Sie die erfassten Daten unter Verwendung der Vorwärtsmodell
Time-Lapse Imaging
- Montieren Sie einen weißen Vorpuppe, die GFP in den Flügel Imaginalscheiben
- Halten Sie die Imaging-Umgebung feucht und bei Raumtemperatur, um eine Dehydratation der Puppe zu vermeiden.
- Legen Sie einen Auslöser, um kontinuierliche Beleuchtung zu vermeiden
- Illuminate mit einem Anregungsstrahl und sammeln sich in Durchleuchtung der GFP-Fluoreszenz-Signal über 360 Grad drehbare die Puppe um seine Hochachse.
- Rekonstruieren Sie die erfassten Daten unter Verwendung der nach vorne Modell.
Histologie
- Dissect Speicheldrüsen CNS / Auge-Discs in 1x PBS.
- Fix Gewebe in 4% Formaldehyd, 1x PEM (100mm Rohre, 1 mM EGTA, 1 mM MgCl 2) für 20min bei Raumtemperatur.
- Entfernen Befestigung und montieren in Vectashield mit DAPI (Vector)
- Bild mit einem Fluoreszenzmikroskop.
Time-Lapse Histologie
- Sammeln Sie weiß prepupae und Bühne sie in einer feuchten Kammer.
- Sammeln Puppen in verschiedenen Entwicklungsstadien
- Prick das Puppenstadium Fall zweimal (0 Std. Nach Puparium Formation) mit einer feinen Nadel (Insekten Stift 000, FST) vor der Fixierung.
- Fix Puppen in 8% Formaldehyd, 1x PEM für 6-8 Stunden bei Raumtemperatur unter leichtem Schütteln.
- Nach dem Entfernen der Fixierung und Spülen mit 1x PBS, schneiden Sie die feste Puppe mit einer scharfen Klinge in zwei Teile senkrecht zur A / P-Achse;
- Tauchen Sie die beiden Stücke in Vectashield mit DAPI (Vector) und mounten auf Deckglas Objektträger (Lab-Tek) für die Bildgebung.
- Erwerben Sie Bilder mit einem Fluoreszenz-konfokalen Mikroskop.
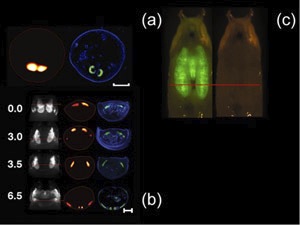
Abbildung 1. Bitte klicken Sie hier , um al sehenarger Version von Abbildung 1.
Diskussion
In-vivo-Rekonstruktionen der Puppenhülle und die GFP-exprimierenden Speicheldrüsen der D. melanogaster Vorpuppe (Scale bar, 500 Mikron) mit den entsprechenden Histologie (blau, DAPI-Färbung, grün, GFP-Fluoreszenz) ist in Abb. 1 (a) gezeigt. Zeitraffer-Serie Abbildung von D. melanogaster Flügel Imaginalscheiben ist in Abb. 1 (b) gezeigt. Die Bilder sind aus einem einzigen lebenden Exemplars erworben, an vier verschiedenen Zeitpunkten (0,3.0, 3,5 und 6,5 Stunden). In der ersten Spalte einer Projekti...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
C. Vinegoni dankt für die Unterstützung von National Institutes of Health (NIH) gewähren 1-RO1-EB006432.
Referenzen
- Ntziachristos, V. Looking and listening to light: the evolution of whole-body photonic imaging. Nat. Biotechnol. 23, 313-320 (2005).
- J, . Optical projection tomography as a tool for 3D microscopy and gene expression studies. Science. 296, 541-545 (2002).
- Dodt, H. U. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat. Methods. 4, 331-336 (2007).
- Vinegoni, C. In vivo imaging of Drosophila melanogaster pupae with mesoscopic fluorescence tomography. Nat. Methods. 5, 45-47 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten