Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мезоскопические флуоресцентная томография для В естественных условиях Изображений развивающихся Drosophila
В этой статье
Резюме
Мезоскопические флуоресценции томографии работает за пределы проникновения ткани срезов флуоресцентной микроскопии. Методика основана на мульти-проекции освещением и фотонной описание транспорта. Мы демонстрируем в естественных условиях всего тела 3D визуализация морфогенеза GFP-экспрессирующих крыло имагинальных дисков Дрозофилы.
Аннотация
Visualizing developing organ formation as well as progession and treatment of disease often heavily relies on the ability to optically interrogate molecular and functional changes in intact living organisms. Most existing optical imaging methods are inadequate for imaging at dimensions that lie between the penetration limits of modern optical microscopy (0.5-1mm) and the diffusion-imposed limits of optical macroscopy (>1cm) [1]. Thus, many important model organisms, e.g. insects, animal embryos or small animal extremities, remain inaccessible for in-vivo optical imaging.
Although there is increasing interest towards the development of nanometer-resolution optical imaging methods, there have not been many successful efforts in improving the imaging penetration depth. The ability to perform in-vivo imaging beyond microscopy limits is in fact met with the difficulties associated with photon scattering present in tissues. Recent efforts to image entire embryos for example [2,3] require special chemical treatment of the specimen, to clear them from scattering, a procedure that makes them suitable only for post-mortem imaging. These methods however evidence the need for imaging larger specimens than the ones usually allowed by two-photon or confocal microscopy, especially in developmental biology and in drug discovery.
We have developed a new optical imaging technique named Mesoscopic Fluorescence Tomography [4], which appropriate for non-invasive in-vivo imaging at dimensions of 1mm-5mm. The method exchanges resolution for penetration depth, but offers unprecedented tomographic imaging performance and it has been developed to add time as a new dimension in developmental biology observations (and possibly other areas of biological research) by imparting the ability to image the evolution of fluorescence-tagged responses over time. As such it can accelerate studies of morphological or functional dependencies on gene mutations or external stimuli, and can importantly, capture the complete picture of development or tissue function by allowing longitudinal time-lapse visualization of the same, developing organism.
The technique utilizes a modified laboratory microscope and multi-projection illumination to collect data at 360-degree projections. It applies the Fermi simplification to Fokker-Plank solution of the photon transport equation, combined with geometrical optics principles in order to build a realistic inversion scheme suitable for mesoscopic range. This allows in-vivo whole-body visualization of non-transparent three-dimensional structures in samples up to several millimeters in size.
We have demonstrated the in-vivo performance of the technique by imaging three-dimensional structures of developing Drosophila tissues in-vivo and by following the morphogenesis of the wings in the opaque Drosophila pupae in real time over six consecutive hours.
протокол
Дрозофилы запасы, используемые в данном эксперименте являются следующие:
- elav-Gal4 (FBti0002575)
- AP-Gal4md544 (FBal0051787)
- UAS-srcEGFP (FBti0013990)
- w1118 (FBal0018186)
Для всех экспериментов, UAS-Gal4 система была использована для гиперэкспрессией GFP в ткани интерес (т.е. слюнных желез или крыло диски). В частности, самок трансгенных с соответствующим Gal4 были скрещены на UAS-EGFP трансгенных товарищей. Крестов было выращено при 25 ° С в увлажненной инкубатора. Когда куколки начать заполнение флаконах (примерно 5-6 дней после начала крест), они были отобраны для GFP флуоресценции при белом prepupal этапе (0-1 ч после формирования пупария) и собранных для томографии.
- Настройка соответствующие кресты и задних при 25 ° С
- 5-6 дней после начала крест, выберите флуоресцентные потомства для работы с изображениями. Использование мокрой кистью для нежного удаления белого предкуколок из сторон флаконе.
- Положите предкуколок в капле воды или PBS размещены в чашке Петри, чтобы удалить частицы пищи и клей, который охватывает куколки дело и делает образца autofluorescent. Аккуратно очистите кисть. Если старение куколки необходимо, место, выбранное белый предкуколок в чашку Петри с мокрым бумажным полотенцем (влажной камере), либо по бокам чистый флакон с летучей пищи. Это будет гарантировать, что есть достаточно влаги, чтобы обеспечить правильное развитие животного.
Монтаж дрозофилы
- Клей нижней части куколки случае в капиллярной стеклянной трубки (800 микрон в диаметре), что передняя / задняя ось мухи ориентирована параллельно трубе.
- Fix капиллярной трубке вертикально на ротационной стадии.
- Отрегулируйте наклон оси вращательное этапе для того, чтобы оси вращения должны быть параллельны пикселей колонны изображения CCD.
Модель определения Вперед
- Fix куколки в капиллярной стеклянной и смонтировать, как описано выше
- Заполните кварцевую капиллярную трубку (100 микрон, О. Д.) с флуоресцентным красителем (Cy5.5)
- Вставьте капилляр внутри куколки при температуре 45 градусов по отношению к передней / задней оси
- Illuminate куколки с пучком лазерного возбуждения с низкой числовой апертуры линзы. Сбор флуоресцентные изображения просвечивание более 360 градусов вращающийся куколки вдоль его вертикальной оси.
- Fit экспериментальных данных с соответствующими вперед модель
Изображений слюнных желез
- Горы куколки выражения GFP в слюнных железах, как описано выше
- Illuminate с возбуждением пучка и собирать в просвечивание сигнала флуоресценции GFP более 360 градусов вращающийся куколки вдоль его вертикальной оси.
- Реконструкция приобретенных данных с использованием передовых моделей
Time-Lapse изображений
- Горы белых prepupa выражения GFP в крыле имагинальных дисков
- Держите изображений среды влажных и при комнатной температуре, чтобы избежать обезвоживания куколки.
- Место выдержки, чтобы избежать непрерывного освещения
- Illuminate с возбуждением пучка и собирать в просвечивание сигнала флуоресценции GFP более 360 градусов вращающийся куколки вдоль его вертикальной оси.
- Реконструкция приобретенных данных с использованием модели вперед.
Гистология
- Рассеките слюнных желез ЦНС / глаз диски 1x PBS.
- Fix тканей в 4% формальдегида, 1x PEM (100 мм трубы, 1мМ EGTA, 1мМ MgCl 2) для 20 минут при комнатной температуре.
- Удалить фиксации и установки в Vectashield с DAPI (вектор)
- Изображение с флуоресцентным микроскопом.
Time-Lapse Гистология
- Сбор белых предкуколок и стадии их во влажной камере.
- Сбор куколки на разных стадиях развития
- Укол куколки случае в два раза (0 часов после Пупарий свита) с помощью тонкой иглы (насекомое контактный 000, ФСТ) до фиксации.
- Fix куколки в 8% формальдегида, 1x PEM в течение 6-8 часов при комнатной температуре при легком помешивании.
- После снятия фиксации и промывки 1x PBS, вырезать фиксированной куколки с острым лезвием на две части перпендикулярно оси / P;
- Погрузите две штуки в Vectashield с DAPI (вектор) и смонтировать на покровного стекла слайдов (Lab-Tek) для работы с изображениями.
- Получение изображений с флуоресценции конфокальной микроскопии.
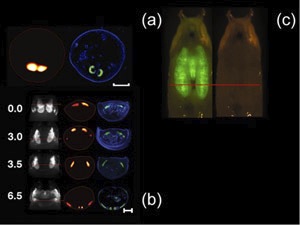
Рисунок 1. Пожалуйста, нажмите здесь , чтобы увидеть др.arger версия рисунке 1.
Обсуждение
В естественных условиях реконструкции куколки дела и GFP-экспрессирующих слюнных желез D. MELANOGASTER prepupa (Масштаб бар, 500 мкм) с соответствующими гистологии (синий, DAPI окрашивания; зеленый, GFP флуоресценции) показана на рис 1 (а). Покадровый серии изображений D. MELANOGASTER крыло имагинальн?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
С. Vinegoni признает поддержке Национального института здоровья (NIH) предоставлять 1-RO1-EB006432.
Ссылки
- Ntziachristos, V. Looking and listening to light: the evolution of whole-body photonic imaging. Nat. Biotechnol. 23, 313-320 (2005).
- J, . Optical projection tomography as a tool for 3D microscopy and gene expression studies. Science. 296, 541-545 (2002).
- Dodt, H. U. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat. Methods. 4, 331-336 (2007).
- Vinegoni, C. In vivo imaging of Drosophila melanogaster pupae with mesoscopic fluorescence tomography. Nat. Methods. 5, 45-47 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены