Method Article
Electroeluting fragments d'ADN
Dans cet article
Résumé
Cette procédure permet la purification de fragments d'ADN à haut rendement.
Résumé
Fragments d'ADN purifiés sont utilisés à différentes fins en biologie moléculaire et ils peuvent être préparés par plusieurs procédures. La plupart d'entre eux nécessitent une électrophorèse précédente des fragments d'ADN afin de séparer la bande d'intérêt. Ensuite, cette bande est excisée à partir d'un gel d'agarose ou d'acrylamide et purifiée en utilisant soit: la liaison et l'élution des particules de verre ou de silice, DEAE-cellulose des membranes », écraser et faire tremper la méthode", électroélution ou très souvent coûteux kits de purification commerciales. Ainsi, en choisissant une méthode dépendra surtout de ce qui est disponible dans le laboratoire. La procédure électroélution permet de purifier l'ADN très propre à être utilisé dans un grand nombre d'applications (séquençage, radiomarquage, restriction enzymatique, la modification enzymatique, etc clonage). Cette procédure consiste à placer l'ADN bande contenant les tranches d'agarose ou d'acrylamide dans les puits d'échantillon de l'electroeluter, puis appliqué actuellement fera le fragment d'ADN à partir de l'agarose et d'être ainsi pris au piège dans un sel coussin pour être récupéré plus tard par précipitation à l'éthanol.
Protocole
- Afin de sélectionner des fragments d'ADN d'intérêt d'être purifiés, ils devraient être résolus dans gels d'agarose ou d'acrylamide gel coloré au bromure d'éthidium par électrophorèse en utilisant un tampon TBE 0.5X (Tris borate EDTA) à 120 volts pendant 1 heure. Pour cela, ~ 700 ng de plasmide pProEx-GdMre11S (6000 pb) préalablement digéré par Ndel et HindIII a été utilisée pour libérer un fragment de 900 pb (560 ng d'ng de plasmide et 84 du fragment).
- Le réservoir electroeluter (figure 1) doit être rempli avec TBE 0.5X également répartis de chaque côté du plateau de la mi prenant soin de ne pas le renverser sur le plateau de mi.
- La bande choisie (ou bandes) est découpée du gel, et placé dans la chambre de l'échantillon le plus près possible de la chaîne V (une tranche par puits). Mémoire tampon d'exécution doit être ajouté à chaque chambre; juste assez pour couvrir la tranche de gel.
- Chaque canal V utilisée doit être rincée avec une pipette Pasteur afin d'éliminer toute bulle d'air emprisonnée.
- Puis 100 ul de 10 M d'acétate de NH 4 (pour faciliter la visualisation d'une petite quantité de bleu de bromophénol est ajouté, juste assez pour la couleur) sont délicatement ajouté à l'intérieur du canal V.
- Le couvercle doit être fermé doucement pour éviter toute remise en suspension du coussin de sel.
- Électroélution est commencée à 100 volts pendant 25 minutes.
- Lorsque electrolution est terminée, 400 ul sont retirés de V-canal, et placé dans un tube de centrifugeuse pour être précipité avec 2 volumes d'éthanol froid et le glycogène (recommandé pour améliorer la récupération de l'ADN) à 4 ° C pendant 1 heure ou jusqu'au lendemain.
- Centrifuger pendant 20 minutes, retirer le surnageant et laver avec de l'éthanol à 70%.
- Tube sec et de quantifier l'ADN à une DO 260 nm.
- La reprise a été obtenu 75% (63 ng récupérés lorsque 84 ng ont été placés sur le V-canal).
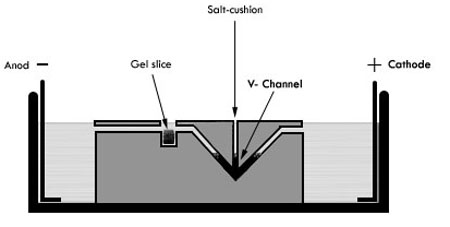
Figure 1. Schéma Electroeluter. Anod une cathode sont indiqués sur chaque côté du réservoir, l'ADN contenu dans le gel en tranches (illustré par un carré noir) migrera vers la cathode en raison de sa charge négative. Ensuite, il sera piégé dans le coussin de sel (représenté comme un triangle inversé noir) situé dans le V-canal.
Discussion
La durée de la course dépendra fortement de la taille des fragments, des fragments normalement jusqu'à 20 ko 50 minutes à 1 heure suffit, alors que pour de petits fragments lumière UV de surveillance toutes les 10 minutes est nécessaire pour empêcher le fragment de passer par la coussin de sel et par conséquent à la chambre tampon anodique diminue de récupération. Il est important de s'assurer que lorsque vous définissez votre alimentation à 100 volts, il ya un mAmp actuelle moins de 10 ans. La bande d'ADN peut être contrôlé en utilisant une lampe UV-main et de détecter quand cette abandonne la tranche de gel. Le sel de coussin peut également être faite avec 3 M acétate de Na.
Cette procédure permet la purification de fragments d'ADN ou d'ARN de différentes tailles avec une bonne récupération (~ 80%) à être radiomarquée, digéré par les enzymes de restriction, traitées par des enzymes de modification, etc
Déclarations de divulgation
Remerciements
Le travail dans Dr Bermudez de laboratoire a été financé par le CONACYT (Grant # 82622). Nous remercions Gabriela Gutierrez-Sosa, Eliuth Reyes-Rodriguez Martinez et Ximena-Torres pour l'enregistrement vidéo de la procédure electroleution.
matériels
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| NdeI | New England Biolabs | R0111L | ||
| HindIII | New England Biolabs | R0104L | ||
| NH4 acetate | JTBaker | 0596 | ||
| agarose | Invitrogen | 15510-027 | ||
| Biophotometer | Eppendorf | 6131 000 020 | ||
| Electroeluter | IBI | UEA CAT 46000 |
Références
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory Manual. , (1989).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon