Method Article
Organes récepteurs musculaires à l'abdomen des écrevisses: un exercice de laboratoire étudiant de la proprioception
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L'objectif principal de cette expérience est de comprendre comment les neurones sensoriels primaires transmettre des informations sur les mouvements et les positions communes que les informations proprioceptives pour un animal. Un autre objectif de ce rapport est actuellement de l'anatomie de la préparation par la dissection et la visualisation des neurones sous un microscope à dissection.
Résumé
L'objectif principal de cette expérience est de démontrer primaires informations sensorielles neurones convoyage des mouvements et des positions que les informations proprioceptives pour un animal. Un objectif supplémentaire de cette expérience est d'apprendre l'anatomie de la préparation par la coloration, la dissection et la visualisation des neurones et des structures sensorielles sous un microscope à dissection. Ceci est réalisé en utilisant l'équipement de base neurophysiologique d'enregistrer l'activité électrique d'un organe récepteur commun et des techniques de coloration. Le récepteur d'organe musculaire (MRO) le système de l'écrevisse est analogue à la broche musculaires intrafusales chez les mammifères, ce qui aide à servir de modèle comparatif qui est plus facilement accessible pour les enregistrements électrophysiologiques. De plus, ces neurones sensoriels sont identifiables parmi les préparations. La préparation est viable dans une solution saline minimale pendant des heures qui se prête aux exercices de laboratoire étudiant. Le MRO est aussi sensible à la neuromodulation qui encourage questions intrigantes dans les sites d'action modulatrice et l'intégration de signaux dynamiques de mouvements et de position statique avec un gain qui peut être changé dans le système.
Protocole
1) INTRODUCTION
Les propriocepteurs sont des neurones qui détectent la position commune, direction, vitesse, et étirer les muscles. La proprioception est une modalité sensorielle unique, parce que les propriocepteurs sont intérocepteurs et les stimuli sens dans le corps au lieu de partir du monde extérieur.
Dans le système de vertébrés, il apparaît que la plupart des communes et des récepteurs de tension ne sont pas nécessaires pour détecter brute informations proprioceptives. Le annulospirales et flowerspray (terminaisons nerveuses sensorielles) des récepteurs sur les fibres musculaires ont été montrées par l'ablation ainsi que des études vibratoires et anesthésiques pour être les deux groupes de récepteurs essentiels nécessaires pour la proprioception (Burgess et al. Pour une revue, 1982). Cependant, il est notable qu'il ya des informations redondantes recueillies par d'autres récepteurs, tels que ceux dans les articulations, qui sont utilisés pour un contrôle précis des mouvements. Arthropodes comme les vertébrés ont des appendices articulés. Par conséquent, il n'est pas surprenant que les propriocepteurs décrit pour les vertébrés ont leurs homologues dans les membres des arthropodes et des articulations.
La disposition anatomique des organes chordotonaux dans les crabes permet l'analyse de chaque neurone individuel selon leur fonction. En outre, des questions de développement peuvent être abordées que l'animal grandit ou lorsque l'animal se régénère un membre (Cooper et Govind, 1991; Hartman et Cooper, 1993). Certains organes communs chordotonaux dans les crabes contenir des centaines de neurones sensoriels primaires (Cooper, 2008) et ces neurones contrôlent les aspects dans le fractionnement gamme dans les mouvements et les positions de l'articulation. Un système moins complexe proprioceptive du contrôle des mouvements et les positions communes sont les organes récepteurs musculaires (OPR) dans l'abdomen de l'écrevisse (Eckert, 1961a, b; McCarthy et MacMillan, 1995). Les mécanorécepteurs dans l'abdomen MRO écrevisses transduire un stimulus étirement dans les terminaisons sensorielles, incorporé dans un muscle, en un potentiel de récepteur gradué. Lorsque le potentiel dépasse un seuil, un potentiel d'action se traduira à la base axone. C'est ce qui est défini et connu comme "le site de pic ouverture" en neurobiologie. Dans ce système, le corps cellulaire réside en apposition à proximité du muscle qu'il surveille. Deux types distincts de récepteurs d'étirement existent dans ce système sensoriel: une lente adaptation et un récepteur rapide adaptation. L'activité est dépendante de la force de l'étirer mécanique. Le système de MRO dans l'écrevisse est analogue à la broche musculaires intrafusales chez les mammifères et les muscles ont aussi le contrôle efférent de maintenir le caractère tendu des muscles comme on le sait pour les muscles intrafusales chez les mammifères.
Les neurones sensoriels fuseau musculaire chez les mammifères sont difficiles à enquêter électrophysiologiquement raison de la nature de l'petites terminaisons sensorielles. Il est également difficile de suivre la localisation des corps cellulaires dans le ganglion de la racine dorsale de leurs terminaisons périphériques. En comparaison, les neurones MRO dans les écrevisses sont facilement accessibles pour les électrodes extracellulaires et intracellulaires pour les enregistrements à long terme. Les corps cellulaires des neurones sensoriels MRO sont relativement importantes (50-100 um de diamètre). Les neurones sensoriels ont également servi de modèle dans la lutte contre la manière dont «étirer activé" canaux en fonction des neurones, les flux ioniques, les canaux de distribution, et la densité des neurones sensoriels (Brown et al, 1978;. Edwards et al, 1981;. Erxleben, 1989; Hunt et al, 1978;. Purali et Rydqvist, 1992; Rydqvist et Purali, 1991; Rydqvist et Swerup, 1991; Cooper et al, 2003).. L'intégration des informations sensorielles de la MRO dans un segment peut influencer d'autres segments adjacents (Eckert, 1961a, b). Il ya quelques rapports sur la modulation de l'entrée sensorielle à partir du MRO (Pasztor et Macmillan, 1990;. Cooper et al, 2003). Modulation des circuits neuronaux est une région riche pour les enquêtes futures de la science fondamentale et cette préparation peut servir de base chez les mammifères pour les applications futures, potentiellement dans la moelle épinière des vertébrés (Rossignol et al, 2001, 2002;. Donnelan, 2009)
1.1) Les résultats d'apprentissage
Dans cette expérience de laboratoire, on va disséquer un abdomen écrevisses et d'apprendre l'anatomie et la physiologie associée de l'MRO. On va apprendre à contrôler l'activité neuronale avec des enregistrements extracellulaires et de l'usage commun d'équipement d'électrophysiologie. On va graphique et interpréter les données obtenues sur la base des stimulations sensorielles fournies. La stimulation sensorielle va varier de positions statiques ainsi que les mouvements dynamiques du segment contrôlé. On va aborder le concept de proprioception dans ce système sensoriel et sa signification. L'adaptation sensorielle sera observée dans une série d'expériences. L'importance ainsi que le mécanisme potentiel derrière l'adaptation sensorielle seront abordées par les élèves.
2) les méthodes
2.1) Matières
- Cage de Faraday
- Micromanipulateur
- Électrodes d'aspiration
- Microscope à dissection
- Illuminateur à haute intensité (source lumineuse)
- Platform Microscope
- Amplificateur différentiel AC / DC (AM Systems Inc Modèle 3000)
- PowerLab 26T (Instruments AD)
- Stade de la tête
- LabChart 7 (DJA Instruments, Colorado Springs, CO, USA)
- Ecrevisses Saline (mM: NaCl 205; 5,3 KCl; 13,5 CaCl 2 .2 H 2 O; 2,45 MgCl2 0,6 H 2 O; HEPES 5 ajusté à pH 7,4)
- Bleu de méthylène: Ceci est fait d'une solution saline écrevisses à une concentration de 0,25%
- Sylgard plats revêtus (Dow Corning, SYLGARD 184 kit d'élastomère de silicone;. Dow Corning Corporation, Midland, MI USA)
- Des outils de dissection
- Broches insectes
2.2) Configuration

Figure 1: Les équipements mis en place
- Configuration jusqu'à la cage de Faraday. Le microscope, l'illuminateur d'intensité élevée, micromanipulateur, et le bain salin tout sera mis en place à l'intérieur de la cage (la cage de Faraday est utilisé pour bloquer des champs électriques externes qui pourraient interférer avec l'enregistrement électrique).
- Installation du microscope dans une position où il est dominant la platine du microscope.
- Position de l'illuminateur de haute intensité dans une position commode.
- Préparez un bain salin en utilisant une solution saline d'écrevisses dans un plat Sylgard et le placer sous le microscope (c'est là que l'abdomen écrevisses disséqué sera placé).
- Placez le micromanipulateur dans une position où l'électrode d'aspiration a un accès facile au bain salin.
- D'aspiration jusqu'à salée jusqu'à ce qu'elle soit en contact avec le fil d'argent à l'intérieur de l'électrode d'aspiration. Disposer l'autre fil sur le côté coupé des électrodes d'aspiration proche de la pointe de l'électrode, afin que les deux fils seront en contact avec le bain salin.
- Connectez l'amplificateur différentiel AC / DC (amplificateur) au 26T Power Lab. Pour ce faire, brancher le cordon d'entrée 1 bon sur le 26T PowerLab à la sortie de l'amplificateur.
- Les contrôles instrument de l'amplificateur doit être réglé sur les paramètres suivants:
- High Pass-DC
- Notch Filter-OFF
- Low Pass-20kHz
- Capacité Comp .- antihoraire
- DC Offset fines et grossières bouton-antihoraire
- DC Offset (+ OFF) - OFF
- GAIN-50
- Entrée (DIFF MONO GND) - DIFF
- MODE (STIM-GATE-REC) - REC
- ΩTEST-OFF
- Les contrôles instrument de l'amplificateur doit être réglé sur les paramètres suivants:
- Branchez le stade de la tête à la «saisie-sonde» sur l'amplificateur.
- Connectez les fils électriques de l'électrode d'aspiration à l'étape de la tête. Les fils doivent être connectés avec le rouge (positif) en haut à gauche, vert (terre) au milieu, noir (négatif à la base. Ceci est indiqué dans la Figure 2. Le fil de terre peut être simplement mis dans le bain salin.
Figure 2: Configuration stade de chef - Maintenant, connectez le câble USB de la 26T PowerLab à l'ordinateur portable. Vérifiez que l'amplificateur et PowerLab26T sont branchés et sous tension avant d'ouvrir LabChart7 sur l'ordinateur.
- Ouvrez LabChart7.
- La zone Centre LabChart Bienvenue apparaîtra ouvert. Fermez-le.
- Cliquez sur Setup
- Cliquez sur Paramètres canal. Changer le nombre de canaux à 1 (en bas à gauche de la boîte) Appuyer sur OK.
- En haut à gauche de la carte de l'ensemble de cycles par seconde à environ 2k. Réglez le volts (axe Y) à environ 500 ou 200 mV.
- Cliquez sur le canal 1 sur la droite du graphique. Cliquez sur l'amplificateur d'entrée. Assurez-vous que les paramètres: single-ended, couplage AC, et inverser (inverse le signal si nécessaire), et d'anti-alias, sont vérifiées.
- Pour commencer l'enregistrement appuyer sur start.
2.3) Dissection
- Ecrevisses (Procamarus clarkii) mesurant 6-10 cm de longueur du corps doit être déjà mis sur la glace pour anesthésier l'animal avant dissection débute.
- Tenir les écrevisses anesthésiés par derrière les griffes d'une seule main. Rapidement, coupé de la cavité de l'œil au milieu de la tête sur les deux faces, puis décapiter les écrevisses (Remarque: le sang de la préparation sera collante quand elle sèche, donc lavez les outils une fois rempli).

Figure 3: Décapitation de l'écrevisse - Une fois que l'écrevisse est décapité, coupé entre le thorax et l'abdomen (queue) sur la face ventrale. Il devrait être facile de séparer l'abdomen du thorax. Note: si l'écrevisse est de sexe masculin, couper le stylETS (mâle parties reproductrices) hors tension avant de séparer la abdomen et du thorax. (Ci-dessous à la figure 4A).
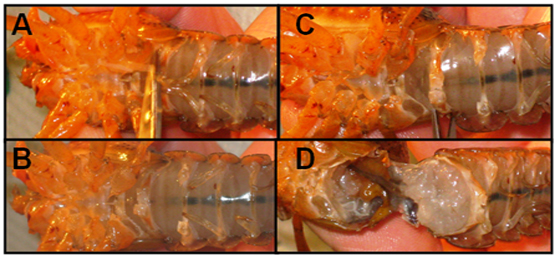
Figure 4: Isolement de l'abdomen- Placer une lame des ciseaux dans l'abdomen, et avec les conseils de ciseaux pointant loin de la préparation, couper le long de la frontière latérale. Répéter l'opération sur le côté opposé.

Figure 5: une dissection longitudinale de l'abdomen - Prenez l'extrémité arrière de la pince à épiler (# 3) et pousser les muscles et les voies gastro-intestinales loin de la face dorsale de la préparation. Soyez sûr de ne pas pousser vers le bas sur les muscles.
- Couper à travers (latéral à côté latéral) de la dernière côte pour enlever la partie ventrale de la queue.

Figure 6: Retrait de la partie ventrale de l'abdomen - Emerge la préparation dans écrevisses saline (solution d'un Van modifiés Harreveld a).
- En regardant la préparation sous le microscope, la profondeur des muscles extenseurs médial (DEM) peut être localisé par ses fibres torsadées en hélice, et la profondeur des extenseurs muscles latéraux, avec des fibres linéaires peuvent être distingués (voir les figures Annexe 1 & 2). Placez deux broches dans la région médiosagittal à la partie distale de l'abdomen, entre les muscles DEM sur la première et seconde nervures (figure 7).

Figure 7: Sécurisation de la préparation de l'enregistrement contenant le nerf le nerf sensitif MRO. - Les faisceaux nerveux qui sera utilisé pour enregistrer à partir courir le long du bord latéral à côté de la cuticule (figure 7). (Il peut être nécessaire de souffler sur la préparation ou la chute de solution saline dans le bain en utilisant un compte-gouttes pour localiser le nerf par son mouvement)
Note:
Chaque segment abdominal a deux ensembles de l'OPR rapidement et lentement adaptation sur le hemisegments droite et à gauche. Les faisceaux nerveux associés courir le long du bord latéral à côté de la cuticule. C'est le faisceau nerveux que l'on sera l'enregistrement. On ne sera pas en mesure d'afficher l'OPR, parce qu'ils sont situés sous le Del1 et 2 muscles (Figures Annexe 1 & 2). Figure 8 donne un aperçu des dissections d'être fait afin d'isoler l'abdomen.

Figure 8: Vue générale de la dissection d'isoler l'abdomen. A, B et C sont la série d'étapes dans la dissection de l'écrevisse.
3) les résultats
3.1) Enregistrement
Généralisée réponses obtenues de la lente et rapide adaptation MRO tout en étirant et le maintien d'un étirement sont illustrés dans la Figure 9. Dans cet exercice-ci sera d'enregistrement des deux OPR ensemble comme leurs axones sont contenus dans le kit même nerf.

Figure 9: L'écrevisse possède deux types de neurones dans le MRO. Le phasique, qui sont innervés par les axones moteurs rapides, et la tonique qui sont innervées par les axones moteurs lents. (A) Quand un récepteur tonique est stimulé il s'adapte lentement à la relance et poursuit une tendance stable de tir potentiels d'action. (B) Quand un récepteur phasique est stimulé il s'adapte rapidement à la relance et les incendies seulement un modèle court de potentiels d'action.
Le nerf entier qui contient des neurones moteurs et sensitifs sont enregistrées à partir de (figure 10). Toutefois on ne détecte que les neurones sensoriels comme le moteur d'entraînement a été séparée de la corde nerveuse ventrale de l'animal.
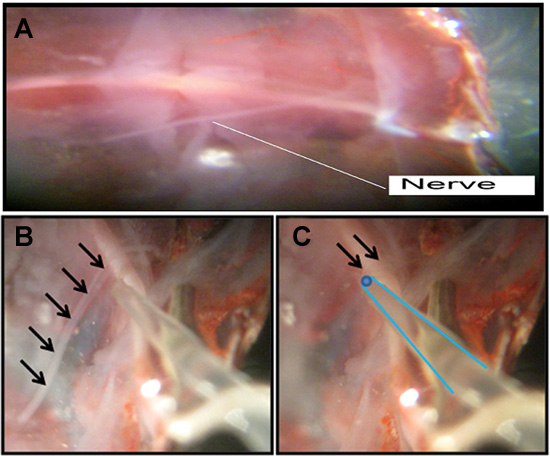
Figure 10: Le faisceau nerveux d'être aspirée dans l'électrode d'enregistrement. (A) Le nerf libre est montré flottant sur l'abdomen disséqué. (B) décrit le faisceau de nerf et la fin d'aspiration en plastique électrode par le nerf. (C) Le nerf segmentaire est tiré dans l'électrode d'aspiration, qui est en bleu.
One est maintenant prêt à enregistrer les réponses électriques de l'OPR.
- Placer la préparation dans le champ de dissection et de préparer l'ensemble d'enregistrement en place.
- Électriquement au sol le bain en plaçant un fil de terre chlorure d'argent dans le bain et l'autre extrémité à un terrain d'entente. Remarque: Parfois, cela peut provoquer un bruit électrique lors de l'enregistrement. Si cela arrive au sol ne le bain.
- Utilisez le microscope pour trouver le nerf à être enregistrées
Remarque: Recherchez le segment avec le nerf le plus accessible. Le nerf est blanc, et peut être vu en utilisant la pipette pour brouillard salin à travers le nerf ou par une légère soufflant sur la préparation. Cela provoque le culot de se déplacer et il est plus facile à identifier. - Maintenant que le nerf a été identifié placer l'électrode d'aspiration du micromanipulateur directement sur le nerf (figure 10).
- Tirez doucement sur la seringue pour attirer le nerf dans l'électrode (on peut voir le nerf étant aspiré dans l'électrode avec l'utilisation du microscope).
- Appuyez sur le bouton de démarrage sur Labscope7.
- Utiliser les pinces déplacez doucement la queue de l'écrevisse à monter et descendre de 180 à 45 et 90 angles. Notez la différence dans les enregistrements à chaque angle différent. (Lors du changement de la position des angles assurez-vous de noter les changements d'angle avec l'activité neuronale pertinentes sur l'écran. Cela peut être fait soit en utilisant le marqueur de commentaire dans le logiciel.)
- D'enregistrer les mouvements de réponse aux différents mouvements statiques dans le tableau ci-dessous.
- Tenez la queue d'écrevisse à 45 ° pendant quinze secondes.
- Poussez arrêt sur l'écran LabChart7. Notez le nombre de potentiels d'action qui s'est produite lors de la dernière seconde enregistrées.
- Tenez la queue d'écrevisse à 45 ° pendant une minute.
- Poussez arrêt sur l'écran LabChart7. Notez le nombre de potentiels d'action qui s'est produite lors de la dernière seconde enregistrées.
Graphique 1:
| Angle (°) | # De potentiels d'action en 1 seconde après 3 secondes | # De potentiels d'action en 1 seconde après 10 secondes |
| 180 ° (plat) | ||
| 45 ° | ||
| 90 ° | ||
Questions à penser à tout en menant ces expériences sont les suivantes: Est-il un modèle et une réponse cohérente à l'extension et des mouvements de flexion de l'articulation? Quelle sorte de réponses sont évoquées par chevillage ou la tenue du telson à divers postes fixes? Est-ce que la réponse cohérente si elle est répétée?
Faire des notes précises sur les types de réactions observées. Après vous êtes satisfait de vos observations, faire des dossiers permanents de cette activité en sauvegardant les fichiers de données. Une fois satisfait avec les observations que vous avez fait dans le segment 3, passer à d'autres enregistrements de nerfs dans les segments de 4 ou 5 ou de l'autre côté du segment 3 pour observer l'activité.
On peut souhaiter pour déterminer si les neuromodulateurs (octopamine, la sérotonine et proctoline) ou d'autres composés ou une composition altérée dans la nature ionique de la solution saline produit des réponses variées de ceux obtenus dans les salines définies.
3.2) Coloration au bleu de méthylène
On peut être capable de disséquer le muscle (voir annexe) pour afficher le MRO avec une technique de coloration. Prenez la préparation et versez le dans une solution saline écrevisses. Placez environ 5 ml de solution de bleu de méthylène dans la préparation et mélanger doucement en tournant le plat pendant quelques minutes. Puis versez le bleu de méthylène en excès dans le conteneur à déchets et versez salines frais sur la préparation. Maintenant, placez le plat sous le microscope pour commencer à disséquer le muscle pour voir le MROS. Couper le segment long de la nervure (latérale médiosagittal) en plaçant une partie de la paire de ciseaux sous le muscle et tirant vers le haut comme vous couper le long des muscles. Une fois que le DEL 1 et 2 muscles sont coupés, puis peler les muscles du dos et une fine couche de muscle (SEM) devrait être observée. L'OPR sont les deux dernières fibres médiales allongé parallèlement au muscle hélice (figure 11).
"Alt =" Figure 11 "/>
Figure 11: Le schéma d'un segment abdominal illustre les principaux groupes musculaires (A) et une préparation colorée au bleu de méthylène (B) permet de délimiter les groupes musculaires dans une préparation intacte. La zone décrite dans A est montré en B avec une vue agrandie. En B, l'Del1 et 2 groupes de muscles ne sont pas coupés comme indiqué dans la moitié inférieure du schéma comme indiqué en A.
Pour les exercices des étudiants on pourrait souhaiter demander aux élèves de répondre aux questions suivantes:
- Qu'est-ce qu'un récepteur intéroceptive?
- Comment puis-récepteurs intéroceptive concernent propriocepteurs?
- Expliquez adaptation sensorielle et comment il pourrait se rapporter à ce laboratoire.
- Quel est le fractionnement de gamme? Que faut-il activer le SNC à faire?
- Est-ce que vous avez enregistré le neurone de type phasique un neurone ou tonique? Pourquoi?
(Suggestion: Que feriez-vous postuler l'activité des neurones moteurs ressemblerait par rapport à l'activité des neurones sensoriels dans un animal intact) - Sur une feuille de papier séparée dessiner un graphe de l'angle de la queue d'écrevisse vs la fréquence des PA.
- Expliquer toute tendance que vous pouvez observer dans le graphique
Discussion
Les détails fournis dans le film et le texte associé ont fourni des étapes clés afin d'enregistrer l'activité suffisante dans la MRO de l'écrevisse in situ. Un des objectifs de notre rapport est d'augmenter la sensibilisation au potentiel de cette préparation dans les laboratoires publics aux étudiants d'investigation pour enseigner les concepts fondamentaux en physiologie sensorielle. Les préparatifs sont très robustes dans la viabilité tout en étant baigné dans une solution saline minime.
La commande du moteur sur les muscles de MRO a été identifié mais la régulation de la transmission et le potentiel de la plasticité synaptique ainsi que l'efficacité de la transmission pour les neurones excitateurs et inhibiteurs reste un espace ouvert pour enquête (Elekes et Florey, 1987a, b; Florey et Florey, 1955; Kuffler, 1954; Kuffler et Eyzaguirre, 1955).
Cette préparation peut être utilisée pour étudier un certain nombre de conditions expérimentales ainsi que l'aire naturelle de locomotion dans l'animal afin de mieux comprendre la biologie de la MRO pour la recherche primaire ainsi que des fins démonstratives. Les propriétés biophysiques de ces neurones sensoriels a été en partie abordées dans leur nature de l'adaptation de l'activité neuronale à un stimulus maintenu (Brown et al, 1978; Edwards et al, 1981;. Purali, 1997; Rydqvist et Purali, 1991; Rydqvist et Swerup, 1991). Cependant, seule une neuromodulation quelques adresser des rapports sur ces récepteurs sensoriels et des fibres musculaires associées (Cooper et al, 2003;. Pasztor et Macmillan, 1990). Les rapports traitent avec seulement quelques-uns des nombreux composés qui sont connus pour être présents dans l'hémolymphe. Beaucoup de modulateurs et des cocktails de modulateurs reste à examiner sur le complexe MRO (muscles et les neurones). Pasztor et Macmillan (1990) examine le neuromodulateurs 5-HT et octopamine sur l'activité du MROS parmi les espèces de crustacés variés et a noté qu'il ya des différences entre les espèces. Ils n'ont pas examiné en détail les influences à long terme de ces neuromodulateurs, ni les effets sur l'activité à différentes positions statiques de la MRO.
Ce type de préparation peut aider à comprendre le fondement de la perception sensorielle et la régulation du traitement neural qui est important dans la réhabilitation et la gestion des maladies pour les humains avec abnormities bloc moteur (Patel et al, 2009;. Rabin et al, 2009;. Marin et al ., 2010). Les différents types d'entrées et les schémas de tir pour la surveillance des mouvements conjoints dans des préparations accessibles invertébrés peuvent être utilisés en robotique / prothèse (Macmillan et Patullo, 2001). Il ya encore beaucoup de questions en attente de réponses dans cette préparation qui peut être bénéfique dans un certain nombre de façons.
Déclarations de divulgation
Remerciements
Soutenue par l'Université du Kentucky, Département de biologie, Bureau des études de premier cycle et le Collège des Arts et des Sciences.
matériels
| Name | Company | Catalog Number | Comments |
| PowerLab 26T |  ADInstruments ADInstruments | ||
| LabChart 7 |  ADI Instruments, Colorado Springs, CO, USA ADI Instruments, Colorado Springs, CO, USA |
Références
- Alexandrowicz, J. S. Muscle receptor organs in the abdomen of Homarus vulgaris and Palinurus vulgaris. Q. J. Microsc. Sci. 92, 163-199 (1951).
- Brown, H. M., Ottoson, D., Rydqvist, B. Crayfish stretch receptor: An investigation with voltage-clamp and ion-sensitive electrodes. J. Physiol. 284, 155-179 (1978).
- Burgess, P. R., Wei, J. Y., Clark, F. J., Simon, J. Signaling of kinesthetic information by peripheral sensory receptors. Ann. Rev. Neurosci. 5, 171-187 (1982).
- Cooper, R. L. Proprioceptive neurons of chordotonal organs in the crab, Cancer magister Dana Decapoda, Brachyura). Crustaceana. 81, 447-475 (2008).
- Cooper, R. L., Govind, C. K. Axon composition of the proprioceptive PD nerve during growth and regeneration of lobster claws. J. Exp. Zool. 260, 181-193 (1991).
- Cooper, R. L., Ward, E., Braxton, R., Li, H., Warren, W. M. The effects of serotonin and ecdysone on primary sensory neurons in crayfish. Microscopy Res. Technique. 60, 336-345 (2003).
- Donelan, J. M., McVea, D. A., Pearson, K. G. Force regulation of ankle extensor muscle activity in freely walking cats. J. Neurophysiol. 101, 360-371 (2009).
- Eckert, R. O. Reflex relationships of the abdominal stretch receptors of the crayfish. I. Feedback inhibition of the receptors. J. Cell. Comp. Physiol. 57, 149-162 (1961).
- Eckert, R. O. Reflex relationships of the abdominal stretch receptors of the crayfish. II. Stretch receptor involvement during the swimming reflex. J. Cell. Comp. Physiol. 57, 163-174 (1961).
- Edwards, C., Ottoson, D., Rydqvist, B., Swerup, C. The permeability of the transducer membrane of the crayfish stretch receptor to calcium and other divalent cations. Neurosci. 6, 1455-1460 (1981).
- Elekes, K., Florey, E. New types of synaptic connections in crayfish stretch receptor organs: an electron microscopic study. J. Neurocytol. 16, 613-626 (1987).
- Elekes, K., Florey, E. Immunocytochemical evidence for the GABAergic innervation of the stretch receptor neurons in crayfish. Neurosci. 22, 1111-1122 (1987).
- Erxleben, C. Stretch-activated current through single ion channels in the abdominal stretch receptor organ of the crayfish. J. Gen. Physiol. 94, 1071-1083 (1989).
- Fields, H. L., Mill, P. J. Crustacean abdominal and thoracic muscle receptor organs. Structure and function of proprioceptors in the invertebrates. , 65-114 (1976).
- Florey, E., Florey, E. Microanatomy of the abdominal stretch receptors of the crayfish Astacus fluviatilis L. J. Gen. Physiol. 39, 69-85 (1955).
- Hartman, H. B., Cooper, R. L. Regeneration and molting effects on the proprioceptor organ in the Dungeness crab, Cancer magister. J. Neurobiol. 25, 461-471 (1994).
- Hunt, C. C., Wilkerson, R. S., Fukami, Y. Ionic basis of the receptor potential in primary endings of mammalian muscle spindles. J. Gen. Physiol. 71, 683-698 (1978).
- Kuffler, S. W. Mechanisms of activation and motor control of stretch receptors in lobster and crayfish. J. Neurophysiol. 17, 558-574 (1954).
- Kuffler, S. W., Eyzaguirre, C. Synaptic inhibition in an isolated nerve cell. J. Gen. Physiol. 39, 155-184 (1955).
- Macmillan, D. L., Patullo, B. W. Insights for robotic design from studies of the control of abdominal position in crayfish. Biol. Bull. 200, 201-205 (2001).
- Marino, B. F., Stucchi, N., Nava, E., Haggard, P., Maravita, A. Distorting the visual size of the hand affects hand pre-shaping during grasping. Exp. Brain Res. , 202-202 (2010).
- McCarthy, B. J., MacMillian, D. L. The role of the muscle receptor organ in the control of the abdominal extension in the crayfish Cherax. J. Exp. Biol. 198, 2253-2259 (1995).
- Mill, P. J., Lowe, D. A. The fine structure of the PD proprioceptor of Cancer pagurus.I. The receptor strand and the movement sensitive cells. Proc. R. Soc. Lond. B. 184, 179-197 (1973).
- Nakajima, Y., Onodera, K. Membrane properties of the stretch receptor neurons of crayfish with particular reference to mechanisms of sensory adaptation. J. Physiol. 200, 161-185 (1969).
- Nakajima, Y., Takahashi, K. Post-tetanic hyperpolarization and electrogenic Na pump in stretch receptor neurone of crayfish. J. Physiol. 187, 105-127 (1966).
- Pasztor, V. M., MacMillan, D. L. The actions of proctolin, octopamine and serotonin on the crustacean proprioceptors show species and neurone specificity. J. Exp. Biol. 152, 485-504 (1990).
- Patel, M., Fransson, P. A., Karlberg, M., Malmstrom, E. M., Magnusson, M. Change of body movement coordination during cervical proprioceptive disturbances with increased age. Gerontol. 56, 284-290 (2010).
- Patullo, B., Faulkes, Z., Macmillan, D. L. Muscle receptor organs do not mediate load compensation during body roll and defense response extensions in the crayfish Cherax destructor. J. Exp. Zool. 290, 783-790 (2001).
- Purali, N. . Mechanisms of adaptation in a mechanoreceptor. A study of mechanical and ionic factors in the crayfish stretch receptors [dissertation]. , (1988).
- Purali, N., Rydqvist, B. Block of potassium outward currents in the crayfish stretch receptor neurons by 4-aminopyridine, tetraethylammonium chloride and some other chemical substances. Acta Physiol. Scand. 146, 67-77 (1992).
- Rabin, E., Muratori, L., Svokos, K., Gordon, A. Tactile/proprioceptive integration during arm localization is intact in individuals with Parkinson's disease. Neurosci. Lett. 470, 38-42 (2010).
- Rydqvist, B., Purali, N. Potential-dependent potassium currents in the rapidly adapting stretch receptor neuron of the crayfish. Acta Physiol. Scand. 142, 67-76 (1991).
- Rydqvist, B., Swerup, C. Stimulus-response properties of the slowly adapting stretch receptor neuron of the crayfish. Acta Physiol. Scand. 143, 11-19 (1991).
- Rossignol, S. Locomotion and its recovery after spinal injury. Curr. Opin. Neurobiol. 10, 708-716 (2000).
- Rossignol, S., Giroux, N., Chau, C., Marcoux, J., Brustein, J., Reader, T. A. Pharmacological aids to locomotor training after spinal injury in the cat. J. Physiol. 533, 65-74 (2001).
- Rossignol, S., Bouyer, L., Barthelemy, D., Langlet, C., Leblond, H. Recovery of locomotion in the cat following spinal cord lesions. Brain Res. Rev. 40, 257-266 (2002).
- Sohn, J., Mykles, D. L., Cooper, R. L. The anatomical, physiological and biochemical characterization of muscles associated with the articulating membrane in the dorsal surface of the crayfish abdomen. J. Exp. Zool. 287, 353-377 (2000).
- Svensson, E., Woolley, J., Wikström, M., Grillner, S. Endogenous dopaminergic modulation of the lamprey spinal locomotor network. Brain Res. 970, 1-8 (2003).
- Swerup, C., Rydqvist, B. The abdominal stretch receptor organ of the crayfish. Comp. Biochem. Physiol. A. 103, 433-431 (1992).
- Vargas, J. G., Yu, W. Audio aided electro-tactile perception training for finger posture biofeedback. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2008, 4230-4233 (2008).
- Vedel, J. P., Clarac, F. Combined reflex actions by several proprioceptive inputs in the rock lobster legs. J. Comp. Physiol. 130, 251-258 (1979).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon