Method Article
Neuromodulation et mitochondriale de transport: Live in Imaging neurones de l'hippocampe sur des durées longues
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons un protocole qui permet l'imagerie de la mitochondrie dans la vie des neurones par l'intermédiaire de microscopie par fluorescence sur des durées longues. Imagerie sur de longues périodes est accompli par des lentivirus médiée par l'expression d'une protéine fluorescente mitochondrially ciblées et l'utilisation d'un moyen peu coûteux étape-top incubateur qui a été conçu et construit dans notre laboratoire.
Résumé
Pour comprendre la relation entre le transport mitochondrial et la fonction neuronale, il est essentiel d'observer le comportement des mitochondries en direct neurones cultivés pour des durées étendu 1-3. C'est maintenant possible grâce à l'utilisation de colorants vitaux et des protéines fluorescentes avec laquelle les composants du cytosquelette, les organites, et d'autres structures dans les cellules vivantes peuvent être étiquetées et ensuite visualisé par microscopie à fluorescence dynamique. Par exemple, dans les neurones embryonnaires de poulet sympathique, le mouvement mitochondrial a été caractérisée en utilisant la rhodamine colorant vital 123 4. Dans une autre étude, les mitochondries ont été visualisées dans les neurones du cerveau antérieur chez le rat par transfection de mitochondrially ciblées EYFP 5. Cependant, l'imagerie des neurones primaires en quelques minutes, heures, jours ou même présente un certain nombre de questions. Ce sont notamment les suivants: 1) le maintien de conditions de culture telles que la température, l'humidité et du pH au cours des séances d'imagerie longue; 2) un signal fort et stable, fluorescentes pour assurer la qualité des images acquises et la mesure précise de l'intensité du signal pendant l'analyse d'image; et 3) la limitation des temps d'exposition lors de l'acquisition d'images pour minimiser photoblanchiment et d'éviter la phototoxicité.
Ici, nous décrivons un protocole qui permet l'observation, la visualisation et l'analyse du mouvement des mitochondries dans des cultures de neurones de l'hippocampe avec une résolution temporelle élevée et dans des conditions optimales de survie. Nous avons construit un prix abordable étape-top incubateur qui permet une régulation de température et de débit de gaz bonne atmosphère, et limite également le degré d'évaporation des médias, en assurant un pH stable et l'osmolarité. Cet incubateur est connecté, via l'entrée et la sortie de tuyaux, d'une norme incubateur de culture tissulaire, qui fournit des niveaux d'humidité constante et une atmosphère de 5-10% de CO 2 / air. Cette conception offre une alternative rentable aux incubateurs microscope sensiblement plus cher que ne garantit pas nécessairement la viabilité des cellules pendant plusieurs heures voire plusieurs jours. Pour visualiser la mitochondrie, nous infecter les cellules avec un lentivirus codant pour une protéine fluorescente rouge qui est ciblé vers la mitochondrie. Ceci assure un signal fort et persistant, qui, en conjonction avec l'utilisation d'une source de lumière au xénon stable, nous permet de limiter les temps d'exposition lors de l'acquisition d'images et de tous, mais exclut photoblanchiment et de phototoxicité. Deux ports d'injection sur le dessus de l'incubateur en scène haut permettent l'administration aiguë de neurotransmetteurs et autres réactifs destinés à moduler le mouvement des mitochondries. En somme, lentivirus médiée par l'expression d'un organite ciblées protéine fluorescente rouge et la combinaison de notre stade-dessus incubateur, une conventionnelles microscope inversé à fluorescence, caméra CCD, et la source lumineuse au xénon nous permettent d'acquérir des images en accéléré du transport mitochondrial neurones vivants sur de longues durées que celles possibles dans les études conventionnelles de déployer des colorants vitaux et off-the-shelf systèmes de survie.
Protocole
1. Description du laboratoire construit Stage-dessus Incubateur
Le maintien des cellules vivantes sur une platine de microscope pour des durées étendu offre trois défis majeurs: 1) contrôle de la température ambiante et la réglementation; 2) contrôle de l'humidité, à savoir, le maintien de taux d'humidité de l'atmosphère de l'environnement et 3) maintien de pH dans le milieu de culture. Ces questions «soutien de la vie" sont essentiels pour des expériences impliquant l'observation à long terme des neurones en culture, cellules qui sont particulièrement sensibles aux changements de température et de pH. Ci-dessous, nous décrivons un simple laboratoire construit étape-top incubateur qui nous avons conçu et construit pour l'imagerie en direct de neurones sur des durées prolongées. Cet incubateur est connecté, via un circuit fermé, à un niveau incubateur de culture tissulaire (Thermo Scientific, Asheville, Caroline du Nord), qui fournit une écurie chauffée (37 ° C), atmosphère humidifiée de 10% de CO de l'air 2 / 90%.
- Incubateur enceinte: Le corps de l'incubateur (figure 1 (I, II); A) a été fabriqué sur une machine de fraisage de C & C informatisée à partir d'un morceau de plastique noir delrin. Il mesure 97.74mm (L) x 73.60mm (L) x 28.58mm (H), (dimensions internes de 96.74mm x 72.60mm x 27.58mm) offrant un volume fermé d'environ 19 370 cm 3. Deux trous ont été forés à chaque extrémité de l'enceinte et équipés de picots en laiton fileté pour accommoder les tuyaux d'arrivée et la sortie de / vers l'incubateur de culture tissulaire. Une ouverture rectangulaire mesurant 70.0mm x 43.0mm a été fraisé dans la partie supérieure de l'enceinte afin de permettre le placement d'une fenêtre en plastique polycarbonate (figure 1 (I, II); B). La base de l'incubateur (figure 1 (I, II, III); C; vue de dessus et de profil montré en détail en haut à gauche), broyé de 3 / 16 des stocks d'aluminium ", des mesures 159.77mm (L) x 109.86mm (W ) x 3,175 mm (D), et est conçu pour s'intégrer dans le renfoncement d'une insertion motorisée Leica 3-plaque de scène (Modèle 11-522-068, Leica GmbH, Leipzig, Allemagne). Quatre poteaux en acier avec filetage interne ont été attachés à . les coins de thebase par encastrement vis à tête plate Ceux-ci fournissent des points d'attache solide pour l'enceinte incubateur, qui a été foré à chaque coin d'accepter les postes (figure 1 (II, III); D). Un joint sorbothane (McMaster Carr, Inc, Elmhurst, IL) a été coupé et monté à la base pour assurer une étanchéité à l'interface boîtier / base. Quatre vis en laiton avec filetage correspondant à celle des postes sont utilisés pour sécuriser l'enceinte de la base (figure 1 (II, III);. D) Un trou d'un diamètre 35.1mm avec une lèvre mince encastrée a été coupé au centre de la base de pépinière pour accueillir GBM 35mm (figure 1 (III); E; détail en haut à gauche); bases supplémentaires ont été conçus pour accueillir d'autres tailles boîte de culture.
- Éléments de chauffage: 10 Kohm Deux résistances dissipateur de chaleur (Digi-Key Corp, Thief River Falls, MN) sont apposées sur les parois intérieures de l'enceinte incubateur. Ce sont reliés à un CC 9V, 500mA transformateur qui est branché dans un contrôleur de température 1000W Alife terrarium (Caroline du Pet Supply, Irmo). Une sonde filaire placé par un joint dans la fenêtre de polycarbonate de l'enceinte détecte incubateur interne de la température ambiante et détermine le flux de courant vers la résistance. En conjonction avec l'incubateur de culture tissulaire, les résistances de fournir une mesure supplémentaire de contrôle de la température ambiante.
- Fermé système atmosphère-circuit: Pour fournir une atmosphère constante humidifié et chauffé de l'air 10% de CO 2 / 90%, l'incubateur en scène du haut est relié, via tuyaux d'alimentation et de sortie (figure 1 (I); F, G), à une standard, à chemise d'eau incubateur de culture tissulaire (figure 1 (I), H); Forma Scientific Modèle 3154; Thermo Scientific, Inc, Asheville, Caroline du Nord). Juste avant la connexion à l'incubateur en scène en haut, le tuyau d'arrivée (figure 1 (I); F) se heurte à une pompe d'aquarium standard (figure 1 (I); I; Lifegard QuietOne Modèle 1200, Pentair natation, El Monte, CA) qui a été enfermé dans une boîte en plastique ABS étanche (figure 1 (I), J; Modèle 1150, Pelican Products, Inc, Torrance, CA) pour maintenir un circuit fermé. Cette pompe favorise flux d'air continu de l'incubateur de culture tissulaire à l'incubateur étape-top. Après l'étape de la pompe, le tuyau d'arrivée fonctionne dans une fiole Erlenmeyer de 1500 ml (figure 1 (I), K) qui agit comme un silencieux pour minimiser la transmission de vibrations de la pompe au stade de l'incubateur-dessus. Un tuyau de sortie (Figure 1 (I), G) menant de l'incubateur en scène haut en incubateur de culture tissulaire (figure 1 (I), H) est équipé d'un ventilateur d'ordinateur fermé (figure 1 (I), L), qui, comme la pompe, est également destinée à promouvoir la circulation d'air continue.
- Couvercle de membrane PTFE pour le 35mm GBM: Avant de placer la culture neuronale dans l'incubateur étape-top pour l'imagerie, le GBM 35 mm est équipé d'une spéciale m'aCouvercle mbrane (figure 1 (II, IV); M; détail affiché en haut à droite) afin de permettre les échanges gazeux et dans le même temps de minimiser l'évaporation du milieu de culture. Ce couvercle est constitué d'une jante en plastique delrin et une feuille de pré-coupés du PTFE membrane (téflon; américaine Durafilm Co., Inc, Holliston MA) qui a été tendue sur la jante et maintenu en place avec un joint Viton qui glisse dans une canal de retrait le long du côté de la jante en plastique delrin.
- Ports d'injection: Deux trous ont été forés dans la fenêtre en polycarbonate (figure 1 (II), le détail du centre, les flèches jaunes près de B) de l'incubateur en scène haut. Ils ont été équipés en acier inoxydable seringue Hamilton termine à fournir des ports d'injection pour administrer la 5-HT, DA, les agonistes des récepteurs différents et antagonistes, et les autres réactifs au cours d'une expérience donnée.
2. Préparation des cultures primaires d'hippocampe
Tout le travail est effectué soit dans une hotte à flux laminaire BSL2 ou dans un banc de flux laminaire. Primaire neurones de l'hippocampe sont isolés à partir d'embryons de rat E18 en suivant les procédures 6-7, et sont cultivées dans un milieu sans sérum qui a été conditionné par des astrocytes primaires corticaux. Les cellules gliales sont préparés selon des méthodes publiées 7. Le milieu conditionné est composé de glucose faible DMEM, complété par la proline (1,76 ug / ml), l'asparagine (0,83 ug / ml), vitamine B12 (0,34 ug / ml), glucose (20 mM), riche en lipides BSA (0,5 mg / ml ) et 2% de B27 8-10. Pas d'antibiotiques sont ajoutés au milieu, car ils peuvent interférer avec la transcription des gènes neuronaux.
- Couvrir la partie centrale en verre lamelle d'une boîte de culture à fond de verre 35mm (GBM) de poly-D-lysine (0,05 mg / ml dans du PBS), et laisser reposer pendant deux heures à 37 ° C. Aspirer la solution de poly-D-lysine, laisser sécher pendant 20 minutes dans une hotte à flux laminaire BSL2. Couvrir la partie lamelle de poly-D-lysine sur la GBM de laminine (0,01 mg / ml dans du PBS), et laisser pendant un minimum de 40 minutes avant de retirer la solution la laminine excès. Mettez de côté pendant 20 minutes.
- Disséquer hippocampes à partir de cerveaux d'embryons de rat E18, et dissocier les comme décrit dans Current Protocols in Neuroscience 6.
- Diluer les cellules dissociées en milieu de croissance pour permettre une densité de 110 000 cellules par GBM. Calculer la concentration nécessaire de cellules dans votre master mix en fonction du nombre d'GBM vous préparer.
- Placez GBM ensemencées dans une température de l'incubateur mis ATA de 37 ° C et un mélange atmosphère de CO de 10% de l'air 2 / 90%.
- Trois à cinq jours plus tard, selon les conditions de croissance des neurones, ajouter arabinoside C (0,14 ng / ml) pour les cultures de réprimer la prolifération gliale.
- Autoriser les cultures de croître pendant deux semaines avant d'infecter les lentivirus. Pendant ce temps, de remplacer un tiers du volume de milieu dans chaque GBM avec un milieu frais tous les trois jours. Ne pas dépasser cette quantité de médias, car cela pourrait conduire à un choc osmotique et la mort cellulaire.
3. Préparation des Encodage lentivirus recombinant protéine fluorescente rouge
Pour les enquêteurs qui n'ont pas accès aux installations pour la production de lentivirus recombinants, la production personnalisée par une entité commerciale, par exemple Biosciences System (Mountain View, Californie) est une option.
Un mitochondrially ciblées gène rouge fluorescent protein (MitoTurboRFP; Axxora LLC, San Diego, Californie) est inséré dans une auto-inactivation du virus recombinant immunodéficience féline sous le contrôle transcriptionnel de l'activateur du cytomégalovirus promoteur majeur du gène précoce immédiat 11. Lentivirus recombinants sont produits par transfection transitoire de cellules 293T.
- Plaque 293T à une densité de ~ 75 000 cellules / cm 2, le lendemain, co-transfecter des cellules avec des plasmides codant le vecteur viral recombinant, gag et pol FIV, et le gène stomatite vésiculaire glycoprotéine G du virus, en utilisant PolyJet (SignaGen Laboratories, Gaithersburg, MD). Un total de 12 ug d'ADN (4,8 mg vecteurs viraux, 4,8 ug de plasmide gagpol, et 2,4 mg de plasmide VSV G) est utilisée pour chaque boîte de culture de cellules 293T 10cm.
- Après 24 heures, aspirer le milieu de culture et les cellules de lavage avec du rouge de phénol solution sans saline équilibrée de Hanks pour éliminer l'ADN résiduel. Ajouter 10 ml de milieu sans sérum basale neuronale complétée par 50μg/ml riche en lipides BSA et Glutamax.
- Le jour suivant, la récolte du surnageant, filtrer à travers un filtre de 0,2 micron à faible liaison protéique et d'ajouter à une unité d'ultrafiltration Vivaspin 20 polyéthersulfone (Sartorius, Concord, USA). Pré-traiter l'unité séquentielle Vivaspin par lavage à l'éthanol 70%, l'eau de qualité culture de tissu, et un tampon phosphate salin. Concentrer le surnageant contenant le virus ~ 50 fois par centrifugation à 1500xg pendant 30 minutes. Aliquoter la préparation de virus et de stocker dans un liquide N 2.
- Estimer la quantité de virus en infectant les cellules de rat B104 avec une aliquote de virus concentré, et en mesurant l'expression des protéines fluorescentes par cytométrie en flux 72 heures plus tard. Le pourcentage de cellules positives fournit une estimation de la quantité de volume à savoir le virus du virus concentré nécessaires pour obtenir l'expression des protéines fluorescentes dans un nombre donné de neurones primaires.
4. L'infection de neurones cultivés
Cultures de neurones hippocampiques sont infectées à 14 jours in vitro, en ajoutant simplement la quantité de virus pour infecter estimé jusqu'à 50% de tous les neurones à partir des données de cytométrie en flux. Aucun polybrène est utilisé. Les cultures sont maintenues pendant 3 jours avant de vérifier l'expression des protéines fluorescentes. Si le signal est trop faible, alors la culture est retourné à l'incubateur de culture tissulaire et retesté après plusieurs jours.
5. Entretien général du système de circuit fermé de soutien de la vie
- Pour maintenir une humidité adéquate, faire en sorte que la chemise d'eau de l'incubateur est périodiquement vérifié et rempli lorsque cela est nécessaire. Soyez sûr de placer un acier inoxydable ou en barquette d'aluminium dans l'incubateur contenant un petit volume d'eau (25mm de profondeur) et algicide.
- Si nécessaire, effacer le tuyaux d'alimentation et de sortie du circuit atmosphère incubateur en vidant l'eau recueillie dans les tubes de captage. Rincer régulièrement les tuyaux avec de l'éthanol à 70%.
6. Application Couvercle Membrane GBM et placement dans l'étape-top Incubateur
- Avant le placement de la GBM intérieur de l'incubateur en scène dessus, remettre le couvercle en plastique avec couvercle recouvert d'une membrane dans une hotte de culture de tissus. Une fois cela fait, vous pouvez déplacer le GBM couvert pour le microscope.
- Insérez la GBM avec la membrane recouverte de couvercle dans l'ouverture en retrait sur la base de l'incubateur en scène haut. Pour éviter de bousculer le GBM, assurez-vous que la base est déjà en place sur la platine du microscope, puisque les clips de base dans la scène avec quelques difficultés, il est préférable de placer le GBM, après que la base est en place.
- Alignez l'enceinte de l'incubateur avec des poteaux en acier sur la base de l'incubateur et inférieure du boîtier sur le socle. Serrez les vis jusqu'à ce qu'une bonne étanchéité est réalisée entre l'enceinte et la base.
7. Image Acquisition
Notez que la majorité des plates-formes de logiciels d'imagerie disponibles ont des fonctionnalités comparables à travers une large gamme de microscopes et de matériel connexe. Une variété d'acquisition d'image et de plates-formes de logiciels d'analyse sont disponibles, y compris MetaMorph et programmes conçus pour les différentes marques du microscope, tels que Leica Application Suite, Nikon NIS-Elements, et AxioVision Carl Zeiss. Dans ce protocole, nous décrivons l'acquisition des images et des procédures d'analyse nous avons effectué à l'aide Slidebook 5 (Intelligent Imaging Innovations, Denver, CO). Toutefois, les étapes constitutives de chaque opération décrite dans ce protocole peut être facilement adaptée à l'utilisation d'une variété d'autres programmes.
Description du microscope à fluorescence inversé, les configurations de filtre, caméra CCD, source de lumière au xénon, et un logiciel d'imagerie:
Pour l'imagerie dynamique du transport mitochondrial dans les neurones de l'hippocampe, nous utilisons un Leica DMI-6000B microscope inversé à fluorescence et modèle 11-522-068 platine motorisée (Leica Microsystems CMS GmbH, Wetzlar, Allemagne) équipé d'un égaliseur Cooke Sensicam caméra CCD (Le Cooke Corporation, Romulus, MI), un Sutter Lambda 10-2 roue à filtres et le contrôleur (Sutter Instrument Company, Novato, CA), et une Sutter DG-4 source de lumière au xénon 300W. Pour visualiser mitochondries étiquetés avec la protéine fluorescente rouge MitoTurbo, nous utilisons la combinaison d'un filtre 555nm à la source de lumière DG-4 pour l'excitation et des filtres de 600 nm (pic; Sedat Quad Modèle Beamsplitter 86100bs monté Leica DM cube de filtre de série, la technologie Chroma Corp, Bellows Falls, VT) et 617nm au microscope et la roue à filtres, respectivement, pour l'émission.
Pour l'acquisition d'image et de l'analyse, nous utilisons le package de logiciels d'imagerie numérique de microscopie Slidebook 5. Ceci est un paquet complet qui permet un contrôle entièrement automatisé du microscope, le stade, la roue à filtres, la caméra et source de lumière lors de l'acquisition d'images, ainsi qu'une variété de traitement d'image et des modules d'analyse.
Ci-dessous, nous apporte une aide spécifique, étape par étape les instructions pour l'acquisition des images laps de temps de déplacement des mitochondries dans les neurones marqués par fluorescence à l'aide Slidebook 5.
- Assurez-vous que le microscope, le contrôleur de roue à filtres, source de lumière et une caméra CCD ont été mis sous tension avant l'ouverture Slidebook 5.
- Pour l'imagerie en direct de la mitochondrie, passer à une immersion dans l'huile 63X objectif, moins la tourelle objectif suffisamment pour fournir l'accès à l'objectif en dessous de la platine du microscope (et le stadeIncubateur-dessus), et appliquer soigneusement l'huile directement à la surface de l'objectif. Ouvrez la fenêtre de discussion en cliquant sur l'icône «Fenêtre Focus» sur la barre d'outils Slidebook. Dans la fenêtre de discussion, allumer la lampe fond clair en faisant glisser un curseur étiqueté «lampe», d'ajuster l'intensité fond clair à un niveau convenable. Acquérir concentrer sur un champ de cellules et de trouver une cellule d'intérêt.
- Sous le titre «Champ d'application» onglet, sélectionnez le 'CY3' fluor. Utilisation de l'oculaire, sous un éclairage fluorescent à trouver le plan de mise pour les mitochondries dans les cellules qui ont été étiquetées avec la protéine Mito TurbRed. Une fois que vous avez acquis grâce à l'accent des oculaires, passer à la caméra CCD et acquérir de nouveau l'accent, si nécessaire.
- Ouvrez la fenêtre de capture d'image en cliquant sur l'icône «Image Capture» sur la barre d'outils Slidebook. En commençant par un temps d'exposition initiale de 100 ms, trouver le temps d'exposition optimale en utilisant le «test» et «Meilleur Trouvez les boutons, ou alternativement, vous pouvez utiliser le 'Once' bouton. Rappelez-vous que le temps d'exposition devrait fournir l'intensité amplement réparties à travers le champ de l'image entière (par exemple, 0-2500; indiqué par l'histogramme en bas de la fenêtre de capture d'image) dans une durée minimale (par exemple, 200-800ms).
- Avant de commencer l'acquisition des images en accéléré, ouvrez le "Avancé" fenêtre en cliquant sur l'onglet "Avancé" toujours dans la fenêtre de capture d'image. Trouvez la 'Focus' onglet, cocher la case 'Autofous' option de cours time-lapse/multipoint capture », et d'ajuster les réglages autofocus d'acquisition d'images en accéléré. Généralement, on utilise les paramètres suivants pour l'autofocus: mise à jour tous les 2-3 attention des cadres; sélectionner comme l'autofocus canaliser le fluor utilisé pour l'imagerie étiquetés mitochondries, c'est à dire, Cy3, plage de recherche total de 2 um pour un grossissement de 63x.
- Dans la 'Capture' fenêtre, sous la case «Type de capture», cochez l'option "Timelapse" et sélectionnez l'intervalle d'imagerie désiré et la durée de la session d'imagerie dans les options 'Capture Timelapse ". Dans nos études sur les effets des neuromodulateurs sur le transport mitochondrial, imagerie time-lapse a été réalisée en séances d'une heure dans lequel un total de 360 images ont été acquises à intervalles de 10 secondes entre les images.
- Démarrer l'acquisition d'images en accéléré en cliquant sur le bouton "Démarrer" en bas, côté droit, de la "capture" fenêtre.
- Après la période initiale, ou le contrôle, la session d'imagerie, d'administrer les neurotransmetteurs et les autres réactifs, via les ports haut de l'incubateur en scène dessus et démarrer une session d'imagerie.
8. Image Analysis
- Ouvrez le fichier image enregistré après la séance d'imagerie dernier.
- Mitochondries individuelles peuvent être étiquetées dans une série d'images en accéléré automatiquement ou manuellement en utilisant les fonctions de masquage fournie dans Slidebook 5.
- Sous le «masque» du menu, sélectionnez "segment" de la barre de menu. En faisant glisser la ligne de seuil bas et haut du 'histogramme' outil, masquant toutes les particules en bleu dans l'image entière, couvrant tous les mitochondries contenues dans le processus, mais en laissant des particules aussi discrète que possible. Appliquer le masque de la série image entière.
- Créer un deuxième masque (sous le «masque» du menu, sélectionnez «Create») qui couvre toute l'image sauf pour le processus d'intérêt dans laquelle les particules ont été mis en évidence par le masque précédent. Ceci est accompli, d'abord, en utilisant l'outil «crayon» la plus épaisse de tracer les limites des zones en dehors du processus, puis, en utilisant l'outil "pot de peinture" à remplir dans les régions délimitées. Appliquez ce masque à la série toute l'image.
- Sous «Masque», «Opérations Masque" sélectionner et effectuer «moins» opération, à savoir, le second masque est soustrait le masque poing (l'image entière, sauf le processus). Un troisième masque sera généré dans laquelle seul le processus d'intérêt est en surbrillance. Notez que ce nouveau masque sera appliqué à la série toute l'image.
- Sous «Annotations, 'select' Object ID».
- Vérifiez la continuité et les affectations numérique des mitochondries individu masqué manuellement en revue la série d'images (en Slidebook 5, le «jeu», «cadre avant, 'et' frame inverse, les boutons en dessous de la fenêtre d'image peut être utilisée à cet effet).
- Sélectionnez le «masque» onglet sur la barre de menu. Sous "Masque", sélectionnez "Suivi de particules» et courir «des particules de base de suivi» pour générer des «Statistiques Chemin,« y compris les coordonnées du centroïde de chaque mitochondrie masqués.
- Distance parcourue par chaque mitochondrie entre deux trames d'image adjacents est calculé à partir des coordonnées de chaque particule dans chaque trame.
- Dans nos études précédentes de l'effet des neuromodulateurs sur le mouvement des mitochondries, nous avons identifié trois populations distinctes de mitochondries:. "Stationnaire", "oscillatoire,» et «mouvement directionnel» Si une mitochondrie voyages de moins de 0,2 um (ou 2 pixels, sous un grossissement de 63X; 1 pixel = 0,10235 UM) au sein d'une heure, il est caractérisé comme «stationnaire». Si une mitochondrie se déplace d'au moins 0,2 um, mais inférieur à 2.5 um, dans un cycle antérograde-rétrograde, il est défini comme «oscillatoire». Enfin, si une mitochondrie parcourt une distance nette de plus de 2,5 um dans une direction, il est classé comme mouvement directionnel. Montre la figure 2 est un histogramme montrant le mouvement de tous les mitochondries étiquetés dans une expérience représentative, ainsi que d'un diagramme circulaire montrant la répartition en pourcentage des trois populations distinctes de mitochondries.
- La vitesse moyenne de chaque mitochondrie est calculé en fonction de la distance totale parcourue lors d'une séance d'imagerie donné. La vitesse moyenne d'une population mitochondriale est calculé en additionnant les vitesses individuelles et en divisant par le nombre total de suivi des mitochondries.
- Kymographs peuvent être générés en utilisant un module prévu dans le Slidebook 5. Utiliser le «masque» de fonction, tracer une ligne fine sur toute l'étendue entière d'un processus donné (par exemple axone); être sûr de passer à travers autant de centroïdes mitochondrial que possible. Allez à la «masque» onglet sur la barre de menu et sélectionnez "Opérations avancées", puis "Analyse courbe lisse. Utilisez le paramètre par défaut pour l'analyse des courbes lisses ou personnaliser comme désiré. Exécuter le module d'analyse courbe lisse. A la fin de l'analyse, un kymographe de la session d'imagerie seront affichés.
- Aller à la barre de menu et "Afficher", puis «Export TIFF.
- Ouvrez le fichier. Tif contenant les kymographe dans Photoshop ou un programme d'image comparable de traitement et de convertir l'image en niveaux de gris inversée.
9. Les résultats représentatifs
En suivant et en analysant le mouvement des mitochondries dans des cultures de neurones de l'hippocampe, nous avons démontré un lien entre la neuromodulation et le trafic mitochondrial. Plus précisément, nous avons constaté que la sérotonine (5-HT) ou l'agoniste du récepteur 5-HT1A, 8-OH-DPAT, stimule le mouvement des mitochondries (figure 2A-C) 8, alors que la dopamine (DA) ou l'agoniste du récepteur D2, la bromocriptine inhibe le mouvement des mitochondries (figure 2D-G) 9.
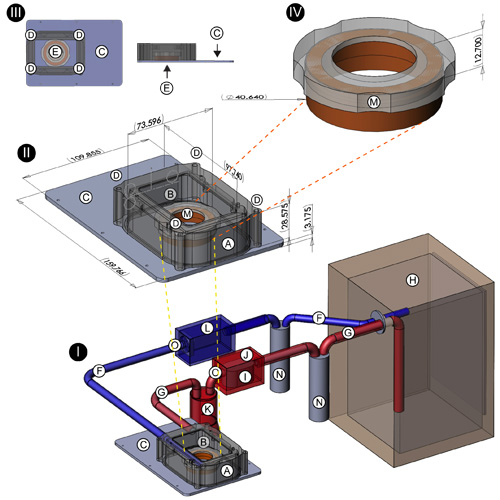
Figure 1. Conception de l'étape-top-circuit système fermé incubateur Les composants suivants du système de pépinière sont présentées: résistant à la chaleur boîtier en plastique delrin (A); ouverture rectangulaire en plastique polycarbonate pour la fenêtre (B); base en aluminium de l'incubateur (C); trous. à accepter des postes d'acier de base (D); trou de diamètre 35.1mm avec lèvre encastré minces au centre de l'incubateur de base pour accueillir des plats GBM 35mm (E); tuyaux Nalgene (liens entre la culture de tissus et le stade-top incubateurs; pièges à humidité) ( F, G, N); incubateur de culture tissulaire (H); pompe d'aquarium (I); étanche boîtier en plastique ABS (logement pour pompe d'aquarium) (J); 2000ml erlenmeyer (silencieux pour la suppression des vibrations dans les tuyaux avant l'étape-dessus pépinière) (K); boîtier en plastique pour ventilateur de refroidissement (L); cadre en plastique pour le 35mm GBM couvercle (M), la position des robinets en plastique (O). Emplacements des ports pour l'administration de réactifs sont indiquées par des flèches jaunes (II).

Figure 2. Les résultats représentatifs: la régulation du transport mitochondrial A.. Axone d'un neurone de rat typiques hippocampe en culture. Mitochondries étiquetés avec une protéine fluorescente lentivirus codés sont indiquées en vert; axones immunomarquées avec phospho-neurofilaments anticorps sont indiquées en rouge. Étendue de l'axone est indiqué par des flèches jaunes. L'image est composée de quatre micrographies qui se chevauchent. B. Exemple d'une série d'images en accéléré montrant les changements dans le mouvement des mitochondries après l'administration de 5-HT. Les images ont été acquises au moyen d'un microscope inversé à fluorescence et stocké sous forme de séquences qui ont ensuite été convertis en films QuickTime. Une séquence représentative d'images montre individuels mitochondries à différents moments avant (à gauche) et après (à droite) l'administration de la 8-OH-DPAT, un agoniste des récepteurs 5-HT1A. Verticale rectangle rouge met en évidence une mitochondrie stationnaire (à gauche) et une mitochondrie oscillatoires (à droite) sur plusieurs moments. La mitochondrie oscillatoires indiqué (panneau de gauche) se dirige vers la terminaison axonale après traitement avec la 8-OH-DPAT (panneau de droite; bordé de rouge flèches blanches). La ligne jaune verticale (à droite) indique la position de départ de la mitochondrie en mouvement. Les intervalles de temps sont affichés en bas à droite de chaque image. Grossissement (63 ×) est indiqué dans le coin inférieur droit du panneau de droite. C, D. Parcelles montrant les changements dans le mouvement des mitochondries après l'administration de 5-HT. Les changements dans le mouvement mitochondriale avant (C) et après (D) l'administration de 5-HT sont présentés comme des parcelles de la vitesse (axe X) vs positions initiales des mitochondries individuels le long de l'axone (axe Y). Vitesse et la proportion d'arrêt (rouge), oscillatoires (bleu), et mouvement directionnel (vert) mitochondria sont représentés dans les parcelles et les camemberts (EISN-dessus des parcelles), respectivement. Pointillés rouges en saillie sur les régions en surbrillance de l'axone bande dessinée à l'axe des Y de chaque parcelle indiquent l'emplacement approximatif et l'étendue du segment de l'axone qui a été imagé. E, F. Les parcelles présentant des changements dans le mouvement des mitochondries après l'administration de DA. Les changements dans le mouvement mitochondriale avant (E) et après (F) l'administration de DA sont présentées comme des parcelles de la vitesse (axe X) vs positions initiales des mitochondries individuels le long de l'axone (axe Y). Vitesse et la proportion d'arrêt (rouge), oscillatoires (bleu), et mouvement directionnel (en vert) sont représentées dans les mitochondries des parcelles et des camemberts (EISN-dessus des parcelles), respectivement. Pointillés rouges en saillie sur les régions en surbrillance de l'axone bande dessinée à l'axe des Y de chaque parcelle indiquent l'emplacement approximatif et l'étendue du segment de l'axone qui a été imagé. G, H. kymographs Représentant montrant le mouvement des mitochondries dans un neurone en culture avant (G) et après (H) l'administration de l'agoniste du récepteur D1R, bromocriptine. Le neurone a été imagée pendant une heure avant (G) et suivantes (H) l'administration d'une heure de la bromocriptine.
Discussion
Employant lentivirus médiée par l'expression d'une protéine fluorescente ciblé à la mitochondrie dans les neurones infectés cultivé et un peu coûteux en laboratoire construit étape-top incubateur qui permet l'imagerie de cellules vivantes pour des durées prolongées, nous avons été en mesure d'étudier le lien entre le mouvement des mitochondries et des signaux neuromodulateurs , tels que la sérotonine (5-HT), la dopamine (DA), et l'acétylcholine (ACh). Nos études ont permis d'élucider une voie de signalisation qui, pour la première fois, le trafic mitochondrial liens à des changements dans l'activité des neurones modulée par des neurotransmetteurs tels que la 5-HT et DA - qui sont au cœur de la fonction neuronale. Nous constatons que l'utilisation de protéines fluorescentes ciblées permet l'observation des mitochondries étiquetés dans la vie des neurones cultivés sur de longues périodes qui peuvent être plus physiologiquement pertinents que les durées beaucoup plus courtes qui sont possibles en utilisant des colorants vitaux. Par ailleurs, l'intensité du signal fluorescent protein nous permet de garder le temps d'exposition courts lors de l'acquisition, en minimisant la possibilité de photoblanchiment ou de phototoxicité. Enfin, une étape-top simple et peu coûteux incubateur qui maintient la température ambiante, l'humidité et de CO 2 niveaux, tout en minimisant l'évaporation de médias, nous permet de suivre le mouvement des mitochondries dans la vie des neurones pendant des heures voire des jours. Les chercheurs qui souhaitent fabriquer un incubateur étape-top pour les observations à long terme des mitochondries dans des neurones vivants ne doivent pas suivre les détails précis de notre conception, à condition que les propriétés des matériaux utilisés (par exemple, le gaz membrane perméable pour éviter l'évaporation des médias ) et les principes appliqués (par exemple, contrôle de la température et l'humidité, du pH tampon, le maintien de l'osmolarité) sont généralement compatibles avec ce qui est décrit dans ce protocole.
Déclarations de divulgation
Remerciements
Nous tenons à remercier Donald Hutson pour contribuer son expertise technique et une grande habileté lors de la conception et la fabrication de l'incubateur en scène haut. Nous sommes également reconnaissants à Ayda Dashtaei pour son excellente assistance technique. Tout le travail a été soutenu par Neurosciences Research Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Quantité | Description (et l'emplacement dans la Figure 1) | ||
|---|---|---|---|
| 1 | Incubateur de culture tissulaire (H) | ||
| 1 | Résistant à la chaleur boîtier en plastique (delrin ou comparables) (A) | ||
| 1 | Cadre en plastique pour le 35mm GBM couvercle (pour l'apposition membrane pour boîte de Petri) (M) | ||
| 1-2 | linéaires pi matériels Effacer PTFE membrane (téflon) | ||
| 4 | Vis à oreilles en laiton | ||
| 2 | Petites résistances radiateur 10kOhm (utilisés comme éléments de chauffage à l'intérieur en scène haut de l'enceinte incubateur) | ||
| 1 | Transformateur (fourniture de courant 9V à résistances) | ||
| 1 | Régulateur de température et sonde terrarium (régulation thermostatique de la puissance aux résistances du radiateur via transformateur) | ||
| 1 | 2000ml Erlenmeyer (silencieux pour la suppression des vibrations dans les tuyaux avant l'étape-dessus incubateur) (K) | ||
| 1 | 1 / 8 feuilles sorbothane "(matériau de joint pour la base de l'étape-dessus incubateur) | ||
| 1 | Hermétique ABS (ou comparable) boîte en plastique (boîtier de la pompe d'aquarium) (J) | ||
| 1 | Pompe d'aquarium (I) | ||
| 1 | Petit ventilateur d'ordinateur | ||
| 1 | Boîtier en plastique pour ventilateur de refroidissement (L) | ||
| 1 | 9V transformateur pour ventilateur d'ordinateur | ||
| 20-30ft | Tuyau Nalgene ou de silicone (liens entre la culture de tissus et le stade-top incubateurs; pièges à humidité) (F, G, N) | ||
| 2 | Robinets en plastique (pour ouvrir et fermer le débit d'air avant et après l'étape-dessus incubateur) (O) | ||
| 4 | Raccords de tuyaux en laiton barbelé (pour les raccords de tuyau de / vers l'étape-top incubateur et enceinte de la pompe d'aquarium) | ||
| 2 | Coupleurs rapides en laiton (pour les raccords de tuyau de / vers l'étape-top incubateur) | ||
| 2 | Coupleurs rapides en laiton (pour les raccords de tuyau de / vers l'étape-top incubateur) |
Tableau 1. Stage-dessus des pièces incubateur:
| Nom du réactif | Société | Numéro de catalogue |
|---|---|---|
| Poly-D-lysine | Sigma-Aldrich | P7280-5MG |
| laminine | Roche Applied Science | 11243217001 |
| 35 mm à fond de verre plats | MatTek | P35GC-0-14-C |
| DMEM | Life Technologies | 10567 |
| B27 | Life Technologies | 17504-044 |
| Glutamax | Life Technologies | 35050 |
| Riche en lipides BSA | Life Technologies | 11020-021 |
| L-asparagine | Sigma-Aldrich | P0380-100G |
| L-proline | Sigma-Aldrich | A8381-100G |
| La vitamine B-12 | Sigma-Aldrich | V2876-100MG |
| 5-HT | Sigma-Aldrich | H9523-25MG |
| 8-OH-DPAT | Sigma-Aldrich | H8520-25MG |
| Dopamine | Sigma-Aldrich | H8502-5G |
| Bromocriptine | Sigma-Aldrich | B2134-25MG |
| SKF38393 | Sigma-Aldrich | D047-100MG |
Références
- Ligon, L. A., Steward, O. Movement of mitochondria in the axons and dendrites of cultured hippocampal neurons. J Comp Neurol. 427, 340-350 (2000).
- Miller, K. E., Sheetz, M. P. Direct evidence for coherent low velocity axonal transport of mitochondria. J Cell Biol. 173, 373-381 (2006).
- Macaskill, A. F. Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses. Neuron. 61, 541-555 (2009).
- Morris, R. L., Hollenbeck, P. J. Axonal transport of mitochondria along microtubules and F-actin in living vertebrate neurons. J Cell Biol. 131, 1315-1326 (1995).
- Rintoul, G. L., Filiano, A. J., Brocard, J. B., Kress, G. J., Reynolds, I. J. Glutamate decreases mitochondrial size and movement in primary forebrain neurons. J Neurosci. 23, 7881-7888 (2003).
- Crawley, J. N. . Current protocols in neuroscience. , (1999).
- Fedoroff, S., Richardson, A. . Protocols for neural cell culture. , (2001).
- Chen, S., Owens, G. C., Crossin, K. L., Edelman, D. B. Serotonin stimulates mitochondrial transport in hippocampal neurons. Mol Cell Neurosci. 36, 472-483 (2007).
- Chen, S., Owens, G. C., Edelman, D. B. Dopamine inhibits mitochondrial motility in hippocampal neurons. PLoS One. 3, e2804-e2804 (2008).
- Chen, S., Owens, G. C., Makarenkova, H., Edelman, D. B. HDAC6 regulates mitochondrial transport in hippocampal neurons. PLoS One. , e10848-e10848 (2010).
- Curran, M. A., Kaiser, S. M., Achacoso, P. L., Nolan, G. P. Efficient transduction of nondividing cells by optimized feline immunodeficiency virus vectors. Mol Ther. 1, 31-38 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon