Method Article
Neuromodulazione e mitocondriale di trasporto: Imaging Live in neuroni dell'ippocampo oltre durate a lungo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Noi descriviamo un protocollo che permette l'imaging di mitocondri in vita i neuroni tramite microscopia a fluorescenza su durate lunghe. Imaging per lunghi periodi si realizza attraverso lentivirus-mediata espressione di una proteina fluorescente mitocondri mirata e l'uso di un poco costoso stadio-top incubatore che è stato progettato e costruito nel nostro laboratorio.
Abstract
Per capire il rapporto tra trasporto mitocondriale e la funzione neuronale, è importante osservare il comportamento mitocondriale in vivo neuroni in coltura per la durata estesa 1-3. Questo è ora possibile attraverso l'utilizzo di coloranti vitali e delle proteine fluorescenti con cui i componenti del citoscheletro, organelli e altre strutture nelle cellule viventi possono essere etichettati e poi visualizzati tramite dinamica microscopia a fluorescenza. Per esempio, embrioni di pollo nei neuroni simpatici, il movimento dei mitocondri è stato caratterizzato utilizzando il colorante vitale rodamina 123 4. In un altro studio, i mitocondri sono stati visualizzati nei neuroni del proencefalo ratto mediante trasfezione di mitocondri mirati eYFP 5. Tuttavia, l'imaging di neuroni primari più minuti, ore o addirittura giorni presenta una serie di questioni. Tra questi sono: 1) mantenimento delle condizioni di coltura, quali temperatura, umidità e pH durante lunghe sessioni di imaging, 2) un segnale forte e stabile fluorescente per garantire sia la qualità delle immagini acquisite e misurazione precisa di intensità del segnale durante l'analisi delle immagini; e 3) limitare i tempi di esposizione durante l'acquisizione dell'immagine per minimizzare ed evitare photobleaching fototossicità.
Qui, descriviamo un protocollo che permette l'osservazione, la visualizzazione e l'analisi del movimento mitocondriale in colture di neuroni dell'ippocampo con alta risoluzione temporale e in condizioni ottimali di supporto vitale. Abbiamo costruito un acquistabile fase-top incubatore che fornisce una buona regolazione della temperatura e il flusso dei gas atmosferici, e limita anche il grado di evaporazione media, assicurando il pH stabile e osmolarità. Questa incubatrice è collegato, tramite tubi di alimentazione e scarico, ad una cultura incubatore standard di tessuto, che fornisce livelli di umidità costante e un'atmosfera di 5-10% di CO 2 / aria. Questo progetto offre una conveniente alternativa agli incubatori microscopio molto più costosi che non necessariamente garantiscono la vitalità delle cellule di molte ore o anche giorni. Per visualizzare i mitocondri, che infettano le cellule con un lentivirus che codifica per una proteina fluorescente rossa che si rivolge al mitocondrio. Questo assicura un segnale forte e persistente, che, in concomitanza con l'uso di una stabile fonte di luce allo xeno, ci permette di limitare i tempi di esposizione durante l'acquisizione dell'immagine e di tutti, ma preclude photobleaching e fototossicità. Due porte di iniezione sulla parte superiore del palco-top incubatore consente la somministrazione acuta di neurotrasmettitori e altri reagenti destinati a modulare il movimento mitocondriale. In sintesi, lentivirus-mediata espressione di un organello mirati proteina fluorescente rossa e la combinazione del nostro stadio-top-incubatore, un microscopio invertito a fluorescenza convenzionale, telecamera CCD, e la sorgente di luce allo xeno ci permettono di acquisire immagini time-lapse di trasporto mitocondriale in neuroni vita nei periodi più lunghi rispetto a quelli possibili negli studi di distribuzione convenzionali coloranti vitali e off-the-shelf sistemi di supporto vitale.
Protocollo
1. Descrizione del Laboratorio di costruzione Stage-top Incubator
Mantenere le cellule viventi su un palco microscopio per durate esteso offre tre sfide principali: 1) controllo della temperatura ambiente e regolazione, 2) il controllo dell'umidità, vale a dire, mantenendo il contenuto di umidità dell'atmosfera ambientale e 3) mantenimento del pH corretto nel terreno di coltura. Temi questi 'sostegno vitale' sono fondamentali per la sperimentazione delle osservazione a lungo termine dei neuroni in coltura, le cellule che sono particolarmente sensibili alle variazioni di temperatura e pH. Di seguito, descriviamo un semplice laboratorio di un palco allestito-top incubatore che abbiamo progettato e costruito per l'imaging dal vivo di neuroni oltre durata estesa. Questo incubatore è collegato, tramite un circuito chiuso, ad una cultura incubatore standard di tessuto (Thermo Scientific, Asheville, NC), che fornisce una stalla riscaldata (37 ° C), atmosfera umidificata al 10% di CO 2 / 90% di aria.
- Incubator custodia: Il corpo della dell'incubatore (figura 1 (I, II); A) è stato realizzato su un sistema informatizzato Fresatrice C & C da un unico blocco di plastica nera delrin. Esso misura 97,74 millimetri (L) x 73,60 millimetri (L) x 28,58 millimetri (H), (dimensioni interne di 96,74 millimetri x 72,60 millimetri x 27,58 millimetri) che fornisce un volume chiuso di circa 19370 centimetri 3. Due fori sono stati perforati alle due estremità del locale e dotati di barbe in ottone filettato per accogliere tubi di entrata ed uscita da / verso il tessuto culturale incubatore. L'apertura rettangolare di 70,0 millimetri x 43,0 millimetri è stata fresata fuori nella parte superiore del contenitore per permettere il posizionamento di una finestra di plastica in policarbonato (Figura 1 (I, II), B). La base della incubatore (figura 1 (I, II, III), C, vista dall'alto e di profilo mostrato in dettaglio in alto a sinistra), fresato da 3 / 16 "di serie in alluminio, misura 159,77 millimetri (L) x 109,86 millimetri (W ) x 3,175 millimetri (D), ed è progettato per adattarsi al recesso inserimento di un motorizzato Leica 3-piastra portaoggetti (Modello 11-522-068, Leica Gmbh, Lipsia, Germania). Quattro pali in acciaio con filettatura interna sono state allegate al . angoli delle thebase da incasso viti a testa piatta Questi forniscono punti di attacco solido per il recinto incubatore, che è stato perforato fuori ad ogni angolo di accettare le cariche (Figura 1 (II, III), D). Una guarnizione sorbotano (McMaster Carr, Inc., Elmhurst, IL) è stato tagliato e montato alla base per garantire una chiusura alla custodia / interfaccia di base. Quattro viti in ottone con filettatura corrispondente a quello dei posti sono utilizzati per fissare la custodia alla base (Figura 1 (II, III);. D) un foro di diametro 35,1 millimetri con un labbro sottile incasso è stato tagliato al centro della base incubatore per ospitare GBM 35 mm (Figura 1 (III), E, dettaglio in alto a sinistra); basi aggiuntive sono state progettate per ospitare altre dimensioni della parabola cultura.
- Resistenze: due 10 Kohm resistenze dissipatore di calore (di Digi-Key Corp., Thief River Falls, MN) sono affissi alle pareti interne del contenitore incubatore. Questi sono collegati ad un DC 9V, 500mA trasformatore che viene collegato a un controller di temperatura terrario Alife 1000W (Carolina del rifornimento dell'animale domestico, Irmo, Carolina del Sud). Una sonda cablata effettuati tramite una guarnizione nella finestra in policarbonato della custodia incubatore rileva la temperatura ambiente interno e determina il flusso di corrente alle resistenze. In concomitanza con il tessuto culturale incubatore, le resistenze di fornire un'ulteriore misura di controllo della temperatura ambiente.
- Sistema chiuso atmosfera circuito: Per fornire un ambiente costante umidificata e riscaldata di aria CO 10% 2 / 90%, lo stadio-top incubatore è collegato, tramite tubi di alimentazione e di uscita (figura 1 (I), F, G), ad un standard, con camicia d'acqua di coltura tissutale incubatore (Figura 1 (I), H); Modello Forma Scientifico 3154; Thermo Scientific, Inc., Asheville, NC). Poco prima di collegare alla fase-top incubatore, il tubo di alimentazione (Figura 1 (I), F), si imbatte in una pompa acquario standard (Figura 1 (I), I; Lifegard QuietOne Modello 1200, Pentair Aquatics, El Monte, CA) che è stato racchiuso in una scatola sigillata in plastica ABS (Figura 1 (I), J; Modello 1150, Pelican Products, Inc., Torrance, CA) per mantenere un circuito chiuso. Questa pompa promuove il continuo flusso d'aria dal tessuto cultura incubatore alla fase-top incubatrice. Dopo la fase della pompa, il tubo di alimentazione corre a un pallone di Erlenmeyer 1500 ml (Figura 1 (I), K), che agisce come un silenziatore per ridurre al minimo la trasmissione delle vibrazioni dalla pompa alla fase-top incubatrice. Un tubo di scarico (figura 1 (I), G), che dal palco-top incubatore al tessuto culturale incubatore (Figura 1 (I), H) è dotato di una ventola per computer in dotazione (Figura 1 (I), L), che, come la pompa, è destinato anche a promuovere il flusso d'aria continuo.
- PFTE coperchio a membrana per 35 millimetri GBM: Prima di mettere la cultura neuronali nella fase-top incubatore per l'imaging, il GBM 35mm è dotata di uno speciale membrane coperchio (figura 1 (II, IV); M; dettaglio mostrato in alto a destra) per consentire lo scambio di gas e allo stesso tempo ridurre al minimo l'evaporazione del terreno di coltura. Questo coperchio è costituito da un cerchio di plastica Delrin e un pre-taglio foglio di membrana PTFE (Teflon; americano Durafilm Co., Inc., Holliston MA) che è stata allungata oltre il bordo e tenuta in posizione con una guarnizione viton che scivola in un canale incassati lungo il fianco del cerchio di plastica delrin.
- Porte di iniezione: Due fori sono stati perforati nella finestra in policarbonato (Figura 1 (II), particolare centro, frecce gialle vicino a B) della fase alto-incubatore. Questi sono stati dotati di acciaio inox siringa Hamilton finisce per fornire porte di iniezione per la gestione dei 5-HT, DA, agonisti ed antagonisti dei recettori diversi, e altri reagenti nel corso di un dato esperimento.
2. Preparazione di colture primarie ippocampale
Tutto il lavoro viene svolto sia in una cappa a flusso laminare BSL2 o in un banco a flusso laminare. Primaria neuroni dell'ippocampo sono isolati dal E18 embrioni di ratto in base alle procedure standard 6-7, e sono cresciuto in mezzo privo di siero che è stato condizionato da astrociti corticali primarie. Cellule gliali sono preparati secondo i metodi pubblicato 7. Il mezzo condizionato è composto da glucosio DMEM bassa, integrato con prolina (1,76 ug / ml), l'asparagina (0,83 ug / ml), vitamina B12 (0,34 ug / ml), glucosio (20 mm), ricchi di lipidi BSA (0,5 mg / ml ) e il 2% della B27 8-10. Non gli antibiotici vengono aggiunti al mezzo in quanto potrebbero interferire con la trascrizione del gene neuronale.
- Coprire la parte centrale in vetro coprioggetti di un 35 millimetri con fondo di vetro piatto cultura (GBM) con poli-D-lisina (0,05 mg / ml in PBS), e lasciar riposare per due ore a 37 ° C. Aspirare il poli-D-lisina soluzione, lasciare asciugare per 20 minuti in una cappa a flusso laminare BSL2. Coprire il poli-D-lisina rivestite parte coprioggetto del GBM con la laminina (0,01 mg / ml in PBS), e lasciare per un minimo di 40 minuti prima di rimuovere l'eccesso di laminina. Mettere da parte per 20 minuti.
- Sezionare dell'ippocampo dal cervello di embrioni di ratto E18, e dissociare come descritto nei protocolli corrente in Neuroscienze 6.
- Diluire le cellule dissociate in terreno di coltura per consentire una densità di 110.000 cellule per GBM. Calcolare la concentrazione necessaria di cellule nel vostro master mix in base al numero di GBM vi sarà la preparazione.
- Luogo GBM seminato in un incubatore temperatura impostata ata di 37 ° C e una miscela atmosfera del 10% di CO 2 / 90% di aria.
- Da tre a cinque giorni dopo, a seconda delle condizioni di crescita dei neuroni, aggiungere arabinoside C (0,14 ng / ml) per le culture di sopprimere la proliferazione gliale.
- Lasciare le culture a crescere per due settimane prima di infettare con il lentivirus. Durante questo periodo, sostituire un terzo del volume del mezzo in ogni GBM con mezzo fresco ogni tre giorni. Non superare questa quantità di mezzi di comunicazione, in quanto ciò può portare a shock osmotico e la morte cellulare.
3. Preparazione di proteina ricombinante Encoding Lentivirus Red Fluorescent
Per gli investigatori che non hanno accesso a strutture per la produzione di lentivirus ricombinanti, produzione su misura da un ente commerciale ad esempio di sistema Biosciences (Mountain View, CA) è un'opzione.
Un mitocondri mirati gene rosso proteina fluorescente (MitoTurboRFP; Axxora LLC, San Diego, CA) è inserito in un auto-inattivazione del virus ricombinante dell'immunodeficienza felina sotto il controllo trascrizionale del enhancer dal maggiore promotore del gene immediato citomegalovirus primi 11. Lentivirus ricombinanti sono prodotte da transitoriamente trasfezione delle cellule 293T.
- Piastra 293T cellule ad una densità di circa 75.000 cellule / cm 2, il giorno seguente, co-trasfezione delle cellule con plasmidi codifica il vettore virale ricombinante, i geni gag e pol FIV, e il virus della stomatite vescicolare gene della glicoproteina G, utilizzando PolyJet (SignaGen laboratori, Gaithersburg, MD). Un totale di 12 ug di DNA (4,8 mcg vettore virale, 4,8 mg gagpol plasmide, e 2,4 g VSV plasmide G) è utilizzato per ogni piatto 10 centimetri coltura di cellule 293T.
- Dopo 24 ore, aspirare il terreno di coltura delle cellule e lavare con rosso fenolo senza soluzione salina bilanciata Hanks per rimuovere il DNA residuo. Aggiungere 10 ml di mezzo privo di siero basale neurale integrato con 50μg/ml ricchi di lipidi BSA e Glutamax.
- Il giorno seguente, raccogliere il surnatante, filtrare su filtro 0,2 micron a basso legame proteico e di aggiungere a una ultrafiltrazione 20 Vivaspin unità polietersulfone (Sartorius, Concord, USA). Pre-trattare l'unità Vivaspin da sequenzialmente lavaggio con etanolo al 70%, la cultura dell'acqua presente nei tessuti di qualità, e PBS. Concentrare il virus contenente supernatante ~ 50 volte mediante centrifugazione a 1500xg per 30 minuti. Aliquota della preparazione virus e conservare in liquido N 2.
- Stimare la quantità di virus per infettare le cellule di ratto B104 con una aliquota di virus concentrati, e misurando l'espressione di proteine fluorescenti mediante citometria di flusso 72 ore dopo. La percentuale di cellule positive fornisce una stima della quantità di volume cioè virus di virus concentrati necessari per ottenere l'espressione proteina fluorescente in un dato numero di neuroni primari.
4. L'infezione di colture di neuroni
Culture dei neuroni dell'ippocampo sono infettati a 14 giorni in vitro con la semplice aggiunta la quantità di virus per infettare stimato fino al 50% di tutti i neuroni in base ai dati di citometria a flusso. Nessun polibrene viene utilizzato. Le culture sono mantenuti per 3 giorni prima di controllare per l'espressione della proteina fluorescente. Se il segnale è troppo debole, allora la cultura viene restituito al tessuto cultura incubatore e sottoposti nuovamente al test dopo alcuni giorni.
5. Manutenzione generale del sistema di supporto vitale Closed Circuit
- Per mantenere l'umidità adeguata, assicurarsi che l'incubatore camicia d'acqua viene periodicamente controllato e riempito quando necessario. Assicurarsi di inserire un vassoio d'acciaio inox o alluminio all'interno dell'incubatore contenente un piccolo volume di acqua (25 mm di profondità) e alghicida.
- Se necessario, cancellare i tubi di alimentazione e all'uscita del circuito di atmosfera incubatore di svuotamento acqua raccolta dai tubi di raccolta. Periodicamente lavare i tubi con il 70% di etanolo.
6. L'applicazione di coperchio a membrana di GBM e posizionamento in fase-top Incubator
- Prima del posizionamento del GBM dentro lo stadio-top incubatore, sostituire il coperchio in plastica con la membrana coperta di coperchio in una cappa di coltura di tessuti. Una volta fatto questo, si può spostare il GBM coperto al microscopio.
- Con attenzione sedile del GBM con la membrana coperta di coperchio in apertura incasso sulla base del palco-top-incubatore. Per evitare spintoni il GBM, assicurarsi che la base è già in atto sul palco microscopio, dato che il clip di base in fase con qualche difficoltà, è meglio posizionare il GBM dopo che la base è in posizione.
- Allineare il recinto incubatore con i pali in acciaio sulla base incubatore e abbassare la recinzione sulla base. Serrare le viti fino a quando una buona tenuta è realizzato tra il recinto e la base.
7. Image Acquisition
Si noti che la maggior parte delle piattaforme disponibili software di imaging hanno funzionalità comparabili tra una vasta gamma di microscopi e relativo hardware. Una varietà di acquisizione delle immagini e piattaforme software di analisi sono disponibili, compreso MetaMorph e programmi destinati rende specifiche del microscopio, come la Leica Application Suite, Nikon NIS-Elements, e Carl Zeiss 'AxioVision. In questo protocollo, si descrive l'acquisizione delle immagini e procedure di analisi abbiamo eseguito utilizzando Slidebook 5 (Intelligent Imaging Innovations, Denver, CO). Tuttavia, i passi costitutivi della operazione descritta in questo protocollo può essere facilmente adattato per l'utilizzo di una varietà di altri programmi.
Descrizione del microscopio a fluorescenza invertito, configurazioni di filtro, telecamera CCD, sorgente di luce allo xeno, e software di imaging:
Per l'imaging dinamico del trasporto mitocondriale nei neuroni dell'ippocampo, usiamo un DMI-6000B Leica microscopio invertito a fluorescenza e modello 11-522-068 stadio motorizzato (CMS GmbH Leica Microsystems, Wetzlar, Germania) dotato di un Sensicam Cooke EQ CCD (La Cooke Corporation, Romulus, MI), un Sutter Lambda 10-2 ruota portafiltri e controller (Instrument Company Sutter, Novato, CA), e un Sutter DG-4 300W sorgente di luce allo xeno. Per visualizzare i mitocondri etichettati con la proteina fluorescente MitoTurbo Rosso, si usa la combinazione di un filtro 555nm alla fonte DG-4 luce per l'eccitazione e filtri di 600 nm (picco; Sedat Quad beamsplitter Modello 86100bs montato Leica cubo DM serie di filtri, la tecnologia Chroma Corp., Bellows Falls, VT) e 617 nm al microscopio e ruota portafiltri, rispettivamente, per le emissioni.
Per l'acquisizione e analisi delle immagini, si usa il digital imaging pacchetto software microscopia Slidebook 5. Si tratta di un pacchetto completo che consente di controllare completamente automatizzata del microscopio, lo stadio, ruota portafiltri, macchina fotografica, e fonte di luce durante l'acquisizione dell'immagine, così come una varietà di elaborazione delle immagini e dei moduli di analisi.
Di seguito, forniamo specifiche, passo-passo le istruzioni per l'acquisizione di immagini in tempo lasso di mitocondri nei neuroni in movimento fluorescente utilizzando Slidebook 5.
- Assicurarsi che il microscopio, il controller ruota portafiltri, fonte di luce, e la camera CCD sono stati accesi prima di aprire Slidebook 5.
- Per l'imaging dal vivo dei mitocondri, passare a un 63x ad immersione in olio obiettivo, abbassare la torretta obiettivo sufficientemente per consentire l'accesso con l'obiettivo sotto il palco microscopio (e lo stadio-Top incubatore), e ad applicare attentamente l'olio direttamente sulla superficie dell'obiettivo. Aprire la finestra di messa a fuoco, cliccando sull'icona 'Finestra Focus' nella barra degli strumenti Slidebook. Nella finestra di messa a fuoco, accendere la lampada brightfield facendo scorrere un cursore etichettato 'lampada' per regolare l'intensità brightfield a un livello adeguato. Acquisire concentrarsi su un campo di cellule e trovare una cella di interesse.
- Nella scheda 'Ambito', selezionare 'CY3' fluor. Utilizzando gli oculari, in condizioni di illuminazione fluorescente trovare il piano di messa a fuoco di mitocondri nelle cellule che sono stati etichettati con la proteina Mito TurbRed. Una volta che avete acquisito attenzione attraverso gli oculari, passare alla camera CCD e ri-acquisire fuoco se necessario.
- Aprire la finestra di acquisizione delle immagini, cliccando sull'icona 'Image Capture' sulla barra degli strumenti Slidebook. A partire da un tempo di esposizione iniziale di 100 ms, trovare il tempo ottimale di esposizione utilizzando il 'Test' e 'Trova le migliori' pulsanti, in alternativa, è possibile utilizzare il pulsante 'Una volta'. Ricorda che il tempo di esposizione dovrebbe fornire ampie intensità diffusa in tutto il campo dell'immagine (per esempio, 0-2500; indicato dal istogramma nella parte inferiore della finestra di cattura delle immagini) all'interno di una durata minima (ad esempio, 200-800ms).
- Prima di iniziare il time-lapse acquisizione delle immagini, aprire la finestra 'Advanced' facendo clic sulla scheda 'Avanzate' ancora all'interno della finestra di acquisizione delle immagini. Trova la scheda 'Focus', controllare il 'autofocus' durante opzione time-lapse/multipoint cattura ', e regolare le impostazioni di messa a fuoco automatica per time-lapse acquisizione di immagini. Generalmente, utilizzare i seguenti parametri per la messa a fuoco automatica: messa a fuoco aggiornamento ogni 2-3 fotogrammi; selezionare la messa a fuoco automatica dei canali del fluoro usati per l'imaging etichettati mitocondri, cioè CY3; intervallo di ricerca totale 2 um per un ingrandimento 63x.
- Nella finestra 'Capture', nella casella 'Tipo Capture', controllare l'opzione 'Timelapse' e selezionare l'intervallo di imaging desiderato e la durata della sessione di imaging in Opzioni 'Capture Timelapse'. Nei nostri studi sugli effetti dei neuromodulatori sul trasporto mitocondriale, time-lapse imaging è stata eseguita in sessioni di un'ora in cui sono stati acquisiti un totale di 360 immagini a intervalli di 10 secondi tra le immagini.
- Ora di inizio-lapse acquisizione delle immagini cliccando sul pulsante 'Start' in basso, a destra, della finestra 'Capture'.
- Dopo il primo, o di controllo, sessione di imaging, amministrare neurotrasmettitori e altri reagenti tramite le porte superiore del palco-top incubatore e iniziare una nuova sessione di imaging.
8. Analisi dell'immagine
- Aprire il file immagine salvato dopo l'ultima sessione di imaging.
- Mitocondri individuali possono essere etichettati in un time-lapse serie di immagini in modo automatico o manualmente utilizzando le funzioni di mascheramento fornite in Slidebook 5.
- Sotto il menu 'maschera', selezionare 'segmento' dalla barra dei menu. Facendo scorrere la linea di soglia bassa e alta dello strumento 'istogramma', mascherando tutte le particelle in blu in tutta l'immagine, che copre tutti i mitocondri contenuti nel processo, ma lasciando particelle discreto possibile. Applicare la maschera alla serie intera immagine.
- Creare una seconda maschera (nel menu 'maschera', selezionare 'Create') che copre l'intera immagine, tranne per il processo di interesse in cui le particelle è stata evidenziata dalla maschera precedente. Questo si realizza, in primo luogo, usando lo strumento 'matita' più spessa di tracciare i confini delle aree al di fuori del processo, e poi, usando lo strumento 'secchiello' a riempire nelle regioni limitate. Applicare questa maschera per la serie intera immagine.
- Sotto 'Maschera,' seleziona 'Operazioni Maschera' e eseguire l'operazione 'meno', cioè la seconda maschera viene sottratto dalla maschera pugno (l'intera immagine tranne il processo). Una maschera terzo sarà generato in cui solo il processo di di interesse. Si noti che questa nuova maschera verrà applicato alla serie intera immagine.
- Sotto 'Annotazioni,' seleziona 'Oggetto ID.'
- Verificare la continuità e l'assegnazione numerica dei singoli mascherato mitocondri manualmente rivedendo la serie di immagini (in Slidebook 5, il 'gioco', 'telaio in avanti,' e 'fotogramma,' pulsanti sotto la finestra immagine può essere utilizzata per questo scopo).
- Selezionare la scheda 'maschera' nella barra dei menu. Sotto 'Mask', 'Monitoraggio delle particelle' selezionare ed eseguire 'delle particelle di base tracking' per generare 'Statistiche Path,' tra cui le coordinate del centroide per ogni mitocondrio mascherato.
- Distanza percorsa da ogni mitocondrio tra due fotogrammi adiacenti immagine viene calcolato dalle coordinate di ogni particella in ogni fotogramma.
- Nei nostri precedenti studi degli effetti di neuromodulatori sul movimento mitocondriale, abbiamo identificato tre distinte popolazioni di mitocondri:. 'Stazionarie', 'oscillatorio,' e 'direzionale in movimento' Se un mitocondrio viaggia inferiore a 0,2 um (o 2 pixel, sotto ingrandimento 63x, 1 pixel = 0,10235 um) entro un'ora, si è caratterizzata come 'stazionarie'. Se un mitocondrio si muove almeno 0,2 um, ma meno di 2.5 um, in un anterograda, retrograda ciclo, viene definito come 'oscillatorio.' Infine, se un mitocondrio percorre la distanza netto di oltre 2,5 um in una direzione, è classificato come movimento direzionale. Illustrato nella figura 2 è un istogramma che mostra il movimento di tutti i mitocondri etichettate in un esperimento rappresentativo, così come un grafico a torta che mostra la distribuzione percentuale delle tre popolazioni distinte di mitocondri.
- Velocità media di ciascun mitocondrio è calcolato in base alla distanza totale percorsa durante una sessione di imaging dato. La velocità media di una popolazione mitocondriale è calcolato sommando velocità individuale e dividendo per il numero totale dei tracciati mitocondri.
- Kymographs possono essere generati utilizzando un modulo fornito in Slidebook 5. Utilizzando la funzione 'Mask', tracciare una linea sottile attraverso l'intera estensione di un determinato processo (per esempio assone); essere sicuri di passare attraverso il maggior numero possibile di centroidi mitocondriale. Vai alla scheda 'maschera' nella barra dei menu e selezionare 'Operazioni avanzate,' e poi 'Analisi curva.' Utilizzare l'impostazione predefinita per l'analisi della curva liscia o personalizzare a piacere. Esegui il liscio modulo di analisi della curva. Al termine dell'analisi, un chimografo della sessione di imaging sarà visualizzato.
- Vai alla barra dei menu e 'Visualizza' e poi selezionare 'Esporta TIFF.'
- Aprire i salvati. Tif file contenente il chimografo in Photoshop o di un analogo programma di elaborazione delle immagini e convertire l'immagine in scala di grigi invertita.
9. Rappresentante Risultati
Da monitorare e analizzare il movimento dei mitocondri in colture di neuroni dell'ippocampo, abbiamo dimostrato un legame tra neuromodulazione e il traffico mitocondriale. In particolare, abbiamo trovato che la serotonina (5-HT) o il 5-HT1A agonista del recettore, 8-OH-DPAT, stimola il movimento mitocondriale (Figura 2A-C) 8, mentre la dopamina (DA) o il agonista del recettore D2, bromocriptina, inibisce mitocondriale movimento (Figura 2D-G) 9.
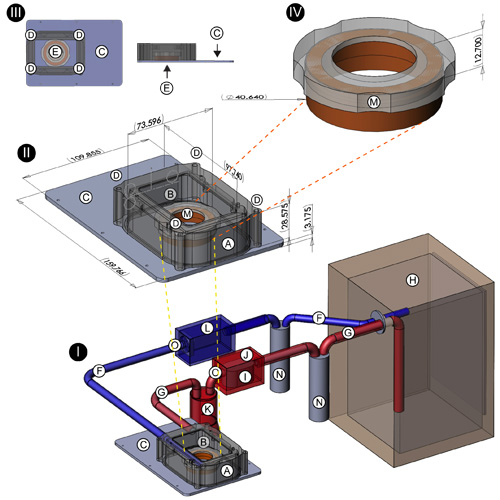
Figura 1. Progettazione di chiuso stadio-top sistema a circuito incubatore I seguenti componenti del sistema di incubazione sono indicati: resistente al calore custodia in plastica Delrin (A); apertura rettangolare per la finestra in policarbonato plastico (B); base in alluminio dell'incubatore (C); fori. di accettare pali in acciaio di base (D); foro di diametro 35,1 millimetri con sottili labbra incasso al centro di incubatore di base per accogliere i piatti GBM 35 mm (E); tubi Nalgene (connessioni tra coltura e fase-top incubatori; trappole umidità) ( F, G, N); incubatore di coltura tissutale (H); pompa acquario (I); a tenuta d'aria scatola di plastica ABS (alloggiamento per la pompa dell'acquario) (J); 2000ml beuta (marmitta per la soppressione delle vibrazioni nel tubo prima fase-top incubatore) (K), contenitore in plastica per ventola di raffreddamento (L), telaio in plastica per il coperchio 35 millimetri GBM (M); posizione dei rubinetti di plastica (O). Sedi di porte per la somministrazione dei reagenti sono indicati da frecce gialle in (II).

Figura 2. Risultati rappresentativi: la regolamentazione del trasporto mitocondriale A.. Assone di un neurone dell'ippocampo di ratto tipico della cultura. Mitocondri etichettati con un lentivirus codifica una proteina fluorescente sono riportati in verde; assoni immunolabeled con fosfo-neurofilamenti anticorpi sono mostrati in rosso. Estensione della assone è indicato da frecce gialle. L'immagine è composta da quattro micrografie sovrapposte. B. Esempio di un time-lapse serie di immagini che illustrano l'evoluzione del movimento mitocondriale dopo la somministrazione di 5-HT. Immagini sono state acquisite tramite un microscopio invertito a fluorescenza e memorizzati come sequenze che sono stati successivamente convertiti in filmati QuickTime. Una sequenza di immagini mostra rappresentante singoli mitocondri in diversi momenti prima (pannello di sinistra) e dopo (pannello di destra) la somministrazione di 8-OH-DPAT, un 5-HT1A agonista del recettore. Verticale rettangolo rosso evidenzia un mitocondrio stazionario (a sinistra) e un mitocondrio oscillatorio (a destra) sui punti più tempo. Il mitocondrio oscillatorio indicato (pannello di sinistra) si sta muovendo verso il terminale degli assoni dopo il trattamento con 8-OH-DPAT (pannello di destra, punte di freccia bianca bordata di rosso). La linea verticale gialla (pannello di destra) indica la posizione iniziale del mitocondrio in movimento. Gli intervalli di tempo sono mostrati in basso a destra di ogni fotogramma. Ingrandimento (63 ×) è indicato nell'angolo in basso a destra del pannello di destra. C, D. grafici che illustrano l'evoluzione del movimento mitocondriale dopo la somministrazione di 5-HT. Cambiamenti in movimento mitocondriale prima (C) e dopo (D) la somministrazione di 5-HT sono presentati come trame di velocità (asse X) vs posizioni iniziali dei mitocondri individuale lungo l'assone (asse Y). Velocità e la percentuale di stazionarie (rosso), oscillatorio (blu), e in movimento direzionale (verde) mitochondria sono rappresentati in grafici e diagrammi a torta (inserti grafici sopra), rispettivamente. Linee rosse tratteggiate proiettando da aree evidenziate dell'assone cartone animato per l'asse Y per ogni parcella indicare la posizione approssimativa e l'estensione del segmento di assone che è stato fotografato. E, F. grafici che illustrano l'evoluzione del movimento mitocondriale dopo la somministrazione di DA. Cambiamenti in movimento mitocondriale prima (E) e dopo (F) la somministrazione di DA sono presentati come trame di velocità (asse X) vs posizioni iniziali dei mitocondri individuale lungo l'assone (asse Y). Velocità e la percentuale di stazionarie (rosso), oscillatorio (blu), e direzionale in movimento (verde) mitocondri sono rappresentati in grafici e diagrammi a torta (inserti sopra complotti), rispettivamente. Linee rosse tratteggiate proiettando da aree evidenziate dell'assone cartone animato per l'asse Y per ogni parcella indicare la posizione approssimativa e l'estensione del segmento di assone che è stato fotografato. G, H. kymographs rappresentante mostrando movimento mitocondriale in un neurone colto prima (G) e dopo (H) amministrazione della agonista del recettore D1R, bromocriptina. Il neurone è stato ripreso per un'ora prima (G) e un'ora dopo (H) somministrazione di bromocriptina.
Discussione
Impiegando lentivirus-mediata espressione di una proteina fluorescente mirata ai mitocondri in infetti neuroni coltivati e un poco costoso laboratorio di un palco allestito-top incubatore che permette l'imaging di cellule vive per periodi estesi, siamo stati in grado di indagare il legame tra movimento mitocondriale e segnali neuromodulatori , come la serotonina (5-HT), dopamina (DA) e acetilcolina (ACh). I nostri studi hanno permesso di chiarire una via di segnalazione che, per la prima volta, i collegamenti il traffico di mitocondriali ai cambiamenti nell'attività dei neuroni-modulata da neurotrasmettitori come la 5-HT e DA - che sono al centro della funzione neurale. Troviamo che l'uso di proteine fluorescenti mirato permette l'osservazione dei mitocondri etichettate in vita i neuroni in coltura per lunghi periodi che possono essere fisiologicamente più rilevanti rispetto alla durata molto più breve che sono possibili utilizzando coloranti vitali. Inoltre, l'intensità del segnale proteina fluorescente ci permette di mantenere tempi di esposizione brevi durante l'acquisizione dell'immagine, riducendo al minimo la possibilità di photobleaching o fototossicità. Infine, uno stadio-top semplice e poco costoso incubatore che mantiene la temperatura ambiente, umidità e livelli di CO 2, riducendo al minimo l'evaporazione dei media, ci permette di seguire il movimento mitocondriale in vita i neuroni nel giro di ore o anche giorni. I ricercatori che desiderano fabbricare un palcoscenico superiore incubatore per le osservazioni a lungo termine dei mitocondri dei neuroni vivere non è necessario seguire i dettagli precisi del nostro design, a condizione che le proprietà dei materiali utilizzati (ad esempio, membrana permeabile ai gas per evitare l'evaporazione dei media ) ei principi applicati (ad esempio, il controllo della temperatura e dell'umidità, tamponamento del pH, della manutenzione di osmolarità) sono generalmente in linea con quanto descritto in questo protocollo.
Divulgazioni
Riconoscimenti
Vorremmo ringraziare Donald Hutson per aver contribuito la sua competenza tecnica e grande abilità durante la progettazione e la realizzazione della fase-top-incubatore. Siamo anche grati a Ayda Dashtaei per la sua eccellente assistenza tecnica. Tutto il lavoro è stato sostenuto dal Neurosciences Research Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Quantità | Descrizione (e della posizione in Figura 1) | ||
|---|---|---|---|
| 1 | Incubatore di coltura tissutale (H) | ||
| 1 | Resistente al calore custodia in plastica (delrin o comparabili) (A) | ||
| 1 | Telaio in plastica per il coperchio 35 millimetri GBM (per l'apposizione della membrana a scatola di Petri) (M) | ||
| 1-2 | lineare ft chiaro PTFE (Teflon) membrana di materiale | ||
| 4 | Viti in ottone pollice | ||
| 2 | Piccole resistenze dissipatore 10kOhm (utilizzati come elementi di riscaldamento all'interno di stage-superiore della custodia incubatore) | ||
| 1 | Trasformatore (fornitura di corrente da 9V a resistenze) | ||
| 1 | Terrario regolatore di temperatura e sonda (regolazione termostatica del potere di resistenze dissipatore tramite trasformatore) | ||
| 1 | 2000ml Beuta (marmitta per la soppressione delle vibrazioni nel tubo prima fase-top incubatore) (K) | ||
| 1 | 1 / 8 "foglio sorbotano (materiale della guarnizione per la base del palco-top incubatore) | ||
| 1 | ABS a tenuta d'aria (o assimilabili) scatola di plastica (alloggiamento per la pompa dell'acquario) (J) | ||
| 1 | Acquario di pompa (I) | ||
| 1 | Piccola ventola di raffreddamento del computer | ||
| 1 | Contenitore in plastica per la ventola di raffreddamento (L) | ||
| 1 | Trasformatore 9V per la ventola di raffreddamento del computer | ||
| 20-30ft | Nalgene o tubi silicone (collegamento tra la cultura del tessuto e stadio-top incubatori; trappole umidità) (F, G, N) | ||
| 2 | Rubinetti in plastica (per aprire e chiudere il flusso d'aria prima e dopo la fase-top incubatore) (O) | ||
| 4 | Spinato ottone raccordi per tubi flessibili (per i collegamenti dei tubi per / da stadio-top incubatore e corpo pompa acquario) | ||
| 2 | Accoppiatori rapidi in ottone (per connessioni tubo da / per stage-top incubatore) | ||
| 2 | Accoppiatori rapidi in ottone (per connessioni tubo da / per stage-top incubatore) |
Tabella 1. Stage-top incubatore parti:
| Nome del reagente | Azienda | Numero di catalogo |
|---|---|---|
| Poli-D-lisina | Sigma-Aldrich | P7280-5MG |
| laminina | Roche Applied Science | 11243217001 |
| 35 millimetri con fondo di vetro piatti | MatTek | P35GC-0-14-C |
| DMEM | Life Technologies | 10567 |
| B27 | Life Technologies | 17504-044 |
| Glutamax | Life Technologies | 35050 |
| Ricchi di lipidi BSA | Life Technologies | 11020-021 |
| L-Asparagina | Sigma-Aldrich | P0380-100G |
| L-prolina | Sigma-Aldrich | A8381-100G |
| La vitamina B-12 | Sigma-Aldrich | V2876-100MG |
| 5-HT | Sigma-Aldrich | H9523-25mg |
| 8-OH-DPAT | Sigma-Aldrich | H8520-25mg |
| Dopamina | Sigma-Aldrich | H8502-5G |
| Bromocriptina | Sigma-Aldrich | B2134-25mg |
| SKF38393 | Sigma-Aldrich | D047-100MG |
Riferimenti
- Ligon, L. A., Steward, O. Movement of mitochondria in the axons and dendrites of cultured hippocampal neurons. J Comp Neurol. 427, 340-350 (2000).
- Miller, K. E., Sheetz, M. P. Direct evidence for coherent low velocity axonal transport of mitochondria. J Cell Biol. 173, 373-381 (2006).
- Macaskill, A. F. Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses. Neuron. 61, 541-555 (2009).
- Morris, R. L., Hollenbeck, P. J. Axonal transport of mitochondria along microtubules and F-actin in living vertebrate neurons. J Cell Biol. 131, 1315-1326 (1995).
- Rintoul, G. L., Filiano, A. J., Brocard, J. B., Kress, G. J., Reynolds, I. J. Glutamate decreases mitochondrial size and movement in primary forebrain neurons. J Neurosci. 23, 7881-7888 (2003).
- Crawley, J. N. . Current protocols in neuroscience. , (1999).
- Fedoroff, S., Richardson, A. . Protocols for neural cell culture. , (2001).
- Chen, S., Owens, G. C., Crossin, K. L., Edelman, D. B. Serotonin stimulates mitochondrial transport in hippocampal neurons. Mol Cell Neurosci. 36, 472-483 (2007).
- Chen, S., Owens, G. C., Edelman, D. B. Dopamine inhibits mitochondrial motility in hippocampal neurons. PLoS One. 3, e2804-e2804 (2008).
- Chen, S., Owens, G. C., Makarenkova, H., Edelman, D. B. HDAC6 regulates mitochondrial transport in hippocampal neurons. PLoS One. , e10848-e10848 (2010).
- Curran, M. A., Kaiser, S. M., Achacoso, P. L., Nolan, G. P. Efficient transduction of nondividing cells by optimized feline immunodeficiency virus vectors. Mol Ther. 1, 31-38 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon