Method Article
Нейромодуляция и митохондриальной Транспорт: Live изображений в нейронах гиппокампа в течение длительного времени
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы опишем протокол, который позволяет визуализации митохондрий в живых нейронов с помощью флуоресцентной микроскопии в течение длительного времени. Изображения в течение длительного периода осуществляется через лентивирус-опосредованной экспрессии mitochondrially целевых флуоресцентного белка и использование недорогих стадии топ-инкубатор, который был спроектирован и построен в нашей лаборатории.
Аннотация
To understand the relationship between mitochondrial transport and neuronal function, it is critical to observe mitochondrial behavior in live cultured neurons for extended durations1-3. This is now possible through the use of vital dyes and fluorescent proteins with which cytoskeletal components, organelles, and other structures in living cells can be labeled and then visualized via dynamic fluorescence microscopy. For example, in embryonic chicken sympathetic neurons, mitochondrial movement was characterized using the vital dye rhodamine 1234. In another study, mitochondria were visualized in rat forebrain neurons by transfection of mitochondrially targeted eYFP5. However, imaging of primary neurons over minutes, hours, or even days presents a number of issues. Foremost among these are: 1) maintenance of culture conditions such as temperature, humidity, and pH during long imaging sessions; 2) a strong, stable fluorescent signal to assure both the quality of acquired images and accurate measurement of signal intensity during image analysis; and 3) limiting exposure times during image acquisition to minimize photobleaching and avoid phototoxicity.
Here, we describe a protocol that permits the observation, visualization, and analysis of mitochondrial movement in cultured hippocampal neurons with high temporal resolution and under optimal life support conditions. We have constructed an affordable stage-top incubator that provides good temperature regulation and atmospheric gas flow, and also limits the degree of media evaporation, assuring stable pH and osmolarity. This incubator is connected, via inlet and outlet hoses, to a standard tissue culture incubator, which provides constant humidity levels and an atmosphere of 5-10% CO2/air. This design offers a cost-effective alternative to significantly more expensive microscope incubators that don't necessarily assure the viability of cells over many hours or even days. To visualize mitochondria, we infect cells with a lentivirus encoding a red fluorescent protein that is targeted to the mitochondrion. This assures a strong and persistent signal, which, in conjunction with the use of a stable xenon light source, allows us to limit exposure times during image acquisition and all but precludes photobleaching and phototoxicity. Two injection ports on the top of the stage-top incubator allow the acute administration of neurotransmitters and other reagents intended to modulate mitochondrial movement. In sum, lentivirus-mediated expression of an organelle-targeted red fluorescent protein and the combination of our stage-top incubator, a conventional inverted fluorescence microscope, CCD camera, and xenon light source allow us to acquire time-lapse images of mitochondrial transport in living neurons over longer durations than those possible in studies deploying conventional vital dyes and off-the-shelf life support systems.
протокол
1. Описание лабораторного построенной сцене верхом инкубатор
Сохранение живых клеток на столике микроскопа в течение длительного длительности предлагает три основные задачи: 1) контроль окружающей температуры и регулирования; 2) контроль влажности, то есть, поддерживая влажность экологической атмосферой и 3) обеспечение надлежащей рН в культуральной среде. Эти вопросы «жизнеобеспечения» являются критическими для экспериментов с участием долгосрочного наблюдения культурного нейроны, клетки, которые особенно чувствительны к изменениям температуры и рН. Ниже мы опишем простой лабораторного построенной сцене верхом инкубаторе, что мы спроектирован и построен для живого изображения нейронов в течение длительного длительности. Этот инкубатор связано, по замкнутому контуру, к стандартному культуре ткани инкубатор (Thermo Scientific, Asheville, Северная Каролина), которая обеспечивает стабильную подогревом (37 ° С), влажной атмосфере 10% СО 2 / 90% воздуха.
- Инкубатор корпуса: корпус из инкубатора (рис. 1 (I, II);) был изготовлен на компьютеризированных фрезерный станок C & C из цельного куска черного пластика Delrin. Он измеряет 97.74mm (Д) х 73.60mm (Ш) х 28.58mm (H), (внутренние размеры 96.74mm х 72.60mm х 27.58mm) предоставления замкнутом объеме около 19 370 см 3. Два отверстия были пробурены с обоих концов корпус и оборудована резьбовыми барбусов латуни для размещения входного и выходного шлангов из / в культуре ткани инкубатора. Прямоугольное отверстие измерения 70.0mm х 43.0mm мололи из в верхней части корпуса, чтобы размещение окна поликарбонатного пластика (рис. 1 (I, II), B). Базе инкубатора (рис. 1 (I, II, III); С; вид сверху и профиль подробно показано в верхнем левом углу), фрезерованные от 3 / 16 "алюминиевые акции, меры 159.77mm (Д) х 109.86mm (W ) х 3.175mm (D), и предназначен, чтобы вписаться в вставить перерыва Leica моторизованных 3-пластины этапе (Модель 11-522-068, Leica GmbH, в Лейпциге, Германия). Четыре стали сообщения с внутренней резьбой были прикреплены к . углах thebase по заподлицо винта с потайной головкой Они обеспечивают твердые точки крепления для корпуса инкубатора, которая была пробурена на каждой углу, чтобы принимать сообщения (рис. 1 (II, III), D). sorbothane прокладкой (McMaster Carr, Inc, Элмхерст, Иллинойс) был сокращен и установлен на базу, чтобы обеспечить уплотнение на корпус / базового интерфейса. Четыре латунные винты с резьбой соответствия, что из сообщения используются для крепления корпуса к основанию (рис. 1 (II, III);. D) 35.1mm диаметр отверстия с тонкими встраиваемые губа была сокращена в центре базы инкубатор для размещения 35 GBMs (рис. 1 (III); E; подробно в левом верхнем углу); дополнительные основания были предназначены для размещения других размеров блюдо культуры.
- Нагревательные элементы: два 10 кОм радиатор резисторы (Digi-Key Corp, Thief River Falls, MN) прикреплены к внутренним стенкам корпуса инкубатора. Они подключены к 9В постоянного тока, 500 мА трансформатор, который подключен к террариум Alife 1000 Вт регулятор температуры (Каролина Pet Поставка, Irmo, Южная Каролина). Проводной датчик, размещаемых путем прокладки в окно из поликарбоната корпус инкубатора определяет внутреннюю температуру окружающей среды и определяет ток на резисторы. В сочетании с тканевой культуры инкубатор, резисторы обеспечивают дополнительную меру окружающего контроля температуры.
- Закрытая система атмосферу схеме: обеспечить постоянное увлажнение и нагревают атмосферу 10% CO 2 / 90% воздуха, стадии топ-инкубатор связано, через входной и выходной шланги (рис. 1 (I), F, G), к стандарт, с водяной рубашкой культуре ткани инкубаторе (рис. 1 (I); H); Forma Научно Модель 3154; Thermo Scientific, Inc, Asheville, NC). Перед подключением к стадии топ-инкубатор, шланг (рис. 1 (I), F) наталкивается на стандартный насос аквариума (рис. 1 (I); I; Lifegard QuietOne Модель 1200, Pentair водных видов спорта, Эль-Монте, Калифорния) , который был заключен в герметичный пластиковый ABS окне (рис. 1 (I), J; Модель 1150, Pelican Products, Inc, Торранс, Калифорния), чтобы сохранить замкнутой цепи. Этот насос способствует постоянному поток воздуха из тканевой культуры инкубатор на сцену верхом инкубатора. После мощности насоса, шланга бежит к 1500ml колбу (рис. 1 (I), К), который действует как глушитель, чтобы минимизировать передачу вибрации от насоса до стадии топ-инкубатора. Розетке шланг (рис. 1 (I), G), ведущей от стадии топ-инкубатора в культуре ткани инкубаторе (рис. 1 (I); H) оснащен вентилятором закрытых компьютер (рис. 1 (I), L), , которая, как насос, предназначен также для содействия непрерывному воздушного потока.
- PFTE мембраны крышкой для 35-мм GBM: Перед размещением нейронов культуры в стадии топ-инкубатор для работы с изображениями, GBM 35 мм оснащен специальным меняmbrane крышкой (рис. 1 (II, IV); M; подробно показано в верхнем правом углу), чтобы разрешить газовый обмен и в то же время минимизировать испарения питательной среды. Это крышка состоит из обода Delrin пластика и нарезанные лист PFTE мембраны (тефлон, американский Durafilm завод, ОАО, Холлистон MA), которая была натянутой на обод и удерживается на месте с прокладкой витон, что проскальзывает в встраиваемые канал вдоль стороне обода пластиковых Delrin.
- Инъекция порты: два отверстия были пробурены в окно поликарбоната (рис. 1 (II), центр подробно, желтые стрелки рядом Б) стадия-топ-инкубатора. Они были оснащены нержавеющей стали Гамильтон шприц концов, что позволяет обеспечить введение порты для введения 5-HT, Д. А., различных агонистов и антагонистов рецепторов, а другими реагентами во время данного эксперимента.
2. Подготовка первичных культур гиппокампа
Все работы выполняются в любом BSL2 ламинарном боксе или в лавке ламинарного потока. Первичная нейронов гиппокампа изолированы от E18 крысиных эмбрионов в соответствии со стандартными процедурами 6-7, и выращивают в бессывороточной среде, что было обусловлено первичной коры астроцитов. Глиальные клетки получают в соответствии с опубликованной методы 7. Кондиционированной среды состоит из низких глюкозы DMEM, дополненной пролин (1,76 мкг / мл), аспарагин (0,83 мкг / мл), витамин В12 (0,34 мкг / мл), глюкозы (20 мм), богатых липидами BSA (0,5 мг / мл ) и 2% B27 8-10. Нет антибиотики добавляли в среду, поскольку они могут помешать нейронов транскрипции гена.
- Обложка центральной части покровного стекла 35 мм со стеклянным дном культуры блюдо (GBM) с поли-D-лизина (0,05 мг / мл в PBS), и оставить стоять в течение двух часов при температуре 37 ° C. Аспирируйте поли-D-лизин решение, дать высохнуть в течение 20 минут в течение ламинарном BSL2. Обложка поли-D-лизин покрытием покровное часть GBM с ламинин (0,01 мг / мл в PBS), и оставить на минимум 40 минут перед удалением избытка раствора ламинин. Отложите на 20 минут.
- Рассеките гиппокампе из мозга E18 крысиных эмбрионов, и отделить их, как описано в Текущий протоколов в неврологии 6.
- Развести диссоциированных клеток в питательную среду, чтобы обеспечить плотность 110 000 клеток на GBM. Расчет необходимой концентрации клеток в вашем мастер смеси в зависимости от числа GBMs вы будете готовить.
- Место посеяны GBMs в инкубаторе набор ата температуре 37 ° С и атмосфере смеси 10% CO 2 / 90% воздуха.
- От трех до пяти дней, в зависимости от условий выращивания нейронов, добавьте арабинозид C (0,14 нг / мл) для культур, чтобы подавить глиальных распространения.
- Разрешить культур расти в течение двух недель до заражения с лентивирусов. За это время заменить одну треть объем среды в каждой GBM свежей средой каждые три дня. Не превышать эту сумму из средств массовой информации, как это может привести к осмотическому шоку и гибели клеток.
3. Подготовка рекомбинантной лентивирус Кодирование красный флуоресцентный белок
Для исследователей, которые не имеют доступа к средствам для создания рекомбинантных лентивирусов, пользовательские производства коммерческой организацией, например, система биологических наук (Маунтин-Вью, Калифорния) является вариантом.
Mitochondrially ориентированных ген красного флуоресцентного белка (MitoTurboRFP; Axxora LLC, San Diego, CA) вставляется в само-инактивации рекомбинантной кошачьего вируса иммунодефицита под транскрипционным контролем усилитель от цитомегаловируса основных немедленного раннего промотора гена 11. Рекомбинантный лентивирусов производятся временно трансфекции 293T клеток.
- Пластина 293T клетки с плотностью ~ 75 000 клеток / см 2, на следующий день, со-трансфекции клеток с плазмидами кодирования рекомбинантный вирусный вектор, FIV кляп и пол гены, и вирус везикулярного стоматита G гена гликопротеина, используя PolyJet (SignaGen Лаборатории, Gaithersburg, MD). В общей сложности 12 мкг ДНК (4,8 мкг вирусного вектора, 4,8 мкг gagpol плазмиды и 2,4 мкг плазмиды VSV G) используется для каждого блюда 10см культуры 293T клеток.
- После 24 часов, аспирация питательной среды и промыть клетки с фенолом красным без Хэнкс сбалансированный солевой раствор для удаления остатков ДНК. Добавить 10 мл бессывороточной нейронных базальной среде, дополненной 50μg/ml богатых липидами BSA и Glutamax.
- На следующий день, урожай супернатант, процеживают через 0,2 мкм низкой связывания с белками фильтр и добавить в Vivaspin 20 полиэфирсульфона ультрафильтрации единица (Sartorius, Конкорд, США). Предварительная обработка Vivaspin единицы последовательным промыванием 70% этанола, культуры тканей класса водой, и фосфатно-солевом буфере. Концентрат вируссодержащих супернатант ~ 50-кратного центрифугированием при 1500xg течение 30 минут. Алиготе подготовки вирусов и хранить в жидком N 2.
- Оценка количества вируса и заразить крыс B104 клеток аликвоту концентрированного вируса и измерения флуоресцентных экспрессии белка с помощью проточной цитометрии 72 часов спустя. Процент положительных клеток позволяет оценить количество вируса, т.е. объем концентрированного вируса, необходимые для получения флуоресцентных экспрессии белка в заданное число первичных нейронов.
4. Заражение культивированный Нейроны
Гиппокампа культурах нейронов инфицированных на 14 дней в пробирке путем простого добавления количества вируса оценивается заразить до 50% всех нейронов на основе данных проточной цитометрии. Нет polybrene используется. Культур сохраняются в течение 3 дней перед проверкой для люминесцентных экспрессии белка. Если сигнал слишком слаб, то культура вернулся в культуре ткани инкубатор и повторное обследование через несколько дней.
5. Общее техническое обслуживание замкнутой системы жизнеобеспечения цепи
- Для обеспечения надлежащей влажности, убедитесь, что водяной рубашкой инкубатора периодически проверяется и заполнены в случае необходимости. Убедитесь, что место нержавеющей стали или алюминия лоток внутри инкубатора содержащие небольшое количество воды (25 мм в глубину) и альгицида.
- При необходимости очистить входной и выходной шланги схемы атмосферу инкубатора путем опорожнения собранной воды из водосборных трубок. Периодически флеш шланги с 70% этанола.
6. Применение мембранного Крышка для GBM и размещения в верхней Стадии-инкубатор
- До размещения GBM внутри стадии топ-инкубатор, заменить пластиковой крышкой с покрытые оболочкой крышку капота культуры ткани. Как только это сделано, вы можете переместить покрыты GBM к микроскопу.
- Тщательно сиденье с GBM покрытые оболочкой крышку встраиваемые открытие на базе стадии топ-инкубатора. Чтобы избежать толкотни GBM, убедитесь, что база уже существует на столике микроскопа, так как база клипов в сцене с трудом, лучше всего разместить GBM после база находится в положении.
- Выравнивание корпуса инкубатора стали сообщения на базе инкубатора и нижнего корпуса на базу. Затяните винты, пока хорошее уплотнение достигается между корпусом и базой.
7. Image Acquisition
Обратите внимание, что большинство доступных платформ ПО для обработки изображений имеют сравнимую функциональность в широком диапазоне микроскопы и соответствующее аппаратное обеспечение. Разнообразие захвата изображений и платформ программного обеспечения для анализа доступны, в том числе Метаморф и программ, предназначенных для конкретных делает микроскопа, такие как Leica приложений, компании Nikon NIS-Elements, а AxioVision Carl Zeiss. В этом протоколе описываются захвата изображений и анализ процедур мы осуществляется с помощью Slidebook 5 (Интеллектуальный изображений Инновации, Denver, CO). Тем не менее, учредительные шаги каждой операции, описанные в этом протокол можно легко адаптировать к использованию ряда других программ.
Описание перевернутой флуоресцентного микроскопа, фильтр конфигураций, ПЗС-камера, ксенон источник света, а также для обработки изображений:
Для динамических изображений митохондриальной транспорта в нейронах гиппокампа, мы используем Leica DMI-6000B перевернутой флуоресцентного микроскопа и модель 11-522-068 моторизованных этапе (Leica Microsystems GmbH CMS, Wetzlar, Германия), снабженные Кук Sensicam EQ CCD камера (Cooke Корпорация, Ромул, MI), Саттер Lambda 10-2 фильтр колесо и контроллер (Саттер Instrument Company, Новато, Калифорния), и Саттер DG-4 300W ксенон источник света. Для визуализации митохондрий помечены MitoTurbo красный флуоресцентный белок, мы используем сочетание 555nm фильтр на DG-4 источника света для возбуждения и фильтры 600 нм (пик; Седат Quad Светоделитель Модель 86100bs установлен на Leica DM серии фильтров куб, Chroma технологии Corp, Сильфон-Фолс, VT) и 617nm в микроскоп и фильтр колеса, соответственно, выбросов.
Для приобретения и анализа изображений, мы используем цифровой микроскопии изображений программный пакет Slidebook 5. Это всеобъемлющий пакет, который позволяет полностью автоматизированного управления микроскопом, сцена, фильтр колеса, камеры и источника света во время захвата изображений, а также различные обработки и анализа изображений модулей.
Ниже мы приведем конкретный, шаг за шагом инструкции для приобретения промежуток времени изображения движущихся митохондрий в флуоресцентно меченных нейронов использованием Slidebook 5.
- Убедитесь, что микроскоп, фильтр контроллер колесо, источник света, и ПЗС-камеры были включены, прежде чем открывать Slidebook 5.
- Для живого изображения митохондрий, переключиться на 63x нефтью погружения цели, нижняя цель башни настолько, чтобы обеспечить доступ к объективной ниже столик микроскопа (и этапИнкубатор-топ), и осторожно применять масло непосредственно на поверхности цели. Открытая фокус окно, нажав значок «Фокус окна" на панели инструментов Slidebook. В центре окна, включить лампу светлое, сдвинув слайдер с меткой 'лампа', чтобы настроить интенсивность светлого к подходящему уровню. Приобретать сосредоточиться на поле клеток и найти ячейку интерес.
- В разделе "Сфера" выберите пункт "Cy3 'фтора. Использование окуляров, под флуоресцентным освещением найти плоскости фокуса для митохондрий в клетках, которые были помечены белка Mito TurbRed. После того как вы приобрели фокус через окуляры, переключиться на ПЗС-камерой и вновь приобрести фокус, если это необходимо.
- Откройте окно захвата изображения, нажав на иконку "Image Capture" на панели инструментов Slidebook. Начиная с начальной время экспозиции составляет 100 мс, найти оптимальное время экспозиции с помощью «Тест» и «Найти лучших" кнопок; качестве альтернативы, вы можете использовать 'После' кнопку. Помните, что время экспозиции должно обеспечить достаточную интенсивность распространения по всему полю изображения (например, 0-2500; указывает гистограмма в нижней части окна, захват изображения) в минимальный срок (например, 200-800 мс).
- Перед началом покадровой получения изображений, открыть "Дополнительно" окна, нажав на вкладку "Дополнительно" все еще в пределах окна захвата изображения. Найти "Фокус" на вкладке, проверить 'Autofous во время вариант time-lapse/multipoint захватывает ", а также настроить параметры автофокусом покадровой получения изображений. Как правило, мы используем следующие параметры для автофокусировки: обновление фокус каждые 2-3 кадра, выбрать, как автофокус канал плавикового использоваться для работы с изображениями помечены митохондрии, то есть Cy3; общий диапазон поиска 2 мкм для 63x увеличением.
- В 'Capture' окно, в графе "Тип Capture», флажок «Timelapse" и выберите необходимый интервал изображения и продолжительность визуализации сессии в рамках опции «Timelapse Захват». В наших исследованиях эффекты нейромодуляторов на митохондриальной транспорта, покадровой визуализации был выполнен в течение одного часа сессии, в которых в общей сложности 360 изображений были приобретены в 10 секундным интервалом между изображениями.
- Начало покадровой получения изображения, нажав кнопку "Пуск" в нижней части, с правой стороны, из 'Capture' окно.
- После первоначального, или контроля, работы с изображениями сессии, администрирования нейротрансмиттеров и других реагентов через верхнюю порты стадии топ-инкубатор и начать новую сессию изображений.
8. Анализ изображений
- Откройте изображение, файл, сохраненный после последней сессии изображений.
- Индивидуальные митохондрии могут быть помечены в замедленной серии изображений автоматически или вручную, используя маскирующие функции, предусмотренные в Slidebook 5.
- Под «Маска» меню, выберите "Сегмент" из меню. По скользящей низкого и высокого порога линии 'гистограмма' инструмент, маскируя все частицы в синий всего изображения, охватывающие все митохондрий, содержащиеся в этом процессе, но оставив в виде отдельных частиц, как это возможно. Нанесите маску на всю серию изображений.
- Создать вторую маску (под «Маска» меню, выберите "Создать"), который охватывает все изображение за исключением процесса интерес, в котором частицы была подчеркнута предыдущие маски. Это достигается, во-первых, с помощью инструмента "карандаш" толстые проследить границы районы за пределами этого процесса, а затем, используя инструмент "Заливка", чтобы заполнить в ограниченной области. Применять эту маску для всей серии изображений.
- В разделе "Маска", выберите «Маска операции и выполнять" минус "операции, то есть, вторая маска вычитается из кулака маски (все изображение, кроме процесса). Третья маска будет сгенерирована, в которой только процесс интерес выделяется. Заметим, что эта новая маска будет применяться к целой серии изображений.
- В разделе "Аннотации", выберите "идентификаторы объектов.
- Проверка непрерывности и численного задания индивидуальных масках митохондрий, вручную обзор серии изображений (в Slidebook 5, "играть", "вперед кадр" и "обратный кадр", кнопок, расположенных ниже окна изображения могут быть использованы для этой цели).
- Выберите «Маска» на вкладке меню. В разделе "Маска", выберите "частиц Tracking 'и запустить« Основные частиц Tracking' для создания 'Путь Статистика », включая координаты центра тяжести для каждого масках митохондрии.
- Расстояние, проходимое каждой митохондрии между двумя соседними кадрами изображения рассчитывается исходя из координат каждой частицы в каждом кадре.
- В наших предыдущих исследованиях влияния нейромодуляторов на митохондриальной движение, мы определили три разные популяции митохондрий:. 'Стационарные "," колебательная "и" направленно движущиеся' Если митохондрии путешествует менее 0,2 мкм (или 2 пикселя, под 63x увеличением, 1 пиксель = 0,10235 мкм) в течение одного часа, она характеризуется как «стационарных». Если митохондрии движется не менее 0,2 мкм, но меньше, чем 2.5 мкм, в антероградной-ретроградный цикл, то оно определяется как «колебательный». Наконец, если митохондрии путешествует чистая расстояние более 2,5 мкм в одном направлении, это классифицируется как движение направленно. Изображенный на рисунке 2, гистограмма показывает движение всех меченых митохондрий в эксперименте представителя, а также круговые диаграммы, показывающей процентное распределение трех различных популяций митохондрий.
- Средняя скорость каждого митохондрии рассчитывается в соответствии с общее расстояние, пройденное в течение данного изображения сессии. Средняя скорость митохондриальных населения рассчитывается путем сложения отдельных скоростях и деления на общее число митохондрий отслеживаться.
- Kymographs можно сгенерировать с помощью модуля представлены в Slidebook 5. Использование «Маска» функции, нарисуйте тонкую линию по всем протяжении данного процесса (например, аксон), не забудьте пройти через столько митохондриальной центроиды насколько это возможно. К «Маска» на вкладке меню и выберите пункт "Дополнительные операции", а затем 'Smooth Анализ кривой. Используйте настройки по умолчанию для гладкого анализа кривой или настроить по своему желанию. Выполнить гладкой модуль анализа кривой. В конце анализа, кимограф из изображений сессии будет отображаться.
- Переход к строке меню и меню "Вид" выберите пункт, а затем "Экспорт TIFF.
- Откройте сохраненный. TIF файл, содержащий кимограф в фотошопе или сопоставимые программы обработки изображений и преобразовать изображение в перевернутом оттенках серого.
9. Представитель Результаты
По отслеживание и анализ митохондриальной движение в культуре нейронов гиппокампа, мы продемонстрировали связь между нейромодуляции и митохондриальной торговли людьми. В частности, мы обнаружили, что серотонин (5-HT) или 5-HT1A рецепторов, 8-OH-DPAT, стимулирует митохондриальную движения (Рис. 2A-C) 8, тогда как дофамин (ДА) или D2 агонистов рецепторов, бромокриптин, тормозит митохондриальной движения (рис. 2D-G) 9.
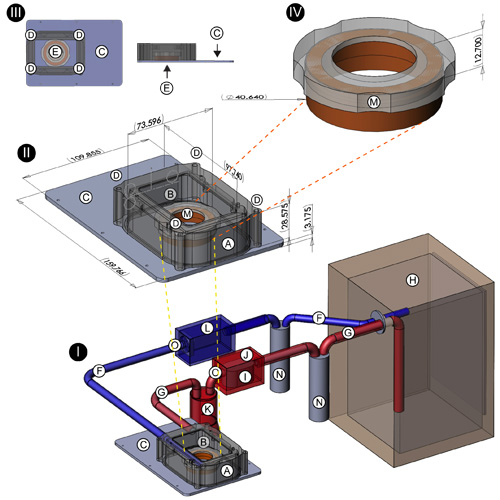
Рисунок 1. Дизайн замкнутой цепи стадии топ-системы инкубатор следующие компоненты системы инкубатор показаны: Термостойкий Delrin пластиковый корпус (); прямоугольное отверстие для оконных поликарбонатного пластика (B), алюминий базе инкубатора (С); отверстий. принять стали сообщения из базы (D); 35.1mm диаметр отверстия с тонкими встраиваемые губой в центре инкубатора базы для размещения 35 блюд GBM (E); Nalgene шланги (соединения между культурой ткани и стадии топ-инкубаторов; влаги ловушки) ( F, G, N); культуре ткани инкубатора (H); аквариум насосом (I); герметичный ABS пластиковый бокс (корпус насоса для аквариума) (J); 2000 мл колбу Эрленмейера (глушитель для подавления вибрации в шланг до стадии топ- инкубатор) (К); пластиковый корпус для охлаждения вентилятора (L), пластиковая рамка для крышки 35 мм GBM (М); положение пластиковых кранами (O). Расположение портов для введения реагентов обозначены желтыми стрелками (II).

Рисунок 2. Представитель результаты: регулирование митохондриального транспорта А.. Axon типичного нейрона гиппокампа крыс в культуре. Митохондрии помечены лентивирус кодировке флуоресцентный белок отображаются зеленым цветом; аксонов immunolabeled с фосфорно-нейрофиламентов антител показаны красным цветом. Объем аксона обозначается желтой наконечники для стрел. Изображение состоит из четырех перекрывающихся снимках. Б. Пример покадровой серии изображений, показывающих изменения в митохондриальной движения после введения 5-HT. Изображения были получены с помощью перевернутой флуоресцентного микроскопа и хранится в виде последовательности, которые впоследствии были преобразованы в Quicktime фильмов. Представитель последовательность изображений показаны отдельные митохондрии в различные моменты времени до (слева) и после (справа) администрацией 8-OH-DPAT, 5-HT1A рецепторов. Вертикальный прямоугольник красного подчеркивает стационарных митохондрии (слева) и колебательные митохондрии (справа) в течение нескольких моментов времени. Колебательные митохондрии указано (слева) движется в сторону аксон терминала после лечения с помощью 8-OH-DPAT (правая панель, красный-белый граничит наконечники стрел). Вертикальная желтая линия (справа) указывает на начальную позицию движущихся митохондрии. Временные интервалы приведены в правом нижнем углу каждого кадра. Увеличение (63 ×) указывается в правом нижнем углу правой панели. C, D. участки, показывающие изменения в митохондриальной движения после введения 5-HT. Изменения в митохондриальной движения до (C) и после (D) введение 5-HT приводятся в виде графиков скорости (ось Х) по сравнению с начальной позиции отдельных митохондрий вдоль аксона (Y ось). Скорость и доля стационарных (красный), колебательной (синий), и направленно движется (зеленый) мitochondria представлены на участках и круговые диаграммы (вставками выше участков), соответственно. Красной пунктирной линией проецирование подчеркнул регионов мультфильма аксону к Y-ось каждого участка указывают приблизительное местоположение и степень аксон сегмент, который был образ. E, F. участки, показывающие изменения в митохондриальной движения после введения DA. Изменения в движении, прежде чем митохондриальная (E) и после (F) администрации Д. А. приводятся в виде графиков скорости (ось Х) по сравнению с начальной позиции отдельных митохондрий вдоль аксона (Y ось). Скорость и доля стационарных (красный), колебательной (синий), и направленно движется (зеленый) митохондрий представлены на участках и круговые диаграммы (вставками выше участков), соответственно. Красной пунктирной линией проецирование подчеркнул регионов мультфильма аксону к Y-ось каждого участка указывают приблизительное местоположение и степень аксон сегмент, который был образ. G, H. представитель kymographs показывает митохондриальной движения в культурной нейрона до (G) и после (H) администрации агонистов рецепторов D1R, бромокриптин. Нейрон отображаемого на один час раньше (G) и один час после (H) администрации бромокриптина.
Обсуждение
Используя лентивирус-опосредованной экспрессии флуоресцентный белок, ориентированные на митохондрии в инфицированных культурный нейронов и недорогие лабораторные построенной сцене верхом инкубатор, который позволяет изображений живых клеток в течение длительного длительности, мы смогли исследовать связь между митохондриальной движения и neuromodulatory сигналы , таких как серотонин (5-HT), допамина (ДА), а также ацетилхолин (АХ). Наши исследования помогли выяснить, что сигнальный путь, в первый раз, ссылки митохондриальной торговли изменений в активности нейронов модулированных по нейромедиаторов, таких как 5-НТ и DA - что лежат в основе нейронных функции. Мы считаем, что использование целевых флуоресцентных белков позволяет наблюдение меченых митохондрий в живых культурных нейронов в течение длительного периода, что может быть более актуальным, чем физиологически гораздо более короткие сроки, которые возможны с использованием витальных красителей. Кроме того, интенсивность флуоресцентного сигнала белка позволяет нам держать экспозиции в течение короткого захвата изображения, сводя к минимуму возможность фотообесцвечивания или фототоксичности. Наконец, простой и недорогой стадии топ-инкубатор, который поддерживает температуру окружающей среды, влажность и уровень СО2, при сведении к минимуму испарение средства массовой информации, позволяет проследить движение митохондриальной в живых нейронов в течение часов или даже дней. Исследователи, которые хотят изготовить стадии топ-инкубатор для долгосрочного наблюдения митохондрий в живых нейронах не должны следовать точные данные о нашем проекте, при условии, что свойства используемых материалов (например, газ мембрану, чтобы избежать испарения СМИ ) и принципы, применяемые (например, контроль температуры и влажности, буферизации рН, поддержание осмолярности) в целом согласуются с тем, что описано в этом протоколе.
Раскрытие информации
Благодарности
Мы хотели бы поблагодарить Дональд Хатсон за вклад его технический опыт и высокое мастерство в ходе проектирования и изготовления стадии топ-инкубатора. Мы также благодарны Айда Dashtaei за отличную техническую помощь. Все Работа выполнена при поддержке Фонда исследования нейронаук.
Материалы
| Name | Company | Catalog Number | Comments |
| Количество | Описание (и расположение на рисунке 1) | ||
|---|---|---|---|
| 1 | Культуры ткани инкубатора (H) | ||
| 1 | Термостойкий пластиковый корпус (Delrin или сопоставимых) () | ||
| 1 | Пластиковая рамка для крышки 35 мм GBM (для крепления мембраны Петри) (M) | ||
| 1-2 | линейный фут Открытый PFTE (тефлон) материала мембраны | ||
| 4 | Винты латунные большого пальца | ||
| 2 | Малый 10кОм резистор радиатора (используется в качестве нагревательных элементов внутри этап-верхнем кожухе инкубатор) | ||
| 1 | Трансформатор (поставка 9В ток резисторы) | ||
| 1 | Террариум регулятором температуры и датчиком (термостатическим регулированием власти радиатор резисторов через трансформатор) | ||
| 1 | 2000 мл колбу Эрленмейера (глушитель для подавления вибрации в шланг до стадии топ-инкубатор) (K) | ||
| 1 | 1 / 8 "sorbothane лист (прокладка материал для базы стадии топ-инкубатор) | ||
| 1 | Герметичная ABS (или сопоставимых) пластиковую коробку (корпус для аквариумных насосов) (J) | ||
| 1 | Аквариум насоса (I) | ||
| 1 | Малый вентилятор охлаждения компьютера | ||
| 1 | Пластиковый корпус для охлаждения вентилятора (L) | ||
| 1 | 9 В трансформатор для вентилятора охлаждения компьютера | ||
| 20-30ft | Nalgene или силиконовые шланги (соединения между культурой ткани и стадии топ-инкубаторов; влаги ловушки) (F, G, N) | ||
| 2 | Пластиковые краны (для открытия и закрытия воздушного потока до и после стадии топ-инкубатор) (O) | ||
| 4 | Колючая латуни шланг разъемы (для соединения шлангов с / на стадии топ-инкубатор и аквариум насос корпус) | ||
| 2 | Латунь быстрой смены навесного оборудования (для соединения шлангов с / на стадии топ-инкубатор) | ||
| 2 | Латунь быстрой смены навесного оборудования (для соединения шлангов с / на стадии топ-инкубатор) |
Таблица 1. Стадии-инкубатор верхней части:
| Название реагента | Компания | Номер в каталоге |
|---|---|---|
| Поли-D-лизина | Sigma-Aldrich | P7280-5мг |
| ламинин | Roche Applied Science | 11243217001 |
| 35 мм со стеклянным дном блюда | Маттек | P35GC-0-14-C |
| DMEM | Life Technologies | 10567 |
| B27 | Life Technologies | 17504-044 |
| Glutamax | Life Technologies | 35050 |
| Липидный богатых BSA | Life Technologies | 11020-021 |
| L-аспарагина | Sigma-Aldrich | P0380-100G |
| L-пролин | Sigma-Aldrich | A8381-100G |
| Витамин B-12 | Sigma-Aldrich | V2876-100мг |
| 5-HT | Sigma-Aldrich | H9523-25 мг |
| 8-OH-DPAT | Sigma-Aldrich | H8520-25 мг |
| Допамин | Sigma-Aldrich | H8502-5G |
| Бромокриптин | Sigma-Aldrich | B2134-25 мг |
| SKF38393 | Sigma-Aldrich | D047-100мг |
Ссылки
- Ligon, L. A., Steward, O. Movement of mitochondria in the axons and dendrites of cultured hippocampal neurons. J Comp Neurol. 427, 340-350 (2000).
- Miller, K. E., Sheetz, M. P. Direct evidence for coherent low velocity axonal transport of mitochondria. J Cell Biol. 173, 373-381 (2006).
- Macaskill, A. F. Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses. Neuron. 61, 541-555 (2009).
- Morris, R. L., Hollenbeck, P. J. Axonal transport of mitochondria along microtubules and F-actin in living vertebrate neurons. J Cell Biol. 131, 1315-1326 (1995).
- Rintoul, G. L., Filiano, A. J., Brocard, J. B., Kress, G. J., Reynolds, I. J. Glutamate decreases mitochondrial size and movement in primary forebrain neurons. J Neurosci. 23, 7881-7888 (2003).
- Crawley, J. N. . Current protocols in neuroscience. , (1999).
- Fedoroff, S., Richardson, A. . Protocols for neural cell culture. , (2001).
- Chen, S., Owens, G. C., Crossin, K. L., Edelman, D. B. Serotonin stimulates mitochondrial transport in hippocampal neurons. Mol Cell Neurosci. 36, 472-483 (2007).
- Chen, S., Owens, G. C., Edelman, D. B. Dopamine inhibits mitochondrial motility in hippocampal neurons. PLoS One. 3, e2804-e2804 (2008).
- Chen, S., Owens, G. C., Makarenkova, H., Edelman, D. B. HDAC6 regulates mitochondrial transport in hippocampal neurons. PLoS One. , e10848-e10848 (2010).
- Curran, M. A., Kaiser, S. M., Achacoso, P. L., Nolan, G. P. Efficient transduction of nondividing cells by optimized feline immunodeficiency virus vectors. Mol Ther. 1, 31-38 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены