Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Etudier Trajectoires Cellule roulant sur les Patterns récepteur asymétrique
Dans cet article
Résumé
Nous décrivons un protocole d'observer et d'analyser les trajectoires de cellules roulant sur des récepteurs asymétriques des substrats. Les données obtenues sont utiles pour l'ingénierie des récepteurs des substrats pour les sans étiquette de séparation des cellules et l'analyse.
Résumé
Déplacement latéral des cellules orthogonales à un flux de circulation en roulant sur les habitudes des récepteurs asymétriques présente une opportunité pour le développement de nouveaux dispositifs pour les sans étiquette séparation et l'analyse des cellules 1. De tels dispositifs peuvent utiliser un déplacement latéral des flux continu de séparation, ou des modèles de récepteur qui modulent l'adhérence de distinguer entre les différents phénotypes cellulaires ou des niveaux d'expression du récepteur. Comprendre la nature des trajectoires de cellules roulant sur les récepteurs des substrats est nécessaire pour l'ingénierie des substrats et la conception de tels dispositifs.
Ici, nous démontrons un protocole pour l'étude des trajectoires de cellules de roulement sur les habitudes des récepteurs asymétriques qui soutiennent l'adhésion des cellules de roulement 2. Bien définis, um échelle schémas de P-sélectine récepteurs ont été fabriqués en utilisant l'impression par microcontact sur l'or-lames recouvertes qui ont été incorporées dans une chambre d'écoulement. HL60 cellules exprimant le ligand PSGL-1 3 ont coulé à travers un champ de lignes à motifs et visualisés sur un microscope à champ clair inversée. Les cellules laminés et suivis le long des bords inclinés des motifs, résultant en une déviation latérale. Chaque cellule généralement roulé pour une certaine distance le long des bords motif (définie comme la longueur de suivi de bord), détaché à partir du bord, et rattaché à un modèle en aval. Bien que ce détachement, il est difficile de suivre la trajectoire entière d'une cellule de l'entrée jusqu'à la sortie de la chambre d'écoulement, de traces de particules logiciel a été utilisé pour analyser les trajectoires et le rendement de roulement des cellules pendant le temps où ils se déplacent sur un seul récepteur à motif de ligne. Les trajectoires ont ensuite été examinés afin d'obtenir des distributions de vitesses de roulement et la cellule de longueurs d'arêtes de suivi pour chaque cellule pour des motifs différents.
Ce protocole est utile pour quantifier les trajectoires de cellules roulant sur les modèles de récepteur et concernant ces paramètres d'ingénierie tels que l'angle modèle et la contrainte de cisaillement. Ces données seront utiles pour la conception de dispositifs microfluidiques pour sans étiquette de séparation des cellules et l'analyse.
Protocole
1. HL60 cellules de roulement
1.1. La fabrication des substrats à motifs.
- En utilisant l'impression par microcontact (μCP) 4-7 pour faire en alternance monocouches auto-assemblées (SAM) de molécules PEG sur les lames de verre recouvert d'or: Fabriquer l'impression microcontact polydiméthylsiloxane (PDMS) timbres qui définit les modèles de récepteur avec angle d'inclinaison de α = 10 ° par une SU-8 processus de moulage. Nettoyer la surface d'or avec une solution piranha (3:1 mélange d'acide sulfurique à 30% de peroxyde d'hydrogène) pendant 20 minutes puis rincer la surface avec de l'eau DI copieuses à 24,5 ° C avant utilisation. Encre du timbre de PDMS avec une solution de PEG 5mM dans l'éthanol. Sécher le timbre dans l'air pendant 20 minutes. Sans forcer, insérez le tampon sur la surface d'or pour 40 secondes et s'assurer qu'il ya un bon contact entre la surface d'or et le timbre. Aucun excès de pression est nécessaire. Rincer la surface avec de l'éthanol et le sécher sous un courant de N 2.
- Incuber le substrat dans la P-sélectine solution (15 ug / ml dans du DPBS) en utilisant une chambre de perfusion (Sciences Electron Microscopy) pour 3 heures à 24,5 ° C le modèle des zones restant avec la P-sélectine. Rincer la surface avec du DPBS copieux.
- Remblai de la surface avec de la BSA (1 mg / ml dans du DPBS) pendant 1 h à bloquer des interactions non spécifiques. Rincer la surface avec du DPBS copieux.
1.2. Cellule roulant Expériences dans une chambre d'écoulement.
- Débit d'une suspension de cellules HL60 (~ 10 5 cellules / mL) au cours des surfaces texturées dans une chambre d'écoulement rectangulaire (Glycotech, Inc; largeur w = 1,0 cm, longueur = 6 cm, hauteur h = 0,0127 cm) à 24,5 ° C. Utiliser une pompe seringue (instruments de précision mondiale, SP230IW) pour générer le débit de 75 uL / min, avec la contrainte de cisaillement correspondante d'environ 0,5 dyn / cm 2 (~ 0,05 Pa). Calculer la contrainte de cisaillement τ en utilisant l'équation d'écoulement plan de Poiseuille τ = 6μQ/wh 2, où μ est la viscosité cinématique (0,001002 Pa s), Q est le débit volumétrique, w est la largeur de la chambre d'écoulement, et h est la hauteur de la chambre d'écoulement.
- Utiliser un microscope inversé (Nikon TE2000-U) avec une caméra montée (Andor ixon 885) pour enregistrer les interactions cellules HL60 rouler avec de l'adhésif P-sélectine substrats utilisant un 4 × objectif, typiquement à une vitesse de 1 image par seconde pour des durées de 300 s. Effectuer trois expériences indépendantes, pour chaque grandeur contrainte de cisaillement et l'angle d'inclinaison motif. Présenter les données que moyenne et l'écart type des valeurs moyennes obtenues par chaque expérience.
- Analyse des données.
Analyser les séquences d'images par une mesure de Matlab (The MathWorks, Inc) programme qui utilise une particule de suivi 8 freeware pour créer des pistes le long des bords de ligne à motifs. Pistes s'étendant jusqu'à la fin de la bande P-sélectine sont choisies et montées avec deux segments de ligne droite - un alignement avec le flux, l'autre aligné avec le bord motif. Ces deux segments sont ensuite utilisés pour calculer la longueur de suivi de pointe, la vitesse de roulement sur le bord, et le laminage de vitesse sur la région plaine.
2. Les résultats représentatifs:
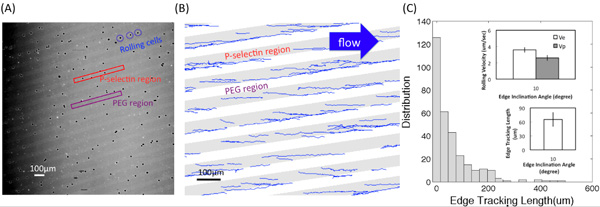
Figure (A) montre une des images de microscopie converti de la vidéo de HL60 interactions rouler avec de l'adhésif P-sélectine substrats en utilisant un objectif 4x. Régions lumineuses et sombres correspondent à la P-sélectine récepteurs et les régions du PEG, respectivement. Figure (B) montre les traces obtenues en utilisant un programme personnalisé de Matlab. L'angle d'inclinaison pointe était de 10 ° et la contrainte de cisaillement a été de 0,5 dyn / cm 2. La longueur de suivi de pointe, l e, le déplacement, d, et les vitesses de roulement sur le bord et l'intérieur des bandes, V e et V p, respectivement, sont décrits dans la figure (C-1). Figure (C-2) montre les distribution (le nombre de cellules enregistrées) de longueur suivi bord. Encarts montrent la valeur moyenne de l e et la vitesse de roulement sur le bord (V e) et l'intérieur des bandes (V p) à l'angle d'inclinaison α = 10 ° et l'ampleur du stress de cisaillement du fluide autour de 0,5 dyn / cm 2. Les barres d'erreur représentent un écart-type, où n = 3 expériences répétées (3 surfaces répliquer) pour chaque condition.
Discussion
Nous avons décrit un protocole pour examiner les cellules trajectoires roulant sur des récepteurs asymétriques surfaces texturées fabriqué en utilisant deux l'impression par microcontact. Les images de microscopie optique de surface à motifs montrant contraste évident entre le PEG et le P-sélectine zones peuvent être utilisées pour confirmer si d'emboutissage est réussie. Sharp, arêtes droites peut être observé lorsque l'horodatage est bien performé. Dur appuyant sur le timbre...
Déclarations de divulgation
Remerciements
Ce projet a été soutenu par le Centre pour l'Innovation Technologique Deshpande au MIT (RK et JMK) et le prix CAREER de la NSF 0952493 à RK à travers le programme chimique et biologique des séparations. Nous remercions l'Institute for Soldier Nanotechnologies (ISN) et le Laboratoire de technique des microsystèmes (MTL) au MIT pour l'utilisation de leurs installations.
matériels
| Name | Company | Catalog Number | Comments |
| Human promyelocytic leukemia cells | ATCC | CCL-240 | HL60 cells |
| Gold-coated glass slides | EMF | TA134 | Gold slides |
| (1-Mercaptoundec-11-yl)tetra(ethylene glycol) | Sigma-Aldrich | 674508 | PEG |
| Recombinant human P-selectin | R&D Systems | ADP3-050 | P-selectin |
| Bovine serum albumin | Rockland Immunochemicals | BSA-50 | BSA |
| Dulbecco’s phosphate buffered saline | Mediatech, Inc. | 21-030 | DPBS |
| Sulfuric acid | Sigma-Aldrich | 339741 | |
| Hydrogen peroxide | Sigma-Aldrich | 316989 |
Références
- Karnik, R., Hong, S., Zhang, H., Mei, Y., Anderson, D. G., Karp, J. M., Langer, R. Nanomechanical control of cell rolling in two dimensions through surface Patterning of receptors. Nano Lett. 8 (4), 1153-1158 (2008).
- Lee, C. H., Bose, S., Van Vliet, K. J., Karp, J. M., Karnik, R. Examining Lateral Displacement of HL60 Cells Rolling on Asymmetric P-selectin Patterns. Langmuir. 27 (1), 240-249 (2011).
- Norman, K. E., Moore, K. L., McEver, R. P., Ley, K. Leukocyte rolling in-vivo is mediated by p-selectin glycoprotein ligand-1. Blood. 86 (12), 4417-4421 (1995).
- Bernard, A., Delamarche, E., Schmid, H., Michel, B., Bosshard, H. R., Biebuyck, H. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- James, C. D., Davis, R. C., Kam, L., Craighead, H. G., Isaacson, M., Turner, J. N., Shain, W. Patterned protein layers on solid substrates by thin stamp microcontact printing. Langmuir. 14 (4), 741-744 (1998).
- Mrksich, M., Whitesides, G. M. Using self-assembled monolayers to understand the interactions of man-made surfaces with proteins and cells. Annual Review of Biophysics and Biomolecular Structure. 25, 55-78 (1996).
- Tan, J. L., Tien, J., Chen, C. S. Microcontact printing of proteins on mixed self-assembled monolayers. Langmuir. 18 (2), 519-523 (2002).
- Lee, D., King, M. R. Microcontact Printing of P-Selectin Increases the Rate of Neutrophil Recruitment Under Shear Flow. Biotechnology Progress. 24 (5), 1052-1059 .
- Greenberg, A. W., Hammer, D. A. Cell separation mediated by differential rolling adhesion. Biotechnol. Bioeng. 73 (2), 111-124 (2001).
- Higuchi, A., Tsukamoto, Y. Cell separation of hepatocytes and fibroblasts through surface-modified polyurethane membranes. J. Biomed. Mater. Res. Part A. 71A (3), 470-479 (2004).
- Alexeev, A., Verberg, R., Balazs, A. C. Patterned surfaces segregate compliant microcapsules. Langmuir. 23 (3), 983-987 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon