Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un débit élevé In situ pour caractériser les modes d'expression d'ARNm dans les fœtus de souris tractus urogénital
Dans cet article
Résumé
Ici, nous décrivons un débit à haute efficacité In situ (ISH) méthode pour visualiser les modèles de l'expression des ARNm dans le développement du fœtus de souris de la prostate sections de tissu. La méthode peut être facilement adapté à visualiser les profils d'expression des ARNm dans les tissus de la souris ou dans des tissus provenant d'autres espèces.
Résumé
Développement de la partie inférieure tractus urogénital (LUT) est un processus complexe. Cette complexité se manifeste lors de la formation de la prostate de l'urètre fœtus de sexe masculin, qui repose sur les signaux des androgènes et des épithélio-mésenchymateuse 1,2 interactions. Comprendre les mécanismes moléculaires responsables de l'élaboration de la prostate peut révéler des mécanismes de croissance qui sont mal réveillé tard dans la vie pour donner naissance à des maladies de la prostate tels que l'hyperplasie bénigne de la prostate et le cancer de la prostate.
Le LUT développement est anatomiquement complexes. Par la prostate de temps en herbe commence le jour après la conception 16.5 (DPC), de nombreux types cellulaires sont présents. Vascularisation, les nerfs et les muscles lisses résident dans le stroma mésenchymateux 3. Ce stroma entoure un épithélium multicouches et donne lieu à la prostate fœtale par androgènes dépendante du récepteur de signaux paracrines 4. L'identité de la stromales androgènes récepteurs réceptif gènes nécessaires pour le développement de la prostate et le mécanisme par lequel les formes de la prostate épithélium canalaire en réponse à ces gènes n'est pas entièrement comprise. La capacité à identifier précisément les types de cellules et de localiser l'expression de facteurs spécifiques en leur sein est impératif de mieux comprendre le développement de la prostate. L'hybridation in situ (ISH) permet pour la localisation des ARNm dans un tissu. Ainsi, cette méthode peut être utilisée pour identifier motif et le calendrier de l'expression de molécules de signalisation et leurs récepteurs, ce qui élucider les régulateurs de la prostate potentiel de développement.
Ici, nous décrivons une technique à haut débit ISH pour identifier les modèles d'expression d'ARNm dans la LUT fœtus de souris à l'aide vibrant microtome coupe sections. Cette méthode offre plusieurs avantages sur d'autres protocoles de l'ISH. Exécution ISH, sur coupes fines adhéré à une diapositive est techniquement difficile; cryocoupes ont souvent mauvaise qualité de la structure alors que les deux sections de paraffine et de cryocoupes aboutissent souvent à la résolution du signal faible. Exécution ISH sur les tissus monture entier peut entraîner le piégeage de la sonde. En revanche, notre technique à haut débit utilise coupe épaisse sections qui révèlent l'architecture du tissu détaillés. Microtubes de modification permettre une manipulation facile des sections lors de la procédure ISH. Un maximum de 4 transcrits d'ARNm peut être projeté à partir d'un simple LUT 17.5dpc avec jusqu'à 24 transcrits d'ARNm détectés en un seul passage, réduisant ainsi les coûts et maximiser l'efficacité. Cette méthode permet de multiples groupes de traitement pour être traitées de façon identique et comme une seule unité, éliminant ainsi tout biais d'interprétation des données. La plupart des chercheurs de la prostate pertinemment, cette méthode fournit une localisation spatiale et temporelle de haute et basse transcrits d'ARNm abondance dans l'urètre fœtus de souris qui donne naissance au réseau de la prostate canalaire.
Protocole
1. Synthèse d'une ribosonde digoxigénine-11-UTP-étiquetées à partir d'un modèle généré par PCR
- Pour synthétiser une ribosonde spécifiques du gène, utilisez Entrez Gene (http://www.ncbi.nlm.nih.gov/sites/entrez) pour obtenir la séquence de référence du gène d'ADNc (RefSeq). Utilisez le programme Primer3 (http://frodo.wi.mit.edu/primer3/) 5 à la conception spécifiques du gène amorces PCR contre la région 3 'de la séquence d'ADNc. Paramètres recommandés pour la sélection des amorces PCR sont décrites ailleurs (http://www.gudmap.org/Research/Protocols/Vezina/Riboprobe_Syn.html).
- Utilisez le programme Megablast (http://www.ncbi.nlm.nih.gov/genome/seq/BlastGen/BlastGen.cgi?taxid=10090) 6 pour évaluer la spécificité de la séquence d'ADN choisie. La séquence d'ADN est considéré comme spécifique lorsque, en utilisant un seuil de 0,01 ATTENDRE, il ne s'aligne pas avec d'autres séquences dans la base de RefSeq.
- PCR amplifient le modèle ribosonde. Composants de la réaction PCR et les conditions de thermocyclage devrait être optimisé pour chaque ensemble d'amorces. Un type réactionnel de 50 ul contient: tampon 1X, 2 mM MgCl 2, 0,2 dNTP, 1X Q solution, 1 pg d'ADNc, 2,5 U polymérase Taq ADN, des amorces de 0.25μm, et sans nucléase H 2 O. Un protocole de thermocyclage typique comprend une dénaturation initiale à 94 ° C pendant 2min suivie par 40 cycles de 94 ° C pendant 30sec, 57 ° C pendant 30sec, 72 ° C pendant 1 min et une extension finale à 72 ° C pendant 10min. L'ADNc utilisé dans les réactions PCR est synthétisée à partir d'ARNm de souris urogénital.
- Séparer les produits de PCR par électrophorèse sur gel, de purifier l'aide du kit d'extraction de gel, et de quantifier les produits purifiés par spectrophotométrie. Le rendement attendu est de 1,2 - 3.6μg.
- Transcrire le produit de PCR dans une ribosonde marquée. La réaction de transcription (40 pi) contient: 400ng produit PCR purifié, 1X mélange de nucléotides étiquetage contenant digoxigénine 11-UTP, 1X tampon de transcription, 5U inhibiteur de RNase, 80U T7 RNA polymérase, et sans nucléase H 2 O. Incuber 3-4h à 37 ° C des échantillons et agiter toutes les 30min.
- Utilisez le kit Qiagen RNeasy Mini pour purifier ribosondes en fonction des instructions pour le nettoyage d'ARN avec dans la colonne digestion par la DNase. Quantifier ribosondes par spectrophotométrie. Le rendement attendu est 4-20 mg. Évaluer la qualité de la sonde en séparant une partie aliquote par électrophorèse sur un 1,5% non dénaturant gel d'agarose. Sondes de haute qualité migrent en bandes distinctes avec traînées minimes.
- Pour assurer la ribosonde reconnaît spécifiquement sa cible, notamment un tissu de contrôle positif pour la première expérience ISH. Le motif de ribosonde cible de l'ARNm devrait être connu dans ce tissu de contrôle positif.
2. Préparation de la lame vibrante microtome (basé sur le protocole précédemment décrit) 7
- Préparer un 4% à faible fondre solution d'agarose en tampon phosphate salin (PBS). Solution de micro-ondes pour dissoudre l'agarose et maintenir la solution à 62 ° C.
- Préparer un moule annulaire polystyrène en enlevant la membrane d'une plaque de culture de diamètre 12mm Millicell ainsi d'insérer et de conserver anneau de polystyrène pour l'utiliser comme un moule d'agarose. Tremper les anneaux nuit dans une solution d'inhibiteur de RNase avant chaque utilisation.
- Afin de garantir une surface de coupe lisse, retirez inhibiteur de rouille et d'autres additifs de la surface de la lame Wilkinson par rinçage avec des solvants suivants, à une concentration de 100%: l'éther de pétrole, le xylène, le chloroforme, le méthanol et l'eau MilliQ. Séparez le double lame longitudinalement en deux lames unique.
- Respecter les lames Wilkinson à une lame de microtome avec de la colle Loctite. La lame du microtome n'est pas utilisé pour la coupe, il ajoute de la rigidité à la lame Wilkinson. La lame du microtome doivent être coupées à la longueur de la lame Wilkinson utilisant cisailles à métaux et, une fois collé, devrait être compensée par 3 - 4mm du bord tranchant de la lame Wilkinson.
3. Dissection, le stockage et la préparation de tissus urogénitaux pour sectionner
- Préparer la solution PBSTw (PBS contenant 0,1% de Tween ™ 20 et 0.2mm d'azide de sodium, filtrée à travers l'unité de 0.22μm Stericup ® filtre). La solution peut être préparée à l'avance et stocké à 25 ° C.
- Incuber une LUT de souris fraîchement disséqués (vessie, l'urètre pelvien, et associé Wolff et Mϋllerian conduit structures dérivées) nuit à 4 ° C dans du PBS contenant fixateur de paraformaldéhyde à 4%.
- Déshydrater les tissus par un lavage pendant 10 minutes à 25 ° C dans une série de méthanol gradué / PBSTw (1:3, 1:1, 3:1 v / v) des solutions. Conserver les échantillons à -20 ° C dans du méthanol à 100% au moins une nuit. Tissus archivés peuvent être conservés au moins 2ans.
- Préparer les tissus pour la coupe en réhydratant les tissus archivés. Laver pendant 10 minutes à 25 ° C dans une série de méthanol gradué / PBSTw (3:1, 1:1, 1:3 v / v) des solutions.
- Disséquer et jetez les deux tiers environ de la vessie, laissant la plupart de la région du trigone attaché à l'urètre.
4. Enrobage des tissus urogénitaux en agarose
- Placez l'anneau moule en polystyrène, une surface plane vers le bas, sur un 25 ° C lame de microscope en verre clair.
- Remplissez le moule de bague avec 62 ° C une solution d'agarose et refroidir pendant environ 2min.
- Enlever les tissus du LUT PBSTw et sécher sur un absorbant essuyer.
- Transfert le tissu dans une solution d'agarose.
- Utilisez une pince à orienter le tissu LUT en agarose afin qu'il est suspendu à mi-chemin entre le haut et le bas du moule de bague et incuber les tissus à 4 ° C jusqu'à ce que l'agarose est solidifié.
- Si le tissu s'enfonce complètement pendant le processus de solidification d'agarose, il peut être excisé de l'agarose et re-embedded. Ajustez le temps de refroidissement de l'agarose au besoin pendant le processus de ré-intégration.
5. Sectionnement des tissus urogénitaux avec un microtome vibrant (basé sur le protocole précédemment décrit) 7
- Montez la lame renforcée Wilkinson dans le microtome vibrant et régler l'angle de la lame à 35 °. Remplissez bain de luxe avec de la glace spécimen PBS et de l'emballage humide autour de la baignoire spécimen.
- Enlevez le bouchon solidifié agarose du moule anneau et éponger la surface du fond avec un absorbant essuyer. Vérifiez que le tissu est orienté correctement. L'orientation des tissus peuvent être ajustées en utilisant une lame de rasoir pour chanfrein le côté plat de la fiche d'agarose.
- Respecter la fiche d'agarose sur un échantillon vibrant microtome de montage du disque avec de la colle Loctite, comme indiqué dans la Fig. 1A.
- Insérez le disque de montage dans le spécimen vibratome.
- Ajuster l'épaisseur de coupe microtome 50 microns, la vitesse à 2, et l'amplitude de lame à 4 et commencer à couper des coupes de tissus.
- Utilisez une pince émoussée pour transférer chaque section de tissu (Fig. 1B) sur une plaque de culture à 24 puits et qui contient glacée PBSTw 0.5mL.
- Pour préparer les échantillons pour l'hybridation, les accises sur place la plupart des agarose autour de chaque section de tissu (le reste agarose va fondre pendant la procédure de l'ISH) et enlever tous les débris associés. Sections de stocker jusqu'à 48 h à 4 ° C dans PBSTw.
6. Préparation panier échantillon pour l'hybridation in situ
- Découpez le fond d'un tube à centrifuger à la marque de 100 ul.
- Faire chauffer le bord coupé du tube dans une flamme jusqu'à ce que le plastique est ramolli, puis appuyez sur le microtube fermement sur le centre d'un carré maille polyester 0.5in.
- Garniture mailles excès et utiliser une aiguille de calibre 18 chauffée pour percer deux trous dans chaque couvercle du tube pour achever la préparation panier (Fig. 1C).
- Retirez le couvercle d'une plaque de 24 puits et forage d'un trou de 12mm centré sur chaque puits. Utilisez le couvercle pour transférer les paniers de l'échantillon entre les lavages du protocole ISH (Fig. 1D).
7. Préparation de poudre d'embryons pour hybridation in situ (basé sur le protocole précédemment décrit) 8
- Recueillir les tissus d'embryon de souris de souris qui sont le même stade que les coupes de tissus qui sont évalués et conserver à -80 ° C. Placer les tissus congelés dans un mouchoir plonger mortier en céramique, dans l'azote liquide, et l'utilisation d'un pilon à broyer le tissu en une fine poudre.
- Mélanger la poudre d'embryon avec 4 volumes d'acétone et d'homogénéiser à l'aide de plusieurs traits d'un homogénéisateur Dounce.
- Transfert homogénat à un verre de 15 ml à bouchon à vis flacon et l'extrait de la nuit à 4 ° C.
- Poudre de l'embryon par centrifugation à 5000rpm pendant 10 minutes à 4 ° C. Retirez et jetez le surnageant contenant des lipides. Reprendre le culot de tissus dans 4vol d'acétone fraîche et extrait pour 2h à 4 ° C.
- Pellet la poudre d'embryon par centrifugation à 5000rpm pendant 10 minutes à 4 ° C. Retirer et jeter le surnageant.
- Sécher à l'air du culot sur un papier Whatman n ° 2 du filtre. Crush granulés pour obtenir une poudre fine et stocker dans un flacon en verre hermétiquement fermés à 4 ° C. Le rendement approximatif est de 50 mg, poudre pour 1 g de poids humide embryonnaire.
8. Dans une journée Hybridation in situ
- Préchauffer solution de préhybridation (50% de formamide, 5x SSC, 1% réactif de blocage, la levure 10μg/mL ARNt, 10μg/mL magasin héparine à -20 ° C) à 60,5 ° C. Cette solution peut être préparée à l'avance et stocké à -20 ° C.
- Préparer une chambre d'hybridation humidifié par le remplissage d'un conteneur de stockage en plastique petite avec environ 0,5 dans l'eau du robinet. Couvercle du récipient et préchauffer à 60,5 ° C.
- Ajouter 2 ml PBSTw aux puits d'une plaque de culture à 24 puits. Paniers Placer l'échantillon dans les trous du couvercle plaque de 24 puits et des coupes de tissus de transfert dans les paniers (jusqu'à 10 sections par panier ont été utilisés).
- Incuber les coupes de tissus pendant 30min à 25 ° C dans 6% H 2 O 2. Ceci et toutes les incubations ultérieures doivent être effectuées avec une légère agitation sur un agitateur orbital, sauf indication contraire. Toutes les incubations unelave D sont menées en plaques de 24 puits et utiliser un volume total de solution d'2mL/well.
- Laver les coupes de tissus 4 x 5min à 25 ° C dans PBSTw.
- Incuber les coupes de tissus pour 12min à 25 ° C dans PBSTw contenant 5μg/mL protéinase K.
- Laver les coupes de tissus 1 x 5min à 25 ° C dans PBSTw.
- Coupes de tissus post-correctif pour 20min à 25 ° C dans du PBS contenant du paraformaldéhyde à 4% et 0,2% de glutaraldéhyde.
- Laver les coupes de tissus 2 x 5min à 25 ° C dans PBSTw.
- Ajouter 2mL/well du tampon préhybridation préchauffé et incuber les coupes de tissus à l'intérieur de la chambre d'hybridation humidifié pendant au moins 1h à 60,5 ° C.
- Ajouter 0.65μg ribosonde marquée au tampon préhybridation dans chaque sections de tissus puits et incuber la nuit dans la chambre d'hybridation humide à 60,5 ° C.
9. En Jour 2 Hybridation in situ
- Préparer les solutions suivantes pour les étapes de lavage post-hybridation: Solution 1 (50% de formamide, 5x SSC, SDS 1%), Solution 2 (10 mM Tris-HCl pH 7,5, 0,5 M de NaCl, 0,1% de Tween ™ 20, 0.2mm d'azide de sodium , filtrée 0.22μm), et la solution 3 (2x SSC, 50% formamide). Ces solutions peuvent être préparées à l'avance. Les solutions 1 et 3 sont conservés à -20 ° C et la solution 2 est stocké à 25 ° C. La durée de conservation des solutions est d'au moins 3 mois.
- Laver les coupes de tissus 3 X 30min à 60,5 ° C avec pré-chauffé la solution 1. Utilisez la chambre humide pendant les lavages.
- Laver les coupes de tissus 1 X 10min à 60,5 ° C avec 1/Solution solution pré-chauffée 2 (1:1 v / v). Utilisez la chambre humide durant le lavage.
- Laver les coupes de tissus 4 X 10min à 25 ° C avec la solution 2.
- Incuber sections de tissus pour 15min à 37 ° C dans une solution contenant 2 0.25μg/mL RNase.
- Laver les coupes de tissus 1 X 10min à 25 ° C avec la solution 2 (sans RNase).
- Laver les coupes de tissus 1 X 10min à 25 ° C avec la solution 3, puis 2 lavages à X1hr 60,5 ° C avec la solution 3. Utilisez la chambre humide pendant la lave 60,5 C °.
- Préparer les solutions suivantes pour la détection immunohistochimique de l'ribosondes DIG-étiqueté: Tampon de blocage des tissus (tuberculose, 1X SCT, 10% de sérum de moutons, de 1% réactif de blocage, 1% de BSA, 0,1% de Tween ™ 20, 0.22μm filtrée), dilution de l'anticorps Tampon (AD, 1xTBS, mouton à 5% de sérum, 1% réactif de blocage, 1% de BSA, 0,1% de Tween ™ 20, 0.2mm d'azide de sodium, 0,22 m ™ filtrée) Tampon d'absorption d'anticorps (AA, 1xTBS, mouton à 5% de sérum, une Réactif% de blocage, 1% de BSA, la poudre d'embryon 6MG/ML), et TBSTw (1xTBS, 0,1% de Tween ™ 20, 0.2mm d'azide de sodium, filtrée 0.22μm). Ces solutions peuvent être préparées à l'avance. TBSTw est stocké à 25 ° C, toutes les autres solutions sont conservées à -20 ° C.
- Laver 3 x 10 min à 25 ° C avec TBSTw.
- Incuber les coupes de tissus au moins 2h à 25 ° C dans le tampon de la tuberculose.
- Alors que les tissus sont en incubation dans le tampon de la tuberculose, ajouter 1.1μL anticorps anti-DIG par 200 pl de tampon AA pour chaque puits. Incuber AA + tampon d'anticorps d'au moins 2h à 4 ° C, puis centrifuger à 10000 rpm pendant 1min. Retirer le surnageant de tampon AA et l'ajouter à 2 ml de tampon d'AD.
- Retirer des coupes de tissus à partir du buffer TB et incuber toute une nuit dans une chambre humidifiée à 4 ° C dans le tampon d'annonces contenant des anticorps.
10. En Jour 3 Hybridation in situ
- Préparer le développement de solutions de couleur NTMT (100mm Tris-HCl pH 9,5, 100 mM NaCl, 50 mM MgCl 2, 0,2 mm d'azide de sodium, filtrée 0.22μm). Cette solution peut être préparée à l'avance et stocké à 25 ° C. Immédiatement avant utilisation, ajouter lévamisole 2mm et 0,1% de Tween ™ 20.
- Retirer la solution d'anticorps (anticorps AD tampon +) à partir des puits et la solution de conserver à 4 ° C. Il peut être réutilisé jusqu'à deux fois supplémentaires.
- Laver les tissus 8 X 10 min à 25 ° C avec TBSTw contenant lévamisole 2mm.
- Soigneusement transfert de tissus à partir des paniers à une boîte de Petri contenant TBSTw. Utilisez une pince pour enlever les débris visibles. Transférer les tissus dans des microtubes propres.
- Laver les tissus 1 X 10 min à 25 ° C avec NTMT 1ml.
- Retirez le NTMT et ajouter 1mL/tube d'un mélange contenant 50% NTMT (contenant lévamisole 2mm) et 50% BM Violet, tubes placer dans une boîte de lumière protégée et incuber à 25 ° C. Temps de développement couleur varie de quelques heures à plusieurs jours. Si la couleur est lent à se développer, 100% BM violet peut être utilisé.
- Le développement et le changement de couleur du moniteur NTMT / BM solution violette si elle accumule cristaux précipités ou si elle subit un changement de couleur du jaune au violet. Après développement en couleur (4-250 heures), les tissus lavage 2 X 5min à 25 ° C avec des 1mL/tube NTMT contenant lévamisole 2mm.
- Incuber les tissus nuit à 4 ° C dans 1mL/tube de PBS contenant 4% de paraformaldéhyde après-fixateur.
- Pour blanchir les tissus, les tissus incuber pendant 30min à 25 ° C dans des 1mL/tube PBSTw contenant 3% de H 2 O 2 . Puis, lavez les tissus 1 X 10min à 25 ° C dans des 1mL/tube PBSTw et stocker à 4 ° C dans 1mL/tube de PBS contenant 4% de paraformaldéhyde après-fixateur.
- Des sections de tissu sont montés sur lames de verre, lamelle, et imagé avec un microscope composé.
11. Les résultats représentatifs:
L'orientation spatiale du tissu LUT en agarose détermine le plan des coupes de tissus. Pour les sections sagittales, au moins les deux tiers de la vessie est excisée et les tissus LUT restantes est intégré dans l'agar de sorte que la ligne médiane urétrale est parallèle à la surface plane de la fiche d'agarose (figure 1A). Des ajustements mineurs dans le plan des tissus peuvent être faites par biseautage le côté plat de la fiche d'agarose. Une section sagittale représentatifs d'un tissu LUT hommes 17.5dpc qui est orienté dans ce plan est montré dans la figure 1B.
Paniers échantillon protéger les coupes de tissus délicats contre la perte et l'accumulation de poussières et de particules lors de la procédure de plusieurs jours l'ISH. Paniers d'échantillons sont préparés par fusion maille polyester à l'extrémité coupée d'un tube de micro 1.5ml (figure 1C). Un petit trou est percé dans le couvercle de chaque panier d'échantillon pour faciliter le flux de solution dans et hors des paniers. Exemple paniers sont suspendus dans les solutions de l'ISH, en les plaçant dans des trous percés dans les couvercles 12mm plaque de 24 puits (figure 1D). Les couvercles modifiés plaque de soutien paniers quand ils sont transférés entre les plaques de 24 puits pendant les changements de solution.
Il est difficile de limiter la coloration de fond non-spécifique pendant les longues périodes d'incubation nécessaire pour la détection des ARNm de faible abondance. L'ajout d'azide de sodium 0.2mm à tampons d'échantillonnage et leur filtration subséquente à travers des filtres 0.22μm semble limiter la coloration de fond (figure 2). En utilisant la méthode décrite ici, il ne semble pas y avoir de différences visibles dans la coloration de fond lorsque les échantillons sont incubés dans une solution de développement de la couleur pour une des périodes prolongées (figure 3).

Figure 1. Préparation d'une souris inférieure urogénitales (LUT) coupe de tissu et de voies microtube un panier pour ISH. Une LUT contenant une partie de la vessie, l'urètre pelvien et associés Wolff et Mϋllerian conduit dérivés structure) est incorporé dans un bouchon cylindrique de 4% à faible fondre l'agarose. (A) La fiche est collée sur un disque spécimen de montage et (B) coupés en sections 50 microns avec un microtome vibrante. (C) Une section LUT est transféré dans un panier microtube qui est préparé en perçant un trou dans le couvercle du tube et maille polyester fusion à l'extrémité inférieure du tube coupé. (D) Le microtube est inséré dans les trous de 12mm percé dans le couvercle plaque 24 puits afin que les coupes de tissus sont suspendus dans une solution tampon au cours du protocole ISH. Pointes de flèches indiquent le tissu LUT dans la fiche d'agarose.
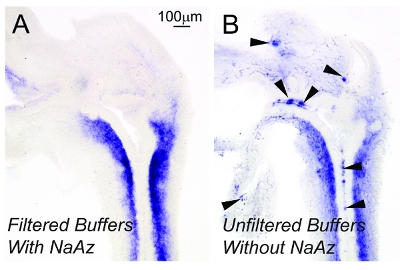
Figure 2. Incorporation d'azoture de sodium 0,2 mm en 0.22μm solutions filtrées améliore la qualité des tissus et réduit la coloration de fond. 17.5dpc tracts souris mâle inférieure urogénitales (LUT) ont été sectionnés dans un plan sagittal sur une épaisseur de 50 microns. Des sections de tissu ont été colorées par ISH aide d'une sonde dirigée contre une homologue torsion. Les tampons utilisés pour ISH ont été soit (A) 0.22μm filtrée et complétée par de l'azide de sodium 0.2mm (Naaz) ou (B) complété non filtré et non pas avec Naaz. Pointes de flèches indiquent la coloration de fond. Les images ont été capturées au même grossissement. Les résultats sont représentatifs schémas de coloration pour n = 3 litière indépendante souris.
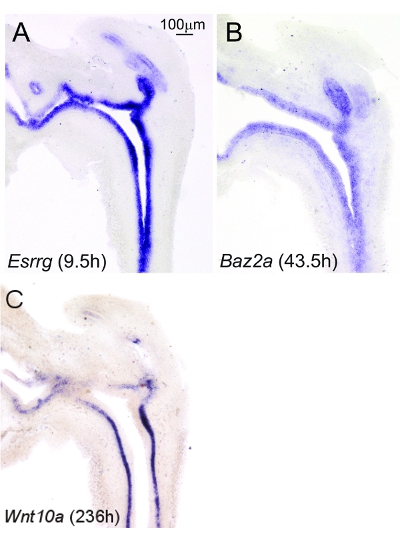
Figure 3. Intensité de coloration de fond ne semble pas augmenter avec le développement de couleur prolongée. 17.5dpc tracts souris mâle inférieure urogénitales (LUT) ont été sectionnés dans un plan sagittal sur une épaisseur de 50 microns. Les sections ont été colorées par ISH en les incubant dans une solution de coloration chromogène pour (A) 9.5h en utilisant une sonde qui reconnaît la transcription abondance élevée liés aux oestrogènes récepteur gamma (Esrrg), (B) pour 43.5h aide d'une sonde qui reconnaît l'abondance moyenne bromodomain transcription adjacent au domaine en doigt de zinc, 2A (Baz2a), ou (C) pour 236h en utilisant une sonde qui reconnaît la transcription faible abondance d'ailes de type MMTV site de l'intégration familiale, membre 10a (Wnt10a). Les images ont été capturées au même grossissement. Les résultats sont représentatifs schémas de coloration pour n = 3 litière indépendante souris.
Access restricted. Please log in or start a trial to view this content.
Discussion
En utilisant la méthode décrite ici, il est possible de détecter des ARNm dans tous les principaux types de cellules et de tissus compartiments de l'LUT foetus de souris mâle et femelle, y compris les plaquettes mésenchymateuses, urothélium, muscle lisse, les bourgeons de la prostate, canal éjaculateur, et le vagin. Les sections 50 microns utilisé dans ce protocole ont l'avantage d'être assez épaisse pour résoudre l'architecture des tissus (tels que les vaisseaux sanguins), mais sont suffisamm...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier le Dr Lan Yi, Cancer Institute du New Jersey, de l'assistance technique dans la préparation de paniers de tissu. Ce travail a été financé par les Instituts nationaux de subventions et de santé DK083425 DK070219.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| Anticorps anti-digoxigénine, des fragments Fab | Roche Applied Science | 11214667001 | |
| Réactif de blocage | Roche Applied Science | 11096176001 | |
| BM Violet AP substrat, précipitant | Roche Applied Science | 11442074001 | |
| Albumine de sérum bovin | Fisher Scientific | BP1600-100 | |
| Plaque de culture cellulaire, 24 puits | Corning | 3524 | |
| Digoxigénine 11-UTP | Roche Applied Science | 1277073910 | |
| dNTP | Roche Applied Science | 11969064001 | |
| Lame de rasoir à double tranchant | Wilkinson Sword | Modèle classique | |
| Eliminase RNase remover | Laboratoires Decon | 1102 | |
| Formamide | Sigma | F5786-1L | |
| Kit d'extraction de gel | Qiagen | 28704 | |
| Glutaraldéhyde, solution à 25% dans H 2 O | Sigma | G6257-100ML | |
| L'héparine, le sel de sodium | Sigma | H3393 | |
| Le peroxyde d'hydrogène, solution à 30% dans H 2 O | Fisher Scientific | BP2633-500 | |
| Lévamisole | Sigma | L9756 | |
| Loctite 404 adhésifs rapidement mis instantanée | Henkel Corp | 46551 | |
| Le chlorure de magnésium | Fisher Scientific | M33-500 | |
| L'acide maléique | Sigma | M0375-500G | |
| Microtubes 1,5 ml | Research Company Biologix | BP337-100 | |
| Insérez Millicell la culture | Millipore | PICM01250 | |
| Molecular résine de broyage | G-Biosciences | 786-138PR | |
| Paraformaldéhyde, solution à 4% en tampon phosphate salin | Affymetrix | 19943 | |
| Tampon phosphate salin, sans Ca & Mg | MP Biomédical | ICN1760420 | |
| Filet de polyester, 33 microns, 12 "x 24" | Petite Parts Inc | CMJ-0033-D | |
| Solution de protéinase K, 20mg/ml | Amresco | E195-5ML | |
| Colonnes QIAshredder | Qiagen | 79654 | |
| Solution Q | Qiagen | Fourni avec l'ADN polymérase Taq | |
| RNase | Sigma | R6513 | |
| Inhibiteur de RNase | Roche Applied Science | 03335399001 | |
| RNeasy Mini kit | Qiagen | 74104 | |
| RNeasy Mini Kit | Qiagen | 74104 | |
| RQ1 RNase DNase | Promega | M6101 | |
| SeaPlaque faible point de fusion d'agarose | Lonza | 50101 | |
| Les moutons de sérum | Sigma | S2263-500ml | |
| Stericup unité de filtre, 0.22μm, polyéthersulfone, 500mL | Millipore | SCGPU05RE | |
| L'azide de sodium, granuleux | Fisher Scientific | S227I-100 | |
| Le chlorure de sodium | Fisher Scientific | BP358-212 | |
| Dodécyl sulfate de sodium | Fisher Scientific | S529-500 | |
| SSC, 20X solution | Produits de la recherche internationale | S24022-4000.0 | |
| SuperScript III système de synthèse du premier brin | Invitrogen | 18080-051 | |
| T7 RNA polymérase | Roche Applied Science | 10881767001 | |
| Taq ADN polymérase | Qiagen | 201203 | |
| Tris-HCl | Fisher Scientific | BP153-1 | |
| Tween 20 | Fisher Scientific | BP337-100 | |
| Vibrant microtome avec baignoire spécimen de luxe | Leica Microsystems | VT1000A | |
| Levure ARNt | Roche Applied Science | 109495 |
Références
- Cunha, G. R. The possible influence of temporal factors in androgenic responsiveness of urogenital tissue recombinants from wild-type and androgen-insensitive (Tfm) mice. Journal of Experimental Zoology. 205, 181-181 (1978).
- Cunha, G. R. Hormonal, cellular, and molecular regulation of normal and neoplastic prostatic development. Journal of Steroid Biochemistry and Molecular Biology. 92, 221-221 (2004).
- Price, D. Comparative aspects of development and structure in the prostate. National Cancer Institute Monographs. 12, 1-1 (1963).
- Cunha, G. R. Stromal-epithelial interactions--I. Induction of prostatic phenotype in urothelium of testicular feminized (Tfm/y) mice. Journal of Steroid Biochemistry. 14, 1317-1317 (1981).
- Rozen, S. Primer3 on the WWW for general users and for biologist programmers. Methods in Molecular Biology. 132, 365-365 (2000).
- Zhang, Z. A greedy algorithm for aligning DNA sequences. Journal of Computational Biology. 7, 203-203 (2000).
- Vezina, C. M. Dioxin causes ventral prostate agenesis by disrupting dorsoventral patterning in developing mouse prostate. Toxicological Sciences. 106, 488-488 (2008).
- Wilkinson, D. G. Detection of messenger RNA by in situ hybridization to tissue sections and whole mounts. Methods in Enzymology. 225, 361-361 (1993).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon