Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Aspiration par micropipette des cellules au substrat joints pour estimer la rigidité cellulaire
Dans cet article
Résumé
Nous décrivons ici une méthode simple et rapide pour mesurer la rigidité cellulaire. Le principe général de cette approche consiste à mesurer déformation de la membrane en réponse à bien défini pression négative appliquée par le biais d'une micropipette à la surface cellulaire. Cette méthode fournit un outil puissant pour étudier les propriétés biomécaniques du substrat-jointes cellules.
Résumé
Nombre croissant d'études montrent que les propriétés biomécaniques des cellules individuelles jouent un rôle majeur dans de multiples fonctions cellulaires, y compris la prolifération cellulaire, la différenciation, la migration et interactions cellule-cellule. Les deux paramètres clés de la biomécanique cellulaires sont déformabilité cellulaire ou la rigidité et la capacité des cellules de se contracter et générer de la force. Nous décrivons ici une méthode rapide et simple pour estimer la rigidité cellulaire en mesurant le degré de déformation de la membrane en réponse à une pression négative appliquée par une micropipette de verre à la surface cellulaire, une technique qui s'appelle aspiration par micropipette ou microaspiration.
Microaspiration est effectuée en tirant un capillaire en verre pour créer une micropipette avec une pointe très petit (2-50 um de diamètre en fonction de la taille d'une cellule ou un échantillon de tissu), qui est ensuite reliée à un transducteur de pression pneumatique et amené à sa fin proximité d'une cellule sous un microscope. Lorsque l'la pointe de la pipette en contact avec une cellule, une étape de pression négative est appliquée à la pipette par le transducteur de pression pneumatique générant une pression bien définie sur la membrane cellulaire. En réponse à la pression, la membrane est aspiré dans la pipette et la membrane déformation progressive ou "membrane projection" dans la pipette est mesurée en fonction du temps. Le principe de base de cette approche expérimentale est que le degré de déformation de la membrane en réponse à une force définie mécanique est fonction de la rigidité de membrane. La rigidité de la membrane est, plus la vitesse de déformation de la membrane et plus la technique de l'état d'équilibre aspiration length.The peut être effectuée sur des cellules isolées, à la fois en suspension et le substrat-joints, organites grandes, et des liposomes.
Analyse est effectuée en comparant les déformations maximales membranaires obtenus sous une pression donnée pour différentes populations de cellules ou des conditions expérimentales. Un «coefficient de rigidité» est estimée en traçant la longueur de déformation de la membrane à aspiration en fonction de la pression appliquée. En outre, les données peuvent être analysées pour estimer le module d'Young des cellules (E), le paramètre le plus courant pour caractériser la rigidité des matériaux. Il est important de noter que les membranes plasmiques des cellules eucaryotes peut être considéré comme un système bi-composant où bicouche lipidique membranaire est sous-tendue par le cytosquelette sous-membranaire et que c'est le cytosquelette qui constitue l'échafaudage mécanique de la membrane et domine la déformabilité de l'enveloppe cellulaire. Cette approche, par conséquent, permet de sonder les propriétés biomécaniques du cytosquelette sous-membranaire.
Protocole
1. Tirer Micropipettes en verre
Equipement: Micropipette Puller, microforge.
Verre: Boroscillicate capillaires en verre (~ 1,5 mm de diamètre externe, ~ 1,4 mm de diamètre interne).
- Micropipettes sont tirés en utilisant la même approche de base qui est utilisé pour préparer des microélectrodes de verre pour les enregistrements électrophysiologiques. En bref, un capillaire en verre est chauffé dans le milieu et que le verre commence à fondre les deux moitiés du capillaire sont séparés générer deux micropipettes. Plusieurs tireurs commerciaux sont disponibles pour effectuer ce processus allant de relativement simples extracteurs verticaux qui utilisent la gravité pour séparer les deux pipettes à part pour très sophistiquées extracteurs horizontaux qui offrent de multiples options programmables pour faire varier la vitesse et d'autres paramètres de la traction. Les deux types d'extracteurs ont été utilisés dans nos expériences.
- Exigences pour la géométrie de la pointe de la pipette: Les pointes des pipettes utilisées dans ces expériences varient généralement entre 2 à 6 um de diamètre externe selon la taille de la cellule. Un autre paramètre important est la forme de la pointe, ce qui devrait se rapprocher d'un tube cylindrique (voir figure 1). Ceci peut être obtenu par l'optimisation des paramètres de la traction et de la vérification de la forme de la pointe au microscope jusqu'à ce que la forme souhaitée est obtenue. La durée optimale de la tige de pipette dépend de la quantité de déformation attendue: si les déformations sont petites um <10, il suffit que la partie en forme de cylindre de la pipette est également relativement courte (de l'ordre de grandeur), pour une plus grande déformations ajuster en conséquence. En général, l'augmentation de la chaleur et / ou augmentation de la «pull» diminue le diamètre de la pointe. L'augmentation de "pull" génère également une pointe avec un cône plus. Dans nos expériences, en utilisant une Sutter P-97 Extracteur horizontal pipette, le programme a étéoptimisé pour les paramètres suivants: chaleur de 473, puis tirer à 22; Velocity 22, 200; Temps de pression 500. Il est également possible de créer des conseils cylindriques en tirant une tige très longue, puis la rupture et de le polir. Des instructions détaillées sur la façon de préparer différents types de pipettes sont donnés dans le manuel Sutter.
- Microforge: Il est également recommandé de tirer-polir la pointe de la pipette afin de générer une surface de verre lisse qui permet une bonne étanchéité de la membrane plasmique. Ceci est fait en mettant la pointe de la pipette à proximité d'une bille de verre chauffée pour une très une fraction de seconde à l'aide d'un microforge. Technique similaire est utilisée en routine pour la préparation des microélectrodes pour les enregistrements électrophysiologiques.
- Remplissage du Micropipette: Micropipettes doit être rempli avec une solution saline physiologique, tels que PBS ou un milieu de croissance non fluorescents. Surtout, la solution doit être complété avec du sérum de 30% qui permettra à la cellule membresbrane de se déplacer facilement dans la pipette. Deux approches peuvent être utilisées pour se débarrasser des bulles d'air dans l'embout de la pipette: (i) d'une extrémité de la pipette peut être immergé dans la première solution pour permettre au liquide pour remplir la pointe par les forces capillaires suivies par le remblayage de la pipette à partir de l'autre extrémité ou (ii) l'ensemble de pipette peut être rempli à partir de l'extrémité arrière en tapotant sur la tige de la pipette pour éliminer les bulles à partir de la pointe.
- Remarque: Pipettes faut être prêt le jour de l'expérience.
2. Préparation de cellules
- L'ensemencement des cellules: microaspiration est effectuée sur des cellules individuelles qui sont soit maintenues en suspension ou sont fixés au substrat. À aspirer les cellules en suspension, les cellules sont soulevés de leurs substrats et la pipette dans une chambre peu profonde longitudinal qui est montée sur le microscope inversé droit avant l'expérience. Pour aspirer substrat-jointes cellules, les cellulessont ensemencées sur des lamelles de petites (~ 10 mm de diamètre) qui peut également être placé dans la chambre de microaspiration avant l'expérience. La raison d'utiliser une chambre peu profonde longitudinale est de permettre une micropipette d'aborder les cellules sous un angle très faible, comme proche de l'horizontale que possible. Ceci est fait pour permettre à la membrane tiré dans la micropipette à visualiser sur un seul plan de mise au point (voir figure 2).
- Visualisation membrane cellulaire: Pour observer la projection membrane dans la pipette, les membranes cellulaires sont colorés avec un colorant fluorescent lipophile, comme DII en utilisant un protocole de coloration standard.
- Chaud solution de PBS.
- Diluer la DII stock à une concentration de travail (5 uM) avec la solution chauffée PBS.
- Ultrasons pendant 5 min pour briser les agrégats de colorants.
- Centrifuger pendant 5 min et prendre surnageant.
- Laver les cellules en PBS, 3 fois 5 min chacun.
- Incuber les cellules avec le colorant de sortelution pendant 30 min dans un incubateur à 37 ° C.
- Laver les cellules avec du PBS 3 fois pendant 5 min chacun.
- Remarque: Il est possible de substituer coloration DII de la membrane avec visualisation du cytosquelette sous-membranaire qui est également tiré avec la membrane dans la pipette. Il doit être pris en compte, cependant, qu'une perturbation du cytosquelette peuvent altérer les propriétés biomécaniques de la cellule. En outre, lors de la réalisation d'expériences sur des cellules microaspiration substrat fixé, il est recommandé d'utiliser l'imagerie 3D pour estimer la longueur de la projection de membrane dans la pipette qui est positionné à un angle par rapport au plan focal des cellules.
3. Microaspiration et d'acquisition d'images
Matériel: Inverted microscope à fluorescence, de préférence avec des capacités de déconvolution 3D (Zeiss Axiovert 200M commandé par ordinateur avec l'axe Z de déplacement de l'objectivitées ou un équivalent); caméra vidéo connectée à un ordinateur (AxioCam MRm ou un équivalent), Capteur de pression (BioTek ou un équivalent), exempt de vibrations station (TMD ou un équivalent), Micromanipulateur (Narishige, Sutter, Burleigh ou l'équivalent; manipulateurs peut être mécanique, hydraulique ou piézo-électrique). Il est également important de souligner que microaspiration peut être effectuée à l'aide d'un microscope sans capacités 3D pour estimer la rigidité de cellules en suspension, tels que les globules rouges ou 1,2 neutrophiles 3, organites isolés, tels que les noyaux 4 ou liposomes artificiels 5.
Logiciel d'acquisition d'images: Zeiss AxioVision ou un équivalent.
- Monter les cellules dans une chambre de microaspiration, tel que décrit ci-dessus, sur un microscope inversé fluorescent. Positionner les cellules de choisir une cellule pour une expérience et le placer dans le centre du champ visuel. Il est important de perform ces expériences dans un environnement exempt de vibrations, en particulier pour les expériences avec les cellules attachées au substrat car les vibrations infimes qui se produisent typiquement sur des bancs et des tables régulières sont susceptibles de compromettre complètement la création de la joint, briser la pointe de la micropipette ou entraîner changements importants dans la position de la pointe qui peut fausser l'analyse des résultats.
- Placer une micropipette remplie de PBS / support p / solution de sérum dans un support de pipette reliée à un transducteur de puissance de tube flexible avec le diamètre ajusté au raccord du support de pipette pour un ajustement serré. Au début de chaque expérience, la pression dans la pipette est équilibré à la pression atmosphérique. La pipette est monté sur un micromanipulateur qui permet un contrôle précis des mouvements de pipette dans un ordre du micron. Positionner une pipette suivant un petit angle à la partie inférieure de la chambre et amener la pointe de la pipette par rapport au centre du champ visuel. The tige de la pipette, une partie cylindrique de l'embout de pipette dans lequel la membrane est aspiré, est aligné horizontalement par rapport au plan focal sur (1) le positionnement de la pipette à la plus faible possible angle (10-15 °) et (2) par la flexion de la tige de la pipette contre le fond de la chambre. Parce que la tige est très mince, il est suffisamment souple pour glisser sur le fond de la chambre tout en se rapprochant d'une cellule, comme le montre schématiquement la figure 1. Abaisser lentement la micropipette à l'autre d'une seule cellule à l'aide du manipulateur cours jusqu'à proximité du plan de mise au point pour la cellule. Puis, à l'aide d'un manipulateur amende déplacer la micropipette au bord de la cellule jusqu'à ce que la pointe de la pipette touche légèrement la membrane. Prendre une image pour observer la position de la pipette. Joints bons sont créés lorsque la pointe de la pipette entière est en contact direct avec la surface de la cellule et le contact est stable. Il n'existe pas de critère objectif fort, cependant, sur la façon dont l'étanchéité est bonne HTept pour l'examen visuel.
- Appliquer une étape de pression négative en utilisant le transducteur et la maintenir jusqu'à la projection membrane est stabilisé. La quantité de pression nécessaire pour aspirer la membrane dans la pipette varie selon le type cellulaire et des conditions expérimentales spécifiques. Dans nos expériences, la déformation initiale est généralement observé lors de l'application de pression dans la plage entre -2 à 15 mm Hg. Lorsque la pression est appliquée, la membrane est déformée progressivement dans la pipette jusqu'à ce qu'elle se stabilise à une certaine longueur, un processus qui prend généralement 2-3 min. Pendant ce temps, les images de déformation de la membrane sont acquises toutes les 30 sec pour suivre la progression de la membrane qui est tiré dans la pipette.
- Augmenter la pression à un niveau supérieur à 2-5 mm Hg étapes et répéter la procédure jusqu'à ce que toute projection membrane se détache de la cellule et se déplace dans la pipette, à quel point l'expérience est arrêtée.
Pour quantifier le degré de déformation de la membrane, la longueur aspiré (L) est mesurée de la pointe de la pipette vers le sommet de la circonférence de la membrane de projection. Il est important de noter, cependant, qu'une plus grande pipette appliquer plus de force sur la membrane cellulaire au même niveau de pression. Pour tenir compte de la variabilité entre les diamètres des pipettes, par conséquent, la longueur aspiré est normalisé pour le diamètre de la pipette (D) mesurée pour chaque expérience.
Les données peuvent être analysées à l'aide d'une norme viscoélastique linéaire demi-espace modèle de la cellule endothéliale, comme décrit dans les études antérieures 6,7. Plus précisément, le module d'élasticité des cellules a été estimée en utilisant l'équation:
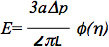
où E est le module d'Young, est l'un internerayon de la pipette, AP est la différence de pression, L est la longueur correspondant à aspiration, et φ (η) est une paroi fonctionner calculée en utilisant le modèle de la force, comme décrit par Theret et al 7. Il est important de noter que plusieurs modèles ont été utilisés pour analyser les données microaspiration y compris un modèle éléments finis qui suppose que la cellule est une sphère déformable avec les propriétés des matériaux isotropes et homogènes et des modèles de goutte de liquide, qui supposent que les cellules forment une forme sphérique, peuvent se déformer en permanence, et de récupérer après leur libération, tel que décrit dans plusieurs excellentes critiques: 8-10. Microaspiration peut également être utilisé pour étudier d'autres paramètres biomécaniques de cellules et de tissus, tels que les propriétés viscoélastiques cellulaires, la tension corticale et la contribution des différents éléments structurels à la biomécanique cellulaire et tissulaire (voir les commentaires ci-dessus pour plus d'informations).
5. ReprésentantRésultats
Dans des études antérieures, aspiration par micropipette a été effectuée soit sur des liposomes 5 ou sur les cellules qui n'ont pas été fixées au substrat 2,11-13. Dans nos études, cependant, les cellules sont généralement maintenu attaché au substrat pour éviter les changements dans la structure du cytosquelette qui sont susceptibles de se produire lorsque les cellules se détacher 14-16. Afin de valider l'utilisation de la technique pour microaspiration substrat jointes cellules, nous avons testé si la perturbation des spectacles de F-actine se traduit par la diminution de la rigidité cellulaire des cellules endothéliales aortiques bovines (CEAB), selon les estimations de cette approche. Figure 3 que, comme prévu , c'est en effet le cas. Plus précisément, la figure 3A montre une série typique d'images fluorescentes d'une membrane endothéliale subir une déformation progressive en réponse à la pression négative appliquée par le biais d'une micropipette. Comme prévu, la membrane est progressivement aspiré dans la pipette et l'aspirated longueur augmente en fonction de la pression appliquée. Les durées cours de l'émission déformation que la perturbation de la F-actine augmente considérablement les longueurs atmosphériques des projections dans toutes les conditions de pression (figure 3B) 14.
En utilisant cette approche, nous avons découvert que la rigidité de la cellule augmente lorsque les membranes cellulaires sont épuisés de cholestérol alors que l'enrichissement en cholestérol n'a pas d'effet 14. La figure 4 montre une cellule cholestérol enrichi, une cellule de contrôle, et une cellule de cholestérol épuisé après avoir atteint la longueur maximale d'aspiration à -15 mm Hg (4A). Les projections généralement commencé à se développer au-10mmHg et les temps des cours de déformation de la membrane peut être mesurée pour des pressions négatives de -10, -15 et -20 mm Hg (4B). Application des pressions supérieures à 25 mmHg-entraîné le détachement de la projection atmosphérique formant une vésicule séparée. Le niveau de pression qui a entraîné le détachement membrane est similar dans différentes conditions de cholestérol. Cette observation était très inattendue parce que les études précédentes ont montré que dans les bicouches lipidiques membranaires une augmentation du cholestérol membranaire augmente la rigidité de la membrane 5,17. Nos autres études ont confirmé ces observations en utilisant plusieurs approches indépendantes, y compris la microscopie à force atomique et la microscopie 18,19 Traction Force 20.
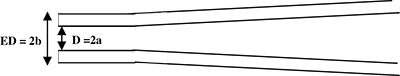
Figure 1. Vue de côté schématique d'une pipette d'enregistrement. La pipette est tiré de générer une tige cylindrique à l'extrémité (vue de côté). Paramètres micropipettes: D = 2a = diamètre intérieur et ED = 2b = diamètre extérieur.

Figure 2. Micropipette l'approche d'une cellule-substrat ci-joint (A) vue de côté schématique;. (B) image au contraste lumineux d'une micropipette sécheveau toucher une cellule de forme typique utilisé dans des expériences d'aspiration; (C) sur l'image de fluorescence de la même cellule marquée avec dIIC 18. La micropipette est toujours présent mais il est invisible (De 14).
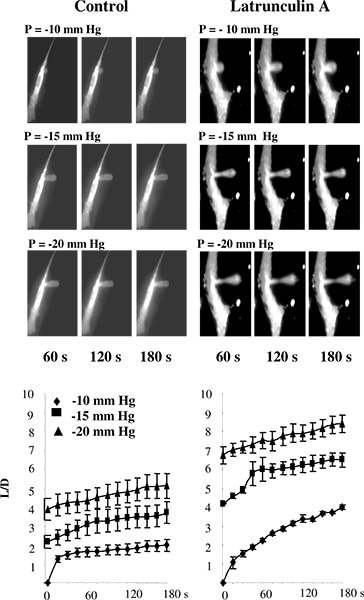
Figure 3. Validation de la mesure de la rigidité cellulaire dans le substrat-jointes cellules en utilisant microaspiration. A: Images de déformation de la membrane progressive de CEAB dans des conditions de contrôle et après exposition à latrunculine La pipette est invisible sur les images car il ne montre aucune fluorescence.. Les cellules ont été exposées à 2 uM Un latrunculine pendant 10 minutes, ce qui réduit considérablement la quantité de F-actine, telle que mesurée par la rhodamine-phalloïdine fluorescence (non représentée), mais n'a eu aucun effet significatif sur la forme de la cellule. Dans une cellule traitée par latrunculine, il existe un amincissement de la membrane dans le milieu de la saillie aspiré mais la saillie est toujours fixé à la caunes. B. Un effet de latrunculine sur les durées de déformation de la membrane où L est aspiré longueur de la projection membrane et D est le diamètre de la pipette pour les cellules témoins (n = 14) et les cellules exposées à 2 uM latrunculine A pendant 10 min (n = 5). Les cellules ont été aspirés avec -10 mm Hg (diamants), -15 mm Hg (carrés) et -20 mm Hg (triangles). (De 14).
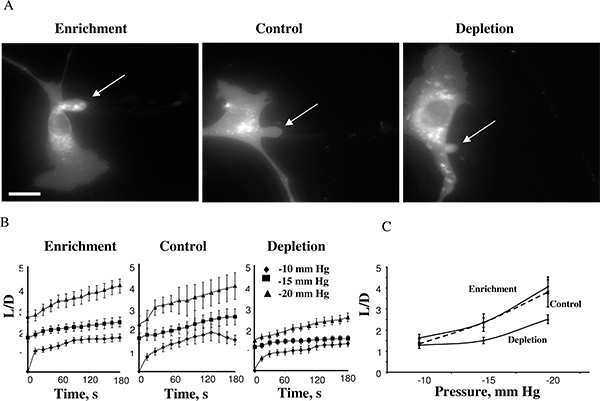
Figure 4. Effet du taux de cholestérol cellulaire sur déformation de la membrane du CEAB. A images. Typiques de déformation de la membrane de cholestérol enrichi, appauvri en cholestérol et les cellules témoins (cellules témoins ont été exposés à MβCD: MβCD-cholestérol mélange à 1:1 ratio qui n'a eu aucun effet sur le niveau de cholestérol dans les cellules (voir encadré). Les images présentées illustrent la déformation maximale à -15 mm Hg. La flèche indique la position de la projection atmosphérique. La barre est de 30 um. B. Temps moyen des cours de longueurs atmosphériques pour les trois populations de cellules expérimentales. C. Maximales longueurs aspirées tracée en fonction de la pression appliquée. La longueur maximale normalisée dans les cellules appauvries était significativement inférieure à celle des cellules témoins pour des pressions -15 mm Hg et 20 mm Hg (P <0,05). (De 14).
Access restricted. Please log in or start a trial to view this content.
Discussion
Microaspiration fournit une méthode simple et hautement reproductible pour estimer la rigidité cellulaire / déformation en appliquant une pression négative à une membrane cellulaire et la mesure de la déformabilité membrane en réponse à une pression bien défini. Il a d'abord été développé par Mitchison et Swann (1954) pour caractériser les propriétés élastiques des œufs d'oursin à fournir des indications sur les mécanismes de la division cellulaire de 21, puis de regarder les prop...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Catalogue / Numéro de modèle | Commentaires |
| Sutter pipette extracteur | Sutter Instruments | P-97 | |
| Microforge | Narishige | MF-830 | |
| Microscope à fluorescence inversé | Zeiss | Axiovert 200M | Le microscope doit être équipé de préférence avec des capacités 3D/deconvolution. |
| Caméra vidéo | Zeiss | AxioCam MRm | |
| Image Acquisition sotware | Zeiss | AxioVision | |
| Capteur de pression pneumatique | BioTek | DPM-1B | Tester DPM1B transducteur pneumatique peuvent maintenant être trouvés par FLUKE. |
| Pipette en verre | Richland | Verre sur mesure | Pipettes ont été adaptés avec un diamètre 1,2 et 1,6 intérieur diamètre extérieur. |
| Dil Dye | Invitrogen | D282 | Se dissout bien dans le DMSO |
Références
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195(2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768(2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114(2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453(2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , Forthcoming (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102(2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon