É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aspiração micropipeta de Células-substrato anexados para Estimar Rigidez celular
Resumo
Aqui nós descrevemos um método rápido e simples para medir a rigidez da célula. O princípio geral da presente abordagem é a de medir a deformação da membrana em resposta ao bem definido de pressão negativa aplicada por meio de uma micropipeta para a superfície celular. Este método fornece uma ferramenta poderosa para estudar as propriedades biomecânicas do substrato anexados células.
Resumo
Número crescente de estudos mostram que as propriedades biomecânicas de células individuais desempenham um papel importante em várias funções celulares, incluindo proliferação, diferenciação, migração e interações célula-célula. Os dois principais parâmetros de biomecânica celulares são deformabilidade celular ou a rigidez e a capacidade das células para se contrair e gerar força. Descrevemos aqui um método rápido e simples para estimar a rigidez das células pela medição do grau de deformação da membrana em resposta à pressão negativa aplicada por uma micropipeta de vidro à superfície da célula, uma técnica que é chamado de aspiração por micropipeta ou microaspiração.
Microaspiração é realizada puxando um capilar de vidro para criar uma micropipeta com uma ponta muito pequena (2-50 um de diâmetro, dependendo do tamanho de uma célula ou de uma amostra de tecido), o qual é então ligado a um transdutor de pressão pneumática e levada para um próximo vizinhança de uma célula sob um microscópio. Quando oponta da pipeta toca uma célula, um passo de pressão negativa é aplicada à pipeta pelo transdutor de pressão pneumática gerando pressão bem definida sobre a membrana celular. Em resposta à pressão, a membrana é aspirada para a deformação da membrana da pipeta e progressivo ou "membrana de projecção" na pipeta é medido como uma função do tempo. O princípio básico desta abordagem experimental é que o grau de deformação da membrana em resposta a uma força mecânica definida é uma função da rigidez da membrana. A membrana é mais rígida, mais lenta a taxa de deformação da membrana e quanto menor for o estado estacionário técnica comprimento.O aspiração pode ser realizada em células isoladas, quer em suspensão e substrato-conectados, organelas grandes, e lipossomas.
A análise é efectuada por comparação da deformação da membrana máxima conseguida sob uma dada pressão para diferentes populações de células ou de condições experimentais. Um "coeficiente de rigidez" é esestimada a locando o comprimento aspirado de deformação da membrana como função da pressão aplicada. Além disso, os dados podem ser ainda analisada para estimar o módulo de Young das células (E), o parâmetro mais comum para caracterizar a rigidez dos materiais. É importante notar que as membranas plasmáticas de células eucarióticas pode ser visto como um sistema bi-componente, onde bicamada lipídica da membrana está subjacente se o citoesqueleto da membrana sub-e que é o citoesqueleto, que constitui o andaime mecânico da membrana e domina a deformabilidade do envelope celular. Esta abordagem, portanto, permite sondar as propriedades biomecânicas do citoesqueleto sub-membrana.
Protocolo
1. Puxando micropipetas de vidro
Equipamento: Micropipeta Puller, Microforge.
Vidro: Boroscillicate capilares de vidro (~ 1,5 mm de diâmetro externo, diâmetro interno de 1,4 mm ~).
- Micropipetas são puxados usando a mesma abordagem básica que é usada para preparar microeletrodos de vidro para gravações de eletrofisiologia. Resumidamente, um capilar de vidro é aquecido no meio e, quando o vidro começa a derreter as duas metades do tubo capilar são separadas gerando duas micropipetas. Vários puxadores comerciais estão disponíveis para executar esse processo varia de relativamente simples puxadores verticais que usam a gravidade para puxar as duas pipetas para além de altamente sofisticados puxadores horizontais que oferecem várias opções programáveis para variar a velocidade e outros parâmetros da atração. Ambos os tipos de extractores foram usadas nas nossas experiências.
- Exigências para a geometria da ponta de pipeta: As pontas das pipetas utilizados nestas experiências normalmente variam entre 2 a 6 um diâmetro exterior, dependendo do tamanho da célula. Outro parâmetro importante é a forma da ponta, o que deve aproximar um tubo cilíndrico (ver Figura 1). Isto pode ser conseguido através da optimização dos parâmetros do puxão e verificar a forma da ponta sob o microscópio até que a forma desejada é obtida. O comprimento óptimo da haste pipeta depende da quantidade de deformação esperada: se as deformações são pequenas <10 uM, é o suficiente para que a parte do cilindro do tipo da pipeta também é relativamente curto (da mesma ordem de magnitude), para maior deformações ajustar em conformidade. Em geral, o aumento do calor e / ou aumento de "puxar" diminui o diâmetro da ponta. O aumento de "pull" também gera uma ponta com um longo cone. Nas nossas experiências, utilizando um Sutter P-97 da pipeta horizontal puxador, o programa foiotimizado para os seguintes parâmetros: Calor de 473; Pull 22, velocidade de 22, 200, pressão de tempo 500. É também possível criar pontas cilíndricos puxando por uma haste longa e, em seguida, romper e polimento. Instruções detalhadas sobre como preparar os diferentes tipos das pipetas são dadas no manual Sutter.
- Microforge: Também é recomendado para disparar-polir a ponta da pipeta para gerar uma superfície de vidro liso que faz uma boa vedação com a membrana plasmática. Isto é feito, trazendo a ponta da pipeta com a proximidade de uma esfera de vidro aquecida para a muito uma fracção de um segundo, utilizando uma microforge. Técnica semelhante é usada rotineiramente para preparar microeletrodos para registros eletrofisiológicos.
- Encher o Micropipeta: Micropipetas deve ser preenchido com uma solução salina fisiológica, tal como PBS ou meio de crescimento não-fluorescente. Importante, a solução deve ser suplementado com soro a 30%, que irá permitir que o mem célulaBrane a mover-se suavemente na pipeta. Duas abordagens podem ser utilizadas para se livrar das bolhas de ar na ponta da pipeta: (i) uma ponta da pipeta pode ser imersa na primeira solução para permitir que o líquido para encher a ponta pelas forças de capilaridade seguido de preenchimento da pipeta do outro lado, ou (ii) toda a pipeta pode ser enchido a partir da extremidade traseira batendo suavemente na haste da pipeta para remover as bolhas a partir da ponta.
- Nota: As pipetas devem ser preparadas no dia da experiência.
2. Preparação de Células
- Semeando as células: Microaspiração é realizada em células individuais, que são ou mantidos em suspensão ou estão ligados ao substrato. Para aspirar as células em suspensão, as células são levantadas dos seus substratos e pipetada para uma câmara longitudinal superficial, que é montado sobre o microscópio invertido imediatamente antes da experiência. Para aspirar substrato anexados células, as célulassão semeadas em pequenos cover-desliza (mm ~ 10 diâmetro), que também pode ser colocado dentro da câmara de micro-aspiração antes da experiência. O racional para usar uma câmara longitudinal superficial é o de permitir uma micropipeta para aproximar as células em um ângulo muito raso, o mais próximo da horizontal quanto possível. Isto é feito para permitir que a membrana puxado para dentro da micropipeta para ser visualizado em um único plano de foco (ver Figura 2).
- A visualização da membrana celular: Para observar a projecção da membrana para a pipeta, as membranas celulares são marcadas com um corante lipofílico fluorescente, tal como dii utilizando um protocolo de coloração convencional.
- Solução PBS quente.
- Dilui-se a DII estoque para uma concentração de trabalho (5 uM) com a solução de PBS aquecido.
- Sonicar durante 5 min a quebrar agregados de corante.
- Spin para baixo por 5 minutos e tomar sobrenadante.
- Lave as células em PBS três vezes, 5 min cada.
- Incubar as células com o corante de modolução durante 30 min numa incubadora a 37 ° C.
- Lavar as células com PBS 3 vezes durante 5 minutos cada.
- Nota: É possível substituir DII coloração da membrana com a visualização do citoesqueleto da membrana sub-que também está a ser puxado em conjunto com a membrana para a pipeta. Ele tem de ser tido em conta, no entanto, que, perturbando o citoesqueleto pode alterar as propriedades biomecânicas da célula. Além disso, ao realizar experiências com células de substrato microaspiração anexas, recomenda-se a utilização de imagens 3D para estimar o comprimento da projecção da membrana para a pipeta, que é posicionado a um ângulo em relação ao plano focal das células.
3. Microaspiração e Aquisição de Imagens
Equipamento: microscópio de fluorescência invertido, de preferência com capacidades de deconvolução 3D (Zeiss Axiovert 200M com computador controlado movimento do eixo Z da objetividadees ou equivalente); câmera de vídeo conectada a um computador (AxioCam MRM ou equivalente), transdutor de pressão (BioTek ou equivalente), sem vibração estação (DTM ou equivalente), micromanipulador (Narishige, Sutter, Burleigh ou equivalente; manipuladores podem ser mecânicos, hidráulicos ou piezoeléctrico). É também importante salientar que a microaspiração pode ser realizada usando um microscópio sem capacidades 3D para estimar a rigidez das células em suspensão, tais como as células de sangue vermelho 1,2 ou 3, organelas neutrófilos isolados, tais como os núcleos 4 ou lipossomas artificiais 5.
Software de aquisição de imagem: Zeiss AxioVision ou equivalente.
- Montar as células para uma câmara de micro-aspiração, como descrito acima, em um microscópio invertido de fluorescência. Posicionar as células escolha de uma célula para uma experiência e colocá-lo no centro do campo visual. É importante para perform destas experiências estão em um ambiente livre de vibrações, em particular para as experiências com células-substrato anexado porque vibrações minúsculas que normalmente ocorrem em bancos e mesas regulares são susceptíveis de comprometer completamente a criação do selo, quebrar a ponta da micropipeta ou resultar em mudanças significativas na posição da ponta que vai distorcer a análise dos resultados.
- Coloque uma micropipeta cheia de PBS / media w / solução de soro num suporte de pipeta ligada a um transdutor de potência por meio da tubagem flexível com o diâmetro ajustado ao conector do suporte da pipeta para um ajuste apertado. No início de cada experiência, a pressão na pipeta é equilibrada com a pressão atmosférica. A pipeta é montado sobre um micromanipulador que permite um bom controle dos movimentos da pipeta num intervalo micron. Posicionar uma pipeta num ângulo raso para o fundo da câmara e trazer a ponta da pipeta para o centro do campo visual. Thhaste e da pipeta, uma parte cilíndrica da ponta da pipeta na qual a membrana é aspirado, é alinhado horizontalmente ao plano focal por (1) o posicionamento da pipeta no ângulo mais raso possível (10-15 °) e (2) pelo flexão da haste da pipeta contra o fundo da câmara. Porque a haste é muito fina é suficientemente flexível para se deslizar sobre o fundo da câmara quando se aproxima de uma célula, tal como mostrado esquematicamente na Figura 1. Lentamente trazer para baixo a micropipeta para o lado de uma única célula utilizando o manipulador de curso até próximo do plano de foco para a célula. Em seguida, utilizando um manipulador fino mover a micropipeta com a extremidade da célula, até a ponta da pipeta toque suavemente a membrana. Tomar uma imagem para observar a posição da pipeta. Selos bons são criadas quando a ponta da pipeta de todo se encontra em contacto completo com a superfície da célula e o contacto é estável. Não há nenhum critério objetivo forte, porém, sobre como é bom o selo é excEPT para o exame visual.
- Aplicar um passo de pressão negativa através do transdutor e mantê-la até projecção membrana é estabilizado. A quantidade de pressão necessária para aspirar a membrana para a pipeta varia dependendo do tipo de célula e condições experimentais específicas. Nas nossas experiências, a deformação inicial é normalmente observado quando se aplica pressão na gama entre 2 a Hg-15mm. Quando a pressão é aplicada, a membrana é deformada progressivamente para a pipeta até que seja estabilizada no comprimento certo, um processo que normalmente demora de 2-3 min. Durante este tempo, as imagens de deformação da membrana são adquiridos a cada 30 seg para monitorar a progressão da membrana, que é puxado para dentro da pipeta.
- Aumentar a pressão para o nível seguinte de 2-5 mm de Hg passos e repetir todo o processo de projecção de membrana até que se destaca a partir da célula e move-se para a pipeta, altura em que o ensaio é interrompido.
Para quantificar o grau de deformação da membrana, o comprimento aspirado (L) é medido a partir da ponta da pipeta para o vértice da periferia da projecção de membrana. É importante notar, contudo, que a maior pipeta aplicar mais força sobre a membrana da célula no mesmo nível de pressão. Para levar em conta a variabilidade entre os diâmetros das pipetas, portanto, o comprimento aspirado é normalizado para o diâmetro da pipeta (D) medido para cada experimento.
Os dados podem ser analisados utilizando um padrão linear viscoelástico modelo semi-espaço da célula endotelial, como descrito em estudos anteriores 6,7. Especificamente, o módulo de elasticidade das células foi estimada utilizando a equação:
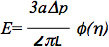
onde E é o módulo de Young, a é o interiorraio da pipeta, Ap é a diferença de pressão, L é o comprimento correspondente aspirado, e φ (η) é uma parede de funcionar calculado utilizando o modelo de força, tal como descrito por Theret et al 7. É importante notar que vários modelos têm sido utilizados para analisar os dados microaspiração incluindo um modelo de elemento finito, que assume que a célula é uma esfera deformável com as propriedades do material isotrópico e homogéneo e modelos gota de líquido, que assumem que as células formam uma forma esférica, pode deformar-se de forma contínua, e recuperar depois da libertação, conforme descrito em várias excelentes revisões: 8-10. Microaspiração também pode ser usado para investigar outros parâmetros biomecânicos de células e tecidos, tais como as propriedades viscoelásticas celulares, tensão cortical e contribuição de diferentes elementos estruturais de células e de tecidos biomecânica (ver as revisões listados acima para obter mais informação).
5. RepresentanteResultados
Em estudos anteriores, a aspiração micropipeta foi realizada quer em lipossomas 5 ou sobre as células que não estavam ligados ao substrato de 2,11-13. Nos nossos estudos, no entanto, as células são tipicamente mantida ligada ao substrato a fim de evitar as alterações na estrutura do citoesqueleto, que são susceptíveis de ocorrer quando as células separar 14-16. Para validar o uso da técnica de micro-aspiração para-substrato anexado células, testou-se a mostra de ruptura de F-actina resulta na diminuição da rigidez celular de células endoteliais aórticas bovinas (BAECs), estimados por esta abordagem. Figura 3 que, tal como esperado , este é realmente o caso. Especificamente, a Figura 3A mostra uma série de imagens fluorescentes típicas de uma membrana endotelial sofrer deformação progressiva em resposta à pressão negativa aplicada por meio de uma micropipeta. Como esperado, a membrana é gradualmente aspirada para a pipeta e o aspirated comprimento aumenta como uma função da pressão aplicada. Os cursos de tempo da mostra deformação que a ruptura de F-actina aumenta significativamente os comprimentos aspirados das projecções em todas as condições de pressão (Figura 3B) 14.
Utilizando esta abordagem, descobrimos que a rigidez das células aumenta quando as membranas celulares são esgotadas de colesterol enquanto que o enriquecimento de colesterol não teve nenhum efeito 14. A Figura 4 mostra uma célula de colesterol-enriquecida, uma célula de controlo, e uma célula de colesterol-esgotada depois de atingir comprimentos de aspiração máximas nas -15 mm Hg (4A). As projeções normalmente começou a se desenvolver em-10mmHg eo tempo-cursos de deformação da membrana pode ser medido para as pressões negativas de -10, -15 e -20 milímetros Hg (4B). Aplicação de pressões acima de-25mmHg resultou na separação da projecção aspirado formando uma vesícula separado. O nível de pressão, que resultou na separação de membrana foi Similar, em diferentes condições de colesterol. Esta observação foi altamente inesperado porque estudos anteriores mostraram que em bicamadas lipídicas das membranas um aumento no colesterol da membrana aumenta a rigidez da membrana 5,17. Nossos estudos posteriores confirmaram essas observações usando várias abordagens independentes, incluindo Microscopia de Força Atômica e Microscopia 18,19 Tração Força 20.
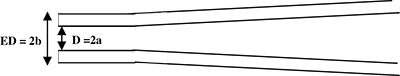
Figura 1. Vista lateral esquemática de uma pipeta de gravação. A pipeta é puxado para gerar uma haste cilíndrica na extremidade (vista de lado). Parâmetros micropipeta: D = 2a = diâmetro interno e ED = 2b = diâmetro externo.

Figura 2. Micropipeta aproximando de uma célula-substrato anexo (A) vista lateral esquemática;. (B) imagem de contraste brilhante de uma micropipeta shank tocar uma célula geralmente em forma usada em experimentos de aspiração, (C) imagem fluorescente de uma mesma célula marcada com DIIC 18. A micropipeta ainda é presente, mas é invisível (de 14).
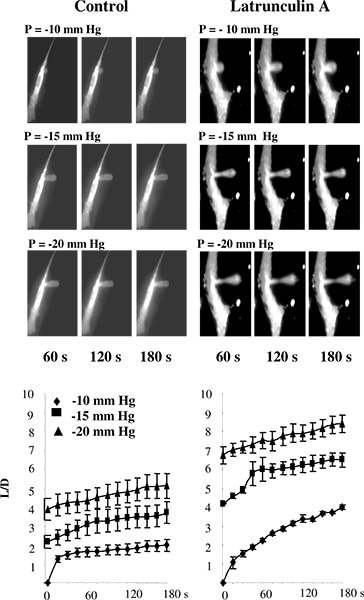
Figura 3. Validação de medir a rigidez das células no substrato de células usando-inscritos microaspiração. A: Imagens de deformação progressiva da membrana BAECs sob condições de controlo e após a exposição à latrunculin A pipeta é invisível nas imagens porque não apresentam fluorescência.. As células foram expostas a 2 uM latrunculin A durante 10 min, o que reduziu drasticamente a quantidade de F-actina, conforme medido por rodamina-faloidina fluorescência (não mostrado), mas não teve nenhum efeito significativo sobre a forma da célula. Em uma célula latrunculin-tratado, há uma diminuição da espessura da membrana no centro da projecção aspirado mas a saliência está ainda ligado ao cells. B. Um efeito de latrunculin sobre os cursos de tempo da deformação da membrana, em que L é aspirado comprimento da projecção da membrana e D é o diâmetro da pipeta para as células de controlo (n = 14) e as células expostas a 2 uM latrunculin A durante 10 min (n = 5). As células foram aspiradas com -10 mm Hg (diamantes), mm Hg -15 (quadrados) e mm Hg -20 (triângulos). (A partir de 14.)
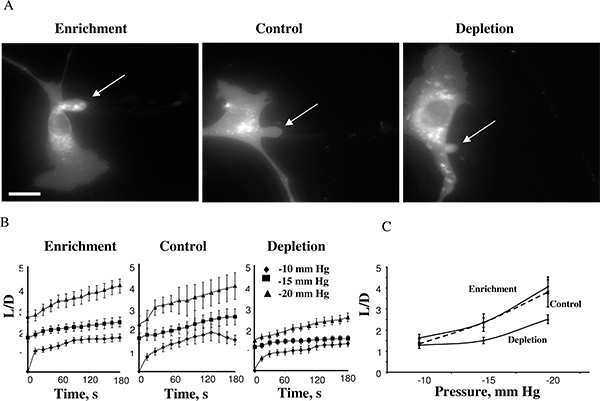
Figura 4. Efeito dos níveis de colesterol na deformação da membrana celular de BAECs. A. Imagens típicas de deformação da membrana de colesterol-enriquecida, colesterol-empobrecido e células de controlo (as células de controlo foram expostos a MβCD: MβCD-colesterol mistura na proporção de 1:1, que não teve nenhum efeito sobre o nível de colesterol livre nas células (ver inset). As imagens apresentadas mostram a deformação máxima à temperatura de -15 mm Hg. A seta indica a posição da saliência aspirado. O bar é de 30 um. B. Tempo médio de cursos de comprimentos aspirados para as três populações de células experimentais. C. Comprimentos máximos aspirados traçado como uma função da pressão aplicada. O comprimento máximo normalizado em células exauridas foi significativamente mais baixa do que a de células de controlo de pressões de -15 mm Hg e mm Hg -20 (P <0,05). (A partir de 14.)
Discussão
Microaspiração proporciona um método simples e altamente reprodutível para estimar a rigidez das células / deformabilidade por aplicação de pressão negativa a uma membrana celular e de medição da deformabilidade da membrana em resposta à pressão bem definida. Ele foi desenvolvido por Mitchison e Swann (1954) para caracterizar as propriedades elásticas do mar, ouriços-do-ovos para fornecer insights sobre os mecanismos de divisão celular 21 e depois de olhar para as propriedades mecânicas em cé...
Divulgações
Não há conflitos de interesse declarados.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Catálogo / Número modelo | Comentários |
| Sutter pipeta extrator | Sutter Instruments | P-97 | |
| Microforge | Narishige | MF-830 | |
| Microscópio Fluorescente invertido | Zeiss | Axiovert 200M | O microscópio deve ser de preferência equipado com capacidades 3D/deconvolution. |
| Videocamera | Zeiss | AxioCam MRM | |
| Aquisição de Imagem sotware | Zeiss | AxioVision | |
| Transdutor de Pressão Pneumático | BioTek | DPM-1B | DPM1B Tester transdutor pneumático agora pode ser encontrado por acaso. |
| Pipeta de vidro | Richland | Vidro personalizado | Pipetas foram personalizadas com um diâmetro de 1,2 e 1,6 de diâmetro interior exterior. |
| DiI Dye | Invitrogen | D282 | Dissolve-se bem em DMSO |
Referências
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados