Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микропипетки Стремление основания подключенных клетки к оценке сотовых жесткости
В этой статье
Резюме
Здесь мы опишем быстрый и простой метод измерения жесткости клетки. Общий принцип этого подхода заключается в измерении деформации мембраны в ответ на четко определенных отрицательным давлением подается через микропипетки к поверхности клетки. Этот метод представляет собой мощный инструмент для изучения биомеханических свойств подложки подключенных клеток.
Аннотация
Растущее число исследований показывают, что биомеханические свойства отдельных клеток играют важную роль во многих клеточных функций, в том числе клеточной пролиферации, дифференцировки, миграции и межклеточных взаимодействий. Два ключевых показателей клеточного биомеханики являются клеточными деформируемости или жесткость и способность клеток к договору и генерировать силу. Здесь мы опишем простой и быстрый метод оценки жесткости клетки путем измерения степени деформации мембраны в ответ на отрицательное давление со стеклянной микропипетки к поверхности клетки, техника, которая называется стремление микропипетки или микроаспирацией.
Микроаспирацией осуществляется путем вытягивания стеклянных капилляра для создания микропипетки с очень небольшой совет (2-50 мкм в диаметре в зависимости от размера клетки или образец ткани), который затем подключается к датчику давления пневматического и доведено до конца близости от клетки под микроскопом. Когдакончика пипетки коснется клетки, шаг отрицательным давлением наносится на пипетку преобразователем пневматическим давлением создания четко определенных давление на клеточные мембраны. В ответ на давление, мембрана всасывается в пипетку и прогрессивной деформации мембраны или "мембраны проекция" в пипетку измеряется как функция времени. Основной принцип этого экспериментального подхода является то, что степень деформации мембраны в ответ на определенной механической силы является функцией мембраны жесткости. Чем жестче мембраны, тем медленнее скорость деформации мембраны и короче стационарных стремление length.The техника может быть выполнено на изолированных клетках, как в подвеске и подложки подключением, большими органелл, и липосомы.
Анализ проводится путем сравнения максимальных деформаций мембраны, достигнутых в рамках данного давления для различных популяций клеток или экспериментальных условиях. «Коэффициент жесткости» является эс-оценивалась путем построения атмосферный длина мембраны деформации в зависимости от приложенного давления. Кроме того, данные могут быть дополнительно проанализированы для оценки модуля Юнга клеток (E), наиболее распространенный параметр характеризует жесткость материала. Важно отметить, что плазменные мембраны эукариотической клетки можно рассматривать как двухкомпонентная система, где двухслойной липидной мембраны в underlied суб-мембранного цитоскелета и что это цитоскелета, что представляет собой механическую эшафот мембраны и доминирует деформируемости клеточной оболочки. Такой подход, следовательно, позволяет зондирования биомеханических свойств суб-мембраны цитоскелета.
протокол
1. Вытащив стекло Микропипетки
Оборудование: микропипетки Puller, Microforge.
Стекло: Boroscillicate стеклянных капилляров (~ 1,5 мм наружным диаметром ~ 1,4 мм внутреннего диаметра).
- Микропипетки тянут, используя тот же базовый подход, который используется для подготовки стекла микроэлектродов для записи электрофизиологии. Короче говоря, стеклянный капилляр нагревается в среднем и, когда стекло начинает плавиться две половинки капилляр растаскивают создания двух микропипетки. Многочисленные коммерческие съемники доступны для выполнения этого процесса, начиная от относительно простых вертикальных съемники, которые используют тяжести тянуть две пипетки на части, чтобы высоко сложные горизонтальные съемники, которые предлагают несколько вариантов программирования для изменения скорости и других параметров тянуть. Оба типа съемников были использованы в наших экспериментах.
- Требованиеа для геометрии кончика пипетки: кончики пипеток, используемые в этих экспериментах обычно находится в пределах от 2 до 6 мкм, внешний диаметр в зависимости от размера ячейки. Другим важным параметром является форма кончика, который должен приблизительно цилиндрическую трубку (см. Рисунок 1). Это может быть достигнуто за счет оптимизации параметров тяги и проверка форму кончика под микроскопом до нужной формы получается. Оптимальная длина хвостовика пипеткой зависит от количества ожидаемых деформаций: при деформации малы <10 мкм, достаточно того, что цилиндрическая часть пипетки и относительно короткие (по порядку величины), для увеличения деформаций настроить соответствующим образом. В целом, увеличение тепла и / или увеличения "тянуть" уменьшается диаметр наконечника. Увеличение "тянуть" также генерирует наконечник с длинным конусом. В наших экспериментах, используя Саттер Р-97 горизонтальных пипетки съемник, программа былаоптимизирован для следующих параметров: Тепло 473; тяги 22; скорость 22, время 200; Давление 500. Кроме того, можно создать цилиндрическую советы, потянув за очень долгое голени, а затем разрушение и полировки его. Подробные инструкции о том, как готовить различные типы пипетки приведены в Sutter руководства.
- Microforge: Рекомендуется также, чтобы стрелять-польской кончика пипетки для получения гладкой поверхности стекла, что делает хорошее уплотнение в плазматическую мембрану. Это делается путем привлечения кончиком пипетки к близости с подогревом стеклянный шар для очень доли секунды использованием microforge. Подобная техника обычно используется для подготовки микроэлектродов для электрофизиологических записей.
- Заполнение микропипетки: микропипетки должны быть наполнены физиологическим раствором, таких как PBS или нефлуоресцентного СМИ роста. Важно, что решение должно быть дополнено с 30% сыворотки, которая позволит клетки сувенирыбранные двигаться плавно в пипетку. Два подхода могут быть использованы, чтобы избавиться от пузырьков воздуха в кончике пипетки: (I) кончика пипетки может быть погружен в решение сначала, чтобы жидкость для заполнения кончике капиллярным силам следует засыпка пипетки С другого конца или (II) все пипетки может быть заполнено от заднего конца, осторожно нажимая на стержень пипетку, чтобы удалить пузырьки из чаевых.
- Примечание: Пипетки должны быть подготовлены в день эксперимента.
2. Подготовка клетки
- Посев клеток: микроаспирацией осуществляется на отдельных клеток, которые либо поддерживали в суспензии или прикрепляются к субстрату. Для аспирации клеток в суспензии, клетки будут сняты со своих оснований и пипеткой в мелкую продольную камеру, которая устанавливается на инвертированный микроскоп прямо перед экспериментом. Для аспирации субстрат-прилагаемый клетки, клеткивысевают на небольшую кавер-квитанции (~ 10 мм в диаметре), которые также могут быть помещены в камеру микроаспирацией до начала эксперимента. Обоснование использования мелкой продольной камеры является разрешение микропипетки подходить к клеткам в очень небольшим углом, как можно ближе к горизонтальной насколько это возможно. Это делается, чтобы мембрана втягивается в микропипетки быть визуализированы на одной плоскости фокуса (см. Рисунок 2).
- Визуализация клеточных мембран: соблюдать мембраны проекции в пипетку, клеточные мембраны окрашивают липофильных флуоресцентных красителей, таких как DII с использованием стандартного протокола окрашивания.
- Теплый раствор PBS.
- Развести фондовом DII в рабочей концентрации (5 мкм) с подогретой решение PBS.
- Разрушать ультразвуком в течение 5 мин сломать красителя агрегаты.
- Спином вниз в течение 5 мин и принимают супернатант.
- Вымойте клетки в PBS 3 раза, 5 мин.
- Инкубируйте клетки с красителем такLution в течение 30 мин при 37 ° C инкубатора.
- Вымойте клетки с PBS 3 раза по 5 мин.
- Примечание: Можно заменить DII окрашивание мембраны с визуализацией суб-мембраны цитоскелета, который также стягивается с мембраной в пипетку. Это должно быть принято во внимание, однако, что возмущающее цитоскелета может привести к изменению биомеханических свойств клетки. Кроме того, при выполнении микроаспирацией эксперименты с подложкой прикрепленные клетки, рекомендуется использовать 3D визуализации для оценки длины мембраны проекции в пипетку, которая расположена под углом к фокальной плоскости клетки.
3. Микроаспирацией и Image Acquisition
Оборудование: Перевернутый флуоресцентного микроскопа, желательно с 3D-возможностями деконволюции (Zeiss Axiovert 200M с компьютерным управлением Z-оси движения объективностиES или эквивалент); видеокамера подключена к компьютеру (AxioCam MRM или эквивалент), датчик давления (BioTek или эквивалент), без вибраций станции (ПРО ТВД или эквивалент), Микроманипулятор (Narishige, Sutter, Burleigh или эквивалент; манипуляторов может быть механической, гидравлической или пьезоэлектрическими). Важно также подчеркнуть, что микроаспирацией может быть выполнена с помощью микроскопа без 3D возможностей для оценки жесткости клеток в суспензии, такие как красные клетки крови нейтрофилов 1,2 или 3, изолированные органелл, таких как ядра 4 или искусственные липосомы 5.
Image Acquisition программного обеспечения: Zeiss AxioVision или эквивалент.
- Установите клеток в микроаспирацией камеру, как описано выше, на перевернутой флуоресцентного микроскопа. Поместите клетки выборе ячейки для эксперимента и поместить его в центр поля зрения. Важно, чтобы перфорированныйRM эти эксперименты в свободном от вибрации окружающей среды, в частности, для экспериментов с подложкой подключенных клетки, потому что минута колебания, которые обычно возникают на скамейках и обычные таблицы, скорее всего, чтобы полностью поставить под угрозу создание печать, сломать кончик микропипетки или в результате значительные сдвиги в позиции совет, который будет искажать анализ результатов.
- Поместите микропипетки заполнены PBS / СМИ ж / сыворотки раствор в пипетку держатель подключен к источнику преобразователя с помощью гибких труб с диаметром доводят до разъемом из пипетки держатель для плотного прилегания. В начале каждого эксперимента давление в пипетке находится в равновесии с атмосферным давлением. Пипетка устанавливается на микроманипулятора, которая позволяет точно управлять движениями в пипетку микрон. Поместите пипетку под небольшим углом к нижней части камеры и принести кончика пипетки к центру поля зрения. Thэлектронной хвостовика пипеткой, цилиндрическую часть пипетки, в котором мембрана атмосферный выравнивается по горизонтали в фокальной плоскости (1) позиционирование пипетки на мелком угле возможно (10-15 °) и (2), сгибание голени из пипетки на дно камеры. Потому что хвостовик очень тонкая она является достаточно гибкой, чтобы скользить на дно камеры при приближении к клетке, как схематически показано на рисунке 1. Медленно сбить микропипетки на сторону одной ячейки с помощью манипулятора Конечно, пока вблизи плоскости фокусировки для клетки. Затем с помощью тонкой манипулятора перемещения микропипетки к краю клетки до кончика пипетки осторожно прикасается к мембране. Возьмите одно изображение для наблюдения за положением пипетки. Хорошее уплотнение создаются, когда весь кончика пипетки находится в полном контакте с поверхностью клетки и контактных стабильно. Существует нет сильных объективный критерий, однако, о том, как хорошее уплотнение отлEPT для визуального осмотра.
- Применить шаг отрицательного давления с помощью датчиков и поддерживать его, пока мембрана проекции стабилизируется. Количество давление, необходимое для аспирации мембраны в пипетку варьируется в зависимости от типа клеток и конкретных условий эксперимента. В наших экспериментах начальная деформация обычно наблюдается при применении давления в диапазоне от -2 до-15мм рт. При давлении, мембрана постепенно деформируется в пипетку, пока не стабилизируется на определенной длине, процесс, который обычно занимает 2-3 мин. В течение этого времени, изображений мембраны деформации приобрела каждые 30 секунд, чтобы отслеживать прогресс мембрана, которая втягивается в пипетку.
- Увеличение давления на следующий уровень в 2-5 мм рт шагов и повторить всю процедуру, пока мембрана проекции отделяется от клеток и движется в пипетку, после чего эксперимент остановлен.
Для количественной оценки степени деформации мембраны, атмосферный длины (L) измеряется от кончика пипетки к вершине окружности мембраны проекции. Важно отметить, однако, что большая пипетка будет применять больше силы на клеточной мембране на том же уровне давления. Для учета изменчивости между диаметрами пипетки, следовательно, атмосферный длины нормированы для диаметра пипетки (D), измеренных для каждого эксперимента.
Данные могут быть дополнительно проанализированы с использованием стандартного линейного вязкоупругого полупространства модель эндотелиальных клеток, как описано в предыдущих исследованиях 6,7. В частности, модуль упругости клетки была оценена по следующей формуле:
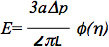
где E-модуль Юнга, является внутреннимрадиус пипетки, p, является перепад давления, L является соответствующей атмосферный длину, и φ (η) является стеной функционировать рассчитывается с использованием модели силы, как описано Theret и др. 7. Важно отметить, что несколько моделей были использованы для анализа данных, включая микроаспирацией конечно-элементной модели, предполагающей, что клетка представляет собой деформируемый сфере с изотропным и однородным свойств материалов и жидкого моделей капли, которые предполагают, что клетки образуют сферическую форму, может деформироваться постоянно, и восстановить после освобождения, как описано в нескольких превосходных отзывов: 8-10. Микроаспирацией также может быть использован для исследования других биомеханических параметров клеток и тканей, таких как сотовые вязкоупругих свойств, корковой напряженности и вклад различных структурных элементов клеток и тканей биомеханики (см. обзоры перечисленных выше для дополнительной информации).
5. ПредставительРезультаты
В более ранних исследованиях, микропипетки стремление было выполнено либо на липосомы 5 или на клетки, которые не были прикреплены к субстрату 2,11-13. В наших исследованиях, однако, клетки, как правило, поддерживали прикрепляется к субстрату, чтобы избежать изменений в структуре цитоскелета, которые могут произойти, когда клетки отделяются 14-16. Для проверки использования микроаспирацией техника для подложки подключенных клеток, мы проверяли, действительно ли нарушение F-актина приводит к снижению в ячейке жесткость бычьей аорты эндотелиальных клеток (BAECs), по оценке этого подхода. 3 видно, что, как и ожидалось , это действительно так. В частности, 3А показан типичный серия флуоресцентных изображений эндотелиальной мембраны проходят прогрессивной деформации в ответ на отрицательное давление, приложенное через микропипетки. Как и следовало ожидать, мембранная постепенно атмосферный в пипетку и aspiratред длина увеличивается в зависимости от приложенного давления. Времени курсы деформации показывают, что нарушение F-актин значительно увеличивает атмосферный длин проекций при всех условиях давления (рис. 3В) 14.
Используя этот подход, мы обнаружили, что клетки жесткость увеличивается, когда клеточные мембраны истощаются холестерина в то время как холестерин обогащения не влияет 14. Рисунке 4 показана холестерина обогащенные клетки, контроль клетки, и холестерин обедненного клетки после достижения максимальной длины стремление в -15 мм Hg (4A). Прогнозы обычно начал развиваться в-10mmHg и времени курсы деформации мембраны могут быть измерены для отрицательного давления -10, -15 и -20 мм рт ст (4В). Применение давления выше 25mmHg в результате отряда атмосферный проекции формирования отдельного пузырька. Уровень давления, в результате мембранного отряд similaг при различных условиях холестерина. Это наблюдение было весьма неожиданным, поскольку предыдущие исследования показали, что в бислоя мембранных липидов увеличение мембранного холестерина увеличивает жесткость мембраны 5,17. Наши дальнейшие исследования подтвердили эти наблюдения с использованием нескольких независимых подходов, в том числе атомно-силовой микроскопии 18,19 и тяговое усилие микроскопии 20.
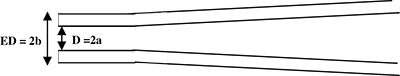
Рисунок 1. Схема сбоку записи пипетки. Пипеткой вытягивается для создания цилиндрическим хвостовиком на конце (вид сбоку). Микропипетки параметрами: D = 2a = внутренний диаметр и ED = 2b = внешний диаметр.

Рисунок 2. Микропипетки приближается к субстрату подключенных ячейки (А) Схематическое вид сбоку;. (B) Яркий контраст изображения из микропипетки сХэнк прикосновения обычно формы ячейки, используемые в стремлении экспериментов; (C) флуоресцентное изображение той же клетки помечены DiIC 18. Микропипетки по-прежнему присутствует, но невидимая (из 14).
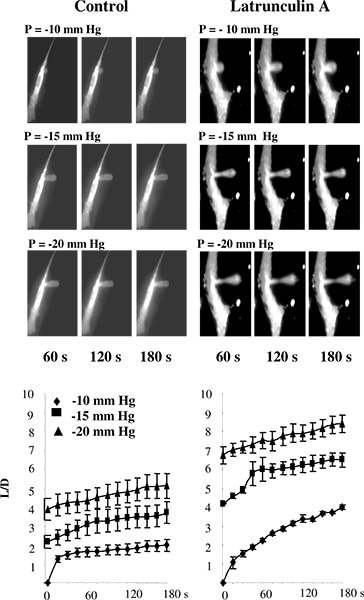
Рисунок 3. Проверка измерительной ячейке жесткость в субстрат-прилагаемый клеток с использованием микроаспирацией. : Изображения прогрессивной деформации мембраны BAECs в контрольных условиях и после воздействия latrunculin пипетки невидимым на изображениях, поскольку она не светиться.. Клетки были выставлены до 2 мкм latrunculin в течение 10 мин, что значительно сократило количество F-актин, измеряемый родамина-фаллоидином флуоресценции (не показано), но не оказали существенного влияния на клеточные формы. В latrunculin обработанные клетки, есть истончение мембраны в середине атмосферный проекции, но проекции по-прежнему ассоциируются с слоктей. B. Влияние latrunculin от времени курсы деформации мембраны, где L всасывается длина проекции мембраны и D-диаметр пипетки для контрольных клеток (n = 14) и клетки подвергаются до 2 latrunculin мкМ в течение 10 мин (п = 5). Клетки атмосферный с -10 мм Hg (алмазы), -15 мм рт (квадраты) и -20 мм рт (треугольники). (С 14).
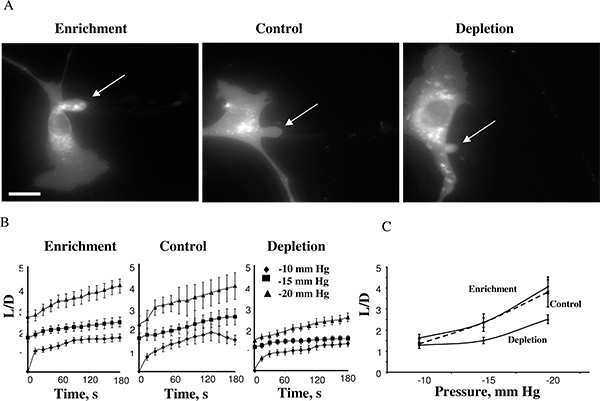
Рисунок 4. Влияние клеточного уровня холестерина на мембранных деформаций BAECs. . Типичные образы мембраны деформации холестерина обогащенные холестерином обедненный и контрольных клеток (контроль клетки подвергали воздействию MβCD: MβCD-холестерина смеси при соотношении 1:1, что не влияло на уровень свободного холестерина в клетках (см. вставке). рисунке изображены максимальной деформации при -15 мм рт. стрелка указывает положение атмосферный проекции. В баре 30 мкм. B. Среднее время-курсы атмосферный длины для трех экспериментальных популяций клеток. C. Максимальная длина атмосферный построены в зависимости от приложенного давления. Максимальное нормированное длиной в истощенных клетках был значительно ниже, чем у контрольных клеток для давления -15 мм рт и -20 мм рт.ст. (Р <0,05). (С 14).
Обсуждение
Микроаспирацией обеспечивает простую и высокую воспроизводимость метода оценки жесткости клеток / деформируемости путем применения отрицательного давления на клеточные мембраны и измерения деформации мембраны в ответ на четко определенных давление. Она была впервые разработана Mitc...
Раскрытие информации
Нет конфликта интересов объявлены.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Каталог / номер модели | Комментарии |
| Саттер пипетки съемника | Sutter Instruments | P-97 | |
| Microforge | Narishige | MF-830 | |
| Перевернутый флуоресцентного микроскопа | Zeiss | Axiovert 200M | Микроскопа должна быть предпочтительно снабжен 3D/deconvolution возможности. |
| Видеокамера | Zeiss | AxioCam MRM | |
| Image Acquisition sotware | Zeiss | AxioVision | |
| Преобразователь давления пневматический | BioTek | DPM-1B | DPM1B пневматический преобразователь Tester теперь можно найти по счастливой случайности. |
| Пипетка стеклянная | Richland | Индивидуальные стекла | Пипетки были настроены с внутренним диаметром 1,2 и 1,6 наружного диаметра. |
| DiI краска | Invitrogen | D282 | Хорошо растворяется в ДМСО |
Ссылки
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены