È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Aspirazione Micropipetta di celle substrato-attached per Stima rigidità cellulare
In questo articolo
Riepilogo
Qui si descrive un metodo rapido e semplice per misurare la rigidità delle cellule. Il principio generale di questo approccio è di misurare la deformazione della membrana in risposta a ben definito pressione negativa applicata mediante una micropipetta alla superficie cellulare. Questo metodo fornisce un potente strumento per studiare le proprietà biomeccaniche del substrato-attached cellule.
Abstract
Crescente numero di studi dimostrano che le proprietà biomeccaniche delle singole cellule svolgono un ruolo importante in molteplici funzioni cellulari, tra cui la proliferazione cellulare, la differenziazione, la migrazione e interazioni cellula-cellula. I due parametri chiave di biomeccanica cellulari sono deformabilità cellulare o rigidità e la capacità delle cellule di contrarsi e generare forza. Qui si descrive un metodo rapido e semplice per valutare la rigidità cellulare misurando il grado di deformazione della membrana in risposta alla pressione negativa applicata da una micropipetta di vetro alla superficie cellulare, una tecnica che si chiama Aspirazione Micropipetta o microaspirazione.
Microaspirazione viene eseguita tirando un capillare di vetro per creare una micropipetta con una punta molto piccola (2-50 micron di diametro a seconda delle dimensioni di una cellula o di un campione di tessuto), che viene poi collegato ad un trasduttore di pressione pneumatica e portato a termine prossimità di una cellula al microscopio. Quando l'punta della pipetta tocca una cella, una fase di pressione negativa è applicata alla pipetta dal trasduttore di pressione pneumatica di generazione di pressione ben definito sulla membrana cellulare. In risposta alla pressione, la membrana viene aspirata nella deformazione della membrana pipetta e progressivo o "proiezione membrana" nella pipetta viene misurato in funzione del tempo. Il principio di base di questo approccio sperimentale è che il grado di deformazione della membrana in risposta ad una forza meccanica definita è una funzione della rigidezza della membrana. La membrana è più rigido, più lenta è la velocità di deformazione della membrana e più breve è il regime tecnica length.The aspirazione può essere eseguita su cellule isolate, sia in sospensione e substrato-annessi, organelli grandi, e liposomi.
Analisi viene eseguita confrontando deformazioni della membrana massimi raggiunti sotto una data pressione di diverse popolazioni cellulari o condizioni sperimentali. Un "coefficiente di rigidezza" è estimated tracciando la lunghezza aspirato di deformazione della membrana in funzione della pressione applicata. Inoltre, i dati possono essere ulteriormente analizzati per stimare il modulo di Young delle cellule (E), il parametro più comune per caratterizzare rigidità dei materiali. È importante notare che la membrana plasmatica delle cellule eucariotiche possono essere visti come una bi-componente in cui è underlied bistrato lipidico di membrana dalla sub-membrana citoscheletro e che è il citoscheletro che costituisce l'impalcatura meccanica della membrana e domina la deformabilità della busta cellulare. Questo approccio, pertanto, permette di sondare le proprietà biomeccaniche del sub-membrana citoscheletro.
Protocollo
1. Tirare Micropipette di vetro
Attrezzatura: Micropipetta Puller, microforgia.
Vetro: Boroscillicate capillari di vetro (~ diametro 1,5 mm esterno, ~ 1.4 mm di diametro interno).
- Micropipette sono tirati utilizzando lo stesso approccio di base che viene usato per preparare microelettrodi di vetro per registrazioni elettrofisiologiche. Brevemente, un capillare di vetro viene riscaldata nel mezzo e quando il vetro inizia a fondere le due metà del capillare sono staccati generando due micropipette. Più estrattori commerciali sono a disposizione per eseguire questo processo vanno da estrattori verticali relativamente semplici che utilizzano la gravità per tirare le due pipette a parte per estrattori orizzontali altamente sofisticati che offrono molteplici opzioni programmabili per variare la velocità e altri parametri del tiro. Entrambi i tipi di estrattori sono stati utilizzati nei nostri esperimenti.
- Requisitos per la geometria della punta della pipetta: Le punte delle pipette usate in questi esperimenti in genere varia tra 2 a 6 micron di diametro esterno a seconda delle dimensioni della cella. Un altro importante parametro è la forma della punta, che dovrebbe approssimare un tubo cilindrico (vedi Figura 1). Questo può essere ottenuto ottimizzando i parametri del tiro e verificando la forma della punta al microscopio finché la forma desiderata. La lunghezza ottimale del gambo della pipetta dipende dalla quantità di deformazione prevista: se le deformazioni sono piccole <10 micron, è sufficiente che il cilindro come parte della pipetta è anche relativamente breve (stesso ordine di grandezza), per ingrandire deformazioni regolare di conseguenza. In generale, aumentando il calore e / o aumento di "pull" riduce il diametro della punta. L'incremento dei "pull" genera anche una punta con un cono più lungo. Nei nostri esperimenti, con un P-97 orizzontale pipetta Sutter estrattore, il programma è statoottimizzato per i seguenti parametri: Calore di 473, Pull 22; Velocity 22, 200; Tempo di pressione 500. È anche possibile creare punte cilindriche tirando un gambo molto lungo e quindi di rottura e lucidatura. Istruzioni dettagliate su come preparare diversi tipi di pipette sono riportati nel manuale Sutter.
- Microforgia: Si raccomanda inoltre al fuoco-lucidare la punta della pipetta per generare una superficie liscia di vetro che lo rende una buona tenuta alla membrana plasmatica. Questo viene fatto portando la punta della pipetta per la vicinanza di una sfera di vetro riscaldata per molto una frazione di secondo, usando un microforgia. Tecnica simile viene solitamente usata per la preparazione di microelettrodi per le registrazioni elettrofisiologiche.
- Riempiendo la micropipetta: micropipette devono essere riempiti con una soluzione salina fisiologica, come PBS o non fluorescenti terreni di crescita. È importante sottolineare che la soluzione deve essere integrato con il 30% di siero che permetterà al mem cellabrana per passare agevolmente nella pipetta. Due approcci possono essere utilizzati per liberarsi di bolle d'aria nella punta della pipetta: (i) una punta della pipetta può essere immerso nella soluzione prima per consentire al liquido di riempire la punta dalle forze capillari seguite da ricoprire lo pipetta dall'altra estremità o (ii) l'intera pipetta può essere riempito dall'estremità posteriore picchiettando delicatamente sul gambo della pipetta per rimuovere le bolle dalla punta.
- Nota: Le pipette devono essere preparate il giorno dell'esperimento.
2. Preparazione delle cellule
- Semina delle cellule: microaspirazione viene eseguita su singole cellule che sono o mantenute in sospensione o sono attaccati al substrato. Per aspirare le cellule in sospensione, le cellule vengono sollevati dai loro substrati e pipettati in una camera poco profonda longitudinale che è montato sul microscopio invertito destra prima dell'esperimento. Per aspirare substrato collegati in cellule, le cellulesono seminate su piccoli cover-tagliandi (~ 10 mm di diametro) che può anche essere collocato nella camera di microaspirazione prima dell'esperimento. La logica di utilizzare una camera poco profonda longitudinale è quello di consentire una micropipetta per avvicinarsi alle cellule con un angolo molto superficiale, il più vicino possibile orizzontale. Questo viene fatto per consentire la membrana tirato in micropipetta da visualizzare su un unico piano di messa a fuoco (vedere Figura 2).
- Visualizing membrana cellulare: Per osservare la proiezione membrana nella pipetta, membrane cellulari vengono colorate con un colorante lipofilo fluorescente, come DII utilizzando un protocollo standard di colorazione.
- Caldo PBS soluzione.
- Diluire il DII magazzino ad una concentrazione di lavoro (5 pM) con la soluzione riscaldata PBS.
- Ultrasuoni per 5 minuti per rompere gli aggregati di colorante.
- Centrifugare per 5 minuti e prendere surnatante.
- Lavare le cellule in PBS 3 volte, ogni 5 min.
- Incubare le cellule con il colorante in modozione per 30 min a 37 ° C incubatore.
- Lavare le cellule con PBS 3 volte per 5 minuti ciascuno.
- Nota: È possibile sostituire DII colorazione della membrana con la visualizzazione del sub-membrana citoscheletro che viene anche tirato insieme con la membrana nella pipetta. Si deve tener conto, tuttavia, che perturbando il citoscheletro può alterare le proprietà biomeccaniche della cella. Inoltre, quando si esegue esperimenti con cellule microaspirazione substrato allegate, si raccomanda di utilizzare l'imaging 3D per valutare la lunghezza della proiezione membrana nella pipetta che è posizionato ad un angolo rispetto al piano focale delle cellule.
3. Microaspirazione e Acquisizione di immagini
Attrezzatura: invertito microscopio a fluorescenza, preferibilmente con capacità di deconvoluzione 3D (Zeiss Axiovert 200M con controllo computerizzato asse Z movimento della oggettivitaes o equivalente), videocamera collegata a un computer (AxioCam MRm o equivalente), trasduttore di pressione (BioTek o equivalente), esente da vibrazioni stazione (TMD o equivalente), Micromanipolatore (Narishige, Sutter, Burleigh o equivalente; manipolatori possono essere di tipo meccanico, idraulico o piezoelettrico). È anche importante sottolineare che microaspirazione può essere eseguita utilizzando un microscopio senza funzionalità 3D per stimare la rigidità di cellule in sospensione, come 1,2 globuli rossi o neutrofili 3, organelli isolati come nuclei 4 o 5 liposomi artificiali.
Immagine del software di acquisizione: Zeiss AxioVision o un equivalente.
- Montare le cellule in una camera microaspirazione, come descritto sopra, su un microscopio invertito a fluorescenza. Posizionare le celle scegliendo una cella per un esperimento e posizionarlo al centro del campo visivo. È importante perform questi esperimenti in un ambiente privo di vibrazioni, in particolare per gli esperimenti con substrato-attached cellule, perché le vibrazioni minuto che si manifestano in genere su panche e tavoli regolari rischiano di compromettere completamente la creazione del sigillo, rompere la punta della micropipetta o provocare significativi spostamenti nella posizione della punta che si distorga l'analisi dei risultati.
- Posizionare una micropipetta riempita con PBS / media w / soluzione di siero in una portapipette collegato ad un trasduttore di potenza dal tubo flessibile con il diametro adeguato al connettore del titolare pipetta per una perfetta tenuta. All'inizio di ogni esperimento la pressione nella pipetta viene equilibrata alla pressione atmosferica. La pipetta è montato su un micromanipolatore che permette un controllo preciso dei movimenti pipetta in un intervallo micron. Posizionare una pipetta con un angolo basso al fondo della camera e portare la punta della pipetta al centro del campo visivo. The gambo della pipetta, una parte cilindrica della punta della pipetta nel quale viene aspirata la membrana, è allineato orizzontalmente al piano focale (1) posizionamento della pipetta al shallowest possibile angolo (10-15 °) e (2) da flettendo il gambo della pipetta contro il fondo della camera. Perché il gambo è molto sottile è sufficientemente flessibile per scorrere sul fondo della camera, mentre si avvicina una cella, come mostrato schematicamente nella figura 1. Lentamente abbassare la micropipetta al lato di una singola cella utilizzando il manipolatore corso fino in prossimità del piano di messa a fuoco per la cella. Quindi, utilizzando un manipolatore multa spostare la micropipetta al bordo della cella finché la punta della pipetta tocca delicatamente la membrana. Prendere una immagine per osservare la posizione della pipetta. Tenute buone vengono creati quando la punta tutta la pipetta è completamente a contatto con la superficie cellulare e il contatto è stabile. Non vi è alcun criterio oggettivo forte, tuttavia, di quanto è buono il sigillo è escEPT per l'esame visivo.
- Applicare una fase di pressione negativa con il trasduttore e mantenerla fino proiezione membrana è stabilizzata. La pressione necessaria per aspirare la membrana nella pipetta varia a seconda del tipo cellulare e specifiche condizioni sperimentali. Nei nostri esperimenti, deformazione iniziale si osserva tipicamente quando si applica pressione nell'intervallo tra -2 e-15mm Hg. Quando la pressione viene applicata, la membrana viene progressivamente deformata nella pipetta finché è stabilizzato a certa lunghezza, un processo che richiede tipicamente 2-3 min. Durante questo tempo, le immagini di deformazione della membrana vengono acquisiti ogni 30 sec per monitorare la progressione della membrana che viene tirato nella pipetta.
- Aumentare la pressione al livello successivo in 2-5 passaggi mmHg e ripetere la procedura fino proiezione stacca dalla membrana cellulare e si muove nella pipetta, a questo punto si ferma l'esperimento.
Per quantificare il grado di deformazione della membrana, la lunghezza aspirato (L) viene misurata dalla punta della pipetta sul vertice della circonferenza della proiezione membrana. È importante notare, tuttavia, che la pipetta si applica più grande forza sulla membrana cellulare allo stesso livello di pressione. Per tenere conto della variabilità tra i diametri delle pipette, pertanto, la lunghezza aspirato viene normalizzato per il diametro pipetta (D) misurata per ciascun esperimento.
I dati possono essere ulteriormente analizzati utilizzando uno standard lineare viscoelastico semispazio modello della cellula endoteliale, come descritto nei precedenti studi 6,7. In particolare, il modulo elastico delle cellule è stata valutata utilizzando l'equazione:
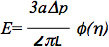
dove E è il modulo di Young, a è l'internoraggio della pipetta, Dp è la differenza di pressione, L è la lunghezza corrispondente aspirato, e φ (η) è una parete funzionamento calcolato utilizzando il modello di forza, come descritto da Theret et al 7. È importante notare che i modelli multipli sono stati utilizzati per analizzare i dati microaspirazione compreso un modello ad elementi finiti che presuppone che una cellula è una sfera deformabile con proprietà di materiale isotropo e omogeneo e modelli goccia di liquido, che assumono che cellule formano una forma sferica, può deformare continuamente, e recuperare a seguito di rilascio, come descritto in numerosi eccellenti recensioni: 8-10. Microaspirazione può anche essere usato per studiare altri parametri biomeccanici di cellule e tessuti, come le proprietà viscoelastiche cellulari, tensione corticale e contributo dei diversi elementi strutturali di biomeccanica cellule e tessuti (vedi le recensioni elencati sopra per maggiori informazioni).
5. RappresentanteRisultati
In studi precedenti, l'aspirazione micropipetta è stato effettuato con il 5 liposomi o su cellule che non sono stati attaccati al substrato 2,11-13. Nei nostri studi, tuttavia, le cellule sono aggiornati normalmente fissato al substrato per evitare variazioni della struttura citoscheletrica che possono verificarsi quando le cellule staccare 14-16. Per convalidare l'uso della tecnica microaspirazione per substrato-attached cellule, abbiamo testato se mostra interruzione di F-actina determina la diminuzione della rigidità delle cellule delle cellule endoteliali aortiche bovine (BAECs), come stimato da questo approccio. Figura 3 che, come previsto , questo è davvero il caso. Specificamente, la Figura 3A mostra una tipica serie di immagini fluorescenti di una membrana endoteliale subire deformazioni progressive in risposta alla pressione negativa applicata attraverso una micropipetta. Come previsto, la membrana viene gradualmente aspirato nella pipetta e la aspiratlunghezza ed aumenta in funzione della pressione applicata. Il tempo-corsi di spettacolo deformazione che distruzione di F-actina aumenta significativamente le lunghezze aspirati delle proiezioni in tutte le condizioni di pressione (Figura 3B) 14.
Usando questo approccio, abbiamo scoperto che la rigidità cellulare aumenta quando le membrane cellulari sono esaurite mentre arricchimento di colesterolo colesterolo non ha avuto effetto 14. Figura 4 mostra un colesterolo arricchita di cellule, una cellula di controllo, ed una cellula colesterolo impoverito dopo aver raggiunto lunghezze massime di aspirazione -15 mm Hg (4A). Le proiezioni di solito ha iniziato a svilupparsi a 10 mmHg, e il tempo-corsi di deformazione della membrana può essere misurata per le pressioni negative di -10, -15 e -20 mm Hg (4B). Applicazione di pressioni superiori-25mmHg provocato il distacco della sporgenza aspirato formando una vescicola separata. Il livello di pressione che ha provocato il distacco della membrana era similar in diverse condizioni di colesterolo. Questa osservazione è molto inaspettato perché studi precedenti hanno mostrato che in bistrati lipidici di membrana un aumento del colesterolo membrana aumenta la rigidità della membrana 5,17. I nostri studi hanno confermato queste osservazioni che utilizzano diversi approcci indipendenti, tra cui microscopia a forza atomica e microscopia 18,19 Forza di trazione 20.
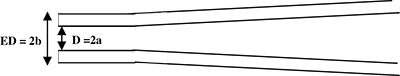
Figura 1. Vista laterale schematica di una pipetta di registrazione. La pipetta è tirato per generare un codolo cilindrico alla punta (vista laterale). Parametri micropipetta: D = 2a = diametro interno e ED = 2b = diametro esterno.

Figura 2. Micropipetta avvicina un substrato-attached cella (A) vista laterale schematica,. (B) di contrasto immagine luminosa di una micropipetta smatassa toccando una cella tipicamente sagomato utilizzato in esperimenti di aspirazione; (C) immagine fluorescente della stessa cella etichettata con DiIC 18. La micropipetta è ancora presente ma è invisibile (da 14).
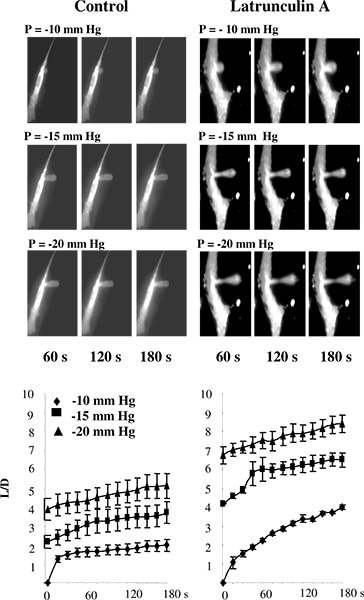
Figura 3. Validazione di misurare la rigidità delle cellule nel substrato-attached celle utilizzando microaspirazione. A: Immagini di deformazione della membrana progressiva BAECs in condizioni di controllo e dopo l'esposizione latrunculin La pipetta è invisibile sulle immagini perché non è fluorescente.. Le cellule sono state esposte a pM latrunculin 2 A per 10 minuti, che riduce drasticamente la quantità di F-actina, come misurato da rodamina falloidina fluorescenza (non mostrato), ma non ha avuto effetto significativo sulla forma cellulare. In un latrunculin trattata cella, esiste un assottigliamento della membrana nel mezzo della proiezione aspirato ma la proiezione è ancora collegato alla cells. B. Un effetto di latrunculin sui relativi tempi di deformazione della membrana dove viene aspirato L lunghezza della proiezione membrana e D è il diametro della pipetta per cellule di controllo (n = 14) e cellule esposte a 2 latrunculin pM A per 10 min (n = 5). Le cellule sono state aspirato con -10 mm Hg (diamanti), -15 mm Hg (quadrati) e 20 mm Hg (triangoli). (Dal 14.)
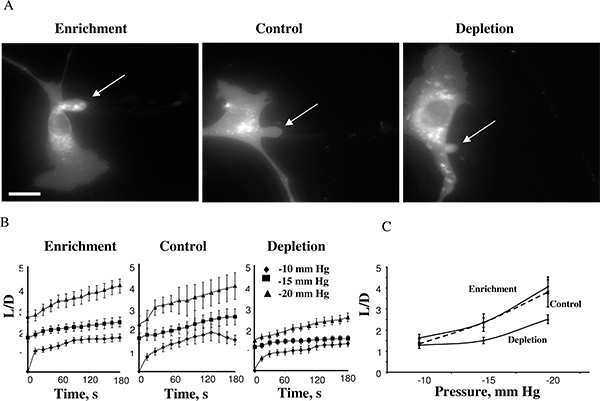
Figura 4. Effetto dei livelli di colesterolo cellulare su deformazione della membrana di BAECs. . A immagini tipiche di deformazione della membrana di colesterolo-arricchito, colesterolo impoverito e cellule di controllo (cellule di controllo sono stati esposti a MβCD: MβCD-colesterolo miscela in rapporto 1:1 che non aveva alcun effetto sul livello di colesterolo libero nelle cellule (vedi inserto). Le immagini mostrate raffigurano la deformazione massima a -15 mm Hg. La freccia indica la posizione della proiezione aspirato. Il bar è di 30 micron. B. Tempo medio-corsi di lunghezza aspirati per le tre popolazioni di cellule sperimentali. C. Lunghezze massime aspirati tracciata in funzione della pressione applicata. La lunghezza massima normalizzata in cellule impoverito era significativamente inferiore a quello delle cellule di controllo per pressioni -15 mmHg e -20 mmHg (P <0,05). (Dal 14.)
Discussione
Microaspirazione fornisce un metodo semplice e altamente riproducibili stimare rigidità cellule / deformabilità applicando pressione negativa ad una membrana cellulare e misurare la deformabilità della membrana in risposta alla pressione ben definita. È stato inizialmente sviluppato da Mitchison e Swann (1954) per caratterizzare le proprietà elastiche dei ricci di mare uova di fornire uno sguardo sui meccanismi di divisione cellulare 21 e poi a guardare le proprietà meccaniche dei globuli rossi 1.<...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Catalogo / Numero del modello | Commenti |
| Sutter pipetta estrattore | Sutter Instruments | P-97 | |
| Microforgia | Narishige | MF-830 | |
| Invertito microscopio a fluorescenza | Zeiss | Axiovert 200M | Il microscopio deve essere preferibilmente dotata di capacità 3D/deconvolution. |
| Videocamera | Zeiss | AxioCam MRm | |
| Acquisizione di immagini sotware | Zeiss | AxioVision | |
| Trasduttore di pressione pneumatica | BioTek | DPM-1B | DPM1B Tester trasduttore pneumatico può essere trovato da FLUKE. |
| Pipetta di vetro | Richland | Vetro su misura | Pipette sono stati personalizzati con un diametro interno 1,2 e 1,6 diametro esterno. |
| DiI Dye | Invitrogen | D282 | Si scioglie bene in DMSO |
Riferimenti
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon