Method Article
Cristaux de récolte et de Cryo-refroidissement de protéines membranaires cultivées dans des mésophases lipidiques pour la détermination de la structure par cristallographie macromoléculaire
Dans cet article
Résumé
Ici est décrit procédures mises en place dans la membrane Caffrey structurale et fonctionnelle du Groupe Biologie des cristaux de récolte et de cryo-cool protéines membranaires lipidiques cultivés dans des phases cubiques et une éponge pour une utilisation dans la détermination de la structure macromoléculaire à l'aide cristallographie aux rayons X.
Résumé
Une voie importante pour comprendre comment les protéines fonctionnent à un niveau mécanistique, c'est d'avoir la structure de la protéine cible disponible, idéalement avec une résolution atomique. Actuellement, il n'existe qu'une seule façon de recueillir de l'information telle qu'appliquée à des protéines membranaires intégrales (Figure 1), et les complexes qu'ils forment, et que cette méthode est macromoléculaire cristallographie aux rayons X (MX). Pour ce faire cristaux MX qualité de diffraction sont nécessaires qui, dans le cas des protéines membranaires, ne forment pas facilement. Une méthode de cristallisation de protéines membranaires qui implique l'utilisation de mésophases lipidiques, en particulier les phases cubiques et éponge 1-5, a gagné une attention considérable en raison de la fin des succès qu'il a eu dans le domaine G du récepteur couplé aux protéines 21.06 ( www . mpdb.tcd.ie ). Cependant, la méthode, ci-après dénommé le méso ou dans lipidique méthode de phase cubique, est livré avec son propre techniquedéfis. Celles-ci proviennent, en partie, en raison de la nature généralement visqueuse et collante de la mésophase lipidique dans laquelle les cristaux, qui sont souvent des micro-cristaux, grandir. Manipulation des cristaux devient difficile en raison, en particulier pendant la récolte afin 22,23. Des problèmes se posent aussi à l'étape qui précède la récolte, qui exige que les plaques sandwich de verre dans laquelle les cristaux se développent (figure 2) 24,25 sont ouvertes pour exposer le bolus mésophase, et les cristaux y sont, pour la récolte, cryo-refroidissement et X éventuels diffraction des rayons collecte de données.
Les variantes mésophases cubiques et une éponge (figure 3) à partir de laquelle les cristaux doivent être récoltés ont profondément différentes rhéologies 4,26. La phase cubique est visqueuse et collante semblable à une pâte dentifrice d'épaisseur. En revanche, la phase éponge est plus fluide avec une nette tendance à couler. En conséquence, les différentes approches pour l'ouverture de cristallisation puits containing cristaux poussent dans le cube et la phase éponge sont appelés pour aussi bien des méthodes différentes sont nécessaires pour la récolte des cristaux à partir des deux types de mésophase. Protocoles pour faire juste cela ont été affinés et mis en œuvre dans la membrane Biologie Structurale et Fonctionnelle (MS & FB), et sont décrits en détail dans cet article JoVE (figure 4). Des exemples sont donnés de situations où les cristaux sont récoltés avec succès et cryo-refroidi. Nous fournissons également des exemples de cas où des problèmes se posent qui conduisent à la perte irrémédiable de cristaux et de décrire la façon dont ces problèmes peuvent être évités. Dans cet article, le Viewer est fourni avec étape par étape les instructions pour l'ouverture de puits de verre en sandwich de cristallisation, pour la récolte et pour cryo-refroidissement des cristaux de protéines membranaires qui poussent dans des phases cubique et d'éponges.
Protocole
1. Laboratoire Set-up pré-récolte
- En prévision de la récolte, remplir le sèche mousse Dewar d'azote liquide et le placer à côté du microscope où la récolte doit avoir lieu.
- Immerger la rondelle de stockage, ouvrez finissent, dans l'azote liquide à l'intérieur du Dewar mousse et laissez refroidir complètement.
- Fixer un micro-montage d'une taille qui correspond le cristal à être récoltées sur une baguette magnétique (figure 5). Il est important d'avoir en main un certain nombre de pièces de rechange baguettes magnétiques préchargé avec des micro-supports pour répondre à des situations où il est nécessaire de récolter plusieurs cristaux à partir d'un bolus les. Baguettes de rechange doivent être disponibles en tout temps.
- Placez une micropipette, des conseils et de la solution de précipitant qui a été utilisé pour la croissance cristalline à côté du microscope récolte. Il peut être nécessaire pour couvrir la mésophase et pour éviter le dessèchement lorsque le bien est ouvert.
- Ont un cahier et un stylo sur le banc à proximité et / oul'ordinateur s'ouvre. Ceux-ci seront utilisés pour consigner les observations relatives à la qualité, l'apparence, l'emplacement, le stockage rondelle numéro, etc, de cristaux, ils sont récoltés, cryo-refroidi et placé dans le stockage.
- Si un assistant est disponible pour aider à la récolte de cette personne doit comprendre clairement le protocole qui sera suivi, l'ordre dans lequel les différentes étapes auront lieu, ainsi que leur rôle dans le processus global.
Avec tous les matériaux et l'équipement en place notre prochaine tâche consiste à:
2. Identifier les plaques et les puits qui contiennent Cristaux
- La méthode la plus simple et la plus directe pour trouver des cristaux de exploitables est d'inspecter les puits à la main en utilisant un microscope à la normale et en lumière polarisée croisée. Réglage de l'intensité de la lumière d'éclairage sur le microscope peut aider à localiser les cristaux.
- Alternativement, un imageur où les plaques sont examinées automatiquement à la normale et traversé polarisentd la lumière, peut être utilisé pour rechercher des cristaux.
- Évaluer l'oeil a enregistré des images numériques sur un écran d'ordinateur.
- Marquer clairement les puits avec des cristaux de commentaires de récolte et d'enregistrement sur la taille, la qualité et l'emplacement des cristaux dans la mésophase dans le portable ou sur un ordinateur.
- Retirer la plaque contenant des cristaux pour la récolte de l'imageur.
3. Ouverture d'un bien avec mésophase cube. Méthode 1
Les plaques dans lequel des cristaux croissent dans le procédé méso sont des plaques en sandwich en verre (figure 2). Pour accéder à la mésophase et les cristaux qui s'y trouvent, il est nécessaire d'ouvrir le puits. Ceci est fait en utilisant un outil de coupe pour couper le verre couvre-objet supérieure qui assure l'étanchéité du puits qui peut alors être retiré.
Il existe plusieurs approches pour couper et enlever la lamelle de plus d'une cristallisation bien. La méthode à utiliser est dicté par le type of mésophase, dans lequel le cristal se trouve en pleine croissance. Cela peut être la phase très visqueuse et collante cube (figure 3A) ou sa variante plus fluide, la phase éponge (figure 3B). Dans cet article, nous montrons comment la vidéo pour ouvrir des puits et de récolter des cristaux de ces deux matériaux hébergement.
- Placer la plaque de cristallisation du verre en sandwich sur la scène d'un microscope optique.
- En utilisant un score outil de coupe de verre couvre-objet légèrement avec deux cercles concentriques situés au-dessus de l'entretoise et à l'extérieur du périmètre du puits. Avec un outil de coupe nouvelle, la notation requiert un minimum de pression appliquée. Remplacer l'outil avec un nouveau quand la pression nécessaire au score augmente même très légèrement, ce qui se produit généralement après l'ouverture de 10 puits.
- Briser le verre dans l'espace compris entre les deux cercles marqués dans le but de libérer la lamelle intérieure. Cela génère beaucoup d'éclats de verre et la poussière. Les faire disparaître avec une humidifiéserviette en papier.
- Retirer la lamelle libéré en le saisissant avec une pince à épiler à pointe fine et il pendulaires loin de et hors du puits. Dans ce cas, la phase cubique reste bloqué et mis en place sur la plaque de base du puits.
- Zoomez pour obtenir une vision plus claire de la mésophase cubique qui est maintenant prêt à être utilisé pour la récolte de cristal.
4. Ouverture d'un bien avec mésophase cubique. Méthode 2
- Utilisation de la vitre coupe pointage outil lignes droites parallèles à la lamelle d'un côté du puits et qui s'étendent à travers le puits lui-même. Ceci permet de faciliter l'accès à des pinces et l'enlèvement du couvre-objet.
Dans cette démonstration, notamment, la lamelle fissures dans la libération de la lamelle sur la surface collante entretoise. Dans le processus, le couvre-objet se déplace dans la position et l'agent de précipitation se sépare de la phase cubique. Lorsque la lamelle est soulevée une partie de la précipitation va avec. Nous nous retrouvons avec un b exposésOlus de mésophase sans aucune précipitation environnante. Immédiatement, ajouter 1 précipitant ul fraîche sur le dessus du bol à l'aide d'une micropipette pour empêcher la mésophase de se dessécher et subissant un changement de phase qui peut endommager les cristaux. Le bolus est maintenant prêt à être utilisé pour la récolte de cristal.
5. Ouverture d'un bien à la phase éponge. Sans succès
La phase éponge est moins indulgent pour travailler avec en raison de son aptitude à l'écoulement. Si les résultats que l'écoulement dans la phase éponge en contact du périmètre de la capillarité et se dégager de la mésophase et les cristaux sont perdues. Un exemple de ce qui se passe est montré dans ce clip vidéo.
- Zoom sur la phase éponge et basculer entre la lumière polarisée normale et croisées pour localiser des cristaux dans la phase éponge.
- En préparation pour l'ouverture du score bien et couper la lamelle comme décrit dans la section 3. Dans le processus, la lamelle fissures. Pour tentertion pour ouvrir le précipitant ainsi les déplacements dans la direction de la fissure et, éventuellement, elle entre en contact avec l'entretoise. Avec le précipitant va une partie de la phase éponge et de sa cargaison de cristaux qui sont perdus.
Dans cette séquence particulière, les polariseurs sur le microscope ne sont pas complètement traversé et les cristaux peuvent être considérés comme des objets lumineux en même temps que le puits et son contenu reste visible.
6. Ouverture d'un bien à la phase éponge. Avec succès
- Zoom sur la phase éponge et d'identifier un cristal à la fois en lumière polarisée normale et croisées.
- Score, couper et enlever une partie de lamelle couvrant le bien, comme dans la section 4.1. Incomplètement traversé la lumière polarisée est utilisé pour garder la trace du cristal.
- Introduire une feuille de papier tissu sec à travers l'ouverture dans le couvre-objet et dans le puits jusqu'à ce qu'il touche la solution de précipitant. Évacuer la solution attentionment jusqu'à ce qu'il soit presque tous disparu, puis enlever le tissu. Cela provoque la précipitation restante et la phase éponge, avec le cristal toujours en place, à se rétracter sous la lamelle.
- Score, couper et enlever avec une pince à épiler le reste de la lamelle, comme dans la section 4.1. Dans ce cas, la phase éponge divise, certains restent dans le puits et quelques bâtons de la lamelle. Le cristal est dans le bol sur le couvre-objet. Parce qu'il ya très peu présente précipitant, la phase éponge commence à subir une transition de phase probablement dû au dessèchement. Cela peut être considéré comme un cycle de biréfringence qui migre vers le centre du bol. Ajouter immédiatement précipitant pour le bol pour arrêter la transition. Le bolus est maintenant prêt à être utilisé pour la récolte de cristal.
7. La récolte et la Cryo-refroidissement cristaux de la phase cubique
- Des allers-retours entre la lumière polarisée croisée normale et à localiser les cristaux en bolus dans la phase cubique et ouverte. En tsa séquence vidéo jusqu'à quatre cristaux biréfringents peut être vu dans les bolus phase cubique avec une lumière polarisée croisée.
- Utilisez un. Montée cryo-boucle (figure 5) pour sonder la mésophase fraîchement exposée pour les cristaux, les cristaux de pêcher et de les plonger, contenue dans le cryo-boucle, dans l'azote liquide dans le Dewar immédiatement après la récolte Idéalement, la récolte et le composant logiciel enfichable de refroidissement devrait se faire dans un mouvement continu et rapide. En adhérant à mésophase peu que possible doivent être récoltées avec le cristal. Dans notre expérience, la cryo-protecteur n'est pas nécessaire avec de méso-cultivés cristaux.
- Comme il n'est pas possible de rechercher le cristal dans le cryo-boucle immédiatement après la récolte inspecter le bolus mésophase utilisé pour la récolte de vérifier que le cristal n'est plus là ce qui suggère qu'il a été récoltée avec succès.
8. Cristaux de récolte et de Cryo-refroidissement de la phase éponge
- Des allers-retours entre la lumière polarisée croisée normale et à localiser les cristaux dans la phase éponge bolus dans le puits ouvert. Dans cette séquence vidéo de nombreux cristaux biréfringents peut être vu dans le bol en lumière polarisée croisée.
- Utiliser un. Montée cryo-boucle (figure 5) pour repêcher les cristaux de la phase éponge et à les plonger, contenus dans ou sur le cryoloop, dans l'azote liquide dans le vase de Dewar immédiatement après la récolte Comme pour la récolte de la phase cubique, dans l'idéal, le processus cryo-refroidissement doit se faire immédiatement le cristal est récolté avec aussi peu de temps que possible écoulé entre l'événement et la récolte réelle immersion dans l'azote liquide. Comme phase éponge adhérant peu que possible doivent être récoltées avec le cristal. Comme indiqué précédemment, cryo-protecteur n'est pas nécessaire avec de méso-cultivés cristaux.
9. Cristaux de stocker dans Dewars
- Après avoir plongé la boucle montée en liquide niTrogen le placer dans une des fentes de retenue de la rondelle de stockage dans la mousse Dewar. Toutes les manipulations sont effectuées avec la boucle, la partie supérieure de la baguette magnétique et la rondelle immergé dans de l'azote liquide.
- Notez l'emplacement et les détails de l'récolté et cryo-refroidi cristal dans le bloc-notes et / ou sur l'ordinateur.
- Lorsque la rondelle dans le Dewar est rempli de mousse ou de la récolte de la journée est terminée transfert de la rondelle dans un porte-rondelle mis de côté dans un stockage ou d'un transport de Dewar rempli d'azote liquide. Les cristaux peuvent être expédiés dans Dewars transport à l'installation synchrotron pour la diffraction de collecte de données.
10. Les résultats représentatifs
Les objectifs des exercices de récolte et de cryo-refroidissement démontré ici sont pour transférer un cristal de la mésophase hébergement en cryo-boucles, pour vitrifier le cristal en forme de boucle et de le placer dans le stockage dans l'azote liquide dans un Dewar. La situation idéale est où la récolte et cryo-refroidissement sont réalisées de telle sorte que la qualité de diffraction du cristal est conservé dans le processus. Comme mésophase peu que possible doivent être récoltées avec le cristal. Ceci est de rendre la localisation du cristal et son centrage dans le faisceau de rayons X beaucoup moins exigeant que, pour accélérer le refroidissement cryogénique en vue de la vitrification, et à réduire les interférences de fond à partir de la dispersion de mésophase de diffraction pendant la collecte de données. Quelques exemples de cryo-refroidis échantillons où le cristal peuvent et ne peuvent pas être vus sont présentés dans la figure 6. Lorsque le cristal ne peut pas être vu par les yeux, il est généralement nécessaire de recourir à tramage de diffraction afin de trouver le cristal et de le centrer dans le faisceau pour la collecte de données 27.
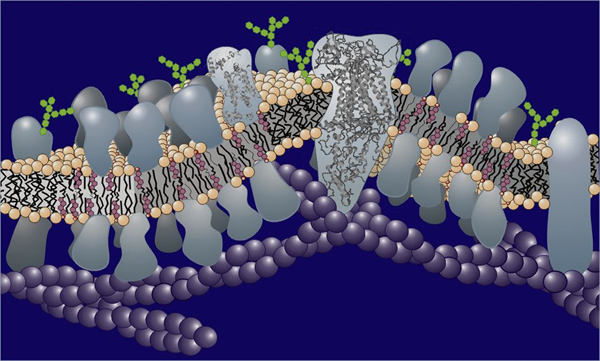
Figure 1. Représentation schématique d'une membrane biologique montrant la bicouche lipidique dans et sur lequel are trouve une variété de protéines.
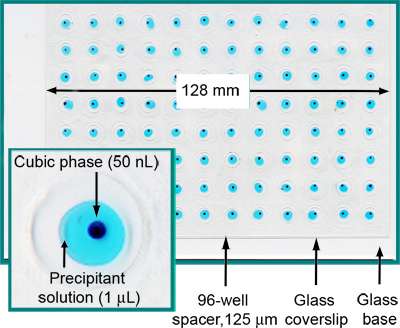
Figure 2. A pleine charge et scellé plaque de 96 puits de cristallisation du verre sandwich. Chaque puits contient 50 nl phase cubique et 1 ul de solution de précipitation. Pour plus de clarté, la phase cubique a été coloré avec le rouge Soudan et la solution de précipitant comprend le bleu de méthylène. De la référence 5.
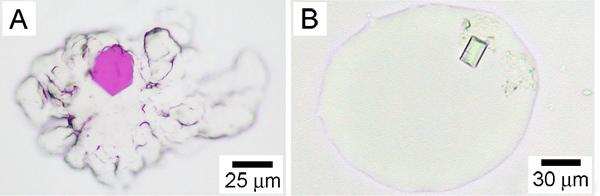
Figure 3. Cristaux de protéines membranaires qui poussent dans la mésophase lipidique. A. La phase cubique avec un cristal de bactériorhodopsine à partir de H. halobium. B. La phase éponge contenant un cristal de la vitamine B12 btuB récepteur / transporteur, de E. coli. De la référence 25. Les phases cubiques et une éponge contrastées appearances est aussi évident en comparant les caches A et B. La phase cubique dans A est extrêmement visqueuse et conserve sa forme originale. Il ne s'écoule pas. Cela est particulièrement évident sur les bords du bol mésophase qui ont une apparence rugueuse. Par contrat, la phase éponge est beaucoup moins visqueux et ne coule. Ainsi, la phase éponge ne parvient pas à conserver sa forme originale et ses bords sont typiquement lisse. Précipitants qui comprennent Jeffamine, le PEG 400, le 2-méthyl-2 ,4-pentanediol, le pentaérythritol propoxylé, le butanediol et l'hexanediol, peut se traduire par une transition de la phase cubique à 4,26 éponge.

Figure 4. L'organigramme résume les étapes de la production, de récolte et de cryo-refroidissement à méso-cultivés cristaux de protéines membranaires (A). Seules les étapes, entourée par le pointillé rougeligne, et décrit en détail dans (B), sont couverts dans cet article JoVE. Panel A est de la référence 3. Cliquez ici pour agrandir la figure .

Figure 5. Un vide cryo-boucle monté sur un axe qui est maintenu en place sur une baguette magnétique. Vues élargies de la broche (A) et de micro-montage (B) de cet important outil pour la récolte et cryo-refroidissement sont affichés. La boucle vide à la fin de la micro-montage en B est de 30 pm de diamètre. Bien que n'ayant pas testé d'autres types de boucles largement, nous constatons que la MiTeGen boucles travail montre bien à la fois les phases cubique et une éponge.

Cristaux Figure 6. Récoltés et cryo-refroidi de protéines membranaires en cryo-boucles tel que vu avec un microscope en ligne sur une ligne de lumière synchrotron. A, B,. Exemples de cristaux récoltés (Caa3 la cytochrome oxydase 34 (A), diacylglycérol kinase, DgkA (B)), où les cristaux (flèche bleue) sont visibles à travers la mésophase cryo-refroidi sur un exemple cryo-boucle. C. récoltées, où le cristal n'est pas visible dans la mésophase cryo-refroidi sur un cryo-boucle. L'extrémité de la boucle est identifiée par une flèche rouge. Faire adhérer la cryo-refroidissement mésophase est identifiée par une flèche bleue.
Discussion
Dans cet article, nous avons montré comment la vidéo cristaux cultivés dans une mésophase lipidique sont récoltées et cryo-refroidi en préparation pour une utilisation dans la collecte des données de diffraction et en fin de compte pour la détermination de la structure. La mésophase hébergement peut être la phase visqueuse et collante cubique ou la phase éponge plus fluide 4. Comment les plaques sandwich de verre sont ouverts et la façon dont les cristaux sont récoltés dépend beaucoup du type de mésophase. Il est donc important de savoir qui de l'un deux a affaire à l'avance. L'identité de l'hébergement des lipides et le précipitant utilisé est importante à cet égard, et l'apparence physique des bolus mésophase dans la cristallisation et peut être utilisée pour les distinguer (figure 3). La récolte de ces deux types de mésophase a été illustrée dans cet article.
La récolte de petits cristaux d'une mésophase lipidique dans les plaques sandwich de verre est un processus laborieux qui nécessite du temps, des compétences, expertiseience, de la patience et une main ferme. Il est important de mettre de côté une quantité appropriée de temps pour la récolte et de mettre en place le laboratoire de sorte que toutes les fournitures et les équipements sont à portée de main à l'avance. Une deuxième personne pour aider à la récolte n'est pas indispensable mais est recommandée. Cette personne peut vous aider à fournir des plaques pré-marqués à l'individu de faire la récolte ainsi que de placer cryo-refroidis boucles montées avec des cristaux récoltés dans la rondelle de stockage. L'assistant peut également jouer un rôle de soutien important dans la documentation des observations sur les cristaux faites au cours de la récolte qui pourrait s'avérer crucial lors de la collecte des données de diffraction. En l'absence d'une assistante, commande vocale enregistrement audio dispositif pourrait être mis à profit pour la documentation.
En suivant le protocole décrit dans cet article vous aidera à faire la visionneuse lever et courir avec la récolte de cristal. Cependant, il est important de comprendre que le processus n'est pas simple et que practice est nécessaire avant de se lancer dans la récolte de précieux cristaux de protéines membranaires. Il est donc recommandé que les plaques d'essai avec des cristaux de protéines qui ne sont pas particulièrement utiles être expérimenté en premier lieu. Ce sera le néophyte avec une expérience précieuse dans la découpe du verre, l'élimination des tessons de verre, en soulevant le couvre-objet à partir de plus de la mésophase, en utilisant la caractéristique de polarisation sur le microscope pour voir les cristaux et de les suivre au cours de la récolte, et enfin traiter les différents types de mésophases et la récolte de leur part. La texture de la mésophase, et par extension de la facilité avec laquelle les cristaux peuvent être récoltés, qui change avec le temps pendant la cristallisation. Il est donc important de pratiquer la récolte de cristaux de moindre valeur, mais avec ceux qui ont grandi dans les mêmes conditions que celles de plus grande valeur. Il est possible de faire croître des cristaux de lysozyme et la thaumatine par le méso ou en phase cubique lipidique méthode 28 et ceux-ci devraient être consiEred par voie de se familiariser avec les matériaux et la méthode. On devrait aussi envisager de travailler avec des protéines sans mésophase premier à apprendre de ses caprices.
Les procédures démontré ici ont toutes été faites à un niveau confortable de 20 ° C environ. Il est possible de faire croître des cristaux par la méthode de méso à des températures plus basses. Ainsi, monooléine que le lipide hébergement dans un état de phase métastable peut être utilisée à 4 ° C 1,2,29,30. Une alternative est d'utiliser la conception rationnelle 7.9 MAG pour la cristallisation à basse température 31. Nous faisons crysallogenesis basse température couramment avec certains objectifs de protéines membranaires. Dans ce cas, la croissance des cristaux et la récolte se fait de plain-pied réfrigérateur à 4 ° C. Travailler dans de telles conditions a ses propres défis non la moindre, est la nécessité pour les vêtements chauds et confortables.
La prochaine étape dans le processus global de détermination de la structure à l'aide crys macromoléculairestallography est de recueillir des données de diffraction sur des cristaux récoltés et composant logiciel enfichable refroidi comme l'a démontré dans cet article. Dans méso-adulte cristaux sont généralement de petite taille. Toutefois, la collecte de données utiles de diffraction a été possible avec des cristaux ayant une dimension maximale de 20 um 9. A cet effet, les micro-faisceau synchrotron de rayons X est utilisé et fait l'objet d'un article séparé JoVE dans cette série 32,33.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nombreux sont ceux qui ont contribué à ce travail et la plupart sont de la Caffrey membrane structurale et fonctionnelle groupe de biologie, les deux membres passés et présents. Pour tous, et surtout à Jingquan Tan et Joseph Lyons, nous adressons nos plus vifs remerciements et son appréciation. Ce travail a été financé en partie par des subventions de la Science Foundation Ireland (07/IN.1/B1836), le National Institutes of Health (GM75915, P50GM073210 et U54GM094599), et le 7e PC COST et Actions Marie Curie (CM0902 et PIEF-GA-2009 -235612).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Composants |
| Pinces courbes | Sigma | F4142 | Outil |
| Embouts de pipette jetables | Gilson | Divers | Jetable |
| Mousse Dewar | Spearlab | FD-500 | Outil |
| Conteneurs de déchets de verre et de métal | Daniels soins de santé | DD479OL | Outil |
| Boucles de récolte | MiTeGen | Divers | Outil |
| La récolte microscope | Nikon | SMZ1500 | Outil |
| Cahier de laboratoire | Divers | NA | Outil |
| Poussoir magnétiquebaguette de chargement bouton échantillon | Hampton Research / dimensions moléculaires | HR4-729/MD7-411 | Outil |
| Puck originale (pour une utilisation avec la SLA de type robots uniquement) | Systèmes de positionnement en cristal | CP-111-035 | Outil |
| Dispositifs de pipetage | Gilson | Divers | Outil |
| Solutions précipitants | Divers | Divers | Réactif |
| Puck Bent Cryo-Tong | Systèmes de positionnement en cristal | CP-111-030 | Outil |
| Cane Puck Livraison Mise à l'écart (SLA originales de style) avec poignée crochet et tige de verrouillage | Systèmes de positionnement en cristal | CP-111-029 | Outil |
| L'eau purifiée | Millipore | Réactif | |
| Lunettes de sécurité | Divers | NA | Outil |
| Bases Pin exemples - magnétique (sans cuivre) | Systèmes de positionnement en cristal | CP-111-015 | Outil |
| Livraison Dewar | Taylor-Wharton | CX100 | Outil |
| Tissus | NA | NA | Jetable |
| Carbure de tungstène coupe-verre (Pointe à tracer carbure) | Outils Silverline (Yeovil, Royaume-Uni) | 633657 | Outil |
Références
- Caffrey, M. Crystallizing membrane proteins for structure determination: use of lipidic mesophases. Annu. Rev. Biophys. 38, 29-51 (2009).
- Caffrey, M., Li, D., Dukkipati, A. Membrane protein structure determination using crystallography and lipidic mesophases - recent advances and successes. Biochemistry. , (2012).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protocols. 4, 706-731 (2009).
- Cherezov, V., Clogston, J., Papiz, M. Z., Caffrey, M. Room to move: crystallizing membrane proteins in swollen lipidic mesophases. J. Mol. Biol. 357, 1605-1618 (2006).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D. 60, 1795-1807 (2004).
- Cherezov, V., Rosenbaum, D. M., Hanson, M. A., Rasmussen, S. G., Thian, F. S., Kobilka, T. S., Choi, H. J., Kuhn, P., Weis, W. I., Kobilka, B. K., Setvens, R. C. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science. 318, 1258-1265 (2007).
- Chien, E. Y., Liu, W., Zhao, Q., Katritch, V., Han, G. W., Hanson, M. A., Shi, L., Newman, A. H., Javitch, J. A., Cherezov, V., Stevens, R. C. Structure of the human dopamine D3 receptor in complex with a D2/D3 selective antagonist. Science. 330, 1091-1095 (2010).
- Granier, S., Manglik, A., Kruse, A. C., Kobilka, T. S., Thian, F. S., Weis, W. I., Kobilka, B. K. Structure of the delta-opioid receptor bound to naltrindole. Nature. 485, 400-404 (2012).
- Haga, K., Kruse, A. C., Asada, H., Yurugi-Kobayashi, T., Shiroishi, M., Zhang, C., Weis, W. I., Okada, T., Kobilka, B. K., Haga, T., Kobayashi, T. Structure of the human M2 muscarinic acetylcholine receptor bound to an antagonist. Nature. 482, 547-551 (2012).
- Hanson, M. A., Roth, B., Jo, E., Griffith, M. T., Scott, F. L., Reinhart, G., Desale, H., Clemons, B., Cahalan, S. M., Schuerer, S. C. Crystal structure of a lipid G protein-coupled receptor. Science. 335, 851-855 (2012).
- Jaakola, V. P., Griffith, M. T., Hanson, M. A., Cherezov, V., Chien, E. Y., Lane, J. R., Ijzerman, A. P., Stevens, R. C. The 2.6 angstrom crystal structure of a human A2A adenosine receptor bound to an antagonist. Science. 322, 1211-1217 (2008).
- Kruse, A. C., Hu, J., Pan, A. C., Arlow, D. H., Rosenbaum, D. M., Rosemond, E., Green, H. F., Liu, T., Chae, P. S., Dror, R. O. Structure and dynamics of the M3 muscarinic acetylcholine receptor. Nature. 482, 552-556 (2012).
- Manglik, A., Kruse, A. C., Kobilka, T. S., Thian, F. S., Mathiesen, J. M., Sunahara, R. K., Pardo, L., Weis, W. I., Kobilka, B. K., Granier, S. Crystal structure of the micro-opioid receptor bound to a morphinan antagonist. Nature. 485, 321-326 (2012).
- Rasmussen, S. G., Choi, H. J., Fung, J. J., Pardon, E., Casarosa, P., Chae, P. S., Devree, B. T., Rosenbaum, D. M., Thian, F. S., Kobilka, T. S., Schnapp, A., Konetzki, I., Sunahara, R. K., Gellman, S. H., Pautsch, A., Steyaert, J., Weis, W. I., Kobilka, B. K. Structure of a nanobody-stabilized active state of the beta(2) adrenoceptor. Nature. 469, 175-180 (2011).
- Rasmussen, S. G. F., Devree, B. T., Zou, Y., Kruse, A. C., Chung, K. Y., Kobilka, T. S., Thian, F. S., Chae, P. S., Pardon, E., Calinski, D. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Rosenbaum, D. M., Cherezov, V., Hanson, M. A., Rasmussen, S. G., Thian, F. S., Kobilka, T. S., Choi, H. J., Yao, X. J., Weis, W. I., Stevens, R. C. GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function. Science. 318, 1266-1273 (2007).
- Rosenbaum, D. M., Zhang, C., Lyons, J. A., Holl, R., Aragao, D., Arlow, D. H., Rasmussen, S. G., Choi, H. J., Devree, B. T. Structure and function of an irreversible agonist-beta(2) adrenoceptor complex. Nature. 469, 236-240 (2011).
- Shimamura, T., Shiroishi, M., Weyand, S., Tsujimoto, H., Winter, G., Katritch, V., Abagyan, R., Cherezov, V., Liu, W., Han, G. W., Kobayashi, T., Setvens, R. C., Iwata, S. Structure of the human histamine H1 receptor complex with doxepin. Nature. 475, 65-70 (2011).
- Thompson, A. A., Liu, W., Chun, E., Katritch, V., We, H., Vardy, E., Huang, X. P., Trapella, C., Guerrini, R., Calo, G., Roth, B. L., Cherezov, V., Stevens, R. C. Structure of the nociceptin/orphanin FQ receptor in complex with a peptide mimetic. Nature. 485, 395-399 (2012).
- Wu, B., Chien, E. Y., Mol, C. D., Fenalti, G., Liu, W., Katritch, V., Abagyan, R., Brooun, A., Wells, P., Bi, F. C., Hamel, D. J., Kuhn, P., Handel, T. M., Cherezov, V., Stevens, R. C. Structures of the CXCR4 Chemokine GPCR with Small-Molecule and Cyclic Peptide Antagonists. Science. 330, 1066-1071 (2010).
- Wu, H., Wacker, D., Mileni, M., Katritch, V., Han, G. W., Vardy, E., Liu, W., Thompson, A. A., Huang, X. P., Carroll, F. I. Structure of the human kappa-opioid receptor in complex with JDTic. Nature. 485, 327-332 (2012).
- Cherezov, V., Abola, E., Stevens, R. C. Recent progress in the structure determination of GPCRs, a membrane protein family with high potential as pharmaceutical targets. Methods Mol. Biol. 654, 141-168 (2010).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. J. Vis. Exp. , (2011).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Cryst. 36, 1372-1377 (2003).
- Cherezov, V., Caffrey, M. Picolitre-scale crystallization of membrane proteins. J. Appl. Cryst. 39, 604-606 (2006).
- Wöhri, A. B., Johansson, L. C., Wadsten-Hindrichsen, P., Wahlgren, W. Y., Fischer, G., Horsefield, R., Katona, G., Nyblom, M., Oberg, F. A Lipidic-Sponge Phase Screen for Membrane Protein Crystallization. Structure. 16, 1003-1009 (2008).
- Cherezov, V. Rastering strategy for screening and centring of microcrystal samples of human membrane proteins with a sub-10 microm size X-ray synchrotron. 6, 587-597 (2009).
- Caffrey, M. A lipid's eye view of membrane protein crystallization in mesophases. Curr. Opin. Struct. Biol. 10, 486-497 (2000).
- Briggs, J., Chung, H., Caffrey, M. The temperature-composition phase diagram and mesophase structure characterization of the monoolein/water system. J. Phys. Ii. 6, 723-751 (1996).
- Qiu, H., Caffrey, M. The phase diagram of the monoolein/water system: metastability and equilibrium aspects. Biomaterials. 21, 223-234 (2000).
- Misquitta, Y., Cherezov, V., Havas, F., Patterson, S., Mohan, J. M., Wells, A. J., Hart, D. J., Caffrey, M. Rational design of lipid for membrane protein crystallization. J. Struct. Biol. 148, 169-175 (2004).
- Caffrey, M., Porter, C. Crystallizing Membrane Proteins for Structure Determination using Lipidic Mesophases. J. Vis. Exp. , e1712 (2010).
- Li, D., Boland, C., Walsh, K., Caffrey, M. Use of a robot for high-throughput crystallization of membrane proteins in lipidic mesophase. J. Vis. Exp. , e4000 (2012).
- Lyons, J. A., Aragao, D., Slattery, O., Pisliakov, A. V., Soulimane, T., Caffrey, M. Structure insights into electron transfer in caa(3)-type cytochrome oxidase. Nature. 10, (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon