Method Article
Isolement et culture des fibres musculaires individuelles et de leurs cellules satellites du muscle squelettique adulte
Dans cet article
Résumé
Isolement et culture des fibres musculaires est l'étalon-or In vitro Système d'étudier la transition des cellules satellites par le repos, l'activation et la différenciation. Surtout, le système de fibres musculaires seule culture préserve l'association cellule myofibres / tige, qui est une composante essentielle de la niche de cellules souches musculaires.
Résumé
La régénération musculaire chez l'adulte est effectué par des cellules souches résidentes appelées cellules satellites. Les cellules satellites sont définis par leur position entre la lame basale et le sarcolemme de chaque myofibrille. Les connaissances actuelles sur leur comportement repose en grande partie sur l'utilisation du protocole d'isolement fibre musculaire unique. En 1985, Bischoff décrit un protocole pour isoler simples fibres en direct de la Brevis fléchisseur des orteils (FDB) de rats adultes dans le but de créer un système in vitro dans lequel l'association physique entre les fibres musculaires et de ses cellules souches sont conservées 1. En 1995, le protocole Rosenblattmodified Bischoff telles que les fibres musculaires sont pris séparément et traités séparément après digestion par la collagénase au lieu d'être isolé par 2 sédimentation par gravité, 3. Le Rosenblatt ou Bischoff protocole a depuis été adapté à différents muscles, l'âge ou les conditions 3-6. La technique myofibres isolation simple est un élément indispensableoutil en raison de ses avantages uniques. Tout d'abord, dans le seul protocole fibre musculaire, les cellules satellites sont maintenus sous la lame basale. Il s'agit d'une caractéristique unique du protocole que d'autres techniques telles que le tri cellulaire activé par fluorescence nécessitent chimiques et des tissus dissociation mécanique 7. Bien que le système de culture myofibres peut pas se substituer à des études in vivo, elle offre une excellente plate-forme pour aborder certaines propriétés biologiques des cellules souches musculaires. Myofibres simples peuvent être cultivées dans des conditions de placage standard ou dans des conditions variables. Les cellules satellites sur fibres musculaires flottants sont soumis à pratiquement aucune influence autre que l'environnement myofibrille. Rigidité substrat et le revêtement ont été montré pour influer sur la capacité des cellules satellites des muscles à se régénérer 8, 9 afin d'être en mesure de contrôler chacun de ces facteurs permet indépendamment discrimination entre les créneaux dépendantes et indépendantes de réponses. Différentes concentrations de sérum ontégalement été montré pour avoir un effet sur la transition de repos à l'activation. Afin de préserver l'état de quiescence des cellules satellites ses associés, les fibres doivent être conservés dans un milieu sérique bas 1-3. Ceci est particulièrement utile lors de l'étude des gènes impliqués dans l'état de quiescence. En milieu riche sérum, les cellules satellites activer rapidement, proliférer, migrer et de se différencier, imitant ainsi le processus de régénération in vivo 1-3. Le système peut être utilisé pour effectuer une variété de tests tels que le test d'inhibiteurs chimiques; l'expression ectopique de gènes par le virus de la livraison; oligonucléotide fondée sur les gènes knock-down ou imagerie en temps réel. Cet article décrit le protocole vidéo actuellement utilisée dans notre laboratoire pour isoler les fibres musculaires simples de l'extenseur commun des orteils (EDL) du muscle de souris adultes (6-8 semaines).
Protocole
Toutes les expériences ont été traitées selon l'Université d'Ottawa de la réglementation des soins aux animaux et de manutention.
Voir le tableau 1 pour une vue d'ensemble du protocole.
1. Avant de commencer l'isolement
- Préparer les solutions suivantes:
Type de collagénase 0,2% I dans du DMEM (Dulbecco modifié Eagle moyen; taux élevé de glucose, L-glutamine avec 110 mg / ml de pyruvate de sodium). Pendant deux muscles EDL préparer 2 ml de Collagenease 0,2% dans du DMEM. Filtrer la solution à travers filtre de 0,22 um. 10 min avant l'isolement, préchauffer à 37 ° C dans un bain d'eau. Aliquotes supplémentaires de la collagénase non dilué peut être congelé à -20 ° C pour une utilisation ultérieure.
Remarque: l'utilisation du DMEM avec du pyruvate de sodium pendant toute la procédure. Fibres ne survivent pas en sodium pyruvate du milieu exempt.- Médias à laver (utiliser pour effectuer tous les lavages). Supplément DMEM avec 1% de pénicilline / streptomycine. Filtre à 00,22 um filtre avant de l'utiliser.
- Milieux de culture myofibrille. Supplément DMEM avec 20% de FBS, extrait d'embryon de poulet 1% et 1% de pénicilline / streptomycine. Filtrer à travers filtre de 0,22 um avant utilisation.
- Matrigel plats revêtus. Pour les fibres de la culture pour la période de temps prolongée, nous vous recommandons d'utiliser comme substrat Matrigel revêtement. Pour préparer des plats revêtus de Matrigel, décongeler une aliquote de Matrigel à 4 ° C pendant une nuit. Le lendemain, diluer Matrigel 1:10 dans du DMEM. Gardez Matrigel à 4 ° C en tout temps et éviter les changements brusques de température car cela va créer des cristaux microscopiques dans la solution de Matrigel résultant de revêtement irrégulier. Placez les plats à revêtir sur glace. Manteau de plats avec un volume juste assez pour couvrir la surface. Laissez-le reposer pendant 1 min. Supprimer complètement le Matrigel restes. Laissez la vaisselle sécher à 37 ° C pendant au moins 3 heures avant de l'utiliser ou de la nuit.
Remarque: aliquotes de Matrigel diluée peut être réutilisée plusieurs fois à des fins de revêtement si elle est conservée à 4 et deg; C. - Enfin, n'oubliez pas de nettoyer la station de microscope et des outils de dissection avec de l'éthanol à 70%.
- Pendant deux isolements EDL (une souris) préparer cinq boîtes de Pétri en plastique (60 * 15mm) comme suit:
- Quatre plats pour l'isolement (1 pour le muscle de dissociation, 3 pour les lavages en série). Tous les plats doivent être enduites de sérum de cheval (HS) pour éviter de se fixer aux fibres musculaires en plastique. Pour manteau, pipette 3 ml de sérum de cheval dans chaque boîte, tourbillon pour permettre même revêtement, enlever le sérum de cheval et laissez-le sécher le plat pendant au moins 30 min. Ajouter 4 ml de DMEM à chaque plat. Garder la vaisselle à 37 ° C dans un 5% de CO 2 incubateur avant de l'utiliser.
Note: le sérum de cheval peut être réutilisée plusieurs fois, si maintenue stérile. En variante, une solution de HS 10% dans du DMEM peut être utilisée pour enrober des plats. Utilisez de la vaisselle SH enduits à travers l'ensemble du protocole et de la culture des fibres musculaires lorsque des conditions variables.- Un plat sera utilisé pour fibres musculaires après l'isolement de la culture. Alttailles de paraboles ernative ou formats peuvent être utilisés pour la culture finale des fibres musculaires en fonction des applications en aval. Cependant, nous ne suggérons pas tailles de paraboles de plus de 60 * 15mm. Myofibres peut être maintenu en suspension pendant plus de 96 heures avant la contraction se produit hyper. Pour les temps de culture plus longues, nous recommandons l'utilisation de Matrigel plats revêtus ou plaques.
- Pour une isolation en fibre (2 EDL), préparer deux stériles Pipettes Pasteur: une pipette de grand calibre pour la manipulation des muscles et une pipette de petit calibre pour la manipulation myofibrille. Utiliser un stylet de diamant pour couper chaque pipette en verre à la longueur souhaitée et polir la chaleur pour lisser les bords de la pipette. À l'aide de la flamme, la courbe de la pointe de la pipette de petit calibre. Cela aidera à la manipulation des fibres simples. Flamme à stériliser. Enrober chaque pipette avec HS avant utilisation.
2. Dissection des muscles et la digestion
- Aux fins de ces expériences, âgées de 8 semaines SV129, Pax7 creer CKLR; Rosa26TdTomato (Pax7Cre-TdTomato) et Myf5-Cre; Rosa26YFP ont été utilisés.
- Vaporiser membres postérieurs avec de l'éthanol à 70%. Pin de l'animal (le visage) pour une plaque de support pour avoir une meilleure idée de la patte arrière au cours de la procédure.
- À l'aide de ciseaux, couper à travers toute la longueur de la branche et exposer le muscle sous-jacent. Retirez la peau ainsi que les cheveux ou la fourrure (figure 1A).
- Avec une paire de ciseaux fins, couper à travers l'aponévrose mince sans endommager les muscles sous-jacents. Visuellement localiser l'EDL. L'EDL se trouve dans la loge antérieure de la patte arrière juste en dessous du muscle tibial antérieur (TA) du muscle.
- Avec l'aide de deux pinces, exposer les tendons distaux.
- Couper les tendons distaux (à la fois de la TA et EDL) avec de fortes ciseaux à ressort Cohann-Vannas.
- Avec l'aide d'une pince tenir à la fois l'assistance technique et les muscles EDL par leurs tendons et les muscles tirez délicatement jusqu'à vers l'extrémité proximale. À ce stade, vous devriez être en mesure de voir clairementle muscle EDL juste en dessous du muscle TA. Maintenant, séparez les EDL dans le muscle TA en tirant les deux tendons dans des directions opposées (figure 1B). Évitez d'étirer le muscle EDL lors de cette opération car cela pourrait endommager les fibres musculaires.
- Exposer le tendon EDL. Pour mieux visualiser le tendon proximal il peut être utile à ce stade d'enlever le muscle TA. Il peut également aider à couper un peu de tissu conjonctif autour du genou (figure 1C).
- Couper le tendon proximal et retirez délicatement l'EDL (figure 1D).
- En maintenant le muscle par ses tendons, de le transférer à 2 ml de solution de collagénase préalablement préparé. Incuber à 37 ° C dans un bain d'eau.
Remarque: pour l'isolation en fibre de succès, il est important d'isoler l'EDL à partir de tendon au tendon afin que l'intégrité myofibrille est maintenue. Étapes de 2,3 à 2,9 peut être réalisée sous un microscope à dissection. Alternativement, l'utilisation d'un magnification verre peut également aider à avoir une meilleure vue sur les muscles. - Répétez les étapes 2,3 à 2,9 pour isoler l'EDL seconde. Transfert de l'EDL deuxième dans le même tube. Pour éviter la digestion inégale, l'isolement de l'EDL seconde devrait être terminé au plus 5 minutes après le premier.
Note 1: temps d'incubation peut être nécessaire d'ajuster en fonction de l'activité de la collagénase. D'incubation plus ou moins long peut être nécessaire en fonction de la taille, l'âge et / ou la fonction musculaire (par exemple, les muscles ont besoin de temps fibrotiques plus digestion).
Note 2: Si l'examen par satellite comportement des cellules dans des conditions de quiescence, l'agitation pendant le temps de digestion musculaire peut activer les cellules satellites 10. - Pendant le temps de la digestion, de vérifier régulièrement le muscle pour éviter de digestion. Arrêtez la digestion lorsque les muscles commencent à se détendre et fibres musculaires sont visibles. Pour arrêter la digestion, transférez les deux muscles dans un plat préchauffé Petri avec 4 ml de DMEM (dissociatisur le plat). Utiliser la pipette taille de gros calibre pour effectuer cette opération.
Remarque: éviter de digestion excessive du muscle car cela entraîne inévitablement l'isolement des fibres musculaires contractées hyper.
3. Seule fibre musculaire de dissociation et de la Culture
- Pour libérer myofibrilles, utilisez la pipette en verre de grand diamètre pour rincer le muscle avec un milieu chaud jusqu'à ce que les fibres naturellement commencent à être libéré. Ne pas triturer le muscle car cela entraînera inévitablement des fibres nuisibles. Effectuer cette opération et les étapes suivantes sous un microscope à dissection.
- Continuer jusqu'à ce que la libération myofibres le nombre désiré est atteint. Si la capsule est tenue à la température ambiante pendant plus de 10 min permettre un min 5 (minimum) d'incubation à 37 ° C, 5% CO 2 à rééquilibrer le milieu.
Remarque: si le fluide atteint des températures inférieures physiologique (37 ° C) pendant une période prolongée fibres musculaires mourront. - En utilisant la taille de petit calibre pipette, transfer vivent fibres musculaires simples à un nouveau plat préchauffé (premier des trois lavages consécutifs). Tenez chaque myofibrille individuellement au lieu de transférer en vrac des fibres musculaires à la fois. Si nécessaire, incuber à 37 ° C, 5% CO 2 pendant 10-15 min à rééquilibrer le milieu.
- Répétez l'étape 3.3 pour 2 ou plusieurs fois jusqu'à ce que toutes les fibres musculaires mortes et les débris sont enlevés. Nous recommandons au moins trois lavages consécutifs pour bon nettoyage.
Remarque: myofibres morts apparaissent le plus court et hyper contracté sous la lumière du microscope. - Incuber fibres musculaires simples à 37 ° C, 5% CO 2 dans le plat dernier lavage (DMEM uniquement) pendant au moins une heure avant de passer au milieu de culture. Ceci permet de s'adapter aux fibres musculaires les conditions in vitro en l'absence de sérum. Nous avons constaté que la culture immédiate des fibres musculaires dans un milieu riche sérique augmente rétrécissement de la fibre.
- Après une heure, le transfert fibres musculaires à un nouveau plat préchauffé ou au format de culture appropriéen fonction de la demande en aval. Fibres Culture en milieu sérique élevé pour permettre l'activation des cellules satellites. En variante, différentes concentrations de sérum ou d'extrait d'embryon de poulet peuvent également être utilisés. Changer le milieu tous les deux jours.
4. Applications en aval
- Immunomarquage. Myofibres Live peuvent être fixées et colorées à aucun moment au cours de l'isolement. Immunofluorescence peut être effectuée à la fois sur myofibres flottantes et le substrat attenante. Si la coloration fibres musculaires flottants, utiliser une pipette en verre de petit diamètre pour transférer des fibres musculaires d'une solution à l'autre. Alternativement, il est possible de garder fibres musculaires dans le même puits pendant toute la procédure et ajouter / supprimer des solutions à l'aide d'une pipette en verre. Éviter l'aspiration standard comme cela se traduira par la suppression des fibres musculaires ainsi. En bref, supprimer complètement milieu de culture; myofibres fixes dans du paraformaldéhyde à 4% préchauffé (PFA) pendant 5 min. Largement laver à plusieurs reprises PBS. Incubationmyofibres te de 1% de glycine dans du PBS ou d'autres solutions de trempe classiques pour minimiser la coloration de fond PFA. Si nécessaire, perméabiliser myofibrilles avec 0,1% de Triton X-100 dans du PBS pendant 10 min suivi d'un lavage de 5 min dans du PBS. Incuber fibres dans une solution de blocage (10% de sérum de cheval, 0,1% de Triton X-100 à 1% NaN) pendant 1 heure à la température ambiante ou de préférence une nuit à 4 ° C. D'autres solutions de blocage peuvent être utilisés, en fonction de l'anticorps d'intérêt. Laver une fois dans du PBS pendant 5 min. Incuber avec l'anticorps approprié primaire dilué dans une solution de blocage pendant 1 heure à température ambiante ou une nuit à 4 ° C. Laver fibres 3 fois à 5 min par lavage dans du PBS pour éliminer tout anticorps non lié. Incuber avec l'anticorps secondaire approprié pendant 45 min à 1 h à température ambiante. Laver 3 fois à 5 min par lavage dans du PBS. Contre les noyaux avec 1 mg / ml DAPI. Si la coloration des fibres flottantes, transférer chaque fibre à une lame de verre convenable pour la microscopie. Enlevez l'excès de PBS ou moyen terme. Appliquer de montage medieuh, puis ajouter la lamelle. Procédez de visualiser myofibres sous un microscope à fluorescence. Voir la figure 4 pour immunofluorescence représentant myofibres EDL. Procédures de coloration alternatives utilisant fortes fixateurs sont décrits dans Verma, M. et al. 11 et Wosniak, AC et al. 12.
- Oligonucléotide ou un plasmide transfection transitoire. Myofibres Live peuvent être transfectées avec le siRNA plasmide ou gène spécifique / s d'intérêt. Lors de l'utilisation de siRNA, transfection double est recommandée pour les inactivation génique efficace. Nous vous suggérons de réaliser la transfection première fois après 8 heures de l'isolement. Six heures après la transfection, remplacez-le par du milieu frais. Pour transfection de siRNA, nous vous suggérons de départ en utilisant une concentration finale de 50 nM. Knockdown l'expression des gènes peut être analysé par extraction de l'ARN ou de préférence par immunomarquage.
- L'infection virale. Infection des fibres musculaires vivantes est possible, bien que l'incidence de la cellulela mort est plus élevée qu'avec la transfection oligo et l'efficacité d'infection peut être variable en fonction des conditions de muscle et de l'âge. Par exemple, intactes myofibrilles musculaires adultes sont particulièrement sensibles non à une infection virale due à la présence de la lame basale qui a été montré pour fournir une barrière protectrice contre l'infection hôte 13, 14. Les vecteurs lentiviraux sont préférables aux vecteurs rétroviraux car ils peuvent infecter des cellules quiescentes (non mitotique). En cas d'infection virale, il est conseillé de fibres culture sur un plat recouvert de Matrigel ou une plaque et laisser myofibres s'adapter aux conditions médias pour les 24 premières heures.
- Vivez l'imagerie. Vivez l'imagerie des fibres musculaires est particulièrement fastidieux et nécessite un microscope équipé d'un 37 ° C, 5% CO 2 chambre. Il est utile pour évaluer le comportement des cellules satellites uniques. Les travaux effectués à l'aide de cette technique a été déterminant pour la découverte de l'hétérogénéité des cellules satellites et d'étudier leur comporVior sur les fibres (15 et 16).
Résultats
Ici, nous avons décrit l'isolement des fibres musculaires individuelles du muscle EDL de souris adultes. Myofibres succès rendement dépendent de plusieurs facteurs, tels que l'activité de la collagénase ou affections musculaires ou de l'âge. Plus important encore, l'isolement du muscle du tendon tendon résultats en longues fibres musculaires intactes de muscle EDL. Figure 1 montre étape par étape la représentation graphique du "tendon tendon" isolement. Une fois que le muscle est complètement digéré, myofibrilles sont libérés en appliquant une légère pression sur le muscle. Figure 2A montre une image représentative d'une expérience d'isolement fibres musculaires après le premier lavage. A ce stade, la culture contient un mélange de faisceaux de fibres musculaires simples qui apparaissent comme de longues et brillantes structures tubulaires, hyper contracté fibres musculaires qui sont sombres et courts et les débris du processus de digestion. À la fin d'au moins trois lavages consécutifs, seuls célibataires myofibres vivants doit rester dans le dish pour la culture ou l'analyse en aval (figure 2B). Figure 2C montre une longue fibre active par rapport à une fibre hyper contracté (C '). Au moment de l'isolement, les cellules satellites apparaissent comme des protubérances minuscules sur la surface myofibres (figure 3A). Si maintenues dans un milieu riche en sérum, les cellules satellites activer, proliférer, migrer et finalement fusionner en myotubes (B). Après 15 jours de culture, les myotubes exprimer la Myf5 journaliste (C) YFP ce qui suggère que la régénération musculaire chez l'adulte est effectuée par des cellules qui à un moment donné au cours de leur développement avaient exprimé le facteur déterminant myogénique Myf5. Toutes les cellules satellites expriment le facteur de transcription paired box Pax7 17. La lignée de souris journaliste Pax7Cre-TdTomato peut être utilisé pour tracer les cellules satellites par l'intermédiaire de l'expression de la TdTomato signal fluorescent (figures 3D et E). Figure 4 montre une immu représentantnofluorescence de double Pax7 + / cellules satellites Myod. Classiquement deux Pax7 + / + Myod cellules satellites sont considérés prolifération des progéniteurs musculaires engagés qui soit complètent le programme de différenciation par le bas tout en maintenant la régulation Pax7 expression Myod ou de retour à la quiétude par régulation négative Myod et le maintien expression de Pax7 18
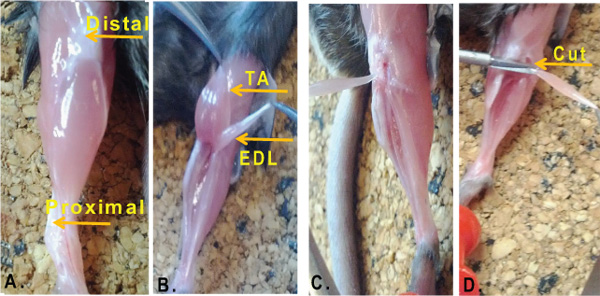
Figure 1. Isolement muscle EDL de la souris membres postérieurs. Un des membres postérieurs. D'une souris adulte âgé 8 semaines. Les flèches indiquent la partie distale (genou) et le tendon proximal (pied) tendon. B. Position anatomique de la tibial antérieur (TA) et le muscle extenseur commun des orteils (EDL) du muscle. C. En maintenant l'EDL à travers le tendon proximal, le muscle est tiré vers le genou pour exposer le tendon distal. D. Le tendon distal estcouper et l'EDL est libéré.
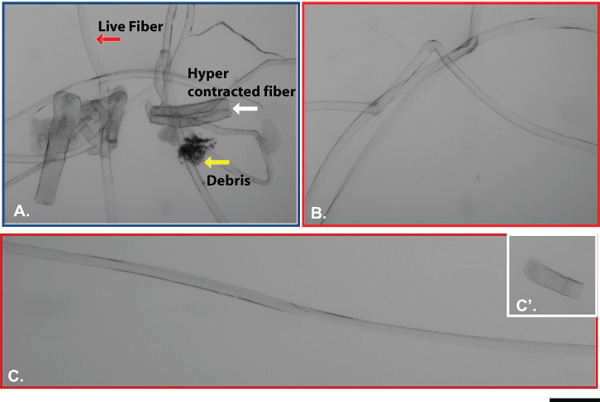
Figure 2. Les résultats représentatifs d'une expérience d'isolement fibre musculaire unique. Une image. Fond clair d'une expérience d'isolement fibres musculaires à la première étape de lavage. La flèche rouge indique myofibres en direct, flèche blanche indique hyper fibres musculaires contractées et flèche jaune indique les cellules, fibres musculaires ou des débris ECM. B. Après lavages successifs dans du DMEM, seuls restent vivants myofibres. C et C '. L'image représente une longue intact direct myofibrille (C) et une hyper court contracté myofibrille (C '). Bar 10 um. Les photos ont été prises avec un microscope Zeiss Axio Observer Z1 équipé AxioCam RH.
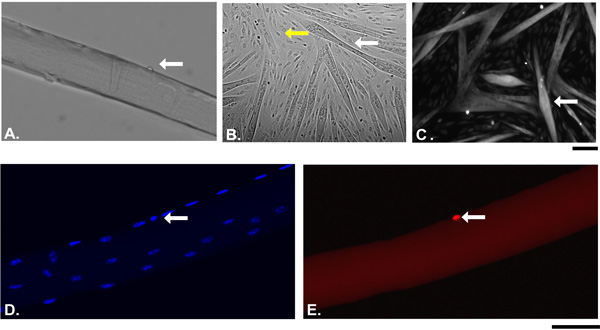
Figur e 3. Les résultats représentatifs d'une expérience de culture myofibres unique. Une image. Fond clair d'une seule fibre musculaire en direct avec sa cellule satellite associé (flèche) juste après l'isolement (temps 0). B. Myofibres simples ont été étalées sur Matrigel et cultivées dans un milieu riche en sérum pendant 15 jours. Flèche blanche indique myotubes différenciés par rapport aux cellules simples (flèche jaune) C. Myofibres individuelle à partir d'une Myf5Cre; RosaYFP souris ont été cultivées comme dans B. La flèche indique Myf5 myotubes dérivés. D et E. Myofibres individuelle à partir Pax7Cre; TdTomato ont été isolés et fixé tout de suite après. Les flèches indiquent les cellules positives Pax7 satellite repos (E, rouge). Les noyaux ont été contre-colorées avec du DAPI (D). Bar: 50 pm. Les photos ont été prises avec un microscope Zeiss Axio Observer Z1 équipé AxioCam RH.
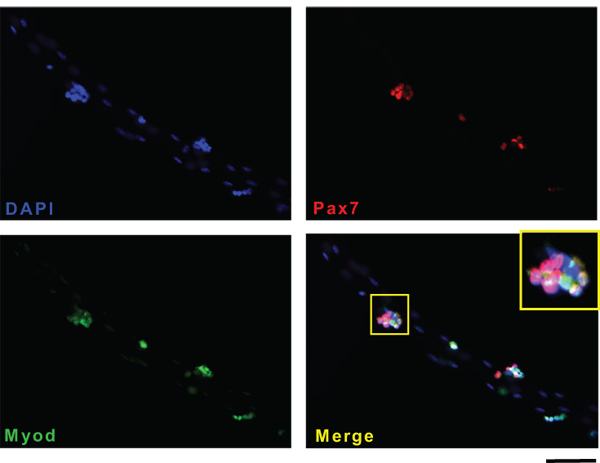
Figure 4. Exemple de marquage en immunofluorescence sur des cellules satellites fibres musculaires. Myofibres uniques ont été isolées et cultivées pendant 72 heures dans des conditions variables. Les cellules satellites sur myofibrilles ont été colorées pour le satellite Pax7 cellule marqueur spécifique (B, rouge) et le Myod facteur myogénique la réglementation (C, vert). Les noyaux ont été contre-colorées avec du DAPI (A). Bars: 50 pm. Les photos ont été prises avec un microscope Zeiss Axio Observer Z1 équipé AxioCam RH.
| Dissection des muscles (5 min chaque muscle) |
|
| Digestion musculaire (30-45 min) |
|
| Isolation en fibre |
|
| Culture de fibres (jusqu'à 3-4 semaines) |
|
Tableau 1. Vue d'ensemble du protocole d'isolement myofibrille. L'protocole d'isolement myofibrille est composée de 4 grandes étapes. Pour chaque étape, le temps approximatif et les principaux points critiques sont discutées. Pour une discussion détaillée de chaque étape, reportez-vous au texte du protocole.
Discussion
L'isolement et la culture des fibres musculaires simples de muscles intacts fournit un excellent modèle in vitro pour étudier le processus de régénération musculaire. Une caractéristique unique de ce système est la préservation des cellules satellites dans leur environnement physiologique sous la lame basale. Plus important encore, cette technique peut être utilisée pour étudier le comportement des cellules souches musculaires à la fois repos et les états activés. Au cours des 20 dernières années, le système de culture myofibres a fourni des indications utiles sur la biologie de la population des cellules satellites par rapport aux deux déterminants intrinsèques et extrinsèques. Par myofibres individuels culture, l'hétérogénéité des cellules satellites par rapport aux fibres musculaires de type musculaire ou potentiel de régénération a été adressée 15. Elaborer des études utilisant l'imagerie en direct de simples fibres cultivées ont permis de gagner des informations sur la migration cellulaire par satellite modèle 16. L'acquisition de données quantitatives est unlso possible. Bien que beaucoup de temps, il fournit des informations importantes sur la distribution et la survenance d'événements spécifiques (cellules souches rapport de division asymétrique, la prolifération et la différenciation, etc.) Ainsi que les applications décrites précédemment, les protéines ou l'extraction d'ARN à partir de fibres individuelles est également possible, bien que l'isolement de la population pure de cellules satellites par FACS ou par d'autres moyens peuvent fournir une meilleure plate-forme pour étudier les changements d'expression des protéines ou des gènes au niveau moléculaire. Dans notre expérience, l'étape la plus critique pour l'isolation en fibre de succès est le "tendon tendon" isolement (étapes 2,5 à 2,9 dans le texte du protocole). Cela garantit que, après la digestion du muscle, les fibres sont libérées de l'EDL avec des dommages minimaux ou pas ce qui accroît leurs performances dans les étapes suivantes.
Déclarations de divulgation
Aucun conflit d'intérêts.
Remerciements
Nous tenons à remercier Sarah Dick pour fournir des lectures critiques et commentaires. MAR titulaire de la Chaire de recherche du Canada en génétique moléculaire et est un chercheur-boursier international du Howard Hughes Medical Institute. Ce travail a été soutenu par des subventions à MAR de la National Institutes of Health, le Howard Hughes Medical Institute, les Instituts de recherche en santé, la Muscular Dystrophy Association et le Programme canadien Chaire de recherche.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif / Matériel | |||
| Collagénase | Sigma-Aldrich | C0130-1g | Préparer frais tout temps pour des résultats optimaux. Aliquotes supplémentaires de la collagénase non dilué peut être conservé à -20 ° C. |
| DMEM + glycémie élevée NaPyr | Invitrogen | 11995073 | Ajout de Pen / Strep est nécessaire de minimiser les contaminations aériennes |
| Caractérisé sérum de veau fœtal | Hyclone | SH30396.03 | Lot # KUJ35152 |
| Sérum de cheval | Hyclone | SH300.74.03 | Lot # AVJ82494 |
| Extrait d'embryon de poulet | Accurate Chemical | CE-650-T, lot B7035010 | Évitez de congélation-décongélation cycles. |
| Matrigel | BD | Boutique aliquotes à -20 ° C. Évitez de congélation-décongélation cycles. Stocker des aliquotes diluées à 4 ° C. | |
| Équipement | |||
| Cohann-Vannas ciseaux printemps 6mm Lames-Straight-Sharp | Outils Fine Science | 15000-02 | |
| Extra-Mince Iris Ciseaux-10.5cm | Outils Fine Science | 14088-10 | |
| Moria-Iris Pince courbé | Outils Fine Science | 11373-12 | |
| Pipettes Pasteur | VWR | 14672-380 | 14672-200 |
| Diamant Pen | VWR | 52865-005 | |
| 60 * 15mm boîte de Pétri | VWR | 25384-092 | |
| Filtre de 0,22 um Acrodisc | VWR | CA28-145-477 | |
| Microscope à dissection StemiV6 | Zeiss | Une source lumineuse supplémentaire peut être nécessaire d'avoir une vue de mieux se concentrer |
Références
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Dev. Biol. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cell Dev. Biol. Anim. 31 (10), 773-779 (1995).
- Anderson, J. E., Wozniak, A. C., Misunoya, W. Single muscle fiber isolation and culture for cellular molecular, pharmacological, and evolutionary studies. Methods Mol. Biol. 798, 85-102 (2012).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and culture of skeletal muscle myofibers as a means to analyze satellite cells. Methods Mol. Biol. 290, 281-304 (2005).
- White, R. B., Biérinx, A. S., Gnocchi, V. F., Zammit, P. S. Dynamics of muscle fibre growth during postnatal mouse development. BMC Developmental Biology. 10 (21), 1-11 (2010).
- Siegel, A. L., Kuhlmann, P. K., Cornelison, D. D. Muscle satellite cell proliferation and association: new insights from myofiber time-lapse imaging. Skeletal Muscle. 2 (1), 1-7 (2011).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods Mol. Biol. 798, 53-64 (2012).
- Engler, A. D., Griffin, M. A., Sen, S., Bonnemann, C. G., Sweeney, H. L., Discher, D. E. Myotubes differentiate optimally on substrates with tissue-like stiffness: pathological implications for soft or stiff microenvironments. J. Cell. Biol. 166 (4), 877-887 (2004).
- Boonen, K. J., Post, M. J. The muscle stem cell niche: regulation of satellite cells during regeneration. Tissue Eng. Part B Rev. 14 (4), 419-431 (2008).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem. Cell Biol. 83 (5), 674-676 (2005).
- Verma, M., Asukura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. J. Histochem. Cytochem. 59 (1), 60-67 (2001).
- Wosniak, A. C., Pilipowics, O., et al. C-Met expression and mechanical activation of satellite cells on cultured muscle fibers. J. Histochem. Cytochem. 51 (11), 1437-1445 (2003).
- Huard, J., Feero, W. G., Watkin, S. C., Hoffman, E. P., Rosenblatt, J. D., Glorioso, J. C. The basal lamina is a physical barrier to herpes simplex virus-mediated gene delivery to mature muscle fibers. J. Virol. 70 (11), 8117-8123 (1996).
- Feero, W. G., Rosenblatt, J. D., et al. Viral gene delivery to skeletal muscle: insights on maturation-dependent loss of fiber infectivity for adenovirus and herpes simplex type 1 viral vectors. Hum. Gene Ther. 8 (4), 371-380 (1997).
- Kuang, S., Kuroda, K., grand, F. L. e., Rudnicki, M. A. Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell. 129 (5), 999-1010 (2007).
- Siegel, A. L., Atchison, K., Fisher, K. E., Davis, G. E., Cornelison, D. D. 3D timelapse analysis of muscle satellite cell motility. Stem Cells. 27 (10), 2527-2538 (2009).
- Seale, P., Sabourin, L. A., Girgis-Gabardo, A., Mansouri, A., Gruss, P., Rudnicki, M. A. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Zammit, P., Golding, J. P., Nagata, Y., Hudon, V., Partridge, T. A., Beauchamp, J. R. Muscle satellite cells adopt divergent fates: a mechanism for self-renewal. J. Cell Biol. 166 (3), 347-357 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon