Method Article
Le système olfactif comme un modèle pour étudier des modèles axonale croissance et la morphologie
Dans cet article
Résumé
We describe a protocol for in vivo labeling of olfactory sensory neurons by electroporation and subsequent confocal laser-scanning or multiphoton microscopy to visualize neuronal morphology and its development over time.
Résumé
The olfactory system has the unusual capacity to generate new neurons throughout the lifetime of an organism. Olfactory stem cells in the basal portion of the olfactory epithelium continuously give rise to new sensory neurons that extend their axons into the olfactory bulb, where they face the challenge to integrate into existing circuitry. Because of this particular feature, the olfactory system represents a unique opportunity to monitor axonal wiring and guidance, and to investigate synapse formation. Here we describe a procedure for in vivo labeling of sensory neurons and subsequent visualization of axons in the olfactory system of larvae of the amphibian Xenopus laevis. To stain sensory neurons in the olfactory organ we adopt the electroporation technique. In vivo electroporation is an established technique for delivering fluorophore-coupled dextrans or other macromolecules into living cells. Stained sensory neurons and their axonal processes can then be monitored in the living animal either using confocal laser-scanning or multiphoton microscopy. By reducing the number of labeled cells to few or single cells per animal, single axons can be tracked into the olfactory bulb and their morphological changes can be monitored over weeks by conducting series of in vivo time lapse imaging experiments. While the described protocol exemplifies the labeling and monitoring of olfactory sensory neurons, it can also be adopted to other cell types within the olfactory and other systems.
Introduction
The lifelong turnover of sensory neurons distinguishes the olfactory system from many other sensory and neuronal systems1,2. Newly formed sensory neurons are continuously generated in the basal portion of the olfactory epithelium3 and extend their axons into the olfactory bulb, the first relay station of the olfactory system4. However, the cellular and molecular mechanisms controlling the formation and maintenance of the olfactory map are far from being fully understood4,5.
Here, we describe a protocol for labeling sensory neurons of the olfactory organ of larval X. laevis by in vivo electroporation of fluorophore-coupled dextrans. The presented protocol allows visualization of axonal morphology and connectivity, track axonal development over time and study mechanisms regulating axonal wiring and guidance.
Electroporation is a well established method to introduce charged macromolecules, like dextran-coupled dyes and DNA, into cells6,7. The cell membrane is permeabilized by application of short voltage pulses and the molecules are electrophoretically delivered into the cytosol8. Spatially restricted electroporation using a micropipette permits selective labeling of cells including neurons and has been applied in various neuronal systems including the visual system of X. laevis9,10.
We show how the electroporated animals can be used to study axonal growth patterns and morphology in living animals using confocal laser-scanning or multiphoton microscopy. The described procedure allows identifying the coarse topology of axonal projections of sensory neurons of the main and accessory olfactory system11,12. Using in vivo time lapse imaging, it is also suitable to supervise the glomerular connections of single mature sensory neurons, and to monitor the evolution of the axonal projection patterns of immature sensory neurons12. The described protocol can be applied to investigate the structure and formation of olfactory circuits in the intact animal and can be adapted to other cell types within the olfactory and other neuronal systems.
Protocole
REMARQUE: la manipulation des animaux et des expériences ont été réalisées comme approuvé par le Comité d'éthique de l'Université de Göttingen pour en expérimentation animale.
1. Préparation d'instruments et pipette Fabrication
- Assurez-vous que la configuration de l'électroporation consiste en un microscope stéréoscopique avec une grande distance de travail et est équipé d'éclairage et filtre ensembles fluorescents pour le colorant utilisé.
- Pour électroporation utiliser un électroporateur cellulaire unique dédié ou un générateur d'impulsions carré générique attaché à un oscilloscope. Connectez les sorties électroporateur à un porte-pipette et une électrode de bain. Connecter la borne positive du générateur d'impulsions à la porte de la micropipette et la borne négative à l'électrode de bain. Assurer à la fois le porte-pipette et l'électrode de bain contiennent des fils d'argent recouvertes d'une fine couche de chlorure d'argent.
- Monter le porte-pipette sur un micromanipulateur pour permettre un positionnement exact.
- Fabriquer micropipettes d'électroporation de capillaires en verre borosilicate avec filament interne.
- Utiliser un étirage de micropipettes horizontal et appliquer un protocole modifié pour la fabrication de pipettes pour des expériences de patch-clamp, comme décrit par Bestman et al., 13.
- Adapter les paramètres pour produire une tige plus longue et une ouverture moindre résultant en une résistance de pipette supérieur d'environ 15-20 MOhm pour l'électroporation d'une cellule unique. La résistance à la pipette doit être inférieur, par exemple, 3-4 Mohm, pour le marquage de groupes de cellules.
- Mesure de la résistance à la pipette, soit directement avec un électroporateur seule cellule dédiée ou à calculer la loi d'Ohm, après la mesure de flux de courant avec un oscilloscope après l'application d'une impulsion de tension définie.
2. Préparation de l'électroporation Solution
- Dissoudre dextran couplé à un fluorophore grenouille sonnerie (98 mM de NaCl, 2 mM de KCl, 1 mM de CaCl2, 2 mM de MgC2 l, glucose 5 mM, 5 mM de pyruvate de Na, 10 mM d'HEPES, pH ajusté à 7,8, l'osmolarité est de 230 mOsmol / l) à une concentration de 3 mM. Les cellules ne peuvent pas être étiquetés avec tant d'éclat si les concentrations de colorant plus faibles sont utilisées. Préparez un grand volume de solution stock et le diviser en petites portions. Les congeler pour stockage (stable pendant des mois).
NOTE: Les dextrans sont disponibles dans différentes tailles et une variété d'émission / spectres d'excitation (par exemple, Alexa 488-dextran 10 kD, Alexa 546-dextran 10 kD, Alexa 568-dextran 10 kD, Alexa 594-dextran 10 kD, TMR-dextran 3 kD.). - Remblayer la micropipette avec un embout de pipette allongé avec un petit volume de solution de dextrane (1-5 ul). Effleurer délicatement la micropipette avec le doigt pour enlever les bulles d'air résiduelles de la pointe de la pipette.
- Monter la micropipette dans le porte-pipette. Assurez-vous que le fil d'argent à l'intérieur de la pipette est en contact avec la solution de colorant.
3. Sélection des larves X. laevis </ Em>
- Utilisez larves albinos de X. laevis pour les expériences. Animaux de type sauvage possèdent mélanophores de pigment rempli qui montrent émission d'autofluorescence pendant confocale / imagerie multiphotonique et ne conviennent donc pas pour les expériences décrites.
- Scène têtards premetamorphotic après Nieuwkoop et Faber 14. Sélectionnez têtards de stades 45-53 pour les expériences.
4. L'électroporation de dextrans fluorophore couplé
- Placer un petit morceau de tissu dans une boîte de Pétri et le couvrir avec un petit volume d'eau contenant 0,02% de tricaïne (Ethyl méthanesulfonate 3 benzoate, ajusté à pH 7).
- Anesthésier les têtards dans l'eau contenant 0,02% de tricaïne. Après quelques minutes, les animaux cessent mouvement. Confirmez anesthésie adéquate en touchant têtards. Ils doivent être non recevable.
- Transférer délicatement le têtard de l'anesthésie à la boîte de Pétri en tissu recouvert.
- Assurez-vous que la électr de bainode ferme le circuit d'électroporation. Assurez-vous que l'électrode est en contact avec le tissu humide; un contact direct avec le têtard est pas nécessaire.
- Placez la pointe de micropipette à proximité de l'organe olfactif en utilisant le micromanipulateur.
- Pénétrer la peau qui recouvre l'organe olfactif avec la pointe de la pipette et prudemment avancer la pointe dans la couche située au centre des neurones sensoriels de l'épithélium olfactif principal ou épithélium voméronasal.
- Déclencher des impulsions de tension positives place pour transférer le colorant dans les neurones sensoriels. Appliquer une impulsion de tension unique (p., 25 V, longueur d'impulsion de 25 ms) ou de trains d'impulsions multiples (p., 50 V, longueur d'impulsion de 300 ps, 400 msec de train à 200 Hz).
REMARQUE: Déterminer paramètres optimaux d'impulsions de tension pour l'souhaité étendre l'étiquetage. Réduire la tension d'impulsions en amplitude, la durée et le nombre de répétitions de réduire le nombre de cellules marquées. Appliquer supérieur impulsion de tension amplitude, la durée et le nombre de pulses pour un étiquetage plus répandue. - Visualisez succès extrusion de colorant et l'électroporation par des impulsions déclenchées en utilisant un éclairage fluorescent de la loupe binoculaire. Le colorant se répand rapidement dans le corps de la cellule dendritique et après l'électroporation réussie.
- Répétez les étapes 4.5 à 4.9 pour le deuxième organe olfactif du têtard.
- Transférer le têtard dans un bécher rempli d'eau fraîche pour la récupération. Après ca. 5 min les têtards se réveillent de l'anesthésie et commencent mouvements de natation normales.
- Après 24 h, le colorant électroporation se propage dans les neurones sensoriels et atteint le bulbe olfactif par transport axonal finalement.
5. Les animaux de montage pour la visualisation in vivo des cellules et des processus axonales
- Anesthésier les têtards dans l'eau contenant 0,02% de tricaïne.
- Soigneusement transférer têtards dans une chambre d'imagerie, par exemple, un petit caoutchouc de silicium recouvert boîte de Pétri avec un évidement de têtard taille.
- Coupez un petit rectangle dans une bande de parafilm. Couvrir le têtard avec le parafilm, laissant le télencéphale antérieur exposé à travers la fenêtre de découpe. Fixer le Parafilm avec des aiguilles sur le plat sans blesser le têtard.
- Assurez-vous que le têtard est immergé dans l'eau suffisante contenant 0,02% de tricaïne.
- Montez la chambre de l'imagerie sur la scène d'un microscope multiphotonique verticale ou microscope confocal.
- Acquérir une pile d'images en trois dimensions du bulbe olfactif. Assurez-vous que la procédure de formation d'image est aussi court que possible et ne dépasse pas 10 à 15 min.
- Retour le têtard dans l'eau normale dans un réservoir séparé et éviter l'exposition à la lumière. Après 5 min, le têtard se réveille de l'anesthésie.
- Répétez les étapes 5.1-5.7 après des intervalles de temps spécifiés, par exemple., Tous les jours.
6. Les animaux de montage pour Ex Vivo Visualisation des cellules et des processus axonales
- Alternativement à l'article 5du protocole, utiliser une préparation de cerveau excisée pour visualiser les neurones sensoriels marqués.
- Anesthésier et tuer le têtard par sectionnement du cerveau à la transition à la moelle épinière. Exciser un bloc de tissu contenant les organes olfactifs, les nerfs olfactifs et le télencéphale antérieur.
- Transférer le bloc de tissu à la solution de la sonnerie de grenouille et enlever le tissu conjonctif avec des ciseaux fins pour exposer la face ventrale du cerveau.
- Transférer le bloc de tissu à une chambre de l'imagerie et la fixer avec un cadre en platine cordes avec des fils de nylon.
- Montez la chambre de l'imagerie sur la scène d'un microscope confocal / multiphotonique.
- Acquérir une pile d'images en trois dimensions du bulbe olfactif.
7. Traitement de l'image et de l'évaluation des données
- Optimiser et à des moyens non-locaux de filtrage pour améliorer la qualité d'image et la visualisation des structures neuronales comme décrit par Coupé, P. et al. 15.
Remarque: Les données des expériences d'imagerie dans les couches profondes du tissu de spécimens vivants sont souvent bruyants. - Créer projections d'intensité maximale des piles d'images pour un aperçu.
- Pour time-lapse expériences d'imagerie écran ensembles de données pour identifier sans ambiguïté simples axones des neurones sensoriels.
- Reconstruire la morphologie cellulaire via le traçage assistée par logiciel de processus neuronaux comme décrit par Peng et al. 16.
Résultats
Le protocole décrit peut être appliquée avec succès pour l'électroporation et la visualisation in vivo des processus axonales des neurones sensoriels du système olfactif de X. anesthésié laevis, en utilisant confocale à balayage laser ou par microscopie multiphotonique (figure 1).
L'électroporation permet dextrans fluorophore couplé à entrer et se propager rapidement à l'intérieur des cellules de l'organe olfactif. Il est utile d'appliquer un éclairage fluorescent pour vérifier l'étiquetage avec succès après le déclenchement d'impulsions de tension. En fonction des paramètres d'électroporation, par exemple., La résistance à la pipette, des groupes de cellules (figure 2A, B) ou des cellules individuelles (figure 2C) de l'organe olfactif sont marqués. Les axones des neurones sensoriels marqués peuvent être visualisés dans le nerf olfactif (figure 2D) et les processus axonales peuvent être observés également dans le bulbe olfactif, généralement 24 heures après l'électroporation réussie(Figure 3). L'électroporation de groupes de neurones sensoriels permet de visualiser les motifs de câblage grossières dans le bulbe olfactif (figure 3A). Cellule unique électroporation peut être utilisée pour étudier les modèles individuels axonales de projection, bifurcations axonales et la connectivité aux structures glomérulaires dans le bulbe olfactif (figure 3C-E).
Têtards albinos transparentes de X. permis de laevis dans confocale in vivo ou l'imagerie multiphotonique des neurones sensoriels marqués dans le cerveau intact de têtard anesthésié. Le développement des modèles de croissance des axones peuvent être suivis sur plusieurs jours / semaines répétée dans la visualisation in vivo de la même neurone sensoriel marqué (figure 4). Selon la maturité du neurone sensoriel au point de l'électroporation de temps le modèle de l'axone dans le bulbe olfactif peut varier considérablement. Neurones matures possèdent déjà des branches axonales complexes qui comportent touffezones és connectés à des glomérules. Le modèle de croissance axonale des neurones matures est plutôt stable, mais l'allongement de branches axonales et les raffinements de touffes glomérulaires sont observables (figure 4A-E). Les neurones sensoriels peuvent être observées in vivo pour des périodes de temps prolongées, par exemple., Plus de trois semaines (Figure 4F-I). D'autre part, les axones des neurones immatures sont encore dans le processus de croissance initiale, ne possèdent pas arborisations touffus et ne sont pas encore connectés à leurs objectifs de glomérulaire finales. Le protocole expérimental permet de suivre le développement de ces neurones pendant la maturation, par exemple., Axone allongement, bifurcations et mise en place d'arborisations tuftés (Figure 4J-L). Pour plus d'exemples voir aussi Hassenklöver et Manzini 12.
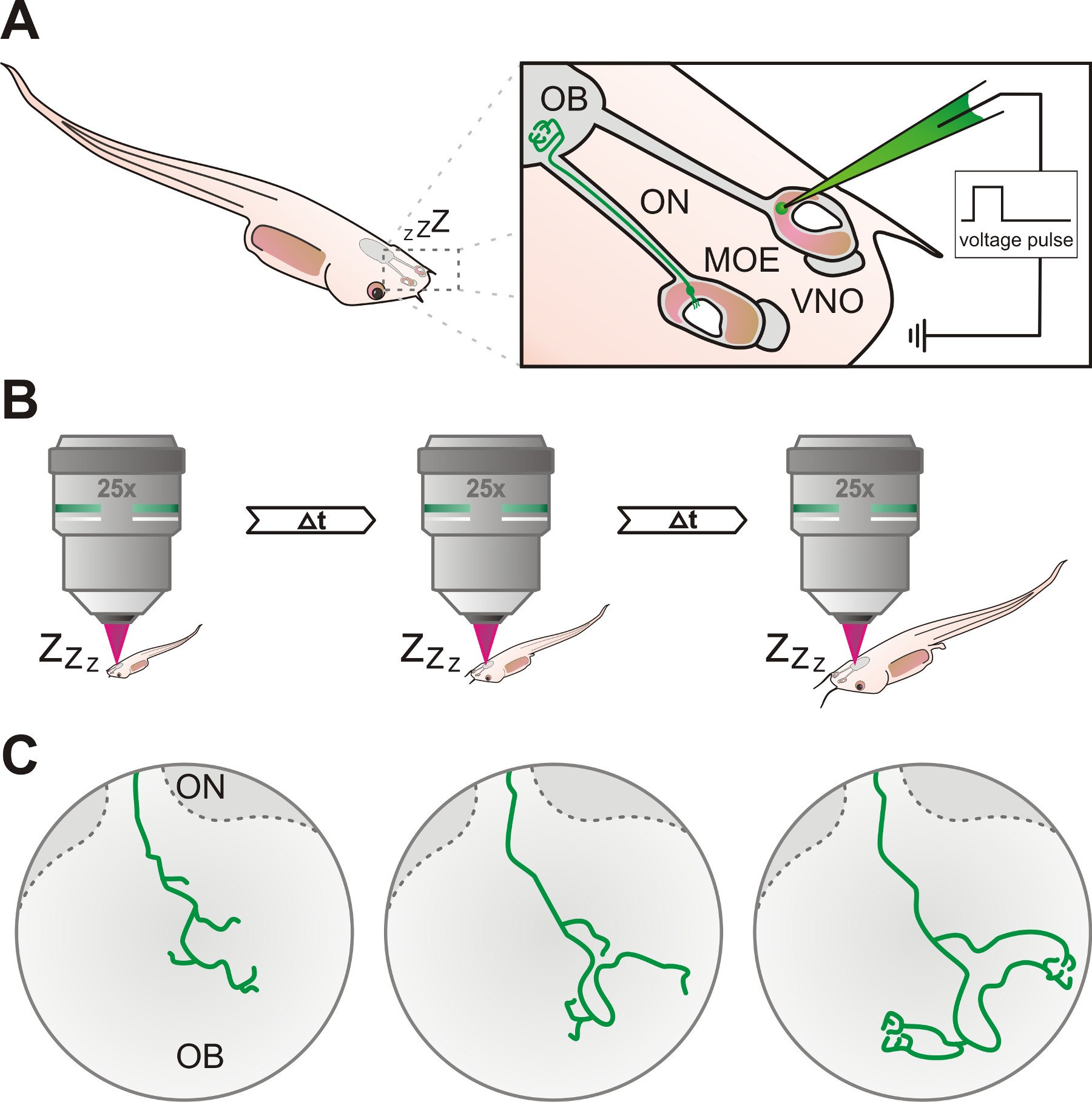
Figure 1. Aperçu schématique du protocole expérimental. (A) des neurones sensoriels de l'épithélium olfactif principal (MEO) ou de l'organe voméronasal (VNO) de l'organe olfactif de X. anesthésié larves laevis sont marqués par électroporation en utilisant une pipette en verre rempli d'une solution de dextran fluorescent. Les axones des neurones marqués peuvent être suivies par le nerf olfactif (ON) et finissent par atteindre le bulbe olfactif (OB). (B) Le têtard est anesthésié et les neurones marqués sont étudiés à plusieurs reprises à l'aide d'un microscope confocal ou multiphotonique dans des intervalles de temps spécifiques. (C) Le développement progressif des modèles de croissance des axones des cellules marquées peut être suivi sur des périodes de quelques jours ou semaines.
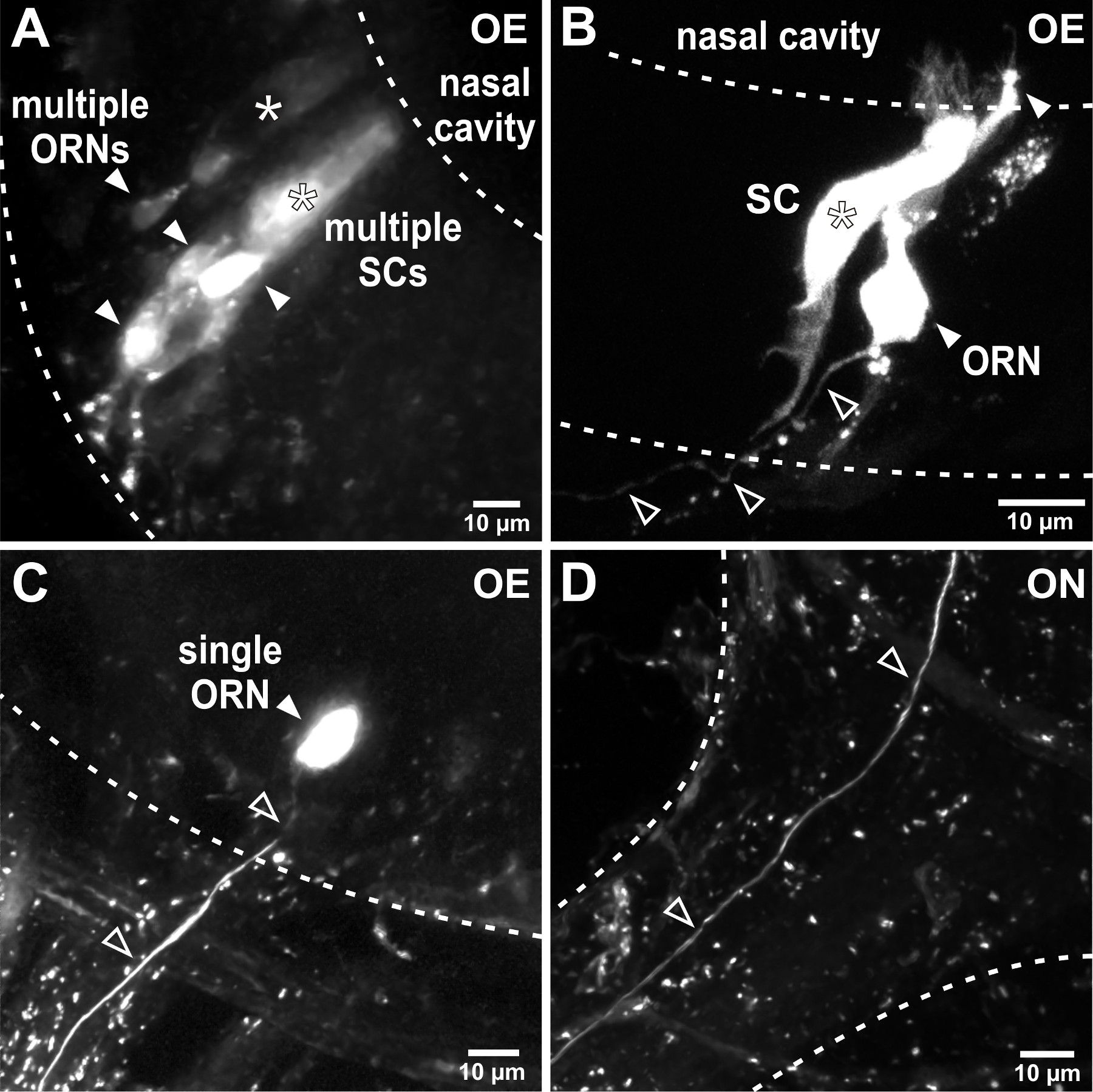
Figure 2. Electroporation des neurones sensoriels de l'organe olfactif. (A) électroporation avec des pipettes à faible résistance conduit à l'étiquetage de plusieurs cellules dans l'organe olfactif. Dans cet exemple, représentant de multiples neurones récepteurs olfactifs (NRO, des pointes de flèches pleines) et deux cellules cylindriques en forme de soutien (SC), astérisques ont été colorées. Les lignes pointillées délimitent les frontières de l'épithélium olfactif (OE). (B) Affiner les paramètres d'électroporation, par exemple., Augmentation de la résistance de la pipette, limite le nombre de cellules marquées. Dans cet exemple, un seul neurone sensoriel (têtes de flèches pleines) et une cellule adjacente de support (astérisque) ont été colorés après l'électroporation. Notez l'axone unique laissant l'épithélium olfactif (têtes de flèches ouvertes). (C) réussie électroporation d'une cellule unique conduit à l'étiquetage exclusif d'un neurone individuel sensorielle (tête de flèche rempli) et son axone connecté (têtes de flèches ouvertes) dans l'épithélium olfactif. (D) L'axone marqué unique (flèches ouvertes) peut être suivie par le nerf olfactif (ON) dans le bulbe olfactif.
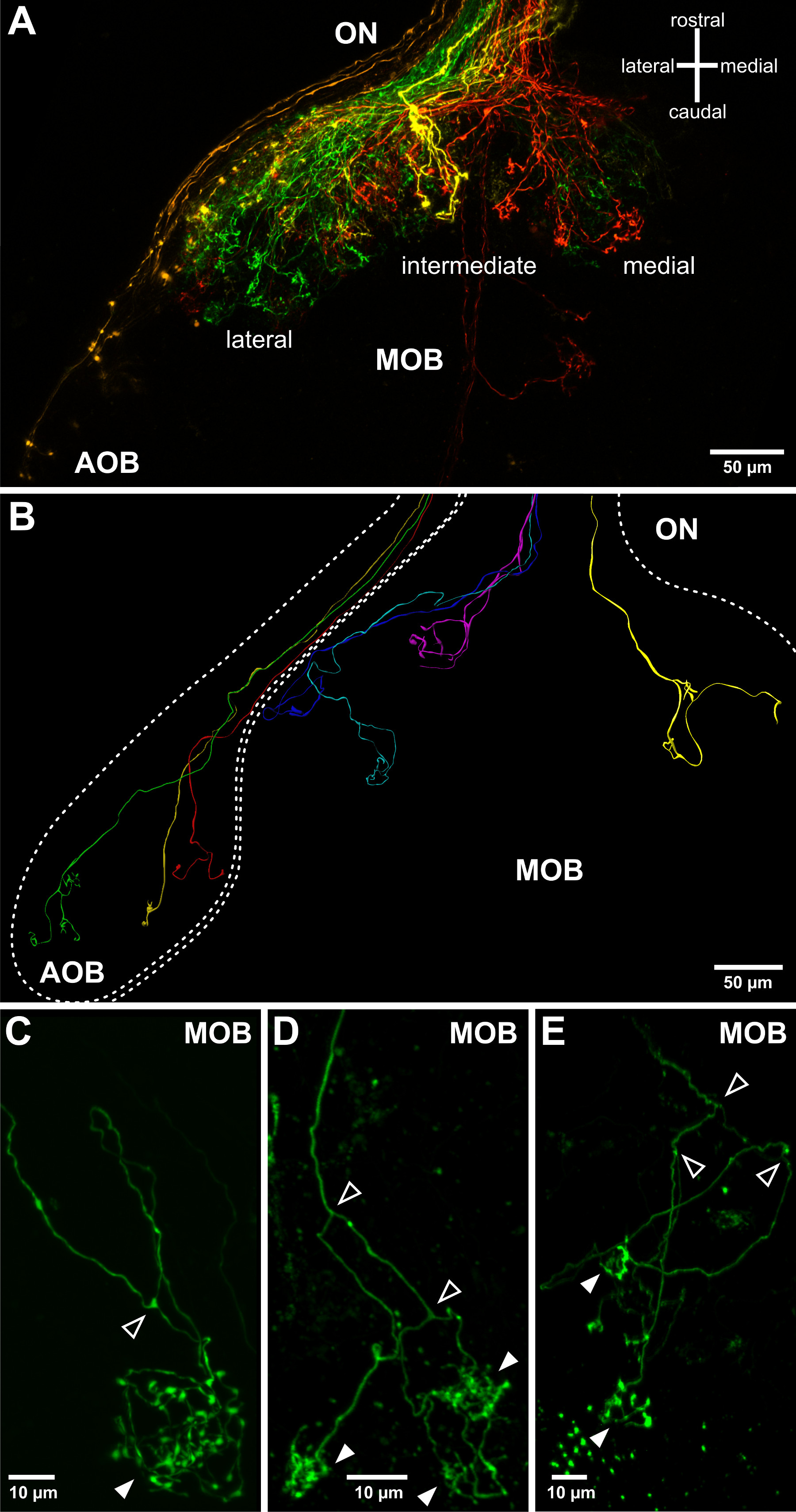
Figure 3. La visualisation des projections axonales olfactifs dans le bulbe olfactif excisé. (A) La topologie grossière de projections axonales de neurones sensoriels dans le bulbe olfactif peut être visualisé en utilisant des pipettes inférieurs d'électroporation de résistance. Un hémisphère bulbe olfactif et son nerf olfactif associé (ON) sont représentés. Quatre dextrans couplés à des fluorophores différents électroporation à quatre endroits éloignés de l'organe olfactif: latérale (vert), intermédiaire (jaune), médial ME (rouge) et VNO (orange). Cela permet de visualiser l'ampoule olfactive accessoire (AOB) et les trois principaux domaines de la principale bulbe olfactif (MOB) de projection. (B) Différents modèles de croissance des axones des neurones sensoriels olfactifs individuelles superposées sur la structure du bulbe olfactif. Représentées sont (CE) Exemples d'axones olfactifs projection unique dans le bulbe olfactif et formant tuftés arborisations / synapses dans les glomérules sphérique (têtes de flèches pleines) combiné trois reconstructions tridimensionnelles de multiples colorations de cellules isolées provenant de différents spécimens de larves.. On notera que dans X. laevis axones olfactifs bifurquent régulièrement (flèches ouvertes) avant la connexion à un, deux ou plusieurs glomérules (pointes de flèches remplies, vous pouvez aussi Hassenklöver et Manzini 12).
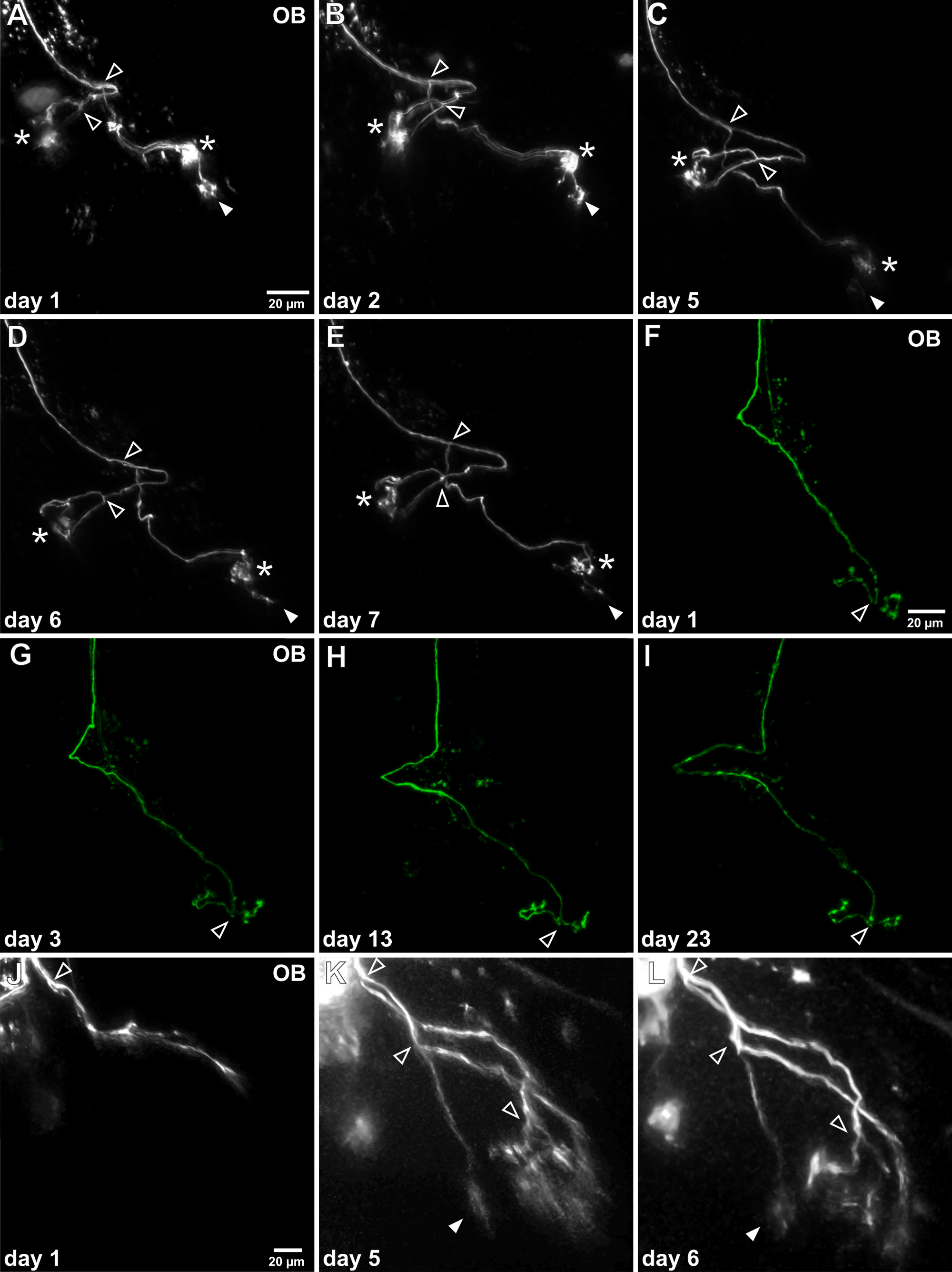
Figure 4. In vivo imagerie time-lapse de simples axones des neurones olfactifs. (AE)Après avoir réussi électroporation de cellules individuelles de l'axone marqué peut être visualisé de manière répétée dans le bulbe olfactif (OB). Cet exemple montre un axone individu qui a été étudié pendant une semaine. La morphologie globale ne change pas considérablement et deux points de ramification principaux peut être identifié (têtes de flèche vides). Notez que dans le cours du temps, une touffe glomérulaire subit une réduction continue (tête de flèche rempli), tandis que les deux autres touffes glomérulaires restent stables (astérisques). (FI) Cet exemple représentatif montre la viabilité d'observations à long terme comme a enquêté sur cet axone spécifique pendant plus de trois semaines. Pas de changement visible de son profil de croissance peut être détectée. (JL) Un exemple d'un axone sensoriel immature dans le processus de croissance est représentée. Il n'a pas encore relié à des glomérules et des touffes glomérulaires caractéristiques sont portées disparues. Après 5 jours, les branches axonales sont allongées, l'axone bifurqué plusieurs fois et arborisations fines sontétabli.
Discussion
La procédure expérimentale décrite ici permet l'étiquetage des neurones sensoriels de l'organe olfactif larvaire de X. laevis par électroporation de dextrans fluorophores couplés et la visualisation ultérieure de la croissance axonale sensorielle chez l'animal vivant. En faisant varier les paramètres de l'électroporation in vivo, il est possible de contrôler le nombre de neurones sensoriels marqués. Il est ainsi possible de marquer de grands groupes de neurones d'un épithélium sensoriel, très peu ou même des cellules individuelles.
Pour assurer le désire étendre l'étiquetage des neurones, il est important d'être particulièrement prudent sur les caractéristiques de micropipette et les impulsions d'électroporation. Des résistances plus élevées et la réduction de l'impulsion de tension d'amplitude, la durée et le nombre de répétitions pipette peut réduire la quantité de cellules marquées, tandis que la diminution des résistances de pipette et supérieur amplitude d'impulsion de tension, de durée et nombre d'impulsions peut conduire à un étiquetage plus répandue. ThE à utiliser des dextrans fluorescents pour l'électroporation fournit une rétroaction visuelle immédiate si les paramètres appliqués sont appropriés. Veillez à ce que l'aide de paramètres pour l'amplitude, la durée et le nombre d'impulsions qui dépassent les valeurs indiquées dans le protocole peut potentiellement conduire à des dommages cellulaires ou même la mort cellulaire 17. Conseils bouchés ou brisés de micropipettes peuvent également entraver l'électroporation réussie.
En électroporation in vivo dans l'organe olfactif de X. laevis est limitée aux stades larvaires depuis la peau de grenouille postmetamorphotic est difficile et ne peut pas être facilement pénétrée par une micropipette. La visualisation in vivo de processus neuronaux peut être entravé par la diffusion de la lumière d'excitation / d'émission dans les zones les plus profondes du cerveau ou de vaisseaux sanguins. Ce problème devient particulièrement évident dans les stades larvaires plus élevés en raison d'un plus grand cerveau et peut conduire à des signaux bruyants rendant l'identification claire des processus axonales fines plus difficile.
Permis Le protocole présenté à visualiser les neurones sensoriels du système olfactif intact sans disséquer l'animal, endommager les cellules pendant l'étiquetage, la préparation des tranches de tissu ou de fixer le tissu nécessaire pour des méthodes alternatives, comme l'étiquetage dans le patch cellule entière expériences -clamp 18. En combinant l'étiquetage de quelques simples ou neurones sensoriels avec in vivo laps de temps d'imagerie, il est possible de visualiser les connexions glomérulaire des neurones sensoriels matures célibataires de plus longs intervalles de temps. De cette façon, il est également possible de suivre l'évolution des modèles de projections axonales des neurones sensoriels immatures pendant plusieurs semaines. Cette dernière option est particulièrement intéressante car elle permet de surveiller les tendances d'axones simples de croissance chez l'animal vivant. Cela ouvre la possibilité d'étudier les mécanismes cellulaires et moléculaires qui contrôlent le guidage axonal et pathfinding. Plusieurs facteurs, y compris l'expression du récepteur odorant, divers AxoIl a été démontré n molécules de guidage et induit odorant-/ activité spontanée des neurones sensoriels de réglementer la conclusion cible des axones des neurones sensoriels 4,5.L'application du protocole ne se limite pas aux neurones sensoriels olfactifs, mais peut également être appliquée à l'étude d'autres types de cellules, par exemple., Les cellules souches / progénitrices neurogènes des zones du cerveau en développement ou cellules mitrales du bulbe olfactif. En outre, la technique illustrée peut également être utilisé en combinaison avec le calcium ou des dextranes sensibles injecté colorants de calcium membrane perméable à obtenir des informations sur le fonctionnement des neurones marqués et / ou les circuits connectés 7,19. La disponibilité d'une large gamme de fluorophores couplés aux dextrans permet l'étiquetage de plusieurs cellules ou populations de différentes couleurs individuelles. Aussi plasmide solution d'ADN, par exemple codant pour des protéines fluorescentes, est adapté à l'électroporation et peut en outre améliorer la versatiliTy et l'utilité de la technique 6. Le protocole peut encore être amélioré pour permettre l'électroporation combiné de dextrans et de l'ADN ou morpholinos chargés de manipuler l'expression des gènes 13,17.
La méthode décrite représente certainement un nouvel outil pour étudier le processus complexe et pas encore pleinement compris qui régulent l'orientation des axones dans le système olfactif des vertébrés.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by DFG Schwerpunktprogramm 1392 (project MA 4113/2-2), cluster of Excellence and DFG Research Center Nanoscale Microscopy and Molecular Physiology of the Brain (project B1-9), and the German Ministry of Research and Education (BMBF; project 1364480).
matériels
| Name | Company | Catalog Number | Comments |
| SZX16 | Olympus | Stereomicroscope with fluorescent illumination | |
| Axon Axoporator 800A | Molecular Devices | Single cell electroporator | |
| ELP-01D | npi electronic | Electroporator | |
| MMJ | Märzhäuser Wetzlar | Manual micromanipulator | |
| P-1000 | Sutter | Horizontal micropipette puller | |
| G150F-4 | Warner Instruments | Glass capillaries for electroporation pipette fabrication; internal filament makes backfilling easier | |
| Alexa 488-dextran 10 kD | Life Technologies | D22910 | |
| Alexa 546-dextran 10 kD | Life Technologies | D22911 | |
| Alexa 568-dextran 10 kD | Life Technologies | D22912 | |
| Alexa 594-dextran 10 kD | Life Technologies | D22913 | |
| TMR-dextran 3 kD (micro-Ruby) | Life Technologies | D7162 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10521 | Anesthetic; use gloves |
| A1-MP | Nikon | Multiphoton microscope | |
| LSM 780 | Zeiss | Confocal microscope | |
| Imaris | Bitplane | Alternative software for neuronal tracing |
Références
- Huard, J. M., Youngentob, S. L., Goldstein, B. J., Luskin, M. B., Schwob, J. E. Adult olfactory epithelium contains multipotent progenitors that give rise to neurons and non-neural cells. J. Comp. Neurol. 400 (4), 486-4810 (1998).
- Schwob, J. E. Neural regeneration and the peripheral olfactory system. Anat. Rec. 269 (1), 33-49 (2002).
- Leung, C. T., Coulombe, P. A., Reed, R. R. Contribution of olfactory neural stem cells to tissue maintenance and regeneration. Nat. Neurosci. 10 (6), 72-726 (2007).
- Lodovichi, C., Belluscio, L. Odorant receptors in the formation of the olfactory bulb circuitry. Physiology (Bethesda. 27 (4), 212-2110 (2012).
- Mori, K., Sakano, H. How is the olfactory map formed and interpreted in the mammalian brain). Annu. Rev. Neurosci. 34, 467-499 (2011).
- De Vry, J., et al. In vivo electroporation of the central nervous system: a non-viral approach for targeted gene delivery. Prog. Neurobiol. 92 (3), 227-244 (2010).
- Hovis, K. R., Padmanabhan, K., Urban, N. N. A simple method of in vitro electroporation allows visualization, recording, and calcium imaging of local neuronal circuits. J. Neurosci. Methods. 191 (1), 1-10 (2010).
- Chen, C., Smye, S. W., Robinson, M. P., Evans, J. A. Membrane electroporation theories: a review. Med. Biol. Eng. Comput. 44 (1-2), 5-14 (2006).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J. Vis. Exp. (17), (2008).
- Gliem, S., et al. Bimodal processing of olfactory information in an amphibian nose: odor responses segregate into a medial and a lateral stream. Cell. Mol. Life Sci. 70 (11), 1965-1984 (2013).
- Hassenklöver, T., Manzini, I. Olfactory wiring logic in amphibians challenges the basic assumptions of the unbranched axon concept. J. Neurosci. 33 (44), 17252-1710 (2013).
- Bestman, J. E., Ewald, R. C., Chiu, S. -. L., Cline, H. T. In vivo single-cell electroporation for transfer of DNA and macromolecules. Nat. Protoc. 1 (3), 1272-1210 (2006).
- Nieuwkoop, P. D., Faber, J., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis. , (1994).
- Coupé, P., Munz, M., Manjón, J. V., Ruthazer, E. S., Collins, D. L. A CANDLE for a deeper in vivo insight. Med. Image Anal. 16 (4), 849-864 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nat. Biotechnol. 28 (4), 348-353 (2010).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Nezlin, L. P., Schild, D. Individual olfactory sensory neurons project into more than one glomerulus in Xenopus laevis tadpole olfactory bulb. J. Comp. Neurol. 481 (3), 233-239 (2005).
- Nagayama, S., et al. In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron. 53 (6), 789-803 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon