Method Article
Обонятельная система как модель для изучения характера роста аксонов и морфология
В этой статье
Резюме
We describe a protocol for in vivo labeling of olfactory sensory neurons by electroporation and subsequent confocal laser-scanning or multiphoton microscopy to visualize neuronal morphology and its development over time.
Аннотация
The olfactory system has the unusual capacity to generate new neurons throughout the lifetime of an organism. Olfactory stem cells in the basal portion of the olfactory epithelium continuously give rise to new sensory neurons that extend their axons into the olfactory bulb, where they face the challenge to integrate into existing circuitry. Because of this particular feature, the olfactory system represents a unique opportunity to monitor axonal wiring and guidance, and to investigate synapse formation. Here we describe a procedure for in vivo labeling of sensory neurons and subsequent visualization of axons in the olfactory system of larvae of the amphibian Xenopus laevis. To stain sensory neurons in the olfactory organ we adopt the electroporation technique. In vivo electroporation is an established technique for delivering fluorophore-coupled dextrans or other macromolecules into living cells. Stained sensory neurons and their axonal processes can then be monitored in the living animal either using confocal laser-scanning or multiphoton microscopy. By reducing the number of labeled cells to few or single cells per animal, single axons can be tracked into the olfactory bulb and their morphological changes can be monitored over weeks by conducting series of in vivo time lapse imaging experiments. While the described protocol exemplifies the labeling and monitoring of olfactory sensory neurons, it can also be adopted to other cell types within the olfactory and other systems.
Введение
The lifelong turnover of sensory neurons distinguishes the olfactory system from many other sensory and neuronal systems1,2. Newly formed sensory neurons are continuously generated in the basal portion of the olfactory epithelium3 and extend their axons into the olfactory bulb, the first relay station of the olfactory system4. However, the cellular and molecular mechanisms controlling the formation and maintenance of the olfactory map are far from being fully understood4,5.
Here, we describe a protocol for labeling sensory neurons of the olfactory organ of larval X. laevis by in vivo electroporation of fluorophore-coupled dextrans. The presented protocol allows visualization of axonal morphology and connectivity, track axonal development over time and study mechanisms regulating axonal wiring and guidance.
Electroporation is a well established method to introduce charged macromolecules, like dextran-coupled dyes and DNA, into cells6,7. The cell membrane is permeabilized by application of short voltage pulses and the molecules are electrophoretically delivered into the cytosol8. Spatially restricted electroporation using a micropipette permits selective labeling of cells including neurons and has been applied in various neuronal systems including the visual system of X. laevis9,10.
We show how the electroporated animals can be used to study axonal growth patterns and morphology in living animals using confocal laser-scanning or multiphoton microscopy. The described procedure allows identifying the coarse topology of axonal projections of sensory neurons of the main and accessory olfactory system11,12. Using in vivo time lapse imaging, it is also suitable to supervise the glomerular connections of single mature sensory neurons, and to monitor the evolution of the axonal projection patterns of immature sensory neurons12. The described protocol can be applied to investigate the structure and formation of olfactory circuits in the intact animal and can be adapted to other cell types within the olfactory and other neuronal systems.
протокол
ПРИМЕЧАНИЕ: обработка животных и эксперименты проводились как утверждается Геттинген университета комитета по этике в эксперименты на животных по.
1. Подготовка инструментов и Pipette Изготовление
- Убедитесь, что установка электропорации состоит из стереомикроскопом с большим рабочим расстоянием и оснащен люминесцентными освещения и фильтров наборов для используемого красителя.
- Для электропорации использовать либо выделенный одного электропоратора клеток или общий квадратный генератор импульсов, прикрепленный к осциллографу. Подключите электропоратора выходы к держателю пипетки и ванной электрода. Подключите положительный вывод генератора импульсов с держателем микропипетки и отрицательным выводом к ванне электрода. Обеспечить как держатель пипетки и ванна электрод содержит серебро провода, покрытые тонким слоем хлорида серебра.
- Установите держатель пипетки на микроманипулятор чтобы точное позиционирование.
- Изготовление электропорации микропипетки из боросиликатного стекла капилляров с внутренним нити.
- Используйте горизонтальную микропипетки съемник и применить модифицированный протокол для изготовления пипеток для локальной фиксации экспериментов, как описано Bestman и др. 13.
- Адаптация параметров для получения более длинный стержень и меньший отверстие наконечника приводит к более высокой устойчивости к пипетки около 15-20 МОм для одного электропорации клеток. Сопротивление пипетка должна быть ниже, например, 3-4 МОм, для маркировки групп клеток.
- Измерьте сопротивление пипетки либо непосредственно с выделенной электропоратора одноклеточного или рассчитать его с законом Ома после измерения тока с помощью осциллографа после приложения импульса определенной напряжения.
2. Приготовление раствора электропорации
- Растворите флуорофора связью декстрана в лягушки звонка (98 мм NaCl, 2 мМ KCl, 1 мМ CaCl 2, 2 мМ MGCL 2, 5 мМ глюкозы, 5 мМ Na-пируват, 10 мМ HEPES, рН доводили до 7,8, осмолярность было 230 мОсм / л) при концентрации 3 мМ. Клетки не могут быть так ярко помечены если используются концентрации низкие красителях. Подготовьте большой объем исходного раствора и разделите его на небольшие аликвоты. Заморозить их для хранения (стабильной в течение нескольких месяцев).
ПРИМЕЧАНИЕ: Декстраны доступны в различных размерах и различных испускания / возбуждения (например, Alexa 488-декстран 10kD, Alexa 546-декстран 10kD, Alexa 568-декстран 10kD, Alexa 594-декстран 10kD, TMR-декстран 3kD.). - Засыпка микропипетки с удлиненным наконечником пипетки с небольшим объемом декстрана раствор (1-5 мкл). Осторожно вылить микропипетку с пальцем, чтобы удалить остатки пузырьков воздуха из пипетки.
- Установите микропипетку в держатель пипетки. Убедитесь, что серебряной проволоки внутри пипетки находится в контакте с раствором красителя.
3. Отбор личинок X. Laevis </ EM>
- Используйте альбиноса личинки X. Laevis для экспериментов. Животных дикого типа обладают пигментные заполненные меланофоры, которые показывают выбросы автофлуоресцентной во конфокальной / многофотонном изображений и, следовательно, не подходит для описанных экспериментов.
- Этап premetamorphotic головастиков после Nieuwkoop и Faber 14. Выберите головастиков стадии 45-53 для экспериментов.
4. Электропорация флуорофором связанных Декстраны
- Поместите кусочек ткани в чашке Петри и покрыть его небольшим количеством воды, содержащей 0,02% Tricaine (эфир 3-аминобензоата метансульфонатного, доводят до рН 7).
- Обезболить головастиков в воде, содержащей 0,02% Tricaine. Через несколько минут животные перестают двигаться. Подтвердите правильное анестезии, прикоснувшись головастиков. Они не должны быть отзывчивым.
- Тщательно передачи головастика с анестезией в ткани покрыты Петри.
- Убедитесь, что ванна электроода замыкает цепь электропорации. Убедитесь, что электрод находится в контакте с влажной тканью; прямой контакт с головастика не надо.
- Расположите микропипетка наконечник близко к органа обоняния с помощью микроманипулятора.
- Проникают в кожу покрытие обонятельный орган с кончика пипетки и осторожно продвигаться наконечник в центре города сенсорных нейронов слоя основного обонятельного эпителия или вомероназального эпителия.
- Trigger положительные импульсы квадрат напряжения для передачи красителя в сенсорных нейронах. Нанесите импульс одного напряжения (например., 25 V, длительность импульса 25 мс) или поезда нескольких импульсов (например., 50 В, длительность импульса 300 мкс, 400 продолжительность мс поезд на 200 Гц).
ПРИМЕЧАНИЕ: Определить оптимальные параметры импульсов напряжения для лучшего расширить маркировки. Уменьшение амплитуды импульсов напряжения, длительность и количество повторений, чтобы снизить количество меченых клеток. Применить более высокую амплитуду импульса напряжения, продолжительность и число рulses для более широкого маркировки. - Визуализация успешной выдавливание красителя и электропорации по сработавших импульсов с использованием флуоресцентного освещения стереомикроскопом. Краситель быстро распространяется в теле клетки и дендритов после успешного электропорации.
- Повторите шаги 4,5-4,9 на второй органе обоняния головастика.
- Передача головастика в химический стакан, наполненный пресной воды для восстановления. После ок 5 мин головастики проснуться от наркоза и начать нормальные движения бассейна.
- После 24 часов электропорации краситель распространяется в сенсорных нейронах и в конечном итоге достигает обонятельной луковицы через аксонов транспорта.
5. Монтажные Животные для In Vivo визуализации клеток и аксонов процессов
- Обезболить головастиков в воде, содержащей 0,02% Tricaine.
- Тщательно передачи головастиков в камере изображения, например, небольшой кремния с резиновым покрытием Петри с головастика размера выемки.
- Вырежьте небольшой прямоугольник в полосе парафильмом. Накройте головастика с парафильмом, оставив переднюю мозге подвергается через окно вырез. Закрепите парафильмом с иглами на блюдо, не повредив головастика.
- Убедитесь, что головастик погружен в достаточном количестве воды, содержащей 0,02% Tricaine.
- Установите камеру изображения на сцене вертикальном много- микроскопом или конфокальной микроскопии.
- Приобретать трехмерную стопку изображений обонятельной луковице. Убедитесь, что процесс создания образа как можно короче и не превышает 10-15 мин.
- Вернуться головастика в обычной воде в отдельной емкости и предотвращения воздействия света. Через 5 мин, головастика выходит из наркоза.
- Повторите шаги 5,1-5,7 после указанные промежутки времени, например., Каждый день.
6. Монтажные Животные для Ex Vivo визуализации клеток и аксонов процессов
- Кроме того в разделе 5протокола, использовать вырезали подготовку мозга визуализировать меченых сенсорных нейронов.
- Обезболить и убить головастика по перерезки мозга при переходе к спинному мозгу. Акцизный блок ткани, содержащий обонятельные органы, обонятельные нервы и переднюю мозге.
- Перенести тканей блок к лягушки решения звонка и удалить соединительную ткань с мелкими ножницами, чтобы разоблачить брюшной стороне мозга.
- Перенесите блок тканей к камере изображений и зафиксировать его с платиновой рамкой струнные с нейлоновыми нитями.
- Установите камеру изображения на стадии конфокальной / многофотонном микроскопом.
- Приобретать трехмерную стопку изображений обонятельной луковице.
7. Обработка изображений и оценка данных
- Оптимизация и применять нелокальные средства фильтрации для улучшения качества изображения и визуализации нейронных структур, как описано купе, P. и соавт. 15,
ПРИМЕЧАНИЕ: Данные экспериментов изображений в глубокие слои тканей живых особей часто шумно. - Создать максимальные прогнозы интенсивность изображения стеки для обзора.
- Для покадровой эксперименты изображений экрана наборы данных для одиночных однозначно идентифицируемых аксонов сенсорных нейронов.
- Реконструировать клеточной морфологии через ПО-помощь отслеживания нейронных процессов, как описано Пэн и др. 16.
Результаты
Описанный протокол может быть успешно применен для электропорации и в естественных условиях визуализации аксонов процессов сенсорных нейронах обонятельной системы наркозом X. Laevis, с помощью конфокальной лазерной-сканирования или многофотонную микроскопии (рис 1).
Электропорация позволяет флуорофором сочетании декстраны, чтобы войти и быстро распространяться внутри клеток обонятельного органа. Это полезно применять люминесцентные освещение, чтобы проверить успешное маркировку после запуска импульсов напряжения. В зависимости от параметров электропорации, например., Сопротивление пипетки, группы клеток (Фигура 2А, В) или одиночных клеток (фиг.2С) от органа обоняния помечены. Аксоны меченых сенсорных нейронов могут быть визуализированы в обонятельного нерва (рис 2D) и аксонов процессы можно наблюдать и в обонятельной луковице, как правило, через 24 часа после успешной электропорации(Рисунок 3). Электропорацию групп сенсорных нейронов позволяет визуализировать крупные образцы проводка в обонятельной луковицы (фиг.3А). Одноместный клеток электропорации может применяться для исследования отдельных аксонов моделей проекционных, аксональные бифуркации и подключение к клубочков структур в обонятельной луковице (3С-E).
Прозрачные альбиносов головастики X. Разрешение Laevis в естественных условиях конфокальной или много- изображений меченых сенсорных нейронов в неповрежденной мозга наркозом головастика. Развитие аксонов моделей роста можно проследить в течение нескольких дней / недель при повторном в естественных условиях визуализации той же маркировкой сенсорного нейрона (рис 4). В зависимости от срока погашения сенсорного нейрона в момент времени, электропорации аксона картина в обонятельной луковице может значительно отличаться. Зрелые нейроны уже обладают сложные аксональные ветви, которые показывают клокред области, связанные с клубочков. Аксонов модель роста зрелых нейронов достаточно стабилен, но удлинение аксонов филиалов и уточнений клубочков пучками наблюдаются (рис 4A-E). Чувствительные нейроны можно наблюдать в естественных условиях в течение длительных периодов времени, например., Больше, чем три недели (рис 4F-I). С другой стороны, аксоны нейронов из незрелых все еще находятся в процессе первоначального роста, не обладают хохлатая arborizations и до сих пор не подключен к их конечных целей клубочков. Экспериментальный протокол позволяет отслеживать развитие этих нейронов во время созревания, например., Аксона удлинение, бифуркации и установление хохлатой arborizations (рис 4J-L). Дополнительные примеры также увидеть Hassenklöver и Манзини 12.
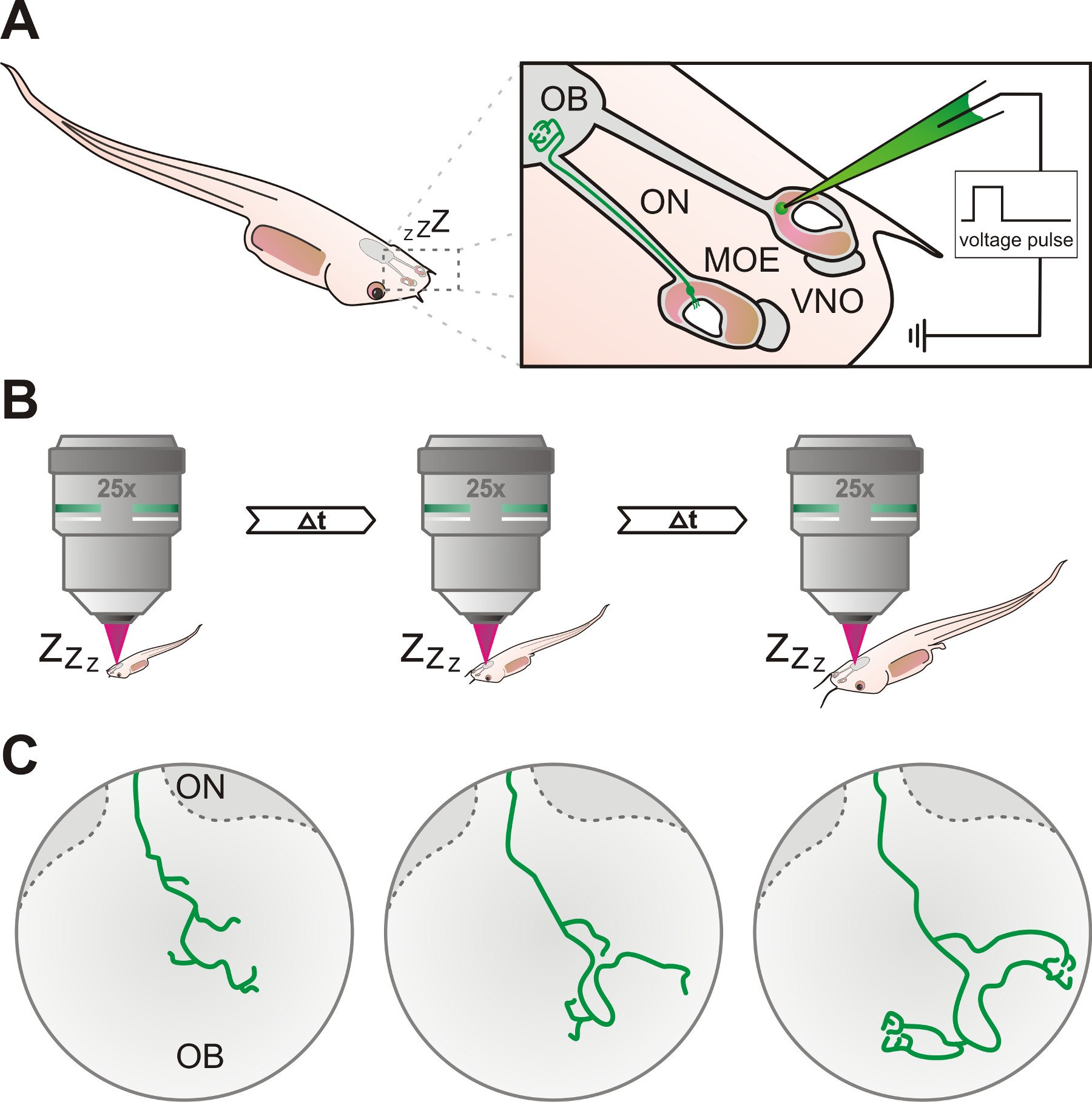
Рисунок 1. Схема обзор экспериментального протокола. (А) Сенсорные нейроны в главном обонятельного эпителия (МЧС) или вомероназальный орган (ВНО) в органе обоняния наркозом X. Laevis личинки помечены с помощью электропорации, используя стеклянную пипетку, наполненную флуоресцентного декстрана решения. Аксоны меченных нейронов может следовать через обонятельного нерва (ON) и в конечном счете достичь обонятельной луковицы (ОВ). (Б) головастика под наркозом и меченые нейроны неоднократно исследовали с помощью конфокальной микроскопии или многофотонной в определенные промежутки времени. (C) поэтапная разработка аксонов моделей роста меченых клеток можно проследить за промежутков времени от нескольких дней до недель.
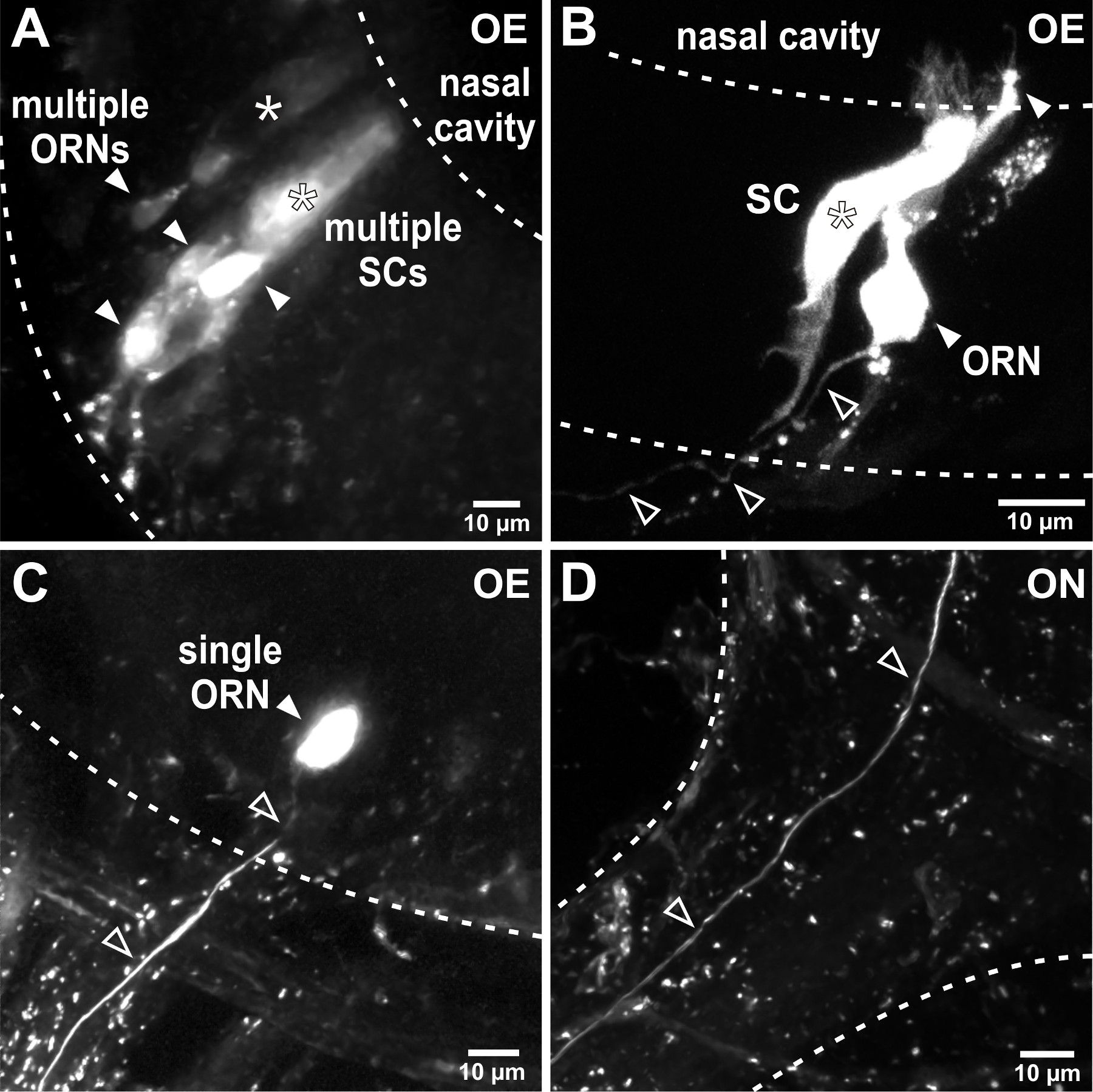
Рисунок 2. Electroporation сенсорных нейронов в органе обоняния. (А) Электропорация с низким пипеток сопротивления приводит к маркировке нескольких ячеек в органе обоняния. В этом представительном примере окрашивали несколько обонятельные нейроны рецепторов (ORNs, заполненные стрелки) и два столбчатых-образный поддерживающие клетки (СКС, звездочки). Пунктирные линии демаркации границы обонятельного эпителия (OE). (B) Уточнение параметров электропорации, например., Увеличение сопротивления пипетки, ограничивает число меченых клеток. В этом примере, один сенсорный нейрон (заполненные стрелки) и одной смежной опорной клетки (звездочка) окрашивали после электропорации. Обратите внимание на один аксон оставляя обонятельный эпителий (открытые стрелки). (C) Успешный сингл электропорации клеток приводит к исключительной маркировки отдельного сенсорного нейрона (заполняется стрелки) и ее связной аксона (открытые стрелки) в обонятельный эпителий. (D) одного помечены аксон (открытые стрелки) может следовать через обонятельного нерва (ON) в обонятельной луковицы.
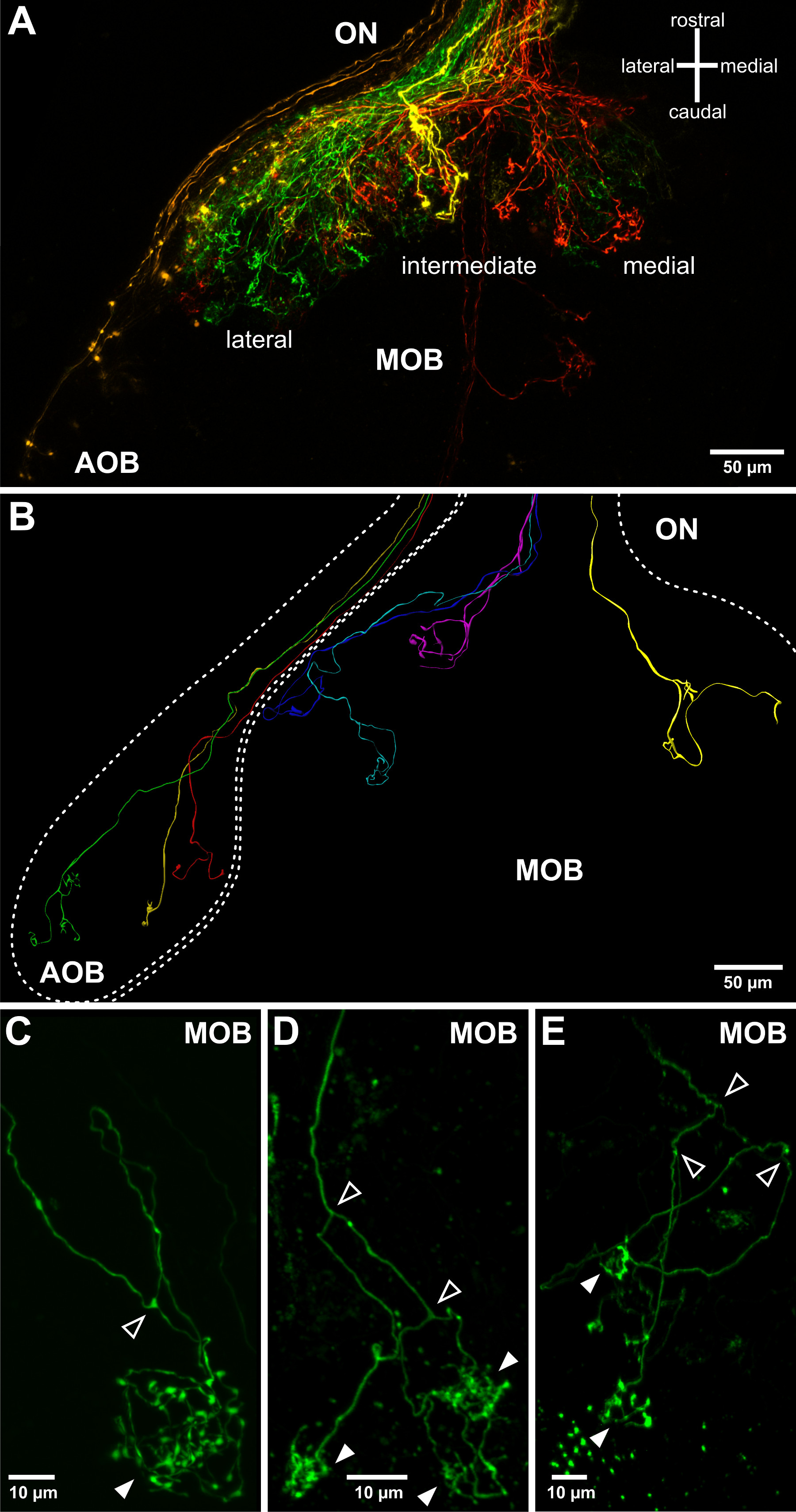
Рисунок 3. Визуализация обонятельные проекции аксонов в вырезанной обонятельной луковице. (А) грубая топология аксонов проекций сенсорных нейронов в обонятельной луковице могут быть визуализированы с использованием более низких электропорации пипетки сопротивления. Один обонятельные полушарие лампы и связанный обонятельный нерв (ON) изображены. Четыре декстраны в сочетании с разными флуорофорами электропорировали в четырех отдаленных местах органа обоняния: боковой (зеленый), промежуточный (желтый), медиальная МЧС (красный) и ВНО (оранжевый). Это позволяет вывести на принадлежность обонятельной луковицы (AOB) и три основных проекционных полей основной обонятельной луковице (MOB). (В) Различные модели роста аксонов из одиночных обонятельные сенсорные нейроны, наложенных на структуре обонятельной луковицы. Изображенные сочетаются трехмерные реконструкции многочисленных окрашиваний одиночных клеток, полученных из различных личинок образцов. (CE) Примеры отдельных обонятельных аксонов, выступающих в обонятельной луковице и образующих хохлатая arborizations / синапсов в сферической клубочков (заполненные стрелки). Следует отметить, что в X. Laevis обонятельные аксоны регулярно раздваиваться (открытые наконечники стрел), прежде чем подключать к одному, два или многократного клубочков (заполненные стрелки, также см Hassenklöver и Манзини 12).
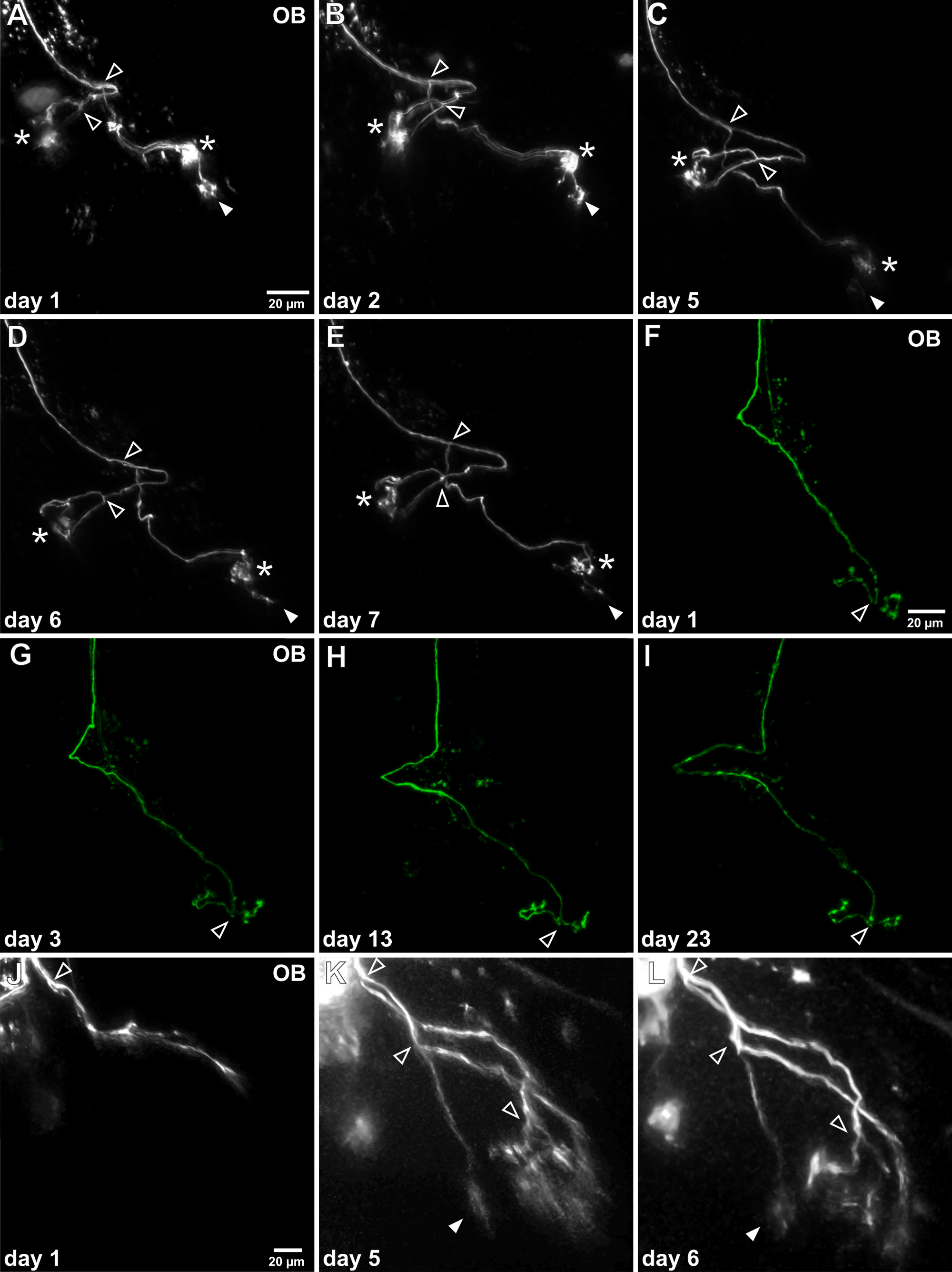
Рисунок 4. В естественных условиях покадровой съемки одиночных аксонов обонятельных нейронов. (AE)После успешного электропорации одной клетки помечены аксона может многократно визуализируется в обонятельной луковице (OB). Этот пример показывает, индивидуальный аксон, который был исследован в течение одной недели. Общая морфология не значительно изменить и два основных момента ветвления могут быть идентифицированы (открытые стрелки). Обратите внимание, что за время, конечно, один клубочковой пучок подвергается непрерывному снижению (заполняется стрелки), в то время как два других клубочковой пучки остаются стабильными (звездочки). (FI) Этот представитель пример показывает жизнеспособность долгосрочных наблюдений, была исследована эта специфическая Аксон в течение более трех недель. Нет очевидное изменение своей модели роста не могут быть обнаружены. (JL) Пример незрелой сенсорного аксона в процессе роста изображен. Это еще не подключен к клубочков и характерные клубочковой пучки отсутствуют. Через 5 дней аксонов ветви удлиненные, аксон раздвоенный несколько раз и тонкие arborizations являютсясоздана.
Обсуждение
Экспериментальная процедура описана здесь позволяет маркировке сенсорные нейроны обонятельного органа личинок X. Laevis путем электропорации флуорофоров связью декстранов и последующей визуализации сенсорной роста аксонов в живом организме. Изменяя параметры в естественных условиях электропорации можно контролировать количество меченых сенсорных нейронов. Таким образом, возможно, чтобы маркировать большие группы нейронов в сенсорном эпителии, очень мало или даже отдельных клеток.
Для обеспечения лучшего расширить нейронов маркировки важно быть особенно осторожными микропипетку характеристик и импульсов электропорации. Более высокие сопротивление пипетки и уменьшение амплитуды импульса напряжения, длительности и числа повторений может уменьшить количество меченых клеток, в то время как уменьшение пипеток сопротивлений и более высокую амплитуду импульса напряжения, длительность и число импульсов может привести к более широкому маркировки. Чте использование флуоресцентных декстранов для электропорации обеспечивает немедленную визуальную обратную связь, если применяемые параметры соответствуют. Будьте осторожны, что с помощью параметров амплитуды, длительности и числа импульсов, которые превышают значений, указанных в протоколе может потенциально привести к повреждению клеток или даже гибели клеток 17. Забитые или сломанные кончики микропипеток также может помешать успешному электропорации.
В естественных условиях электропорации в органе обоняния X. Laevis ограничивается личиночной стадии, так как кожа postmetamorphotic лягушки является жестким и не может быть легко проникает с помощью микропипетки. Визуализация в естественных нейронных процессов может быть затруднено рассеяния света возбуждения / эмиссии в более глубоких областей мозга или кровеносных сосудов. Эта проблема становится особенно очевидным в более высоких личиночных стадий за счет большего мозга и может привести к зашумленных сигналов делающих четкая идентификация мелких аксонов процессов сложнее.
Разрешения представил протокол "jove_content" визуализировать сенсорных нейронов в неповрежденной обонятельной системы без рассечения животного, повреждения элементов в процессе маркировки, готовится кусочками ткани или фиксации ткани по мере необходимости для альтернативных методов, как в маркировке цельноклеточная патча -clamp эксперименты 18. При объединении маркировку нескольких или одиночных сенсорных нейронов с в естественных условиях времени визуализации градиента, можно визуализировать клубочка соединения отдельных зрелых сенсорных нейронов на больших интервалах времени. Таким образом, также возможно, чтобы следить за развитием аксонов узоров проекционных незрелых сенсорных нейронов в течение нескольких недель. Этот последний вариант особенно интересен, так как позволяет мониторинг динамику роста отдельных аксонов в живом. Это открывает возможность для расследования клеточные и молекулярные механизмы, которые управляют аксонов и поиск пути. Несколько факторов, в том числе экспрессии рецепторов одоранта, различные ОВБМолекулы направляющие N и отдушки, вызванной / спонтанной активности сенсорных нейронов, как было показано, чтобы регулировать целевой вывод о сенсорных нейронов аксоны 4,5.Применение протокола не ограничивается обонятельных сенсорных нейронов, но также может применяться для изучения других типов клеток, например., Стволовые клетки / прародитель нейрогенных зон развивающегося мозга или митральных клеток обонятельной луковицы. Кроме того продемонстрировал метод также может быть использован в комбинации с чувствительного к кальцию декстранов или вводят мембранные проницаемым красители кальция, чтобы получить функциональную информацию о меченого нейрона и / или подключенного схемы 7,19. Наличие широкого спектра флуорофоров, соединенных с декстраны разрешает маркировку нескольких отдельных клеток или популяций с разными цветами. Плазмида также называют ДНК-раствором, например кодирования для флуоресцирующих белков, подходит для электропорации и может дополнительно повысить versatiliти и полезность техники 6. Протокол может быть дополнительно повышена, чтобы позволить сочетании электропорацию декстранов и ДНК или заряженных Morpholinos манипулировать экспрессию генов 13,17.
Описанный метод, безусловно, представляет собой новый инструмент для исследования комплекса и до сих пор не полностью изучены процессы, которые регулируют аксонов руководство в позвоночных обонятельной системы.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by DFG Schwerpunktprogramm 1392 (project MA 4113/2-2), cluster of Excellence and DFG Research Center Nanoscale Microscopy and Molecular Physiology of the Brain (project B1-9), and the German Ministry of Research and Education (BMBF; project 1364480).
Материалы
| Name | Company | Catalog Number | Comments |
| SZX16 | Olympus | Stereomicroscope with fluorescent illumination | |
| Axon Axoporator 800A | Molecular Devices | Single cell electroporator | |
| ELP-01D | npi electronic | Electroporator | |
| MMJ | Märzhäuser Wetzlar | Manual micromanipulator | |
| P-1000 | Sutter | Horizontal micropipette puller | |
| G150F-4 | Warner Instruments | Glass capillaries for electroporation pipette fabrication; internal filament makes backfilling easier | |
| Alexa 488-dextran 10 kD | Life Technologies | D22910 | |
| Alexa 546-dextran 10 kD | Life Technologies | D22911 | |
| Alexa 568-dextran 10 kD | Life Technologies | D22912 | |
| Alexa 594-dextran 10 kD | Life Technologies | D22913 | |
| TMR-dextran 3 kD (micro-Ruby) | Life Technologies | D7162 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10521 | Anesthetic; use gloves |
| A1-MP | Nikon | Multiphoton microscope | |
| LSM 780 | Zeiss | Confocal microscope | |
| Imaris | Bitplane | Alternative software for neuronal tracing |
Ссылки
- Huard, J. M., Youngentob, S. L., Goldstein, B. J., Luskin, M. B., Schwob, J. E. Adult olfactory epithelium contains multipotent progenitors that give rise to neurons and non-neural cells. J. Comp. Neurol. 400 (4), 486-4810 (1998).
- Schwob, J. E. Neural regeneration and the peripheral olfactory system. Anat. Rec. 269 (1), 33-49 (2002).
- Leung, C. T., Coulombe, P. A., Reed, R. R. Contribution of olfactory neural stem cells to tissue maintenance and regeneration. Nat. Neurosci. 10 (6), 72-726 (2007).
- Lodovichi, C., Belluscio, L. Odorant receptors in the formation of the olfactory bulb circuitry. Physiology (Bethesda. 27 (4), 212-2110 (2012).
- Mori, K., Sakano, H. How is the olfactory map formed and interpreted in the mammalian brain). Annu. Rev. Neurosci. 34, 467-499 (2011).
- De Vry, J., et al. In vivo electroporation of the central nervous system: a non-viral approach for targeted gene delivery. Prog. Neurobiol. 92 (3), 227-244 (2010).
- Hovis, K. R., Padmanabhan, K., Urban, N. N. A simple method of in vitro electroporation allows visualization, recording, and calcium imaging of local neuronal circuits. J. Neurosci. Methods. 191 (1), 1-10 (2010).
- Chen, C., Smye, S. W., Robinson, M. P., Evans, J. A. Membrane electroporation theories: a review. Med. Biol. Eng. Comput. 44 (1-2), 5-14 (2006).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J. Vis. Exp. (17), (2008).
- Gliem, S., et al. Bimodal processing of olfactory information in an amphibian nose: odor responses segregate into a medial and a lateral stream. Cell. Mol. Life Sci. 70 (11), 1965-1984 (2013).
- Hassenklöver, T., Manzini, I. Olfactory wiring logic in amphibians challenges the basic assumptions of the unbranched axon concept. J. Neurosci. 33 (44), 17252-1710 (2013).
- Bestman, J. E., Ewald, R. C., Chiu, S. -. L., Cline, H. T. In vivo single-cell electroporation for transfer of DNA and macromolecules. Nat. Protoc. 1 (3), 1272-1210 (2006).
- Nieuwkoop, P. D., Faber, J., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis. , (1994).
- Coupé, P., Munz, M., Manjón, J. V., Ruthazer, E. S., Collins, D. L. A CANDLE for a deeper in vivo insight. Med. Image Anal. 16 (4), 849-864 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nat. Biotechnol. 28 (4), 348-353 (2010).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Nezlin, L. P., Schild, D. Individual olfactory sensory neurons project into more than one glomerulus in Xenopus laevis tadpole olfactory bulb. J. Comp. Neurol. 481 (3), 233-239 (2005).
- Nagayama, S., et al. In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron. 53 (6), 789-803 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены