Method Article
Enregistrement souris vocalisations ultrasoniques pour évaluer la Communication Sociale
Dans cet article
Résumé
Mouse ultrasonic vocalizations are used as proxies to model the genetic bases of vocal communication deficits in mouse models for neuropsychiatric disorders. The present protocol describes three experimental contexts that reliably elicit ultrasonic vocalizations from pups (throughout development) and adult mice (same-sex interactions, male-estrus female interactions).
Résumé
Mice emit ultrasonic vocalizations in different contexts throughout development and in adulthood. These vocal signals are now currently used as proxies for modeling the genetic bases of vocal communication deficits. Characterizing the vocal behavior of mouse models carrying mutations in genes associated with neuropsychiatric disorders such as autism spectrum disorders will help to understand the mechanisms leading to social communication deficits. We provide here protocols to reliably elicit ultrasonic vocalizations in pups and in adult mice. This standardization will help reduce inter-study variability due to the experimental settings. Pup isolation calls are recorded throughout development from individual pups isolated from dam and littermates. In adulthood, vocalizations are recorded during same-sex interactions (without a sexual component) by exposing socially motivated males or females to an unknown same-sex conspecific. We also provide a protocol to record vocalizations from adult males exposed to an estrus female. In this context, there is a sexual component in the interaction. These protocols are established to elicit a large amount of ultrasonic vocalizations in laboratory mice. However, we point out the important inter-individual variability in the vocal behavior of mice, which should be taken into account by recording a minimal number of individuals (at least 12 in each condition). These recordings of ultrasonic vocalizations are used to evaluate the call rate, the vocal repertoire and the acoustic structure of the calls. Data are combined with the analysis of synchronous video recordings to provide a more complete view on social communication in mice. These protocols are used to characterize the vocal communication deficits in mice lacking ProSAP1/Shank2, a gene associated with autism spectrum disorders. More ultrasonic vocalizations recordings can also be found on the mouseTube database, developed to favor the exchange of such data.
Introduction
Les patients souffrant de troubles neuropsychiatriques affichent généralement des déficits dans la communication sociale (par exemple, les patients atteints de troubles du spectre autistique, la schizophrénie ou la maladie d' Alzheimer) 1. Des souris génétiquement modifiées sont de plus en plus fréquemment utilisés pour modéliser les causes génétiques de ces troubles 2. Étudier la communication sociale dans ces modèles de souris est d'un grand intérêt pour la compréhension des mécanismes de mutations génétiques conduisant à des dysfonctionnements sociaux atypiques et pour tester de nouvelles thérapies. Puisque les souris sont des animaux sociaux et de communiquer les uns avec les autres à l'aide olfactive, tactile, des signaux visuels et acoustiques, ils sont des modèles appropriés pour évaluer la communication sociale.
Vocalisations ultrasoniques souris sont maintenant couramment utilisés en tant que proxy pour modéliser les bases génétiques des déficits de communication vocaux 3,4 (mais l'existence de l' apprentissage vocal dans cette espèce est encore débattue 5,6, même si la plupart des études récentes ARGUe l'absence d'apprentissage vocal 7). Des souris de laboratoire ont été trouvés pour émettre vocalisations ultrasoniques dans les relations mère-enfant, dans les interactions socio-sexuelle mâle-femelle, dans les interactions sociales de même sexe (revue en référence 8) et dans les interactions sociales 9 juvéniles-juvénile. Chiots souris émettent des appels d'isolement pendant les deux premières semaines de la vie quand elle est isolée du barrage et littermates 10. Les mâles émettent des vocalisations ultrasonores lorsqu'il est en présence d'une femelle oestrus (ou indices urinaires de son) 11,12. Les mâles et les femelles émettent une vocalisation ultrasonique lors de l' interaction avec un congénère inconnu du même sexe 13,14. L'organisation et les fonctions de ces vocalisations ne sont pas complètement claires et doivent d'autres investigations. Les connaissances actuelles sur l'aspect fonctionnel est limité à l'explicitation du comportement de récupération chez les mères entendre les appels d'isolement des petits, la facilitation de la proximité des femelles adultes vers vocalizat mâle adulteions 15 et le comportement exploratoire accru des hommes adultes auditifs adultes vocalisations femmes 16.
Caractériser les anomalies dans la communication vocale dans des modèles murins de troubles neuropsychiatriques devrait être effectuée dans des conditions normalisées pour exclure la contribution majeure des conditions expérimentales. Ces caractérisations, combinées à l'évaluation des interactions sociales simultanées et des études neurobiologiques, dans divers modèles génétiques devraient améliorer nos connaissances sur la contribution génétique aux différents aspects de la communication par ultrasons de la souris. Sur une longue période, il devrait donner plus de lumière sur certaines bases neurobiologiques de la communication sociale chez les humains. Nous visons actuellement à fournir des protocoles simples à obtenir de manière fiable vocalisations ultrasoniques au cours du développement et à l'âge adulte pour les souris mâles et femelles dans le laboratoire. Ces protocoles devraient faciliter la normalisation des enregistrements à comparer de façon plus fiable ultrles émissions de vocalisation Asonic entre les souches et les laboratoires. Il devrait également faciliter la mise en place de ces enregistrements dans les laboratoires ayant aucune expérience préalable avec la souris vocalisations ultrasoniques enregistrements. Nous soulignons également la possibilité actuelle de combiner les données de vocalisations ultrasoniques avec des données comportementales détaillées collectées simultanément au cours des interactions sociales chez les souris adultes, afin d'obtenir des informations cruciales sur les déficiences sociales, ainsi que sur le contexte de l'émission des vocalisations ultrasoniques. Ces analyses permettront un éclairage nouveau sur l'organisation et les fonctions des vocalisations ultrasoniques de souris. Enfin, nous annonçons également la possibilité de partager des enregistrements de vocalisation ultrasonique avec toute la communauté scientifique sur la base de données mouseTube (http://mousetube.pasteur.fr). Accès libre aux données d'enregistrement audio devrait stimuler la connaissance sur la communication par ultrasons de la souris en permettant aux scientifiques de comparer leurs propres données avec vocalisations ultrasoniques enregistrées dans d'autres laboraratoires (avec des souches / protocoles similaires ou différents), et / ou de contester leurs méthodes d'analyse avec les fichiers enregistrés dans des conditions différentes.
Protocole
déclaration d'éthique: Les procédures impliquant des sujets animaux ont été approuvés par le Comité d'Ethique en Expérimentation animale (Cetea) n ° 89 à l'Institut Pasteur, Paris.
1. Préparation d'un animal
- Pour enregistrer les appels d'isolement des petits, obtenir les femmes enceintes à partir de la souche de souris d'intérêt. Note: Race mâles et les femelles hétérozygotes pour obtenir au moins 10 portées, y compris de type sauvage, hétérozygotes et knock-out chiots pour obtenir robustes animaux témoins.
- Obtenir deux catégories de souris adultes pour enregistrer les vocalisations pendant les interactions du même sexe.
- Obtenir au moins 12 mâles ou 12 femelles de chaque génotype que les souris de test à partir de la souche d'intérêt (pour tenir compte de la variabilité inter-individuelle). Remarque: Ce protocole est bien adapté pour les adultes, mais elle peut être ajustée à des mineurs, avec un temps d'isolement réduite avant l'expérience 9. Ce test fonctionne pour les hommes ou les femmes. Cependant, évitez les tests de sexe masculins à partir de souches de souris qui présentent un phénotype agressif clair dans le test d'interaction sociale mâle-mâle.
- Afin de maximiser la quantité d'interactions affiliatifs, isoler les animaux d'essai avant les expériences. Maison mâles individuellement pendant 3 semaines (pour réduire les interactions agressives au minimum 14,17) et les femelles pendant 3 jours (E. Ey, données non publiées) pour accroître leur motivation sociale.
- Obtenir des mâles ou des femelles à partir de souches représentatives de l'arrière - plan génétique de la souche de test pour les utiliser comme nouveaux venus (par exemple, que les souris en interaction, voir la section 3.1.3). Par exemple, si la souche mutante à l'étude a été généré sur la C57BL / 6J, utilisez C57BL / 6J comme nouveaux venus. Calculer le nombre d'animaux nécessaires pour que chacune de ces souris est pas utilisé plus de 2 fois par jour comme nouveau venu. Maison dans des groupes.
- Obtenir deux catégories de souris adultes pour enregistrer les vocalisations mâles en présence d'une femelle oestrus.
- Obtenir à lEst 12 mâles sexuellement matures de chaque génotype de la souche d'intérêt (pour tenir compte de la variabilité inter-individuelle). Remarque: Si les hommes ont jamais eu l' expérience avec les femmes avant, les mettre dans des cages individuelles et de les laisser passer une nuit avec deux femmes jours avant le test afin d' accroître leur motivation pour émettre vocalisations ultrasoniques 6.
- Obtenir les femelles sexuellement matures de la souche des mâles enregistrés d'arrière-plan. Par exemple, si les mâles mutants étudiés ont été générées sur la C57BL / 6J, utiliser C57BL / 6J femelles. Calculer le nombre de femelles nécessaires pour que chacune de ces souris ne sert plus de 3 fois par jour. Maison dans des groupes.
2. Pup Appels d'isolement
- Pup identification
- Trois jours avant la date prévue de la naissance, isoler les femelles enceintes.
- Vérifiez les femelles pour la naissance tous les matins et tous les soirs. Notez le jour de la naissance comme P0.
- Identifier les chiots à P1 à l'aide de longue durée patte tatouages (injection sous-cutanée de tatouage vert coller avec 0,3 mm x 13 mm [30 G ½ "] aiguille). Créer un code avec un, deux, trois ou quatre pattes marquées. Soyez aussi vite que possible, de perturber au minimum les chiots, et les remettre dans le nid le plus tôt possible.
- Mettre en place la cage pour enregistrement Pup appels d'isolement.
- Utilisez soit une chambre de self-made-insonorisé (figure 1A) ou une boîte en polystyrène simple. Placer un thermomètre dans le boîtier pour surveiller la température de chaque enregistrement. Assurez-vous que la température reste comprise entre 18 ° C et 22 ° C.
- Placez un microphone en haut (à travers un trou dans le haut de la boîte). Réglez la hauteur du microphone de telle sorte que la membrane du microphone est 12-15 cm au-dessus du fond de la boîte où le chiot va se coucher. Connectez le microphone à la carte son et la carte son de l'ordinateur.
- Pour régler le gain du soue carte, procéder à un essai d'enregistrement avec un chiot qui ne sera pas utilisé dans l'expérience. Mettez le chiot dans les mêmes conditions que dans l'expérience (voir 2.3.1). Ferme la porte. Réglez le gain sur la carte son, de sorte que ce soit sur la valeur maximale (pour avoir la plus grande amplitude possible pour les vocalisations), mais sans surcharger (vérifier sur l'écran du spectrogramme en direct sur le logiciel d'enregistrement).
Remarque: Quelques appels peuvent être surchargés si l'amplitude de la majorité des appels est maintenue au plus haut niveau possible. - Inscrivez-vous le niveau de gain pour chaque session d'enregistrement et ne pas changer entre les chiots / litières / sessions. Les variations des niveaux de gain conduirait à la détection d'appels inexacts et les variables acoustiques mesures avec les mêmes seuils dans les analyses utilisant la détection automatique et mesures (voir 5.1 à 5.4).
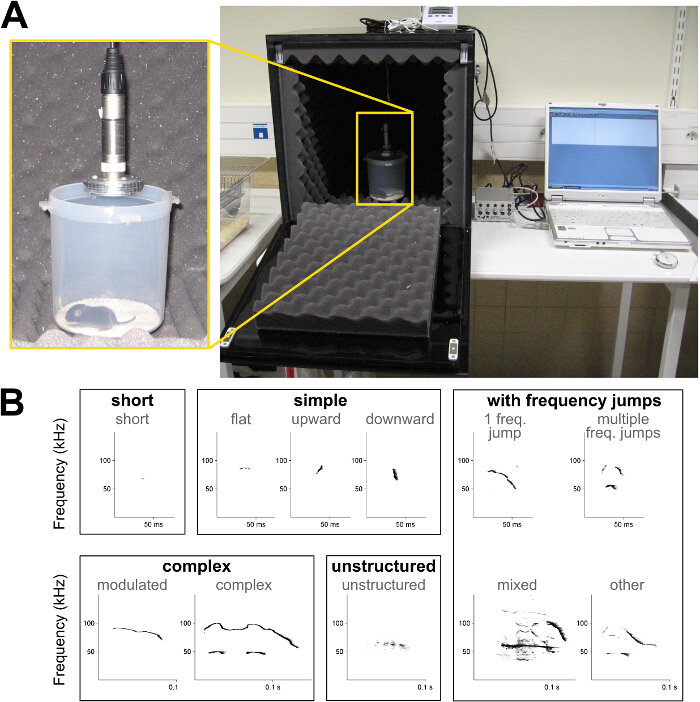
Figure 1: Mettre en place pour enregistrer l' isolement des appels de souriceaux et spectrogrammes de vocalisations ultrasoniques (A) Exemple d'une chambre insonorisée self-made pour enregistrer les appels d'isolement des petits.. (B) spectrogrammes des différents types d'appels utilisés dans la présente classification du type d'appel; voir la description dans le tableau 1. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Procéder à l'enregistrement de l'isolement des petits appelle tous les deux jours. Effectuer des enregistrements dans la matinée pour petits nés dans la nuit, et dans l'après-midi pour les petits nés au cours de la journée pour éviter la catégorisation dans les mêmes chiots de classe d'âge avec une demi-journée de différence d'âge. Ceci est le plus notable pour les très jeunes stades P2 et P4.
- Prenez un chiot dans la litière. Placer rapidement et doucement que possible dans un récipient en plastique lavé avec de l'éthanol à 10% et on sèche (diamètre: 9cm; hauteur: 10 cm pour empêcher les chiots âgés de sortir de la zone couverte par le microphone). Mettez le destinataire juste sous le microphone.
- Fermez la boîte aussi rapidement et silencieusement que possible. Commencez l'enregistrement de chiot vocalisations ultrasoniques dans le logiciel d'enregistrement (format 16 bits, 300 kHz de fréquence d'échantillonnage pour capter l'amplitude sonore jusqu'à 150 kHz avec une haute qualité).
- Après le temps nécessaire de l'enregistrement écoulé (jusqu'à 5 min), arrêtez l'enregistrement. Prenez le chiot hors de la boîte. Notez les tatouages de patte du chiot.
- Prendre la température axillaire du chiot avec une sonde-thermomètre. Mark le chiot sur son dos avec un petit point avec un stylo à odeur-moins (encre de l'eau), de reconnaître plus facilement les chiots déjà enregistrés dans le nid quand le prochain est choisi et d'éviter la manipulation de tous les chiots à chaque fois qu'une nouvelle est choisi. Mettez le chiot de retour dans le nid.
- Laver le récipient en plastique et la matière plastique recouvrant le fond avec 10% d'éthanol et bien le sécheravant de mettre le prochain chiot à l'intérieur.
- Choisissez le prochain chiot dans la litière et répéter 2.3.
- Vérifiez le poids du corps, la coordination motrice, géotaxie négative, et les marques de développement (pour les détails de la batterie d'essais réduite s'il vous plaît voir les sections de la méthode dans Schmeisser et al. 18 et dans Ey et al. 19) après une période de repos de 1 heure pour permettre les chiots de récupérer après l'émission épuisante de vocalisations ultrasoniques. Utiliser une autre cohorte d'animaux si la batterie de tests complète du développement comme dans Chadman et al. , Et 20 Scattoni et al. , 21 est menée.
- Répétez ces enregistrements tous les deux jours entre P2 et P12 pour caractériser chiot comportement vocal et le développement tout au long de leurs deux premières semaines de vie.
3. ultrasons vocalisations lors du même sexe Interactions sociales
- vocalisation Recordings
- Préparer une cage d'essai (50 x 25 cm x 30 cm 3; Plexiglas, 100 lux [lumière blanche de faible intensité]) nettoyés avec de l'eau de savon, séchés et remplis de 2 cm de la litière fraîche dans la chambre insonorisée.
- Placez le microphone afin que les vocalisations émises par tous les coins de la cage peuvent être enregistrées. Fixer le microphone dans un coin de la cage de test (soit sur la cage ou sur un trépied) et régler le microphone-cage inférieure d'angle pour couvrir toute la surface de la cage.
Remarque: Ultrasons sont très directionnel. - Placer une caméra vidéo sur la partie supérieure de la chambre insonorisée pour capturer toute la surface de la cage d'essai.
Remarque: Vérifiez que le microphone ne se cache pas un coin de la cage de test sur la vidéo. - Avant l'essai, ajuster le gain de la carte son avec un mâle et une femelle de rechange de rechange qui ne sera pas utilisé dans l'expérience plus tard. Mettre ces animaux dans la cage d'essai dans la chambre d'enregistrement. Réglez le niveau de gain sur la carte son afin de maximiser l'amplitude des vocalisations enregistrées but pour minimiser la surcharge comme on le voit dans l'affichage de spectrogramme en direct sur le logiciel d'enregistrement.
Remarque: Le gain dépend de la distance entre le microphone et les animaux de vocalisation.
- Placez le microphone afin que les vocalisations émises par tous les coins de la cage peuvent être enregistrées. Fixer le microphone dans un coin de la cage de test (soit sur la cage ou sur un trépied) et régler le microphone-cage inférieure d'angle pour couvrir toute la surface de la cage.
- Introduire l'animal à tester (mâle ou femelle, il sera appelé le «occupant») dans la cage d'essai sur la litière fraîche. Laissez habituer à la cage d'essai dans la chambre insonorisée pendant 20 minutes afin de maximiser son intérêt pour le congénère inconnu introduit en 3.1.3.
- Après cette période d'habituation, introduire le 2 ème animal pour l'interaction (mâle ou femelle, même sexe que l'occupant, mais différentes marques auriculaires / patte tatouage pour les identifier plus tard, il sera appelé le «nouveau venu»).
- Commencez à enregistrer les vocalisations ultrasoniques (format 16 bits, 300 kHz de fréquence d'échantillonnage pour capter l'amplitude sonore jusqu'à 150 kHz avec une haute qualité) et la vidéo pour capturer l'introduction du nouveau venu dans la cage d'essai. Commencer l'enregistrement uvocalisations ltrasonic pendant habituation (occupant seul) si une comparaison entre le niveau de vocalisation émission de référence lors de l'exploration de la cage et l'interaction sociale est nécessaire.
- Synchroniser manuellement / visuellement les enregistrements audio et vidéo en appuyant sur la montre de temps ( "bip" sonore à proximité du microphone) exactement quand les pattes arrière de la souris nouveau venu toucher le sol.
- Laisser les deux animaux interagissent pendant le temps désiré (par exemple 4 minutes, une durée suffisante pour collecter suffisamment de vocalisations ultrasoniques).
- Mettez l'occupant et le nouveau venu de retour dans leurs cages d'accueil respectives. Vider la litière utilisée de la cage de test, le laver avec de l'eau savonneuse et le sécher avec des serviettes en papier. Mettez la literie fraîche et le replacer dans la chambre insonorisée pour le prochain test.
- Préparer une cage d'essai (50 x 25 cm x 30 cm 3; Plexiglas, 100 lux [lumière blanche de faible intensité]) nettoyés avec de l'eau de savon, séchés et remplis de 2 cm de la litière fraîche dans la chambre insonorisée.
4. Homme vocalisations lors de l'interaction avec un Estrus Femme
- Tôt le matin, le jour de l'essailes hommes, prennent des frottis vaginaux de chaque femelle afin de déterminer leur statut sexuel dans le cycle de l'oestrus.
- Tenir la femelle par la queue et la maintenir sur la grille de la cage. Utiliser une pipette pour rincer le vagin plusieurs fois avec 20 ul de PBS (c. -à injecter et rappeler les mêmes 20 ul de PBS plusieurs fois). Rappelez-vous les 20 pi de PBS avec la même pointe de la pipette. En utilisant du PBS stérile, pour éviter toute infection si les femelles doivent être testés pendant plusieurs jours consécutifs.
- Passez le PBS contenant la suspension de cellules vaginales sur une diapositive. Mettez quatre échantillons sur une diapositive (identifier les personnes sur le côté de la lame avec un crayon). Laissez les diapositives sécher avant de procéder à la coloration.
- Travailler sous la hotte de laboratoire.
- Préparer un bain de May-Grünwald pur, un bain de solution de tampon phosphate (0,1 M) et un bain de Giemsa R (1/20 dans une solution tampon phosphate).
- Placez les diapositives dans le bain de May-Grünwald pur pendant 3 min, puisrincer dans le bain de solution de tampon phosphate pendant 1 min, et enfin les transférer pendant 10 minutes dans le bain de Giemsa R (1/20 dans une solution tampon phosphate).
- Après cela, rincez les lames à nouveau dans le bain de solution de tampon phosphate pendant 10 secondes et les laisser sécher.
- Examiner les lames colorées au microscope. Les femelles qui peuvent être utilisés pendant la journée sont ceux dont les échantillons présents que de grandes cellules épithéliales cornées (sans noyau, teinté en bleu, plein oestrus).
- Mettez les mâles dans la chambre d'essai d'au moins 30 min avant de les tester.
- vocalisation Recordings
- Répéter 3.1 si nécessaire.
- Introduire le mâle à tester (sur la literie fraîche). Laissez-le habituer à la cage de test dans la chambre insonorisée pendant 10 min.
- Après cette période d'habituation, d'introduire une femelle en oestrus (parmi ceux sélectionnés à partir de la coloration).
- Commencez à enregistrer les vocalisations ultrasoniques et la vidéopour capturer l'introduction de la femelle dans la cage d'essai. Commencez à enregistrer les vocalisations ultrasoniques pendant habituation (mâle seul) si une comparaison entre le niveau de vocalisation émission de référence lors de l'exploration de la cage et l'interaction sociale est nécessaire.
- Synchroniser manuellement / visuellement les enregistrements audio et vidéo en appuyant sur la montre de temps ( "bip" sonore à proximité du microphone) exactement quand les pattes arrière de la souris femelle touchent le sol.
- Laisser les deux animaux interagissent pendant le temps désiré (par exemple 4 minutes, une durée suffisante pour collecter suffisamment de vocalisations ultrasoniques).
- Mettez le mâle et la femelle de retour dans leurs cages d'accueil respectives. Vider la litière utilisée de la cage de test, le laver avec de l'eau savonneuse et le sécher avec des serviettes en papier. Mettez la literie fraîche et le replacer dans la chambre insonorisée pour le prochain test.
Note: Il est optimal d'utiliser chaque femelle oestrus qu'une seule fois chaque jour (mais si nécessaire, il peutêtre utilisé jusqu'à 3 fois le même jour, mais pas dans une rangée).
5. Variables à extraire
- Préparer des fichiers audio pour les analyses. Remarque: La procédure ci - dessous est spécifique à A ViSoft SASLab Pro et peut varier en fonction du logiciel utilisé.
- Couper les fichiers de sorte qu'ils commencent exactement au "bip" de la montre de temps, et se terminer après la durée souhaitée (5 min pour les enregistrements de chiot, 4 min pour les enregistrements adultes).
- Filtrez la amplitude de moins de 30 kHz en utilisant un filtre passe-haut (Edition> Filtre> Filtre FIR Time Domain; High Pass avec une fréquence de 30 kHz coupée). Utilisez le traitement par lots pour filtrer tous les fichiers d'intérêt (Actions> Traitement par lots> filtre FIR).
- Identifier chaque vocalisation ultrasonique en les étiquetant avec le logiciel.
- Utilisez la détection automatique pour les enregistrements de chiot (Outils> Etiquettes> Créer la section des étiquettes à partir des événements de forme d'onde). Régler seuil, temps de maintien et de la marge fou la détection la plus précise. Vérifier manuellement la détection et ajuster les étiquettes si nécessaire (recommandé).
- Utiliser la détection visuelle (insertion manuelle d'étiquettes) pour les enregistrements adultes avec le bruit de fond (sélectionnez les vocalisations, clic droit, et insérer la section étiquette du marqueur).
- Créer le spectrogramme. Activer les mesures automatiques de paramètres (Outils> Mesures des paramètres automatiques> Mesures de paramètres automatiques Configurer).
- Cochez la case "Activer les mesures automatiques", les "paramètres Compute de toute spectrogramme", et les cases "de mise à jour automatique". Sélectionnez "séparation Element": interactive (étiquettes de section).
- Cochez les cases pour calculer les paramètres souhaités temporels (Durée de l'élément, Intervalle, Start / Heure de fin) et les paramètres en fonction spectre (fréquence de pointe), et l'emplacement des mesures (Début de l'élément, Fin de l'élément, Moyenne, Max, Min) .
- Copiez les mesures et collez lem dans une feuille de calcul.
Remarque: Pour les enregistrements effectués avec des adultes, des mesures de paramètres en fonction spectre pourrait être impossible à cause du bruit de fond. Utilisez des mesures manuelles de la fréquence maximale en cliquant sur les différentes valeurs de fréquence directement sur le spectrogramme et coller manuellement les valeurs dans un tableau.
- Déterminer le taux d'appel, à savoir, le nombre d'appels par minute en déterminant d' abord le nombre de vocalisations émises (nombre total d'étiquettes). Ensuite, calculer le taux d'appel en divisant le nombre total de vocalisations enregistrées par la durée (en minutes) du fichier.
- Déterminer l' organisation temporelle, à savoir la distribution des intervalles de temps entre les appels afin de déterminer l' organisation de la séquence.
- Calculer les intervalles de temps entre la fin de la vocalisation n et le début de la vocalisation n + 1 en utilisant le temps de chaque étiquette de début / fin.
- Établir la densité de distribution des intervalles de temps entre Ultrasonvocalisations ic.
- Déterminer appel répertoire, à savoir, définir les types présents dans l'enregistrement d'appel. Utilisez l'exemple de la classification présentée dans le tableau 1 et la figure 1B.
- Lorsque l'étiquetage de chaque vocalisation en 5.1.3, écrivez le nom du type d'appel dans l'étiquette.
- Calculer le nombre exact et la proportion de chaque type d'appel pour construire le répertoire vocal.
- Déterminer les caractéristiques acoustiques pour chaque vocalisation, à savoir, la durée, la fréquence de crête ( par exemple, la fréquence avec la plus grande amplitude) au début et à la fin de l'appel, la fréquence maximum et le minimum de crête et la fréquence moyenne si la mesure automatique est possible (figure 1B) .
- Utilisez la fonction automatique de mesures de paramètres dans le logiciel pour mesurer automatiquement la durée, les caractéristiques de fréquence de pointe (par exemple, début, fin, moyenne, maximum, minimum) dans les enregistrements de chiot.
- Utiliser la durée de l'étiquette telle que la durée de la vocalisation pour les enregistrements adultes. Mesurer manuellement sur la fenêtre de spectrogramme les caractéristiques de fréquence de pointe (par exemple, début, fin, maximum, minimum).
- Couple de données de vocalisation ultrasonique et des données d'interaction sociale (MiceProfiler plugin à partir de la plate - forme ICY 22).
- Assurez-vous de synchroniser aussi précisément que possible l'audio et les enregistrements vidéo comme décrit dans le protocole.
- Encode la vidéo de l'interaction sociale en utilisant la souris Profiler Tracker plug - in de la plate - forme ICY comme décrit dans de Chaumont et al. 22. Démarrez le suivi exactement quand les pattes arrière de l'animal introduit touchent le sol.
- Téléchargez le fichier vidéo codé et son fichier xml correspondant (généré par souris Profiler Tracker) dans la souris Profiler Video Label Maker Plugin de la plate - forme ICY comme décrit dans de Chaumont etal. , 22.
Remarque: La souris Profiler Video Label Maker Plugin reliera automatiquement le fichier vidéo et le fichier texte généré à partir de l'analyse du fichier audio si elles ont le même nom (voir: http://icy.bioimageanalysis.org/plugin/Mice_Profiler_Video_Label_Maker) . - Après avoir vérifié que l'échelle de la souris est correcte, cliquez sur "Créer" USV stats pour chaque fichier pour obtenir le nombre et la proportion de vocalisations émises au cours de chaque événement social dans un fichier séparé.
6. Téléchargement de fichiers sur la base de données mouseTube
- Assurez-vous que les fichiers sont sur un serveur de stockage qui peut être accessible depuis l'extérieur de l'institution.
Remarque: Les serveurs hébergés dans certains établissements ayant des niveaux élevés de sécurité auront besoin d'une configuration spécifique pour être accessible par des personnes se connectant depuis l'extérieur de l'institution. - Allez sur le site mouseTube (http://mousetube.pasteur.fr). Connectez-vous (identifier une mot de passe sont attribués à chaque utilisateur par les administrateurs).
- Vérifiez si la souche de souris déjà enregistré existe dans la base de données mouseTube en cliquant sur le bouton "Souches". Sinon, demandez aux administrateurs de créer.
- Créer des sujets en utilisant les "sujets> Créer" bouton. Entrez les codes d'identification des animaux enregistrés. Rassemblez-les en groupes pour faciliter la récupération ultérieure des données.
- Entrez la description du protocole utilisé pour enregistrer les vocalisations ultrasoniques utilisant les "Protocoles> Créer" bouton.
- Créer une expérience pour chaque session d'enregistrement en utilisant les "Expériences> Créer un" bouton. Spécifiez le protocole, le groupe d'individus qui ont été enregistrées, le matériel et les logiciels utilisés et leurs spécificités.
Remarque: L'expérience rassemble toutes les métadonnées correspondant aux fichiers de vocalisation. - Créer le lien vers les fichiers de vocalisation en utilisant les "Vocalisations> Create & #34; bouton. Sélectionnez l'expérience au sein de la liste. Copier-coller l'adresse du fichier de vocalisation (ce lien commence par http: // ...) dans le champ correspondant du "Fichiers de lien" colonne. Valider les entrées en cliquant sur le bouton "Créer un lien entre mouseTube et les fichiers".
Note: Il est pas tenu de remplir chaque case pour chaque fichier en même temps. - Si nécessaire, modifier les liens saisis à tout moment, et ajouter des détails dans la section «Notes». Ne pas hésiter à écrire des notes pour donner plus de détails. Par exemple, si un lien vers un fichier vidéo qui a été enregistrée en même temps que le fichier audio a été saisi, cela peut être spécifié dans les «Notes».
Résultats
Avec les présents protocoles, nous avons caractérisé le comportement vocal des souris dépourvues ProSAP1 / SHANK2, un gène associé à des troubles du spectre autistique (TSA) 23-25. ASD se caractérisent par des déficits dans la communication sociale et les comportements stéréotypés 1. Nos SHANK2 - / - souris affichent l' hyperactivité, l' augmentation de l' anxiété et la communication vocale atypique 18,26. En effet, nous avons constaté que SHANK2 - / - souris affiche un profil de développement atypique dans leur taux d'appels d'isolement de chiot d'émission par rapport à l'inverse courbe typique en forme de U dans leurs congénères de type sauvage SHANK2 -. / - Souris affiche un taux d'appel a augmenté à P4 et une diminution de taux d'appel à P6 en comparaison avec leurs congénères de type sauvage (figure 2). Nous avons également observé un taux d'appel a diminué dans les interactions femelles impliquant un SHANK2 - / - femelle dans COMPARAISOn avec des interactions impliquant un littermate de type sauvage (Figure 2). Nous avons examiné le répertoire des 5 catégories d'appels différents. Il a semblé être différent entre les petits (par exemple ici P2, P6 et P10) et les adultes (figure 3). différences liées Génotype-étaient significatives pour la plupart à l'âge adulte. Pendant les interactions sociales impliquant des adultes SHANK2 - / - mâles ou des femelles avec un C57BL / 6N femelle, appels plus courts et des appels non structurés ont été enregistrés par rapport aux interactions impliquant leurs congénères de type sauvage (Figure 3D et E). Appels et la fréquence des sauts moins complexes appels ont également été enregistrées au cours des interactions avec C57BL / 6N femme impliquant SHANK2 adulte - / - femelles par rapport aux interactions impliquant SHANK2 + / + femelles (Figure 3E). Enfin, nous avons également mesuré les variables acoustiques manuellement. Il n'y avait pas liée génotype différence significative dule développement de l'anneau. En revanche, la durée des appels enregistrés au cours des interactions impliquant des SHANK2 adultes - / - femelles étaient plus courtes que celles enregistrées au cours des interactions impliquant leurs congénères de type sauvage (figure 4A). Nous avons également souligné que la fréquence maximale de vocalisations ultrasoniques a augmenté au cours du développement des petits sans différence significative liée génotype-26. Pendant les interactions impliquant SHANK2 - / - mâles ou femelles avec C57BL / 6N femelle, vocalisations ultrasoniques avaient une fréquence de crête inférieure en comparaison avec les appels enregistrés pendant les interactions impliquant leurs congénères de type sauvage (figure 4B).
En outre, le présent Protocole a également permis d'étudier le contexte de l' émission des vocalisations ultrasoniques en combinant les données à partir d' enregistrements audio aux données comportementales extraites de MiceProfiler (logiciel ICY, Institut passéeseur, Paris). Par exemple, dans les interactions femmes-femmes, la plupart des vocalisations ultrasoniques ont été émis lorsque les animaux étaient en contact et plus précisément l'occupant renifler la région ano-génitale du nouveau venu, ou au moins l'occupant étant derrière le nouveau venu. Les souris également émis de nombreuses vocalisations ultrasoniques lorsque l'occupant a approché le nouveau venu (figure 5, panneau supérieur). Moins vocalisations ont été enregistrés lorsque le SHANK2 des occupants - / - souris ont été en contact physique avec le nouveau venu (par exemple, reniflant la région ano-génitale du nouveau venu) que lorsque l'occupant est une souris de type sauvage. Moins vocalisations ont été déclenchées lorsque l'occupant derrière le nouveau venu était un SHANK2 - / - souris que quand il était une souris de type sauvage. Plus de vocalisations ont également été enregistrés au moment où le nouveau venu était dans le champ visuel de la souris de l' occupant, et plus encore dans les types sauvages que dans les mutants (figure 5, panneau inférieur).
s = "jove_content" fo: keep-together.within-page = "1"> 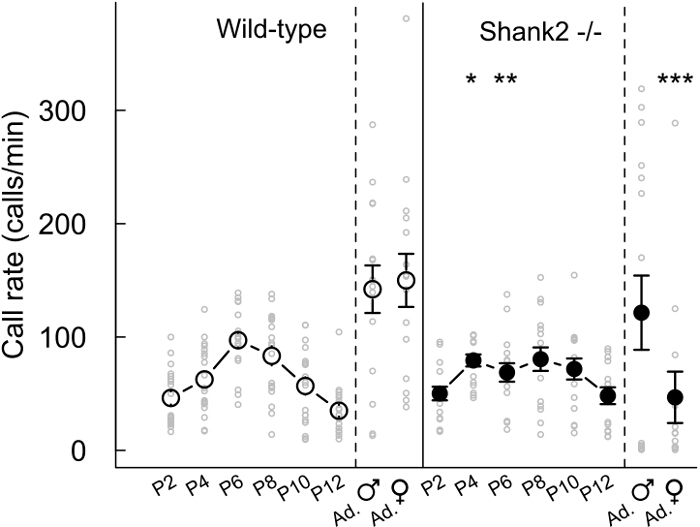
Figure 2:. Taux d'émission des vocalisations ultrasoniques au cours du développement et chez les mâles adultes et SHANK2 femme - / - souris et littermates de type sauvage taux de chiots Appel (tous les deux jours de P2 à P12, n = 18-19 SHANK2 + / +, n = 15-16 SHANK2 - / -) et les adultes au cours mâle-oestrus interactions femelles (n = 15 SHANK2 + / +, n = 16 SHANK2 - / -) et les interactions femme-femmes (n = 15 SHANK2 + / +, n = 13 SHANK2 - / -) chez les souris de type sauvage (panneau de gauche) et SHANK2 - / - souris (panneau de droite). Les données sont présentées sous forme de moyenne +/- SEM et des points individuels (non apparié tests de Wilcoxon: * p <0,05, ** p <0,01, *** p <0,001).ge.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
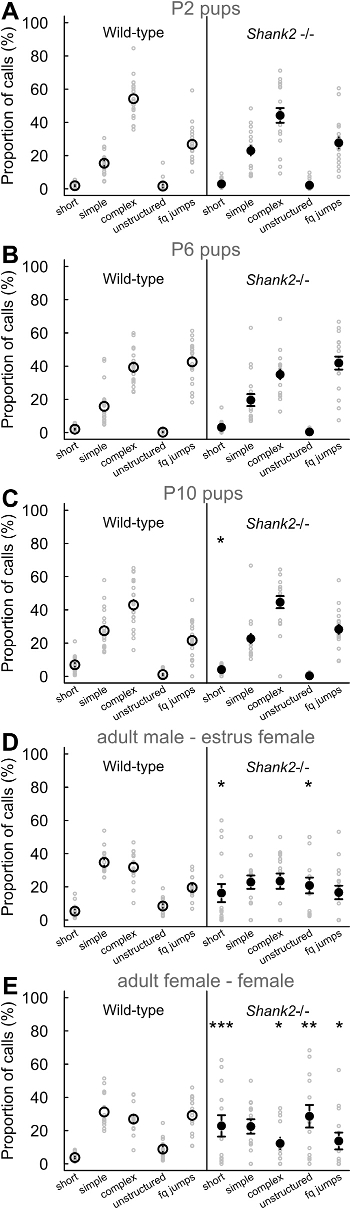
Figure 3:. Répertoire vocal de SHANK2 - / - souris et littermates de type sauvage Proportions des cinq différents types d'appels émis par les petits P2 (A; n = 20 SHANK2 + / +, n = 18 SHANK2 - / -), chiots P6 (B; n = 19 SHANK2 + / +, n = 18 SHANK2 - / -), chiots P10 (C; n = 20 SHANK2 + / +, n = 18 SHANK2 - / -), les mâles adultes avec une femelle oestrus (D n = 16 SHANK2 + / +, n = 16 SHANK2 - / -) et les femelles adultes avec une autre femelle (E; n = 15 SHANK2 + / +, n = 13 SHANK2 - chez les souris de type sauvage (panneaux de gauche) et SHANK2) - - / / - souris (panneaux de droite). Les données sont présentées sous forme de moyenne +/- SEM et des points individuels (tests de chi carré: * p <0,05, ** p <0,01, *** p <0,001). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
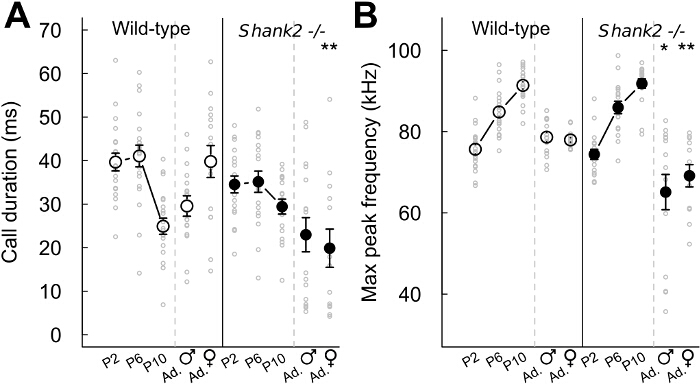
Figure 4:. Les variables acoustiques extraites de vocalisations ultrasoniques dans SHANK2 - / - souris et littermates de type sauvage (A) Durée de tous les types d'appels confondus émis par les petits P2 (n = 20 SHANK2 + / +, n = 18 SHANK2 - / - ), les petits P6 (n = 19 SHANK2 + / +, n = 18 SHANK2 - / -), les petits P10 (n = 20 SHANK2 + / + , n = 18 SHANK2 - / -), les mâles adultes avec une femelle oestrus (n = 16 SHANK2 + / +, n = 16 SHANK2 - / -) et les femelles adultes avec une autre femelle (n = 15 SHANK2 + / +, n = 13 SHANK2 - / -) chez les souris de type sauvage ( à gauche) et SHANK2 - / - souris (panneau de droite). (B) la fréquence maximale de crête mesurée sur tous les types d'appels confondus dans les chiots P2, P6 chiots, chiots P10, les mâles adultes avec une femelle oestrus et femelle adulte avec une autre femelle (même Ns comme ci - dessus). Les données sont présentées sous forme de moyenne +/- SEM et des points individuels (non appariés teste Wilcoxon: * p <0,05, ** p <0,01, *** p <0,001). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
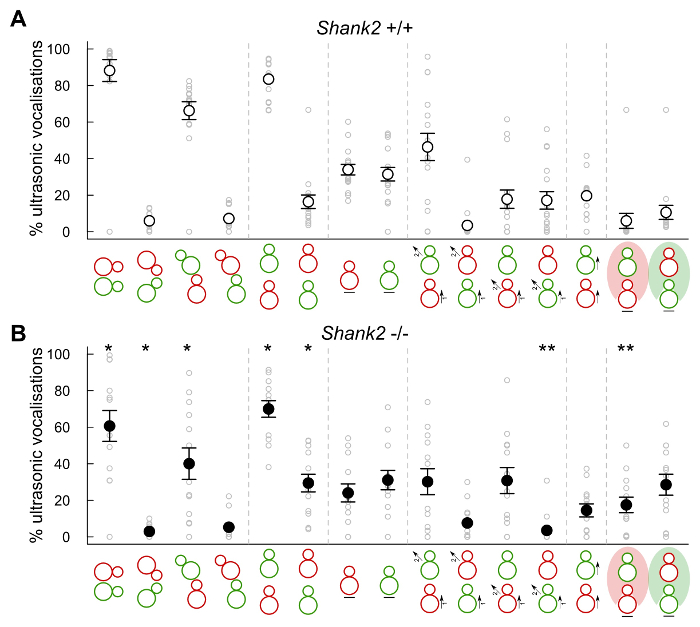
Figure 5: Contexte. s d'émission des vocalisations ultrasoniques de souris dans les interactions adulte femelle-femelle sociale Proportion des vocalisations ultrasoniques émises par des paires comportant un SHANK2 + / + une / souris 6N C57BL (n = 16, A) et les paires comportant une SHANK2 - / - avec a / souris 6N C57BL (n = 13, B) pendant les types d'événements comportementaux suivants (rouge: occupant, vert: nouveau venu): contacts sociaux, oro orale contact, ano-génitales sniffing de la souris occupant, ano- génitales renifler de la souris nouveau venu, occupant derrière nouveau venu, nouveau venu derrière l'occupant, l'immobilité de l'occupant, l'immobilité du nouveau venu, l'approche de l'occupant et échapper au nouveau venu, l'approche du nouveau venu & échapper à l'occupant, l'approche et échapper à l'occupant, l'approche et échapper au nouveau venu, occupant suivant le nouveau venu, nouveau venu dans le domaine de l'occupant, occupant la vision dans le domaine du nouveau venu vision. Les données sont pressentie comme moyenne +/- SEM et des points individuels (tests non apparié de Wilcoxon: * p <0,05, ** p <0,01). Les données non publiées. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| types d' appels | La description |
| court | durée ≤5 msec et la fréquence gamme ≤6.25 kHz |
| simple | durée> 5 ms et la fréquence gamme ≤6.25 kHz (plat), ou la modulation de fréquence dans une seule direction (vers le haut ou vers le bas) avec la gamme de fréquence> 6,25 kHz |
| complexe | modulations de fréquence dans plus d'une direction et de fréquence> 6,25 kHz (modulation), ou l'inclusion d'un ou plusieurs autres fréquences component (phénomènes harmoniques ou non-linéaires, mais pas de saturation), mais aucune contrainte sur la gamme de fréquences (complexe) |
| sauts de fréquence | inclusion d'un saut (un saut de fréquence) ou plusieurs sauts (sauts de fréquence, d'autres) en fréquence sans intervalle de temps entre les composantes de fréquence consécutives, avec (mixte) ou sans une partie bruyante au sein de l'appel de son pur |
| non structurées | pas identifiable composant son pur; appels "bruyants" |
Tableau 1:. Caractéristiques des cinq types de vocalisations ultrasoniques de souris Des exemples de critères de durée, gamme de fréquences, modulations de fréquence et de sauts de fréquence utilisées pour déterminer 5 différents types d'appel au sein de vocalisations ultrasoniques de souris.
Discussion
Le protocole présenté ici fournit des méthodes normalisées et fiables pour recueillir des vocalisations ultrasoniques de souris dans le laboratoire. Ces situations très limitées présentent l'avantage de la normalisation. Ils sont utilisés avec succès pour comparer les souches ou génotypes au sein des souches 18,19,26,27. Tel que présenté dans les résultats représentatifs, ces méthodes permettent l'identification de la communication sociale atypique chez les souris mutées pour SHANK2, un gène associé à des troubles du spectre autistique. Les comparaisons entre les souches de souris, entre les différents contextes ou même entre les laboratoires seront déclenchés par la disponibilité de grands ensembles de données sur la base de données mouseTube. Cet outil devrait stimuler les études sur les vocalisations ultrasoniques de souris en permettant des analyses multivariées.
Les protocoles décrits ici sont optimisés pour tester les souris des génotypes différents au sein d'une souche, comme cela se fait dans la majorité des études sur la modélisation de la génétique contribution à des troubles neuropsychiatriques. Il est recommandé de concevoir expérimentalement chaque étude pour avoir les meilleurs contrôles possibles. En effet, les effets de la litière peuvent masquer ou gonfler artificiellement les effets génétiques 28,29. Il est donc conseillé d'inclure des contrôles de même portée pour chaque génotype. Elevage parents hétérozygotes devraient donc être favorisés, car il permettra à l'adaptation correcte des souris mutantes et de contrôle au sein d'une litière. Cela justifie le marquage de tous les chiots tatouage de la patte (aveuglé génotype) pour suivre les individus à travers les enregistrements tous les deux jours. Le génotypage est effectué au moment du sevrage, en prélevant des échantillons de la queue. Lors de l'enregistrement des appels d'isolement de chiot de P2, nous ne recommandons pas de prélever des échantillons de la queue déjà chez les petits, puisque cette opération inclut la manipulation supplémentaire et le stress très proche dans le temps d'une session d'enregistrement.
Les protocoles suggérés ici pour susciter vocalisations ultrasoniques chez les adultes ne permet pas une identification claire de la emitter des vocalisations. Cela explique pourquoi nous manipulons la motivation de l'animal d'essai. En effet, les souris de test sont isolées et non le nouveau venu et les animaux d'essai habituent pendant une longue période à la cage d'essai au cours des interactions du même sexe. Dans les interactions hommes-femmes, la femelle introduit est pas isolé et le mâle de test accoutume pour la réduction du temps depuis la motivation pourrait être plus élevé dans ce contexte sexuel. Ces manipulations de motivation devraient maximiser la probabilité de la souris d'essai émettant des vocalisations et non pas celui présenté. Pour enregistrer les vocalisations ultrasoniques mâles dans un contexte sexuel, un écouvillon simple coton frais urine (ie, non congelés) d'une femelle oestrus peut également être introduit dans la cage 30. Cette méthode permet l'attribution de vocalisations ultrasoniques au mâle de test avec 100% de certitude, mais il empêche la collecte d'informations précises sur le contexte social actuel d'émission de ces vocalisations. Par conséquent, nous sommes favorables à l'protocol décrit ici (avec un oestrus femelle librement en mouvement). Nous vous recommandons également de toujours utiliser des souris introduit à partir de la même souche lors du test de la souris à partir d'une souche mutante et d'analyser les données comme une paire de souris vocalisations. Une étude récente favorise l'utilisation de la triangulation pour localiser l'émetteur 31. Dans cette étude, les femmes ont été trouvées pour émettre également vocalisations ultrasoniques lors de rencontres avec un mâle. Ceci pourrait être expliqué par le fait qu'ils ont été isolés pendant au moins deux semaines avant la session d'enregistrement. La généralisation de l'utilisation de la triangulation proposée dans cette étude devrait néanmoins permettre l'identification de l'émetteur des vocalisations dans la plupart des cas, si les enregistrements vidéo sont correctement synchronisés.
Les appels de chiots enregistrés au cours du développement d'isolement ne sont pas dérangés par le bruit de fond de la literie. Habituellement, une analyse automatique fonctionne très bien pour extraire les principales variables. En revanche, les vocalisations enregistrées des adultes sont disturbed par le bruit de fond provenant des animaux qui se déplacent dans la litière. L'analyse automatique peut échouer, et donc une analyse manuelle doit être utilisée. Néanmoins, l'ajout de literie dans la cage de test devrait fournir des conditions qui sont moins stressant pour les animaux que le sol nu (que les souris n'aiment pas). D'autres efforts de la communauté sont concentrés sur l'amélioration de la détection automatique des vocalisations ultrasoniques dans diverses conditions, y compris ceux impliquant des bruits de fond. Par exemple, le logiciel VOICE permet d'analyser les vocalisations qui avaient été sélectionnés manuellement pour l'absence de bruit de fond 32. Dans ce logiciel, l'extraction des variables acoustiques est automatique, mais il faut la sélection manuelle initiale.
Il convient de noter que la variabilité inter-individuelle est très important dans le comportement vocal de souris. Par exemple, le taux des hommes adultes en présence d'une femelle oestrus d'appel est très distribué (Figure 1). Nous suggest ces protocoles normalisés pour obtenir des vocalisations ultrasoniques déjà pour limiter la variabilité liée au contexte expérimental. Néanmoins, nous tenons à souligner l'importance de présenter non seulement la moyenne et SEM pour les données, mais surtout les points individuels dans des échantillons de petite taille 33. Il est également très pertinent - sinon nécessaire - pour enregistrer au moins 12 individus de chaque groupe / génotype pour recueillir des données représentatives. Dans de nombreux cas, la variabilité inter-individuelle ne doit pas être caché (généralement, il ne peut pas être), et il pourrait être d'une grande importance pour identifier les individus porteurs de la mutation génétique étudiée, mais n'affichant aucun phénotype atypique. Ces personnes pourraient fournir des indices sur les compensations, ce qui pourrait ouvrir de nouvelles voies pour les thérapies des troubles génétiques.
Dans la plupart des caractérisations du comportement des modèles de souris pour les troubles neuropsychiatriques, le comportement vocal et les contacts sociaux sont considérered à part (par exemple, 19,27,34,35). Les méthodes d'analyse récentes fournissent maintenant une caractérisation détaillée semi-automatique des événements sociaux et les séquences d'événements lors d' une interaction ( à l' aide MiceProfiler par exemple) 36, ainsi que la possibilité de combiner cette analyse avec des données provenant des enregistrements audio. Le principal avantage de cette méthode est de fournir une vue d'ensemble de la communication sociale dans les modèles de souris de TSA, d'identifier plus précisément les aspects de la communication sociale sont touchés. Dans le présent protocole de synchronisation est encore manuel, mais cela peut être amélioré en déclenchant l'enregistrement vidéo via le logiciel d'enregistrement audio. Ce type d'analyse devrait devenir la norme de fournir une vision plus globale des déficits de communication sociale dans les modèles de souris de troubles neuropsychiatriques. En outre, jusqu'à présent, les signaux vocaux sont généralement analysées à partir du côté de l' émetteur ( par exemple, des tests sont conçus pour favoriser l'émission de vosignaux cal par la souris testée, comme dans les protocoles actuels). L'accent doit désormais être mis sur le récepteur de ces signaux, afin de mieux identifier les fonctions de ces signaux acoustiques. Cela devrait être fait en évaluant également le comportement des souris nouveau-venu dans les protocoles actuels chez les adultes ( en utilisant MiceProfiler par exemple) 36, en utilisant des expériences de lecture 16, ou par la mise en place de nouveaux protocoles. En effet, les présents protocoles prévoient des situations très contraints qui pourraient ne pas refléter les conditions éthologiques exactes de vocalisation émission chez la souris. L'émission spontanée de vocalisations ultrasoniques devra être mieux caractérisé en utilisant des enregistrements audio et vidéo en continu à jeter plus de lumière sur le comportement vocal spontanée de souris.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by the Fondation de France; by the ANR FLEXNEURIM [ANR09BLAN034003]; by the ANR [ANR- 08-MNPS-037-01-SynGen]; by Neuron-ERANET (EUHF-AUTISM); by the Fondation Orange; by the Fondation FondaMentale; by the Fondation de France; by the Fondation Bettencourt-Schueller. The research leading to this article has also received support from the Innovative Medicine Initiative Joint Undertaking under grant agreement no. 115300, resources of which are composed of financial contribution from the European Union's Seventh Framework Program (FP7/2007-2013) and EFPIA companies' in kind contribution. We thank Julie Lévi-Strauss for helpful comments on the manuscript and six anonymous reviewers whose comments noticeably improved the manuscript.
matériels
| Name | Company | Catalog Number | Comments |
| needles 0.3mm x 13 mm [30 G 1/2"] | BD Microlance | 304000 | - |
| green tattoo paste | Ketchum Manufacturing Inc., Ottawa, Canada | 329AA | - |
| thermometer | Fisherbrand, Waltham, USA | 4126 (W255NA) | - |
| self-made soundproof chamber (pups) | Institut Pasteur, Paris | - | acoustic foam + plexiglas; inside dimensions (W x H x D): 32 cm x 33 cm x 32 cm |
| small surface thermister + single probe thermocouple | Harvard Apparatus | 599814 + 601956 | - |
| smell-less pen | for instance: Giotto | - | ink made with water, washable: these pens are designed for babies |
| Ethanol absolute (100%) | Sigma Aldrich, Saint-Quentin Fallavier, France | 24103 | diluted 1/10 |
| Condenser ultrasound microphone Avisoft-Bioacoustics CM16/CMPA | Avisoft Bioacoustics, Berlin, Germany | #40011 | furnished with extension cables by the Avisoft company |
| Ultrasound Gate 416H | Avisoft Bioacoustics, Berlin, Germany | #34163 | sound card |
| Avisoft Recorder USGH | Avisoft Bioacoustics, Berlin, Germany | #10301; #10302 | recording software for Windows Vista, 7 and 8 |
| Avisoft SASLab Pro | Avisoft Bioacoustics, Berlin, Germany | #10101, 10111; #10102, 10112; | Windows 10, 8.1, 8, 7 or Vista including Intel-based Apple Macintosh running Boot Camp, Parallels or similar virtualization software. |
| Laptop or Apple Macintosh running Boot Camp | - | - | running Windows 10, 8.1, 8, 7 or Vista; for the Apple Macintosh, Boot Camp is preferred to virtualizations softwares such as Parallels due to memory constraints |
| plastic recipient (pup recordings) | Lock & Lock, Chatswood, USA | HPL932D | Lock & Lock Stackable Airtight Container Round 700 ml; use without the cover; dimensions: 9 cm diameter, 10 cm height |
| PBS 1x (pH = 7.4) | Gibco (Life Technologies) | 10010-023 | - |
| slides | Menzel-Gläser, Thermo Scientific | J1800AMNZ | Superfrost Plus |
| May-Grünwald solution 500 ml | RAL Réactifs, Martillac, France | 320070-0500 | - |
| Giemsa R 500 ml | RAL Réactifs, Martillac, France | 720-1107 | diluted 1/20 in phosphate buffer solution |
| phosphate buffer solution (self-made) | - | - | pH = 7, 0.1 M: 39 ml NaH2PO4 0.2 M + 61 ml Na2HPO4 0.2 M + 100 ml H2O (final volume: 200 ml) |
| test cage | Institut Pasteur, Paris | - | 50 x 25 cm, 30 cm height; Plexiglas |
| self-made soundproof chamber (adult recordings) | Institut Pasteur, Paris | - | acoustic foam + PVC; inside dimensions (W x H x D): 66 cm x 90 cm x 46 cm |
| video camera | From Noldus Information Technologies, Wageningen, The Netherlands | - | high-resolution CamTech Super-Hi-Res video camera; 25 fps |
| EthoVision XT | Noldus Information Technology, Wageningen, The Netherlands | http://www.noldus.com/animal-behavior-research/products/ethovision-xt | video acquisition software |
| Mice Profiler Tracker plugin from the ICY platform | Bio Image Analysis, Institut Pasteur, Paris | http://icy.bioimageanalysis.org/plugin/Mice_Profiler_Tracker | tracking software to analyse behavioral events during social interactions |
Références
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-V). , (2013).
- Ey, E., Leblond, C. S., Bourgeron, T. Behavioral Profiles of Mouse Models for Autism Spectrum Disorders. Autism Res. 4 (1), 5-16 (2011).
- Bourgeron, T., Jamain, S., Granon, S. Animal Models of Autism - Proposed Behavioral Paradigms and Biological Studies. Contemporary Clinical Neuroscience: Transgenic and Knockout Models of Neuropsychiatric Disorders. , 151-174 (2006).
- Scattoni, M. L., Crawley, J., Ricceri, L. Ultrasonic vocalizations: A tool for behavioural phenotyping of mouse models of neurodevelopmental disorders. Neurosci. Biobehav. Rev. 33 (4), 508-515 (2009).
- Portfors, C. V., Perkel, D. J. The role of ultrasonic vocalizations in mouse communication. Cur. Opin. Neurobiol. 28, 115-120 (2014).
- Arriaga, G., Zhou, E. P., Jarvis, E. D. Of mice, birds, and men: the mouse ultrasonic song system has some features similar to humans and song-learning birds. PLOS ONE. 7, e46610(2012).
- Hammerschmidt, K., Schreiweis, C., Minge, C., Pääbo, S., Fischer, J., Enard, W. A humanized version of Foxp2 does not affect ultrasonic vocalization in adult mice: Ultrasonic vocalization of "humanized" FoxP2 mice. Genes Brain Behav. , (2015).
- Portfors, C. V. Types and functions of ultrasonic vocalizations in laboratory rats and mice. J. Am. Assoc. Lab. Anim. Sci. 46, 28-34 (2007).
- Panksepp, J. B., et al. Affiliative Behavior, Ultrasonic Communication and Social Reward Are Influenced by Genetic Variation in Adolescent Mice. PLOS ONE. 2, (2007).
- Zippelius, H. -M., Schleidt, W. M. Ultraschall-Laute bei jungen Mäusen. Naturwissenschaften. 43, 502(1956).
- Whitney, G., Coble, J. R., Stockton, M. D., Tilson, E. F. Ultrasonic emissions: do they facilitate courtship of mice. J. Comp. Physiol. Psychol. 84, 445-452 (1973).
- Holy, T. E., Guo, Z. S. Ultrasonic songs of male mice. PLOS Biol. 3, 2177-2186 (2005).
- Maggio, J. C., Whitney, G. Ultrasonic vocalizing by adult female mice (Mus musculus). J. Comp. Psychol. 99, 420-436 (1985).
- Chabout, J., et al. Adult Male Mice Emit Context-Specific Ultrasonic Vocalizations That Are Modulated by Prior Isolation or Group Rearing Environment. PLOS ONE. 7 (1), e29401(2012).
- Hammerschmidt, K., Radyushkin, K., Ehrenreich, H., Fischer, J. Female mice respond to male ultrasonic "songs" with approach behaviour. Biol. Lett. 5, 589-592 (2009).
- Wöhr, M., Moles, A., Schwarting, R. K. W., D'Amato, F. R. Lack of social exploratory activation in male -opioid receptor KO mice in response to playback of female ultrasonic vocalizations. Soc. Neurosci. 6, 76-87 (2011).
- Granon, S., Faure, P., Changeux, J. -P. Executive and social behaviors under nicotinic receptor regulation. Proc. Nat. Acad. Sci. 100 (16), 9596-9601 (2003).
- Schmeisser, M. J., et al. Autistic-like behaviours and hyperactivity in mice lacking ProSAP1/Shank2. Nature. 486 (7402), 256-260 (2012).
- Ey, E., et al. Absence of Deficits in Social Behaviors and Ultrasonic Vocalizations in Later Generations of Mice Lacking Neuroligin4. Genes Brain Behav. 11, 928-941 (2012).
- Chadman, K. K., et al. Minimal Aberrant Behavioral Phenotypes of Neuroligin-3 R451C Knockin Mice. Autism Res. 1, 147-158 (2008).
- Scattoni, M. L., Gandhy, S. U., Ricceri, L., Crawley, J. N. Unusual Repertoire of Vocalizations in the BTBR T plus tf/J Mouse Model of Autism. PLOS ONE. 3, (2008).
- De Chaumont, F., Coura, R. D. -S., et al. Computerized video analysis of social interactions in mice. Nat. Methods. 9, 410-417 (2012).
- Leblond, C. S., et al. Genetic and Functional Analyses of SHANK2 Mutations Suggest a Multiple Hit Model of Autism Spectrum Disorders. PLOS Genet. 8 (2), e1002521(2012).
- Berkel, S., et al. Mutations in the SHANK2 synaptic scaffolding gene in autism spectrum disorder and mental retardation. Nat. Genet. 42, 489-491 (2010).
- Pinto, D., et al. Functional impact of global rare copy number variation in autism spectrum disorders. Nature. 466, 368-372 (2010).
- Ey, E., et al. The autism ProSAP1/Shank2 mouse model displays quantitative and structural abnormalities in ultrasonic vocalisations. Behav. Brain Res. 256, 677-689 (2013).
- Scattoni, M. L., Ricceri, L., Crawley, J. N. Unusual repertoire of vocalizations in adult BTBR T plus tf/J mice during three types of social encounters. Genes Brain Behav. 10, 44-56 (2010).
- Zorrilla, E. P. Multiparous species present problems (and possibilities) to developmentalists. Dev. Psychobiol. 30 (2), 141-150 (1997).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neurosci. 14 (1), 37(2013).
- Hoffmann, F., Musolf, K., Penn, D. J. Freezing urine reduces its efficacy for eliciting ultrasonic vocalizations from male mice. Physiol. Behav. 96, 602-605 (2009).
- Neunuebel, J. P., Taylor, A. L., Arthur, B. J., Egnor, S. R. Female mice ultrasonically interact with males during courtship displays. eLife. 4, (2015).
- Burkett, Z. D., Day, N. F., Peñagarikano, O., Geschwind, D. H., White, S. A. VoICE: A semi-automated pipeline for standardizing vocal analysis across models. Sci. Rep. 5, 10237(2015).
- Weissgerber, T. L., Milic, N. M., Winham, S. J., Garovic, V. D. Beyond Bar and Line Graphs: Time for a New Data Presentation Paradigm. PLOS Biol. 13 (4), e1002128(2015).
- Jamain, S., et al. Reduced social interaction and ultrasonic communication in a mouse model of monogenic heritable autism. Proc. Nat. Acad. Sci. U. S. A. 105, 1710-1715 (2008).
- Won, H., et al. Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function. Nature. 486, 261-265 (2012).
- Ferhat, A. -T., Le Sourd, A. -M., de Chaumont, F., Olivo-Marin, J. -C., Bourgeron, T., Ey, E. Social Communication in Mice - Are There Optimal Cage Conditions? PLOS ONE. 10 (3), e0121802(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon