Method Article
Préparation physiologique des cellules ciliées de l'sacculus du ouaouaron (
Dans cet article
Résumé
(Rana catesbeiana) de sacculus du ouaouaron permet un examen direct de la physiologie des cheveux cellules. Ici, la dissection et la préparation de la sacculus du ouaouaron pour les études biophysiques est décrite. Nous montrons expériences représentatives de ces cellules ciliées, y compris le calcul de la relation de force de déplacement d'un faisceau et la mesure de son mouvement non forcé.
Résumé
L'étude de l'audition et de l'équilibre repose sur des idées tirées des études biophysiques des systèmes modèles. Un tel modèle, l'sacculus du ouaouaron, est devenu un pilier de la recherche auditive et vestibulaire. Des études de cet organe ont mis en évidence la façon dont les cellules sensorielles cheveux peuvent activement détecter des signaux provenant de l'environnement. En raison de ces études, nous avons maintenant mieux comprendre la mécanique de déclenchement et de la localisation des voies de transduction d'une cellule capillaire, le rôle du calcium dans l'adaptation mécanique, ainsi que l'identité des courants de cellules ciliées. Cet organe très accessible continue de fournir un aperçu du fonctionnement des cellules ciliées. Nous décrivons ici la préparation de la sacculus du ouaouaron pour les études biophysiques sur ses cellules ciliées. Nous incluons la procédure de dissection complète et de fournir des protocoles spécifiques pour la préparation de la sacculus dans des contextes spécifiques. Nous incluons en outre des résultats représentatifs à l'aide de cette préparation, y compris le calcul deinstantanée relation de force de déplacement d'un faisceau de cheveux et de la mesure de l'oscillation spontanée d'un faisceau.
Introduction
Les organes acousticolatéral de mammifères possèdent une architecture complexe et se trouvent dans une niche anatomique qui peut être difficile d'accès. Par exemple, la cochlée de mammifère comprend un labyrinthe en spirale et est noyé dans l'os temporal épaisse. L' isolement de la cochlée provoque souvent des dommages mécaniques aux cellules sensorielles situées à l' intérieur et il a donc avéré être une tâche difficile 1. Les neuroscientifiques ont ainsi tourné pour modéliser des systèmes qui sont plus facilement extraits du sanctuaire de l'oreille.
L' un de ces systèmes modèles, la sacculus du ouaouaron (Rana catesbeiana), a depuis des décennies ont donné un aperçu généralisables dans la fonction des systèmes auditifs et vestibulaires. Le sacculus est un organe à fonction mixte avec des rôles sensoriels dans les deux basse fréquence auditive et sensation sismique. Les cellules sensorielles de l'sacculus sont ses cellules ciliées, transducteurs spécialisés qui convertissent l'énergie mécaniqueen signaux électriques au sein de nos organes auditifs et vestibulaires. Faisant saillie à partir de la surface apicale de chaque cellule de cheveux est une touffe de cheveux mécanosensible qui comprend une touffe de microvillosités graduée appelée agrandie stereocilia. Les conseils de stéréocils adjacents sont reliés entre eux par filamenteuses protéines tip-liaison qui mécaniquement les canaux ioniques de porte en réponse à des stimuli mécaniques 2, 3. Bien que les organes auditifs et vestibulaires répondent à différents types de stimuli, ils partagent un mécanisme de détection commun. Cette communauté est à la base des nombreuses connaissances acquises en mécanotransduction cheveux cellulaire grâce à des études de la sacculus de ouaouaron. Par exemple, processus actif de la cellule de cheveux a été largement étudié dans cet organe 4, 5, 6, 7, et le faisceau de cheveux emploie un processus de consommation d'énergie pour produire de mécaniquetravail. Non seulement il a été démontré que les cellules ciliées génèrent un travail actif 6, mais les mécanismes sous - jacents distincts du processus actif et les caractéristiques de réglage d'une cellule de cheveux ont été dévoilées à travers des études de ouaouaron acousticolatéral organes. Ceux-ci incluent faisceau de cheveux actif 8 et la motilité de cellules ciliées résonance électrique 9, 10, 11 dans la saccule et la sélectivité en fréquence à ruban synapse de la cellule capillaire 12 dans la papille amphibien.
Le sacculus du ouaouaron fait appel à neuroscientifiques sensorielles pour de nombreuses raisons. Contrairement à la cochlée des mammifères, cet organe se trouve dans la capsule otique facilement accessible. Deuxièmement, les cellules ciliées au sein de cet organe peuvent rester en bonne santé pendant plusieurs heures dans des conditions appropriées 13, 14. Cela permet d'experimentation sur ces cellules sur de longues échelles de temps par rapport à leurs homologues de mammifères. Troisièmement, l'organe a peu de courbure, ce qui permet une manipulation aisée. Quatrièmement, chaque organe comprend un millier ou plusieurs cellules ciliées 15, fournissant à la fois un haut débit et une forte probabilité de localiser un ensemble approprié de cellules de cheveux pour une expérience donnée. Enfin, le sacculus du ouaouaron est facilement visualisé en raison de la minceur de cet organe et de grande taille de ses cellules ciliées.
Ces propriétés offrent une grande polyvalence pour l'étude des cellules sensorielles au sein de la sacculus du ouaouaron. En fonction de la question à portée de main, l'un des plusieurs préparations expérimentales peuvent être obtenues à partir du sacculus. Le plus simple d'entre eux est la préparation d'une chambre. Ici, le sacculus est immobilisé dans une chambre remplie de périlymphe artificielle, une solution saline riche en sodium et riche en calcium. Cette préparation permet l'étude des courants de cellules de cheveux et de base mécanique de faisceau de cheveux. Une deuxième configuration, la préparation à deux chambres, peut être utilisé pour étudier les mouvements de faisceaux de poils spontanés. Ici, le côté apical des cellules ciliées est exposé à un riche en potassium et pauvre en calcium du sérum physiologique appelé endolymphe artificielle, alors que le côté basolatéral est baigné de périlymphe artificielle. Ces deux compartiments imitent l'arrangement in vivo des salines et de fournir un environnement qui permet des faisceaux de cheveux osciller spontanément.
Nous décrivons dans cet article la préparation du sacculus du ouaouaron pour l'étude biophysique de ses cellules ciliées sensorielles. Nous fournissons d'abord une description détaillée de l'isolement de cet organe de l'oreille interne de la grenouille. Nous décrivons ensuite les deux l'un et de deux chambres préparations expérimentales et inclure des résultats représentatifs pour chaque configuration.
Protocole
Déclaration éthique: Toutes les procédures ont été approuvées par le Comité institutionnel des animaux soin et l' utilisation (IACUC) à l'Université Rockefeller.
1. Pré-expérimental Prespanparation
- Solutions
- Préparer la solution de l' eugénol (2,5 g · L -1 · kg -1 grenouille). Préparer les solutions salines (tableau 1).
NOTE: Pour une préparation à une chambre, préparer la périlymphe artificielle; pour une préparation à deux chambres, préparer à la fois périlymphe artificielle et endolymphe artificielle.
- Préparer la solution de l' eugénol (2,5 g · L -1 · kg -1 grenouille). Préparer les solutions salines (tableau 1).
2. Outils expérimentaux
- Préparation d' une fibre de verre de stimulation
- Cibler un capillaire en verre borosilicate avec un extracteur d'électrode dans une traction d'une ligne avec la chaleur élevée et à haute vitesse. Chargez le capillaire tiré dans un extracteur entraîné par solénoïde.
- Apportez la pointe du capillaire vers un filament avec une perle de verrefondu sur celui-ci jusqu'au contact du capillaire de perles de verre.
- Allumer le filament pour faire fondre l'extrémité du tube capillaire dans le cordon de verre. Une fois qu'un mince pont de formes de verre entre le capillaire et le bourrelet, éteignez le filament et dans le même temps activer l'extracteur solénoïde.
NOTE: Ce va tirer le capillaire en verre à angle droit à son axe long et de créer une fibre solide. - Assurez-vous que le diamètre de la fibre est de pas plus de 0,5 à 1 pm et que sa longueur ne dépasse pas 100 à 300 um. Si la longueur de la fibre dépasse cette dimension, couper avec des ciseaux de l'iris. Utilisez des ciseaux qui sont déjà ternes pour éviter d'endommager les outils de dissection.
- Pour améliorer le contraste optique, pulvérisez cathodiquement la fibre. Utiliser une machine à enduire par pulvérisation cathodique avec une source d'or-palladium. charger Verticalement chaque fibre dans une coucheuse par pulvérisation cathodique avec son extrémité conique vers la source. Apportez la pointe de la fibre à une distance de 1 - 2 cm de la source d'or-palladium.
- Fermer lapulvérisation dans la chambre de coucheuse pour former un joint et allumez-le. rincer à plusieurs reprises sur l'air ambiant avec de l'argon. Après rinçage de l'air, réduire la pression dans la chambre à 10 Pa (70 mTorr).
- Pulvérisez cathodiquement dans 10 s impulsions avec 10 s retards sur un parcours de 120 s.
REMARQUE: la pointe de la fibre foncera sur la durée de ce protocole si le revêtement de pulvérisation a été un succès.
- Préparation de micro - électrodes pointues
- Tirez un capillaire en verre avec un filament interne à l'aide d'une seule ligne à haute température pull. Les électrodes doivent avoir une résistance de 100-300 MQ lorsqu'il est rempli de 3 M KCl. Remplir chaque électrode avec 3 M KCl.
- Bend la pointe de chaque électrode avec le microforge pour le rendre perpendiculaire à la surface apicale des cellules ciliées lorsqu'il est monté dans le headstage amplificateur 16.
- Préparation de pipettes ionophorèse
- Tirer un capillaire en verre avec un intérieurfilament à une pointe de 50 MQ. Remplir avec soluté concentré (sulfate par exemple, 500 mM gentamicine).
- Préparation de l' aluminium carré de montage
- Coupez un 1 cm x 1 cm carré de papier d'aluminium. Perforer la feuille dans le centre avec la pointe d'une tige de décérébration ou un autre objet pointu. La forme de la perforation de sorte qu'il est circulaire et environ 1 mm de diamètre.
- Préparation de la seringue vide rempli de graisse.
- Retirer le piston d'une seringue de 5 ml. Remplir la seringue de l'arrière avec de la graisse à vide. Remplacer le piston.
- Préparation de polytétrafluoroéthylène applicateur de colle
- Faire une longue axiale de 2 mm coupé dans l'extrémité d'un bâton applicateur en bois. La fente doit être au centre de l'applicateur lorsqu'il est vu en bout.
- Avec des ciseaux pointus ou une lame de rasoir, couper un 2 mm x 4 mm rectangle de polytétrafluoroéthylène d'une feuille d'épaisseur de 1 mm.
- Utilisez une lame de rasoir pour éclaircir l'un des 2 bords mm de long du rectangle de polytétrafluoroéthylène. À partir du milieu du rectangle, de réduire l'épaisseur du rectangle en découpant vers l'extérieur pour former un biseau à l'extrémité du rectangle.
- Insérer le rectangle de polytétrafluoréthylène dans la fente d'applicateur en bois de telle sorte que le bord oblique opposé à la baguette. Appliquer 5 min époxy à la base du rectangle de polytétrafluoroéthylène pour le fixer en place. Permettre à l'applicateur de colle durcir pendant 1 h à température ambiante.
- Préparation de la moitié inférieure de deux chambres de montage
- Machine ou 3D imprimer la moitié inférieure des deux chambre de montage (fichier supplémentaire 2). Identifier le diamètre en retrait cercle de 20 mm sur la surface inférieure de la chambre.
- Appliquer une fine couche d'époxy pour les latérales plus 3 mm du cercle évidé. Appliquer une 18 mm lamelle de verre circulaire sur l'époxy. Laisser époxy durcir pendant 1h.
3. Extraction des organes internes de l'oreille
- Anesthetize un ouaouaron en le plaçant dans un petit seau contenant une solution d'anesthésique eugénol pendant 10 min. Réglez le volume de solution pour que humero-scapulaires de la grenouille mensonges joint juste au-dessus de l'interface liquide-air.
- Euthanasier le ouaouaron anesthésiés en double décérébration.
- Attrapez la grenouille anesthésiés avec un doigt au-dessus de son nez et un autre en dessous de la mâchoire et tourner la tête de la grenouille avant.
- Rapidement plonger la tige de décérébration dans la voûte crânienne à travers le foramen magnum, qui se trouve sur la ligne médiane entre les processus occipital de la grenouille.
- retirer lentement et faire tourner la tige jusqu'à ce que sa pointe quitte le foramen magnum. Forcer la tige caudale à travers le foramen vertébral pour détruire la moelle épinière.
- Vérifiez que la grenouille a été correctement doublement décérébrés en observant que ses membres inférieurs sont étendus.
- Attrapez la grenouille avec un pouce au-dessus du nez et le premier doigt saisir les dents vomériennes pour une meilleure stabilité. Décapitez la grenouille en coupant l'articulation temporo-mandibulaire bilatérale et en coupant perpendiculairement à l'axe rostrocaudal. Pour veiller à ce que les organes de l'oreille interne à l'intérieur du crâne restent intacts, veiller à ce que la coupe est caudale à la fois tympans.
- À l' aide d' un microscope à stereodissection, exécuter une ligne médiane à travers le tissu coupé palatale des dents vomériennes dans la mesure la plus postérieure du tissu (figure 1A).
- Sever et claire avec des coupes horizontales du scalpel toute musculaires situées au-dessous du tissu palatin pour révéler le cartilage postérieur. Après avoir retiré le muscle, observer la forme de sucettes du cartilage formant la limite temporelle de la capsule otique.
- Sever la columelle à son point de contact avec le cartilage de la capsule otique.
- rasage à plusieurs reprises des couches minces de ce cartilage en faisant PEU PROFONDEcoupes horizontales w à travers elle. Évitez les coupes profondes pour éviter d'endommager les organes de l'oreille interne. Ceci ouvre la capsule otique trouvée dans la structure de sucettes du cartilage temporel (figure 1B). Au sein de la capsule otique sont les organes intra-auriculaires de la grenouille (figure 1C).
- Coupez la partie postérieure et bords latéraux de la capsule otique, en prenant soin de ne pas endommager les organes de l'oreille interne. Au cours de la dissection, le débit souvent saline sur les organes de l'oreille interne pour veiller à ce qu'ils restent submergés et hydratés.
- Repérez les deux ouvertures circulaires dans l'os temporal au niveau du raccordement médiale du cartilage de la ligne médiane. Couper vers le bas à travers l'ouverture la plus médiane pour rompre l'os temporal.
- Faire une deuxième coupe vers le bas à travers la capsule otique à son bord postéro-latérale. Retirez le morceau de cartilage entre ceci et la coupe précédente pour fournir un accès aux organes de l'oreille interne.
- Soulever perdre le cartilage entre les coupes des étapes 3.8 and 3.9 et coupé à l'écart de la capsule otique. Cette action coupe le canal semi-circulaire le plus proche, qui peut ensuite être utilisé comme une poignée pour les manipulations ultérieures.
- Prendre soin de ne pas toucher la sacculus, sectionner le VIII e nerf crânien.
- Tenir l'ampoule du canal semi-circulaire le plus proche. Tournez doucement l'oreille interne pour exposer les deux canaux semi-circulaires restantes. Lors de l'exposition de chaque canal, le rompre.
- Tenir le nerf ou d'une ampoule de canal semi-circulaire, extraire l'oreille interne de la tête et placez-le dans un plat rempli de froid périlymphe artificielle oxygéné. Retrait de l'oreille interne permet la visualisation des passages au sein de l'os temporal par lequel les canaux semi - circulaires , une fois passés (figure 1D).
REMARQUE: Répétez ces étapes pour extraire la deuxième oreille.
4. Une chambre Préparation
- L' isolement du saccule
- Localisez le sacculus en identifiant son grand white masse de otoconia et le nerf sacculaire qui se trouve au - dessus (Figure 1E). Prenez soin de ne pas traumatiser physiquement le sacculus pendant les étapes suivantes afin de maintenir l'intégrité des cellules ciliées sacciformes.
- Couper les canaux semi-circulaires pour rendre l'oreille interne plus maniable.
- Retirer la citerne périlymphatique recouvrant le côté neural du sacculus. Effectuer des coupes en douceur autour du périmètre de la citerne. couper ensuite les petits piliers de tissu qui relient la membrane du réservoir vers le côté de neurones de la saccule.
- Retirez le lagena et son nerf associé.
- Tenir le nerf sacculaire, soulevez doucement le sacculus et couper à travers la fine membrane du sac otoconial. Comme otoconia déversement hors du sac, libérer le sacculus en coupant autour de son périmètre.
NOTE: Après l'isolement du sacculus, les autres organes de l'oreille interne peuvent être sauvés si on le souhaite. Enlèvement de la saccule facilite l'identification d'autres structures, telles queles papilles des amphibiens et basilaire. - Utilisez des ciseaux ou des pinces pour essuyer soigneusement toute otoconia restant sur le sacculus. Prenez soin de ne pas toucher le sacculus pendant ce processus.
- Coupez toute membrane otoconial-sac restante du bord de la sacculus. Cette membrane a tendance à adhérer aux surfaces en plastique et en verre, et son retrait réduit au minimum les défis dans la manipulation du tissu.
- Couler doucement saline sur sacculus avec une pipette Pasteur pour enlever tout otoconia restant (figure 1F).
REMARQUE: Répétez cette procédure pour le second sacculus, qui est une image miroir de la première.
- La digestion et le montage
- Utilisation de l'extrémité arrière d'une pipette Pasteur avec sa pointe brisée, transférer le sacculi isolé à une boîte de Pétri contenant 3 ml de 67 mg ∙ L -1 protease XXIV en périlymphe artificielle.
NOTE: Ce traitement de la protéase digère les liens tethering chaque ampoule kinociliary le otolithiquesla membrane, ce qui permet le retrait de la membrane, sans endommager les faisceaux de poils sensoriels. - Laisser incuber le tissu pendant 30 minutes à 22 ° C (ou 35 min à 21 ° C). Transférer chaque sacculus digéré à une chambre expérimentale face ouverte et fixer le tissu avec des épingles magnétiques.
- La macula sacculaire se trouve directement au-dessous de la membrane et otolithique est la partie de la saccule qui contient des cellules ciliées. Identifier et retirer délicatement sa membrane otolithiques sus-jacente à l'aide d'une amende de cils, en prenant soin de ne pas toucher la macula sacculaire.
- Utilisation de l'extrémité arrière d'une pipette Pasteur avec sa pointe brisée, transférer le sacculi isolé à une boîte de Pétri contenant 3 ml de 67 mg ∙ L -1 protease XXIV en périlymphe artificielle.
5. Préparation à deux compartiments
- L' isolement du saccule
- Isoler le sacculus des organes de l'oreille interne comme dans la section 4.1.
- Montage et digestion
- Remplir le bloc de montage (fichier supplémentaire 3) avec la périlymphe artificielle et placer la feuille d'aluminium perforée sur une ouverture, en utilisant deux points de videgraisser pour le maintenir en place et former un joint faible.
- Transfert d'un sacculus à la feuille et le centrer sur le dessus du trou avec la macula vers le bas et le moignon du nerf vers le haut.
- Retirer la solution saline entourant le sacculus avec un morceau de tissu torsadée. Wick la solution saline pour sécher la surface du carré d'aluminium entourant le sacculus.
- Utilisez l'applicateur de polytétrafluoroéthylène pour appliquer la colle cyanoacrylate pour former un joint étanche le long de la frontière entre le bord de la sacculus et le carré d'aluminium. Faire en sorte que toute la circonférence de la saccule est recouverte de colle.
NOTE: En procédant trop lentement permet à la colle cyanoacrylate au fluage sur le côté neural du sacculus et éventuellement le couvrir. Il est donc impératif d'achever rapidement cette tâche. - Placer une goutte de solution saline au-dessus du tissu monté pour durcir la colle. Un mince film de colle peut se former sur le dessus de la goutte de solution saline; enlever avec une pince.
- Retirez délicatement til fleuret à partir du bloc de montage. Retournez le tissu monté sur de sorte que le côté maculaire de la sacculus fait face vers le haut et flotter sur un plat artificiel périlymphe rempli Petri.
- Ajouter une goutte de solution XXIV de la protéase sur le dessus de la macula et laisser incuber pendant 30 min à 22 ° C (ou 35 min à 21 ° C). Remplissez le canal inférieure de l'appareil à deux chambres (fichier supplémentaire 2) avec de la graisse périlymphe et lieu vide autour de la chambre centrale.
- Placez le sacculus de feuille monté sur la chambre basse avec son nerf face à la surface de la chambre. Ajouter de la graisse autour du périmètre de la feuille.
- Placez la chambre supérieure (fichier supplémentaire 1) de la préparation sur la feuille, en prenant soin de former un joint avec la graisse à vide. Remplir la chambre supérieure avec endolymphe artificielle barboter et retirez délicatement la membrane otolithiques avec un cil.
Résultats
L'épithélium sensoriel de sacculus du ouaouaron peut être utilisé dans différentes configurations pour sonder la physiologie des cellules ciliées. Étant donné que le tissu est relativement plat, il peut être monté dans les deux préparations à une ou deux chambres. La configuration d'une chambre offre une configuration simple pour les enregistrements électrophysiologiques et micromécaniques des cellules ciliées. La préparation à deux chambres, à la place simule à la fois la endolymphatique et périlymphatique compartiments respectivement sur les côtés apicaux et basaux de cellules ciliées. Ces compartiments fournissent ensemble un milieu physiologiquement pertinent pour l'étude de transduction mécanique des cellules ciliées.
Les caractéristiques de sensibilité et de transduction des cellules ciliées à la base de leur réponse à une stimulation électrique mécanique. Pour sonder ces caractéristiques, nous avons enregistré simultanément à partir d'un cheveu cellule la position de son paquet etLe potentiel des récepteurs de la cellule (figure 2). Nous avons d'abord attaché une fibre de verre flexible à l'ampoule kinociliary d'un faisceau de cheveux pour appliquer des impulsions de force. Nous avons alors mesuré le déplacement du faisceau de poils au moyen d' un système à deux photodiodes 2 (figure 2A). Nous en même temps que l'acquisition du potentiel de la cellule de cheveux en empalant la cellule avec un microélectrodes pointu. Nous avons obtenu une courbe déplacement-réponse en traçant la réponse à la tension de crête provoquée par chaque stimulus mécanique contre un déplacement correspondant de la touffe de cheveux (figure 2B). réponse électrique de la cellule de cheveux saturent pour les deux extrema en positif et négatif déplacement. La réduction du potentiel de membrane avec des étapes de déplacement négatif indique la présence d'un courant de repos à l'intérieur mécanotransduction. Ce courant de repos est modulée par l'action de Ca2 + à la fois une adaptation rapide et lente 17, 18, 19, 20, 21.
Le comportement d'une cellule de cheveux dépend non seulement de ses propriétés électriques, mais aussi sur la micromécanique de son faisceau de cheveux sensorielle. Les deux chambres configuration imite la séparation des endolymphe et périlymphe in vivo, offrant des conditions idéales pour l'étude de la mécanique d'un faisceau de cheveux. Dans ces conditions et avec la membrane otolithiques enlevé, faisceaux de cheveux peuvent osciller spontanément 6. Ici, nous avons utilisé la préparation à deux chambres pour évaluer les micromécanique de faisceaux individuels. Nous avons enregistré les oscillations spontanées d'un faisceau de cheveux en projetant son ombre sur un double photodiode déplacement moniteur (Figure 3). Pour évaluer le rôle de l'aminoglycoside antibiotique gentamicine sur mécanotransduction, nous Rele iontophorèse elon gentamicine directement sur la touffe de cheveux (figure 3). La concentration de gentamicine libérée augmente proportionnellement avec le courant passé à travers la micropipette. Gentamicine inhibe les oscillations d'un faisceau de cheveux et induit un décalage du faisceau vers le côté haute statique. Ces effets reflètent le rôle de gentamicine comme un bloqueur des canaux ouverts qui maintient l'état ouvert des canaux mécano tout en bloquant les pores de la perméation. Iontophorèse de produits chimiques chargés permis localisé et la libération quantifiable des produits chimiques à diverses concentrations en l'absence de rupture mécanique induites par l' écoulement de fluide et est donc parfaitement adapté pour l'étude des organites mécanosensibles tels que le faisceau de cheveux 22.
Mouvement spontané d'un faisceau de cheveux résulte de l'interaction entre l' adaptation et non linéaire rigidité du faisceau 7,xref "> 8, 23, 24. Ce mouvement spontané est une signature de processus actif d'un faisceau de cheveux, qui convertit l' énergie du signal en travail mécanique pour surmonter la traînée visqueuse. faisceaux de cheveux ont été montrés pour présenter la rigidité instantanée non linéaire dans le vestibulaire 2, auditif 25, et la ligne latérale systèmes 26.
Nous avons mesuré directement la rigidité instantanée d'un faisceau de cheveux individuels de la sacculus du ouaouaron (Figure 4). Pour ce faire , nous avons couplé la pointe d'une fibre de verre flexible pour ampoule kinociliary du faisceau de cheveux (figure 4A). Nous avons fourni des forces pour le faisceau de poils en déplaçant la base de la fibre. La force exercée sur le faisceau de poils par la fibre de stimulation correspond à la différence entre les déplacements des bas de la fibree et le pourboire, multiplié par la rigidité de la fibre 2, 27. Délivrant des impulsions à travers une gamme de forces révèle une relation entre la force exercée sur le faisceau et le déplacement qui a suivi du faisceau. La pente de cette relation force-déplacement correspond à la rigidité instantanée du faisceau de cheveux (figure 4A).
Cette méthode a permis de mesurer la rigidité instantanée d'un faisceau individuel en fonction de sa déflexion (figure 4B). La courbe force-déplacement instantanée présente une relation non linéaire, révélant une raideur non linéaire du faisceau sur une plage d'environ 20 nm autour de sa position de repos. En dehors de cette gamme, le faisceau de cheveux se comporte comme un matériau Hooke, sa raideur est linéaire pour des détournements de grande ampleur.
Ces résultats demonstévaluer la polyvalence du sacculus de ouaouaron dans l'étude de la physiologie des cheveux cellules. L'utilisation de ces préparations et d'autres, on peut explorer transduction mécanique à plusieurs étapes de la transmission des informations à partir du faisceau vers le cerveau.

Figure 1: Dissection de l' oreille interne du Bullfrog. (A) Voir le palais supérieur du ouaouaron de sa face ventrale permet l' identification de la trompe d' Eustache (cercle). réflexion latérale de la peau qui recouvre le côté droit du palais supérieur révèle l'emplacement de l'oreille interne (boîte en pointillés). (B) le retrait du cartilage sur la face ventrale de l' os temporal de la grenouille ouvre la capsule otique (ligne pointillée). (C) à afficher une image d'agrandissement supérieur de la capsule otique, dans lequel le saccule, lagena, CN VIII et SACC parti- nerf peut être facilement identifié. (D) une vue de la capsule otique après le retrait des organes de l' oreille interne révèle les emplacements des canaux semi - circulaires. (E) Après le retrait de l'oreille interne isolée, l'sacculus, lagena et VIII e nerf crânien (CN VIII) peut être facilement identifié. (F) Le sacculus isolé possède un court moignon du nerf sacculaire et une membrane otolithiques couché sur son épithélium sensoriel. Les étiquettes correspondent à la (i) sacculus, (ii) lagena, (iii) CN VIII, (iv) le nerf sacculaire, et (v) membrane otolithiques. Axe étiquettes P et A correspondent respectivement aux directions antérieures et postérieures. Les barres d'échelle représentent 1 cm (A, B), 1 mm (C, D, E), et 400 pm (F).
S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
s "target =" _ blank "> S'il vous plaît cliquer ici pour télécharger une version vectorielle de cette figure.
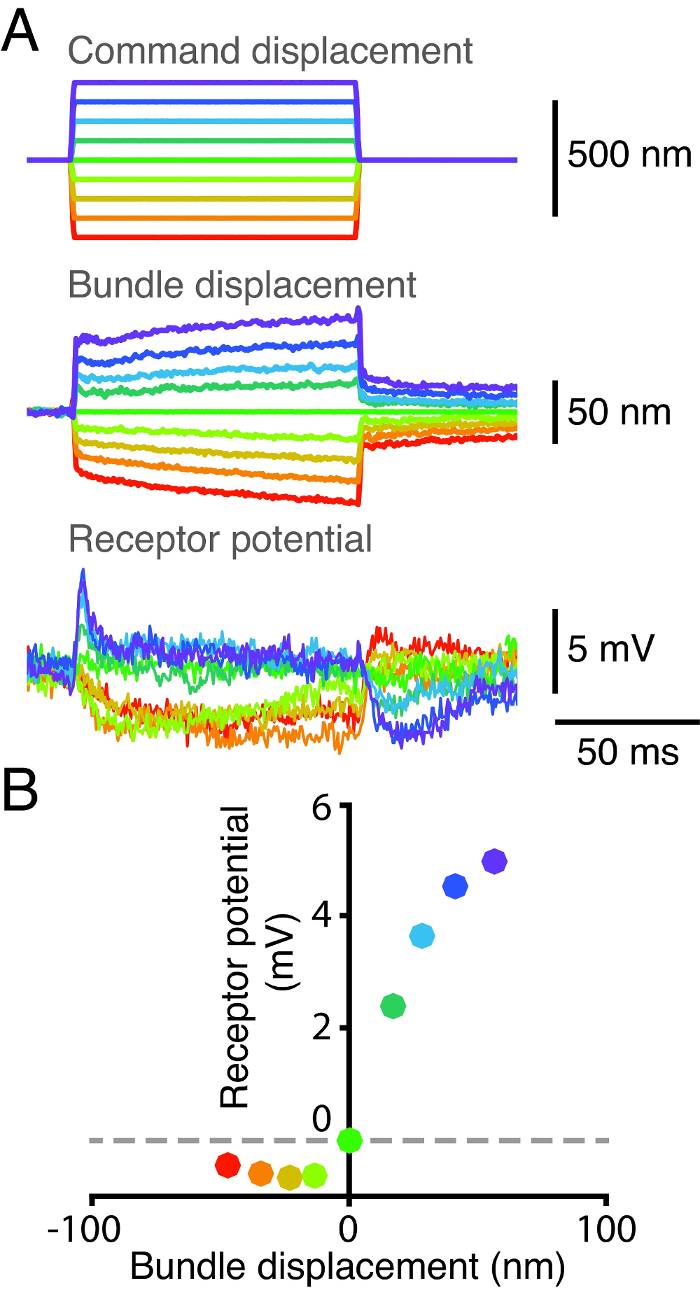
Figure 2: Courbe Déplacement-réponse pour une cellule unique cheveux. (A) La pointe d'une fibre de relance de verre a été couplé à l'ampoule kinociliary d'un faisceau de cheveux et la base de la fibre a été déplacée par la suite dans neuf étapes distinctes. La position du faisceau a été suivi sur un système dual-photodiode, et son potentiel de récepteur a été mesurée simultanément en utilisant une microélectrode dont la sortie a été passé à travers un amplificateur en mode pont. La résistance à la pointe de l'électrode était de 95 MQ et le potentiel de membrane de repos du faisceau était -47 mV. (B) Un tracé du potentiel du récepteur du faisceau en fonction de son déplacement révèle une relation non linéaire entre la réponse de l'ensemble et sonposition. Chaque point correspond au potentiel et la moyenne moyenne de déplacement sur une fenêtre de temps de 2,5 ms, à partir de 2,5 ms après le début de la stimulation mécanique. Chaque couleur représente un ensemble de séries de temps correspondant à la même impulsion de déplacement.
S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
S'il vous plaît cliquer ici pour télécharger une version vectorielle de cette figure.
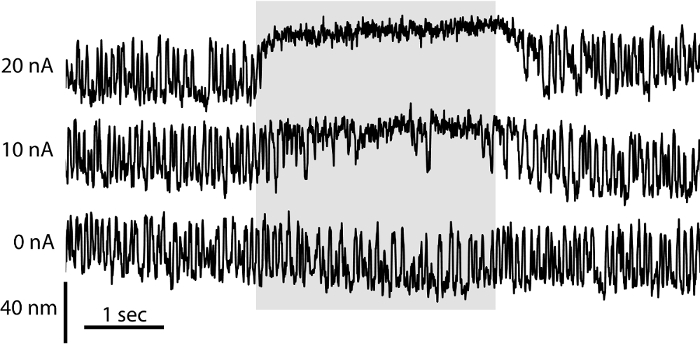
Figure 3: Effet de la gentamicine sur Spontaneous Bundle Cheveux Oscillation. Le mouvement spontané d'une touffe de cheveux dans une préparation à deux chambres a été enregistrée à l'aide d'un système de photodiode double. En l'absence de libération iontophorétique de la gentamicine (0 nA), les cheveuxfaisceau affiche des oscillations symétriques. Comme l'amplitude du courant passe à travers une pipette iontophorèse rempli avec 500 mM de sulfate de gentamicine pousse (10 nA, 20 nA), la fréquence des excursions de cheveux faisceau tombe d'une manière dose-dépendante et le faisceau est décalé vers son bord grand pour plus périodes.
S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
S'il vous plaît cliquer ici pour télécharger une version vectorielle de cette figure.
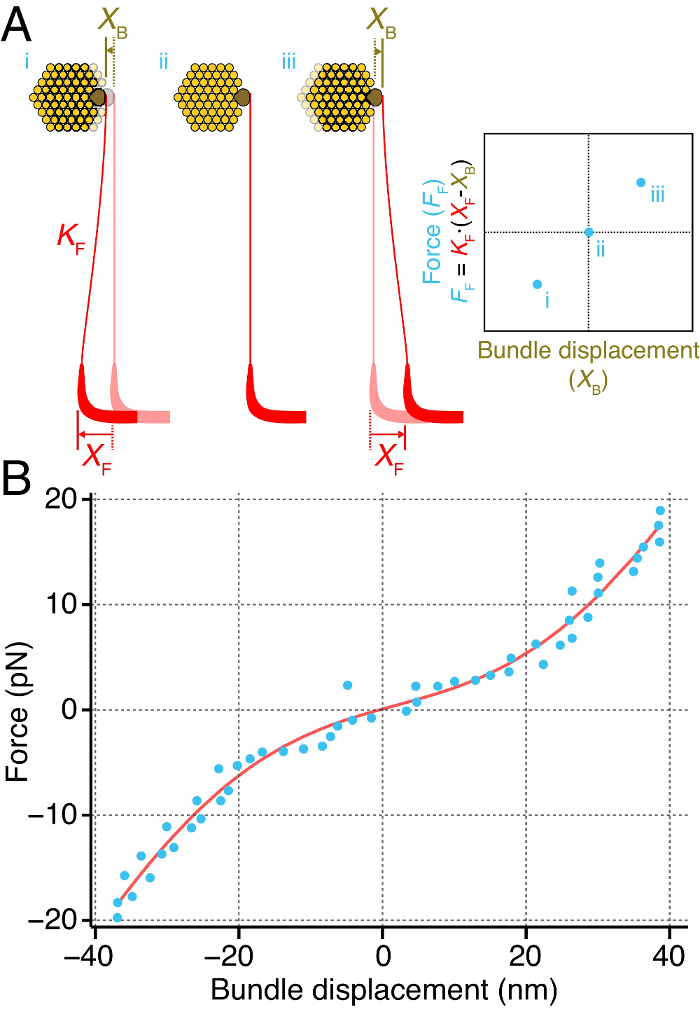
Figure 4. Calcul Instantané Rigidité d'un Bundle cheveux. (A) Une fibre de stimulation (rouge) de raideur K F t est coupléeo l'ampoule kinociliary (brun) d'un faisceau de cheveux individuel (jaune). Le déplacement de la base de la fibre à une distance connue X F provoque le faisceau à se déplacer sur une distance X B. La différence entre les déplacements de la fibre et le faisceau est proportionnelle à la force exercée sur le faisceau par la fibre de stimulation, F F. La répétition de ce à travers une gamme de forces donne une relation force-déplacement instantanée (à droite), dont la pente correspond à la rigidité instantanée du faisceau de cheveux. (B) un paquet particulier a été soumise à la force des impulsions d'amplitude croissante et son déplacement dans les 50 premières millisecondes après le début de l' impulsion a été mesurée (points bleus). Ici, le faisceau de cheveux affiche une rigidité instantanée non linéaire sur une plage d'environ 20 nm autour de sa position de repos. La courbe rouge correspond à un ajustement de la relation F = k * X - 60 * z * (1 / (1 + exp (- z * (X - X 0) / (k B * t))) + F 0, où F est la force appliquée au faisceau, X est le déplacement, k du faisceau = 790 ± 51 μN · m -1 est le faisceau constante raideur lorsque tous les canaux sont soit fermé ou ouvert, z = 0,43 ± 0,04 pN est la force d'un ressort de déclenchement unique, X 0 = 2 ± 1,9 nm est la position de la liasse à laquelle 50% de ses canaux sont ouverts, k B est Boltzmann constante, T est la température, et F 0 = 11,7 ± 1,3 pn est une force de décalage. L'ajustement possède un coefficient de détermination de 0,98. La fibre de relance avait une raideur de 107 μN ∙ m -1.
S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
es / ftp_upload / 55380 / Figure4_v5.eps "target =" _ blank "> S'il vous plaît cliquer ici pour télécharger une version vectorielle de cette figure.
| soluté | Formule Poids (g / mol) | Ajouter à 1 L | |
| périlymphe artificielle | endolymphe artificielle | ||
| NaCl | 58,4 | 6,54 g | 0,117 g |
| KCl | 0,149 | 0,149 g | 8,62 g |
| CaCl 2 , 2H 2 O ⦁ | 147 | 2 mL de 1 M CaCl 2 Stock | 250 pi de 1 M CaCl 2 Stock |
| HEPES | 238,3 | 1,19 g | 1,19 g |
| D - (+) - glucose | 180,2 | 0,541 g | 0. 541 g |
Tableau 1. Solutions pour Dissection et préparation expérimentale. Affichées dans ce tableau sont les recettes pour périlymphe artificielle et des solutions de endolymphe artificiels utilisés dans la dissection et à la préparation d'une ou deux chambre. Les solutions doivent être portées à pH de 7,2 à 7,4 avec environ 2 ml de NaOH (périlymphe) ou 2 ml de KOH (endolymphe). La force osmotique devrait lire environ 230 mmol · kg -1 due à la dissociation ionique incomplète.
Discussion
Dans la sacculus du ouaouaron se trouvent plusieurs milliers de cellules ciliées sensorielles facilement accessibles. Ici, nous démontrons l'extraction et la préparation du sacculus pour les enregistrements d'une et deux chambres. Ces deux préparations permettent les deux études micromécaniques et électrophysiologiques des cellules ciliées et leurs faisceaux associés. Parce que le tissu peut survivre pendant plusieurs heures avec un remplacement fréquent de sérum physiologique oxygénée, les expériences peuvent se poursuivre pendant de longues durées. Les cellules ciliées dans ces préparations restent généralement viables pour l'enregistrement de microélectrodes jusqu'à 6 h après la dissection, tandis que les faisceaux de cheveux oscillent spontanément jusqu'à 24 h après l'extraction.
extraction réussie et montage du sacculus charnières sur plusieurs surmontant les défis communs. Tout d'abord, le contact direct avec la surface apicale de la macula saccular doit être évitée dans toute la procédure de préparation. Le nerf sacculaire fournit une poignée pratique pour manipu sûrlation de l'sacculus. Une fois libéré du reste des organes de l'oreille interne, l'sacculus doit être transféré à l'aide d'une pipette de gros calibre tout en restant immergé dans le liquide pour éviter des dommages mécaniques à son épithélium sensoriel. Le retrait de otoconia de la surface maculaire doit être complété sans endommagement mécanique des cellules ciliées. Parce que le otoconia se trouvent directement au sommet de la macula, les cellules ciliées peuvent être endommagés par un contact accidentel entre les outils de dissection et la membrane otolithiques tout en enlevant otoconia. Pour éviter tout dommage, nous recommandons que la masse gélatineuse de otoconia lieu à un endroit loin de la macula et enlevé en une seule masse. Cela évite la fragmentation de la masse otoconial dans de nombreux groupes, dont chacun serait extraits individuellement. Si de petites grappes de otoconia restent, ils peuvent être enlevés avec une pression de fluide douce délivrée par une pipette Pasteur. Un dernier défi implique la formation d'un joint étanche entre le carré sacculus et de l'aluminium dans le montagepréparation à deux chambres. Employant un carré avec une perforation suffisamment petite pour permettre un chevauchement d'environ 100 um entre le sacculus et les permis d'aluminium autour d'étanchéité complète du tissu. La colle doit être mis en contact à environ 100 um de tissu sacculaire autour du périmètre de la macula, afin de former un joint étanche.
La concentration de Ca 2+ libre est une considération importante dans l'étude des cellules ciliées. Ca 2+ régule l' adaptation à la fois rapide et lente, déterminant ainsi la cinétique de l'appareil de mécanotransduction et les caractéristiques des phénomènes actif de traitement de la touffe de cheveux, y compris le mouvement du faisceau spontanée 8, 23. Calcium Endolymphatic in vivo est présent à 250 uM, donc la cinétique plus physiologiquement pertinents sont évalués à cette concentration (Maunsell RJH, R. Jacobs, et AJ Hudspeth. Unpublisobservations hed 16). Toutefois, les enregistrements de microélectrodes de cellules ciliées nécessitent une concentration en calcium externe supérieure à 2 mM pour assurer une bonne étanchéité de la membrane cellulaire autour de la microélectrode. Il est donc impératif d'utiliser une solution saline riche en calcium pour ces expériences. Enfin, on peut souhaiter étudier les effets du calcium externe sur mécanotransduction en utilisant une variété de concentrations de calcium. Dans ces cas, il est important de se rappeler que les concentrations de calcium inférieures à 1 uM généralement conduire à la pointe du lien de rupture et la perte irréversible de transduction 28.
Les deux préparations expérimentales décrites ici permettent une gamme de mesures biophysiques sur les cellules ciliées. Cependant, des mesures additionnelles peuvent être effectuées avec de légères modifications à ces préparations. Dans la préparation saccular plié, faisceaux de cheveux sont visualisées latéralement. Imaging cheveux bundle mouvement à partir de ce point de vue révèle mot cohérenteion à la fois à court et grand stéréocils 29. Ici, la macula sacciforme est d'abord séparé de son tissu sous-jacent et ensuite plié le long de l'axe défini par le nerf sacculaire de telle sorte que les faisceaux de poils font face vers l'extérieur et sont visualisées latéralement au niveau du pli. Une deuxième modification, dissociation cheveux cellulaire, permet l'étude des deux faisceau de la cellule de cheveux et son soma. Les cellules ciliées sont dissociées mécaniquement sur une lame de verre pour l' imagerie et électrophysiologique enregistrement 30. Enfin, les cellules ciliées peuvent être extrudes à partir de l'épithélium en suivant un protocole de dissociation similaire, mais sans l'étape de dissociation mécanique. Ce traitement conduit à des cellules ciliées qui expulsent progressivement hors de l'épithélium, permettant d'accéder à des enregistrements électrophysiologiques basolatérale, tout en minimisant les dommages mécaniques. Ces préparations et leurs nombreuses modifications illustrent la polyvalence de la saccule de grenouille comme système modèle pour la biophysiqueétude des cellules ciliées sensorielles.
Déclarations de divulgation
The authors declare no competing interests.
Remerciements
The authors wish to acknowledge Dr. A. J. Hudspeth for funding and expertise in developing the preparations described in this paper. We also wish to thank Brian Fabella for creating and maintaining much of the custom equipment and software used in this protocol.
J. B. A. is supported by grant F30DC014215, J. D. S. is supported by grant F30DC013468, and both J. B. A. and J. D. S. are supported by grant T32GM07739 from the National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Common to both preparations | |||
| Stereo-dissection microscope | Leica | MZ6 | Other sources can be used |
| Tricaine methanesulfonate | Sigma | E10521 | Other sources can be used |
| Metal pithing rod | Fine Science Tools | 10140-01 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | |
| Glass Pasteur pipette and bulb (x2) | Fisher Scientific | 22-042816 | |
| Fine eyelash mounted on a hypodermic needle | Fisher Scientific | 22-557-172 | |
| Dow-corning vacuum grease | Fisher Scientific | 14-635-5C | |
| Syringe for vacuum grease | Fisher Scientific | 14-829-45 | Other sources can be used |
| 35 mm Petri dish (x2 - 3) | Fisher Scientific | 08-772A | Other sources can be used |
| Micropipette puller | Sutter | P-97 or P-2000 | |
| 120 V Solenoid puller | Home-made, see parts list | ||
| Sputter coater | Anatech USA | Hummer 6.2 | |
| Current source for iontophoresis | Axon Instruments | AxoClamp 2B | Other sources can be used |
| Piezoelectric actuator | Piezosystem Jena | P-150-00 | |
| Amplifier for piezoelectric actuator | Piezosystem Jena | ENV800 | |
| Borosilicate glass capillary | World Precision Instruments | 1B120F-3 | |
| Name | Company | Catalog Number | Comments |
| For one-chamber preparation | |||
| Microelectrode amplifier | Axon Instruments | AxoClamp 2B | Can be used for iontophoresis and microelectrode recordings simultaneously |
| Magnetic pins (x2) | Home-made, see parts list | ||
| Open-top chamber with magnetic sheet | Home-made, see parts list | ||
| Name | Company | Catalog Number | Comments |
| For two-chamber preparation | |||
| Upper chamber | Supplementary file 1 | ||
| Troughed lower chamber | Supplementary file 2 | ||
| Aluminum foil | Fisher Scientific | 01-213-100 | Other sources can be used |
| Mounting block | Supplementary file 3 | ||
| Wooden applicator sticks | Fisher Scientific | 23-400-112 | Other sources can be used |
| Teflon sheet | McMaster-Carr | 8545K12 | For teflon applicator |
| Cyanoacrylate glue | 3M | 1469SB | |
| Lab tissues (Kimwipes) | Fisher Scientific | 06-666A | Other sources can be used |
| Gentamicin sulfate | Sigma-Aldrich | G1914 | Other sources can be used |
| Quick-setting epoxy | McMaster-Carr | 7605A18 | |
| 18 mm glass coverslips | Fisher Scientific | 12-546 | Other sources can be used |
| Name | Company | Catalog Number | Comments |
| Saline components | |||
| NaCl | Fisher Scientific | S271-3 | Other sources can be used |
| KCl | Sigma-Aldrich | P4504-500G | Other sources can be used |
| CaCl2 • 2H2O | Fisher Scientific | 10035-04-8 | Other sources can be used |
| HEPES | Sigma-Aldrich | H3375-100G | Other sources can be used |
| D-(+)-glucose | Sigma-Aldrich | G7021 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Parts lists for home-made equipment | |||
| Solenoid puller | |||
| Solenoid | Guardian Electric | A420-065426-00 | Other sources can be used |
| Foot-pedal switch | Linemaster | T-51-SC36 | Other sources can be used |
| Pipette holder | World Precision Instruments | MEH900R | Other sources can be used |
| Coarse manipulator | Narishige Group | MM-3 | Other sources can be used |
| Platinum wire | Alfa Aesar | 25093 | Other sources can be used |
| Power supply | Leica | Z050-261 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Magnetic pins | |||
| Epoxy | McMaster-Carr | 7556A33 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
| Insect pins | Fine Science Tools | 26000-40 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Open-top magnetic chamber | |||
| Flexible magnetic strip | McMaster-Carr | 5759K75 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
Références
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of Adult Mouse Utricle and Adenovirus-mediated Supporting-cell Infection. JoVE (Journal of Visualized Experiments). (61), e3734-e3734 (2012).
- Howard, J., Hudspeth, A. J. Compliance of the hair bundle associated with gating of mechanoelectrical transduction channels in the bullfrog's saccular hair cell. Neuron. 1 (3), 189-199 (1988).
- Jaramillo, F., Hudspeth, A. J. Localization of the hair cell's transduction channels at the hair bundle's top by iontophoretic application of a channel blocker. Neuron. 7 (3), 409-420 (1991).
- Assad, J. A., Hacohen, N., Corey, D. P. Voltage dependence of adaptation and active bundle movement in bullfrog saccular hair cells. Proceedings of the National Academy of Sciences of the United States of America. 86 (8), 2918-2922 (1989).
- Benser, M. E., Issa, N. P., Hudspeth, A. J. Hair-bundle stiffness dominates the elastic reactance to otolithic-membrane shear. Hearing research. 68 (2), 243-252 (1993).
- Martin, P., Hudspeth, A. J. Active hair-bundle movements can amplify a hair cell's response to oscillatory mechanical stimuli. Proceedings of the National Academy of Sciences of the United States of America. 96 (25), 14306-14311 (1999).
- Salvi, J. D., Ó Maoiléidigh, D., Fabella, B. A., Tobin, M., Hudspeth, A. J. Control of a hair bundle's mechanosensory function by its mechanical load. Proceedings of the National Academy of Sciences. 112 (9), E1000-E1009 (2015).
- Martin, P., Bozovic, D., Choe, Y., Hudspeth, A. J. Spontaneous Oscillation by Hair Bundles of the Bullfrog's Sacculus. Journal of Neuroscience. 23 (11), 4533-4548 (2003).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. 400, 275-297 (1988).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage-and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. , (1988).
- Fisher, J. A. N., Kowalik, L., Hudspeth, A. J. Imaging electrical resonance in hair cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (4), 1651-1656 (2011).
- Patel, S. H., Salvi, J. D., Ó Maoiléidigh, D., Hudspeth, A. J. Frequency-selective exocytosis by ribbon synapses of hair cells in the bullfrog's amphibian papilla. The Journal of neuroscience : the official journal of the Society for Neuroscience. 32 (39), 13433-13438 (2012).
- Gale, J. E., Meyers, J. R., Periasamy, A., Corwin, J. T. Survival of bundleless hair cells and subsequent bundle replacement in the bullfrog's saccule. Journal of neurobiology. 50 (2), 81-92 (2002).
- Hudspeth, A. J. Mechanoelectrical transduction by hair cells of the bullfrog's sacculus. Progress in brain research. 80, 129-135 (1989).
- Hudspeth, A. J. Integrating the active process of hair cells with cochlear function. Nature Reviews Neuroscience. 15 (9), 600-614 (2014).
- Corey, D. P., Hudspeth, A. J. Response latency of vertebrate hair cells. Biophysical journal. 26 (3), 499-506 (1979).
- Cheung, E. L. M., Corey, D. P. Ca2+Changes the Force Sensitivity of the Hair-Cell Transduction Channel. Biophysical journal. 90 (1), 124-139 (2006).
- Choe, Y., Magnasco, M. O., Hudspeth, A. J. A model for amplification of hair-bundle motion by cyclical binding of Ca2+ to mechanoelectrical-transduction channels. Proceedings of the National Academy of Sciences of the United States of America. 95 (26), 15321-15326 (1998).
- Assad, J. A., Corey, D. P. An active motor model for adaptation by vertebrate hair cells. Journal of Neuroscience. 12 (9), 3291-3309 (1992).
- Crawford, A. C., Evans, M. G., Fettiplace, R. Activation and adaptation of transducer currents in turtle hair cells. The Journal of physiology. , 405-434 (1989).
- Howard, J., Hudspeth, A. J. Mechanical relaxation of the hair bundle mediates adaptation in mechanoelectrical transduction by the bullfrog's saccular hair cell. Proceedings of the National Academy of Sciences of the United States of America. 84 (9), 3064-3068 (1987).
- Purves, R. D. The release of drugs from iontophoretic pipettes. Journal of Theoretical Biology. 66 (4), 789-798 (1977).
- Tinevez, J. Y., Jülicher, F., Martin, P. Unifying the various incarnations of active hair-bundle motility by the vertebrate hair cell. Biophysical journal. 93 (11), 4053-4067 (2007).
- Ó Maoiléidigh, D., Nicola, E. M., Hudspeth, A. J. The diverse effects of mechanical loading on active hair bundles. Proceedings of the National Academy of Sciences of the United States of America. 109 (6), 1943-1948 (2012).
- Kennedy, H. J., Crawford, A. C., Fettiplace, R. Force generation by mammalian hair bundles supports a role in cochlear amplification. Nature. 433 (7028), 880-883 (2005).
- van Netten, S. M., Khanna, S. M. Stiffness changes of the cupula associated with the mechanics of hair cells in the fish lateral line. Proceedings of the National Academy of Sciences of the United States of America. 91 (4), 1549-1553 (1994).
- Bormuth, V., Barral, J., Joanny, J. F., Jülicher, F., Martin, P. Transduction channels' gating can control friction on vibrating hair-cell bundles in the ear. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7185-7190 (2014).
- Crawford, A. C., Evans, M. G., Fettiplace, R. The actions of calcium on the mechano-electrical transducer current of turtle hair cells. The Journal of physiology. , 369-398 (1991).
- Kozlov, A. S., Risler, T., Hudspeth, A. J. Coherent motion of stereocilia assures the concerted gating of hair-cell transduction channels. Nature Neuroscience. 10 (1), 87-92 (2007).
- Lumpkin, E. A., Hudspeth, A. J. Regulation of free Ca2+ concentration in hair-cell stereocilia. Journal of Neuroscience. 18 (16), 6300-6318 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon