Method Article
Preparazione fisiologico delle cellule ciliate dalla sacculus del toro americana (
In questo articolo
Riepilogo
(Rana catesbeiana) sacculus del toro americana permette esame diretto della fisiologia delle cellule ciliate. Qui la dissezione e la preparazione del sacculus della rana toro per gli studi biofisici è descritto. Mostriamo esperimenti rappresentativi di queste cellule cigliate, incluso il calcolo di relazione forza-spostamento di un fascio e la misurazione del suo movimento non forzata.
Abstract
Lo studio dell'udito e dell'equilibrio poggia su intuizioni tratte da studi biofisici dei sistemi modello. Uno di questi modelli, la sacculus del toro americana, è diventato un pilastro della ricerca uditivo e vestibolare. Studi di questo organo hanno rivelato come sensoriale cellule capelli può rilevare attivamente segnali dall'ambiente. A causa di questi studi, ora capiamo meglio il gating meccanica e la localizzazione dei canali di trasduzione di una cellula di capelli, il ruolo del calcio nella adattamento meccanico, e l'identità delle correnti di cella capelli. Questo organo altamente accessibile continua a fornire una conoscenza del funzionamento delle cellule ciliate. Qui si descrive la preparazione del sacculus della rana toro per gli studi biofisici sulle sue cellule ciliate. Includiamo la procedura di dissezione completa e prevedere specifici protocolli per la preparazione del sacculus in contesti specifici. Includiamo inoltre risultati rappresentativi utilizzando questa preparazione, tra cui il calcolo delistantanea relazione forza-spostamento di un fascio di capelli e la misurazione di oscillazione spontanea di un fascio.
Introduzione
Gli organi acousticolateralis di mammiferi possiedono un'architettura complessa e si trovano all'interno di una nicchia anatomica che può essere difficile accesso. Ad esempio, la coclea mammiferi comprende un labirinto a spirale ed è inserita all'interno dell'osso temporale spessore. Isolamento della coclea spesso provoca danni meccanici alle cellule sensoriali giace all'interno di esso ed ha quindi dimostrato di essere un compito difficile 1. I neuroscienziati hanno così trasformato per modellare sistemi che sono più facilmente estratti dal sanctum dell'orecchio.
Uno di questi sistemi modello, la sacculus del toro americana (Rana catesbeiana), ha per decenni ha prodotto una visione generalizzabile nella funzione di sistemi uditivi e vestibolari. Il sacculus è un organo a funzione mista con ruoli sensoriali sia dell'udito a bassa frequenza e sensazione sismica. Le cellule sensoriali della sacculus sono le sue cellule ciliate, trasduttori specializzati che convertono l'energia meccanicain segnali elettrici all'interno dei nostri organi uditivi e vestibolari. Sporgente dalla superficie apicale di ciascuna cella di capelli è un fascio di capelli meccanosensibili che comprende un ciuffo graduata di microvilli allargata chiamato stereocilia. Le punte di stereocilia adiacenti sono interconnessi da filamentose proteine punta-link che meccanicamente cancello canali ionici in risposta a stimoli meccanici 2, 3. Anche se gli organi uditivi e vestibolari rispondono a diversi tipi di stimoli, essi condividono un meccanismo di rilevamento comune. Questa comunanza è alla base delle molte conoscenze acquisite in meccanotrasduzione capelli cellule attraverso studi del sacculus Bullfrog. Ad esempio, processo attivo della cellula capelli è stata ampiamente studiata in questo organo 4, 5, 6, 7, e il pacco dei capelli impiega un processo dispendioso energia per produrre meccanicalavoro. Non solo è stato dimostrato che le cellule ciliate generano lavoro attivo 6, ma distinti meccanismi alla base del processo attivo e le caratteristiche di ottimizzazione di una cella di capelli sono stati svelati attraverso studi di Bullfrog acousticolateralis organi. Questi includono attiva capelli fascio motilità 8 e capelli cella risonanza elettrica 9, 10, 11 nella sacculus e selettività frequenza nastro sinapsi della cellula capelli 12 nella papilla anfibio.
sacculus del toro fa appello ai neuroscienziati sensoriali per numerose ragioni. A differenza della coclea mammiferi, questo organo si trova all'interno della capsula otica facilmente accessibile. In secondo luogo, cellule ciliate all'interno di questo organo possono rimanere in buona salute per molte ore in condizioni appropriate 13, 14. Questo permette experimentation su queste cellule per lunghi tempi relativi alle loro controparti di mammifero. In terzo luogo, l'organo ha poco curvatura, permettendo una facile manipolazione. Quarto, ogni organo comprende un migliaio di cellule cigliate 15, fornendo sia un elevato rendimento ed una elevata probabilità di localizzare un insieme appropriato di cellule capelli per un dato esperimento. Infine, sacculus del toro è facilmente visualizzabile causa della sottigliezza di questo organo e grandi dimensioni delle sue cellule capelli.
Queste proprietà forniscono una grande versatilità per lo studio delle cellule sensoriali all'interno sacculus della rana toro. A seconda della questione trattata, una delle diverse preparazioni sperimentali possono essere ottenuti dal sacculus. Il più semplice di questi è la preparazione monocamerale. Qui sacculus viene immobilizzato in una camera riempita con perilymph artificiale, una soluzione salina ricca di sodio e alta calcio. Questa preparazione consente lo studio delle correnti di cella di capelli e la meccanica di base fascio di capelli. Una seconda configurazione, la preparazione doppia camera, può essere usato per studiare i movimenti spontanei fascio di capelli. Qui la parte apicale delle cellule ciliate è esposto ad un potassio-ricchi e poveri calcio-salino chiamato endolinfa artificiale, mentre il lato basolaterale è immersa nella perilinfa artificiale. Questi due scomparti imitano la disposizione in vivo di saline e di fornire un ambiente che permette fasci capelli per oscillare spontaneamente.
Descriviamo in questo lavoro la preparazione di sacculus della rana toro per lo studio biofisico delle sue cellule ciliate sensorie. In primo luogo abbiamo a disposizione una rappresentazione dettagliata della isolamento di questo organo da orecchio interno della rana. Abbiamo poi descrivere sia l'una e due camera di preparazioni sperimentali e includere i risultati rappresentativi per ogni configurazione.
Protocollo
Etica Dichiarazione: Tutte le procedure sono state approvate dal Comitato Istituzionale Animal Care e Usa (IACUC) presso la Rockefeller University.
1. Pre-sperimentale Prespanparation
- soluzioni
- Preparare la soluzione eugenolo (2,5 g · L -1 · kg -1 rana). Preparare le soluzioni saline (Tabella 1).
NOTA: Per una preparazione monocamerale, preparare perilymph artificiale; per una preparazione bicamerale, preparare sia perilinfa artificiale e endolymph artificiale.
- Preparare la soluzione eugenolo (2,5 g · L -1 · kg -1 rana). Preparare le soluzioni saline (Tabella 1).
2. Strumenti sperimentali
- Preparazione di fibra di vetro stimolazione
- Limitare un capillare di vetro borosilicato con un estrattore elettrodo in una sola linea di tiro con l'alto calore e l'alta velocità. Caricare il capillare tirato in un estrattore a solenoide-driven.
- Portare la punta del capillare verso un filamento con una perlina di vetrofuso su di esso fino a quando i contatti capillari del perline di vetro.
- Accendere il filamento per fondere la punta del capillare in perle di vetro. Una volta che un sottile ponte di forme di vetro tra il capillare ed il tallone, spegnere il filamento e intorno allo stesso tempo attivare l'estrattore solenoide.
NOTA: Questo tirerà il capillare di vetro ad angolo retto al suo asse lungo e creare una fibra solida. - Assicurarsi che il diametro della fibra è non più di 0,5 - 1 um e che la sua lunghezza non superi 100 - 300 micron. Se la lunghezza della fibra supera questa dimensione, tagliare con le forbici iris. Usare le forbici che sono già sordo per evitare di danneggiare gli strumenti di dissezione.
- Per aumentare il contrasto ottico, sputter cappotto la fibra. Utilizzare un dispositivo a induzione polverizzazione con una fonte d'oro-palladio. Verticalmente caricare ciascuna fibra in una spalmatrice polverizzazione con la sua estremità rastremata verso la sorgente. Portare punta della fibra ad una distanza di 1 - 2 cm dalla fonte di oro-palladio.
- Chiudi ilsputter camera di dispositivo a induzione per formare una tenuta e accenderlo. Lavare ripetutamente l'aria ambiente con argon. Dopo il lavaggio l'aria, ridurre la pressione nella camera a 10 Pa (70 mTorr).
- Sputter cappotto in 10 s impulsi con 10 s ritardi nel corso di un corso di 120 s.
NOTA: La punta della fibra sarà scurire tutta la durata del presente protocollo, se il rivestimento sputtering è stato un successo.
- Preparazione di microelettrodi taglienti
- Tirare un capillare di vetro con un filamento interno, con un modulo linea di tiro ad alta temperatura. Gli elettrodi devono avere una resistenza di 100 - 300 MW quando riempita con 3 M KCl. Riempire ogni elettrodo con 3 M KCl.
- Bend punta di ciascun elettrodo con la microforge per renderlo perpendicolare alla superficie apicale delle cellule dei capelli quando montato nella headstage dell'amplificatore 16.
- Preparazione di pipette ionoforesi
- Tirare un capillare di vetro con un internofilamento di una punta di 50 MW. Riempire con soluto concentrato (solfato per esempio, 500 mm gentamicina).
- Preparazione di alluminio quadrata di montaggio
- Tagliare da 1 cm x 1 cm quadrati di foglio di alluminio. Perforare il foglio al centro con la punta di una canna enervazione o altri oggetti appuntiti. Forma la perforazione in modo che è circolare e di circa 1 mm di diametro.
- Preparazione del vuoto siringa di grasso-riempita.
- Rimuovere lo stantuffo da una siringa da 5 ml. Riempire la siringa dal retro con grasso per vuoto. Sostituire lo stantuffo.
- Preparazione di politetrafluoroetilene colla applicatore
- Fare un assiale lungo 2 millimetri tagliato a la fine di un bastoncino di legno. La fessura deve essere al centro dell'applicatore se visto dall'estremità.
- Con forbici affilate o una lama di rasoio, tagliare a 2 x 4 mm rettangolo di politetrafluoroetilene da un foglio dello spessore di 1 mm.
- Utilizzare una lama di rasoio per sottile uno dei bordi del rettangolo politetrafluoroetilene 2 mm lungo. A partire dalla metà del rettangolo, ridurre lo spessore del rettangolo affettando verso l'esterno per formare uno smusso sulla punta del rettangolo.
- Inserire il rettangolo politetrafluoroetilene nell'applicatore feritoia di legno in modo che il bordo smussato rivolto verso il bastone. Applicare 5 min epossidica alla base del rettangolo politetrafluoroetilene per fissarlo in posizione. Lasciare che l'applicatore di colla di cura per 1 ora a temperatura ambiente.
- Preparazione della metà inferiore di due camere di montaggio
- Macchina o 3D stampare la metà inferiore dei due-camera di montaggio (file supplementare 2). Identificare il diametro incasso cerchio di 20 mm la superficie inferiore della camera.
- Applicare un sottile strato di resina epossidica per i laterali più di 3 mm del cerchio incasso. Applicare una 18 millimetri coprioggetto di vetro circolare sulla resina epossidica. Lasciare resina epossidica per la cura per 1h.
3. Estrazione di organi interni dell'orecchio
- Anestetizzare un toro americana ponendolo in un piccolo secchio contenente soluzione anestetica eugenolo per 10 minuti. Regolare il volume della soluzione in modo che omeroscapolari della rana bugie comuni appena sopra l'interfaccia liquido-aria.
- Euthanize la rana toro anestetizzato con un doppio enervazione.
- Afferrare la rana anestetizzato con un dito in cima il naso e un altro sotto la mascella e ruotare la testa della rana in avanti.
- Rapidamente precipitare l'asta enervazione nella volta cranica attraverso il foro occipitale, che si trova sulla linea mediana tra i processi occipitali della rana.
- Lentamente ritirare e ruotare l'asta fino a quando la punta si discosta dal foro occipitale. Forzare l'asta caudale attraverso i forami vertebrali per distruggere il midollo spinale.
- Verificare che la rana è stato correttamente doppiamente pithed osservando che i suoi arti inferiori si estendono.
- Afferrare la rana con un pollice in cima al naso e l'indice afferrare i denti vomerine per una migliore stabilità. Decapitare la rana tagliando l'articolazione temporo-mandibolare bilateralmente e successivamente tagliare ortogonalmente all'asse rostrocaudale. Per assicurare che gli organi dell'orecchio interno all'interno del cranio restano intatti, in modo che il taglio è caudale ad entrambi timpani.
- Utilizzando un microscopio stereodissection, eseguire una linea mediana tagliare il tessuto palatale dai denti vomerine nella misura più posteriore del tessuto (Figura 1A).
- Sever e chiaro con tagli orizzontali del bisturi ogni muscolo che si trovano sotto il tessuto del palato per rivelare la cartilagine posteriore. Dopo aver rimosso il muscolo, osservare la forma lollipop della cartilagine temporale che forma il confine della capsula otica.
- Sever columella nel suo punto di contatto con la cartilagine della capsula otica.
- Ripetutamente radere strati sottili di questa cartilagine facendo shallotagli orizzontali w attraverso di essa. Evitare tagli profondi per evitare danni agli organi dell'orecchio interno. Questo apre la capsula otica trovato all'interno della struttura lecca-lecca della cartilagine temporale (Figura 1B). All'interno della capsula otica sono organi dell'orecchio interno della rana (Figura 1C).
- Tagliare il posteriore e bordi laterali della capsula otica, facendo attenzione a non danneggiare gli organi dell'orecchio interno. Durante la dissezione, spesso il flusso di soluzione salina nel corso degli organi dell'orecchio interno per garantire che essi rimangano sommerse e idratata.
- Individuare le due aperture circolari nell'osso temporale in connessione mediale della cartilagine alla linea mediana. Tagliare verso il basso attraverso l'apertura più mediale alla rottura dell'osso temporale.
- Fare un secondo taglio verso il basso attraverso la capsula otica al suo bordo postero-laterale. Rimuovere il pezzo di cartilagine tra questo e il precedente taglio per fornire l'accesso agli organi dell'orecchio interno.
- Fare leva perdere la cartilagine tra i tagli da 3,8 punti and 3.9 e tagliato via dalla capsula otica. Questa azione recide canale semicircolare vicina, che può quindi essere utilizzato come maniglia per ulteriori manipolazioni.
- Facendo attenzione a non toccare il sacculus, recidere la VIII ° nervo cranico.
- Tenere l'ampolla del canale semicircolare più vicino. Ruotare delicatamente l'orecchio interno per esporre i restanti due canali semicircolari. Su esponendo ogni canale, tagliare esso.
- Tenendo il nervo o un ampolla canale semicircolare, estrarre l'orecchio interno dalla testa e metterlo in un piatto pieno di fresco perilinfa artificiale ossigenato. Rimozione dell'orecchio interno permette la visualizzazione dei passaggi all'interno dell'osso temporale attraverso cui i canali semicircolari volta passati (Figura 1D).
NOTA: Ripetere questi passaggi per estrarre il secondo orecchio.
4. Preparazione One-camera
- Isolamento di sacculus
- Individuare il sacculus identificando la sua grande Pentecostee la massa di otoconia e il nervo sacculare che si trova in cima ad essa (Figura 1E). Fare attenzione a non traumatizzare fisicamente il sacculus durante le seguenti operazioni al fine di mantenere l'integrità delle cellule ciliate sacculari.
- Tagliare i canali semicircolari per rendere l'orecchio interno più manovrabile.
- Rimuovere la cisterna perilinfatico sovrastante il lato neurale del sacculus. Effettuare tagli dolci intorno al perimetro della cisterna. Successivo recidere i piccoli pilastri di tessuto che colmano membrana della cisterna al lato neurale del sacculus.
- Rimuovere il Lagena e la sua neuropatico associato.
- Tenendo il nervo sacculare, sollevare delicatamente il sacculus e tagliare il sottile membrana del sacco otoconial. Come otoconia fuoriuscite di uscita, liberare la sacculus tagliando attorno al suo perimetro.
NOTA: Dopo aver staccato la sacculus, i restanti organi dell'orecchio interno possono essere salvati se lo si desidera. La rimozione del sacculus facilita identificazione delle altre strutture, come ad esempiole papille anfibio e basilare. - Usare le forbici o pinze per pulire attentamente tutta la otoconia rimanente sul sacculus. Fare attenzione a non toccare la sacculus durante questo processo.
- Tagliare ogni residuo di membrana otoconial uscita dal bordo sacculus '. Questa membrana tende ad aderire alle superfici di plastica e vetro e la sua rimozione minimizza sfide nella gestione del tessuto.
- Scorrere delicatamente salina sopra la sacculus con una pipetta Pasteur per eliminare ogni residuo di otoconia (Figura 1F).
NOTA: Ripetere questa procedura per il secondo sacculus, che è l'immagine speculare della prima.
- Digestione e di montaggio
- Utilizzando il back-end di una pipetta Pasteur con la punta spezzata, trasferire il sacculi isolato di una capsula di Petri contenente 3 ml di 67 mg ∙ L -1 proteasi XXIV in perilinfa artificiale.
NOTA: Questo trattamento proteasi digerisce i link legare gli ogni lampadina kinociliary al otoliticamembrana, consentendo la rimozione della membrana senza danneggiare i fasci capelli sensoriali. - Incubare il tessuto per 30 minuti a 22 ° C (o 35 min a 21 ° C). Trasferire ogni sacculus digerito a una camera sperimentale a faccia aperta e fissare il tessuto con i perni magnetici.
- La macula sacculare trova direttamente sotto la membrana otolitica ed è la parte del sacculus che contiene cellule cigliate. Identificare e rimuovere con attenzione la sua membrana otolitica sovrastante con una multa ciglia, facendo attenzione a non toccare la macula sacculare.
- Utilizzando il back-end di una pipetta Pasteur con la punta spezzata, trasferire il sacculi isolato di una capsula di Petri contenente 3 ml di 67 mg ∙ L -1 proteasi XXIV in perilinfa artificiale.
5. Preparazione a due camere
- Isolamento di sacculus
- Isolare il sacculus dagli organi dell'orecchio interno come nella sezione 4.1.
- Montaggio e digestione
- Riempire il blocco di montaggio (file supplementare 3) con perilinfa artificiale e posizionare il foglio di alluminio perforato su una apertura, con due macchie di vuotograsso per tenerlo in posizione e formare una tenuta debole.
- Trasferimento uno sacculus al foglio e centrarlo sopra il foro con la macula rivolto verso il basso e il moncone del nervo rivolto verso l'alto.
- Rimuovere la soluzione salina che circonda la sacculus con un pezzo di tessuto intrecciato. Stoppino la soluzione salina per asciugare la superficie della piazza in alluminio che circonda il sacculus.
- Utilizzare l'applicatore politetrafluoroetilene per applicare colla cianoacrilato per formare una chiusura a tenuta lungo il confine tra il bordo del sacculus e il quadrato di alluminio. Assicurarsi che l'intera circonferenza del sacculus è coperto con la colla.
NOTA: Procedendo troppo lentamente permette il collante cianoacrilato a strisciare sul lato neurale del sacculus ed eventualmente coprirlo. E 'quindi indispensabile per completare rapidamente questo compito. - Mettere una goccia di soluzione salina in cima tessuto montato per curare il collante. Un sottile strato di colla può formare sulla parte superiore della goccia di soluzione salina; rimuovere con una pinza.
- Rimuovere con attenzione tegli sventa dal blocco di montaggio. Vibrazione tessuto montato in modo che il lato maculare della sacculus rivolto verso l'alto e galleggiare su un perilymph-riempita piatto Petri artificiale.
- Aggiungere una goccia di soluzione proteasi XXIV sopra della macula e incubare per 30 min a 22 ° C (o 35 min a 21 ° C). Riempire il canale più bassa dell'apparato a doppia camera (file supplementare 2) con grasso perilinfa e posto vuoto intorno alla camera centrale.
- Posizionare il sacculus lamina montata sulla camera inferiore con il suo nervo rivolta verso la superficie della camera. Aggiungere grasso intorno al perimetro della lamina.
- Posizionare la camera superiore (file supplementare 1) della preparazione sul foglio, avendo cura di formare una tenuta completa con il grasso per vuoto. Riempire la camera superiore con endolinfa artificiale bolliti e rimuovere delicatamente la membrana otolitica con un ciglio.
Risultati
L'epitelio sensoriale sacculus del toro può essere impiegato in varie configurazioni per sondare la fisiologia delle cellule dei capelli. Poiché il tessuto è relativamente piatto, può essere montato in entrambe le preparazioni uno o due camera. La configurazione uno-camera permettono una semplice configurazione per le registrazioni elettrofisiologiche e micromeccanici di cellule ciliate. La preparazione bicamerale simula invece sia il endolymphatic e scomparti perilinfatici sui rispettivamente ai lati apicali e basali delle cellule ciliate. Questi compartimenti insieme forniscono un ambiente fisiologicamente rilevanti per lo studio delle meccanotrasduzione dalle cellule dei capelli.
Le caratteristiche di sensibilità e di trasduzione di cellule ciliate sono alla base la loro risposta elettrica allo stimolo meccanico. Per sondare queste caratteristiche, abbiamo contemporaneamente registrato da una singola cellula capelli la posizione del suo fascio epotenziale recettore della cellula (Figura 2). Per prima attaccato una fibra di vetro flessibile al bulbo kinociliary di un fascio di capelli per applicare impulsi di forza. Abbiamo poi misurato spostamento del pacco dei capelli utilizzando un fotodiodo doppio sistema 2 (Figura 2A). Abbiamo contemporaneamente acquisito il potenziale delle cellule capelli impalare la cella con un microelettrodo tagliente. Abbiamo ottenuto una curva spostamento-risposta riportando la risposta di tensione di picco suscitato da ogni stimolo meccanico contro lo spostamento corrispondente del fascio di capelli (Figura 2B). risposta elettrica della cellula capelli satura sia extrema positivo-negativo e cilindrata. La riduzione del potenziale di membrana con gradini spostamento negativo indica la presenza di una corrente entrante riposo meccanotrasduzione. Questa corrente di riposo viene modulata dall'azione di Ca 2+ sia veloce e lento adattamento 17, 18, 19, 20, 21.
Il comportamento di una cella di capelli dipende non solo sulle sue proprietà elettriche, ma anche sulle micromeccanica del suo fascio di capelli sensoriale. I imita configurazione a due camere la separazione di endolymph e perilymph in vivo, che fornisce le condizioni ideali per lo studio della meccanica di un fascio di capelli. In queste condizioni e con la membrana otolitica rimosso, fasci capelli può oscillare spontaneamente 6. Qui abbiamo utilizzato la preparazione bicamerale per valutare i micromeccanica dei singoli pacchetti. Abbiamo registrato le oscillazioni spontanee di un fascio di capelli dalla loro ombra su un doppio fotodiodo spostamento monitor (Figura 3). Per valutare il ruolo della aminoglicosidico gentamicina antibiotico su meccanotrasduzione, abbiamo iontophoretically Relè ased gentamicina direttamente sul pacco dei capelli (Figura 3). La concentrazione di gentamicina rilasciato aumenta proporzionalmente con la corrente passa attraverso la micropipetta. Gentamicina inibisce oscillazioni del pacco dei capelli e induce uno spostamento del fascio verso il lato alto statico. Questi effetti riflettono il ruolo di gentamicina come un bloccante aperto canali che mantiene lo stato di apertura dei canali meccanotrasduzione, bloccando la loro pori permeazione. Ionoforesi di prodotti chimici praticati permessi localizzato e il rilascio di sostanze chimiche quantificabile a varie concentrazioni in assenza di fluido rottura meccanica flusso indotta ed è quindi particolarmente adatto per lo studio di organelli meccanosensibili come il fascio di capelli 22.
Moto spontaneo di un fascio di capelli nasce dalla interazione tra adattamento e non lineari fascio rigidità 7,xref "> 8, 23, 24. Questo movimento spontaneo è una firma di processo attivo di un fascio di capelli, che converte l'energia del segnale in meccanica per superare resistenza viscosa. fasci di capelli hanno dimostrato di esibire non lineare rigidità istantanea nel vestibolare 2, uditivo 25, e laterale-linea sistemi 26.
Abbiamo misurato direttamente la rigidità istantanea di un individuo fascio di capelli dal sacculus del toro (figura 4). Per ottenere questo, accoppiati l'estremità di una fibra di vetro flessibile lampadina kinociliary del pacco dei capelli (Figura 4A). Abbiamo consegnato forze al pacco dei capelli spostando di base della fibra. La forza esercitata sul pacco dei capelli dalla fibra impulso corrisponde alla differenza tra gli spostamenti del bas della fibraE e punta, moltiplicati per la rigidità della fibra 2, 27. Fornire impulsi attraverso una gamma di forze rivela una relazione tra la forza esercitata sul pacco e spostamento conseguente del fascio. La pendenza di questa relazione forza-spostamento corrisponde alla rigidità istantanea del pacco dei capelli (Figura 4A).
Questo metodo ha permesso di misurare la rigidità istantanea di un pacchetto individuo come funzione della sua deformazione (Figura 4B). La curva di forza-spostamento istantaneo visualizza una relazione non lineare, rivelando una rigidità non lineare del fascio in un intervallo di circa 20 nm attorno alla sua posizione di riposo. Al di fuori di questo intervallo, il fascio di capelli si comporta come un materiale Hookean, la sua rigidità è lineare per le deviazioni di grande magnitudo.
Questi risultati demonstvalutare la versatilità del sacculus bullfrog nello studio della fisiologia delle cellule ciliate. Usando queste e altre preparazioni, si può esplorare mechanotransduction a più stadi nella trasmissione delle informazioni dal fascio verso il cervello.

Figura 1: dissezione del dell'orecchio interno della Bullfrog. (A) Guarda il palato superiore della rana toro dal suo lato ventrale consenta l'identificazione della tuba di Eustachio (cerchio). riflessione laterale della pelle che copre il lato destro del palato superiore rivela la posizione dell'orecchio interno (casella tratteggiata). (B) rimozione della cartilagine sul lato ventrale dell'osso temporale della rana apre capsula otica (linea tratteggiata). (C) espressa è un'immagine ingrandimento maggiore della capsula otica, in cui il sacculus, lagena, CN VIII, e SACC lare nervo può essere facilmente identificato. (D) Una vista della capsula otica asportazione degli organi dell'orecchio interno rivela le posizioni dei canali semicircolari. (E) Dopo la rimozione del isolato dell'orecchio interno, la sacculus, lagena e VIII ° nervo cranico (CN VIII) può essere facilmente identificato. (F) La sacculus isolato possiede una breve moncone del nervo sacculare e una membrana otolitica sdraiato sopra il suo epitelio sensoriale. Etichette corrispondono al (i) sacculus, (ii) lagena, (iii) CN VIII, (iv) del nervo sacculare, e (v) membrana otolitica. Etichette asse P e A corrispondono rispettivamente alle direzioni posteriori e anteriori. Barre di scala rappresentano 1 cm (A, B), 1 mm (C, D, E), e 400 micron (F).
Clicca qui per vedere una versione più grande di questa figura.
s "target =" _ blank "> Clicca qui per scaricare una versione vettore di questa figura.
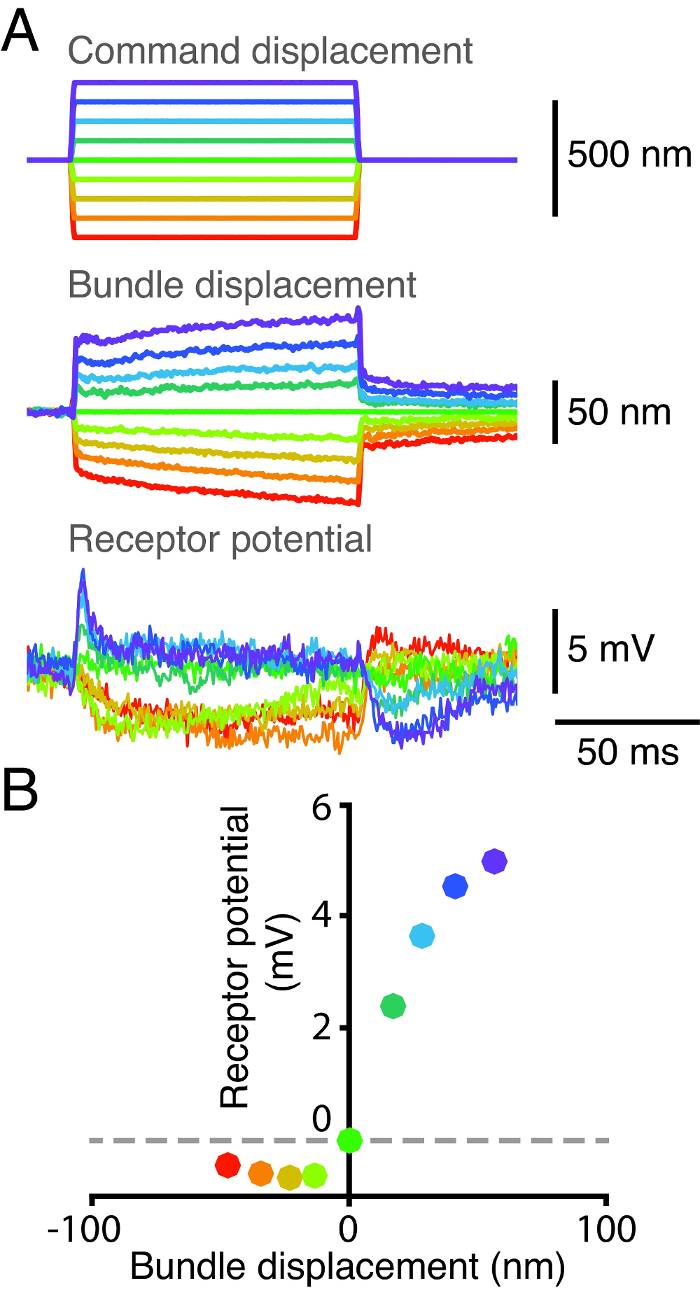
Figura 2: Curva Dislocamento-risposta per una cella singola capelli. (A) La punta di una fibra di vetro stimolo veniva accoppiato al bulbo kinociliary di un fascio di capelli e la base della fibra è stato successivamente spostato in nove passi discreti. La posizione del fascio è stato rintracciato su un sistema a doppio fotodiodo, e il suo potenziale recettore è stata misurata utilizzando contemporaneamente un microelettrodo la cui uscita è stata approvata attraverso un amplificatore in modalità bridge. Resistenza punta dell'elettrodo è stata del 95 MW e il potenziale di membrana a riposo del fascio era -47 mV. (B) Un appezzamento di potenziale recettore del fascio in funzione dello spostamento rivela una relazione lineare tra la risposta e la sua del fascioposizione. Ogni punto corrisponde allo spostamento media potenziale e medio su una finestra temporale di 2,5 ms, a cominciare 2,5 ms dopo l'inizio della stimolazione meccanica. Ogni colore rappresenta un insieme di serie storiche corrispondente allo stesso impulso di spostamento.
Clicca qui per vedere una versione più grande di questa figura.
Fate clic qui per scaricare una versione vettore di questa figura.
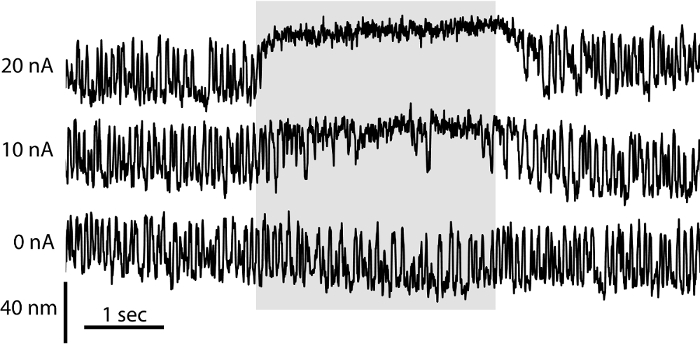
Figura 3: Effetto della Gentamicina su spontanea dei capelli Bundle oscillazione. Il movimento spontaneo di un fascio di capelli in un preparato bicamerale stato registrato utilizzando un sistema a doppio fotodiodo. In assenza di immissione iontoforetica di gentamicina (0 nA), i capellifascio mostra oscillazioni simmetriche. Poiché la grandezza della corrente passa attraverso una pipetta Iontoforetico riempito con 500 mM gentamicina solfato cresce (10 nA, 20 nA), la frequenza delle escursioni capelli fascio cade in maniera dose-dipendente e il fascio è spostato verso il bordo alto per più periodi di tempo.
Clicca qui per vedere una versione più grande di questa figura.
Fate clic qui per scaricare una versione vettore di questa figura.
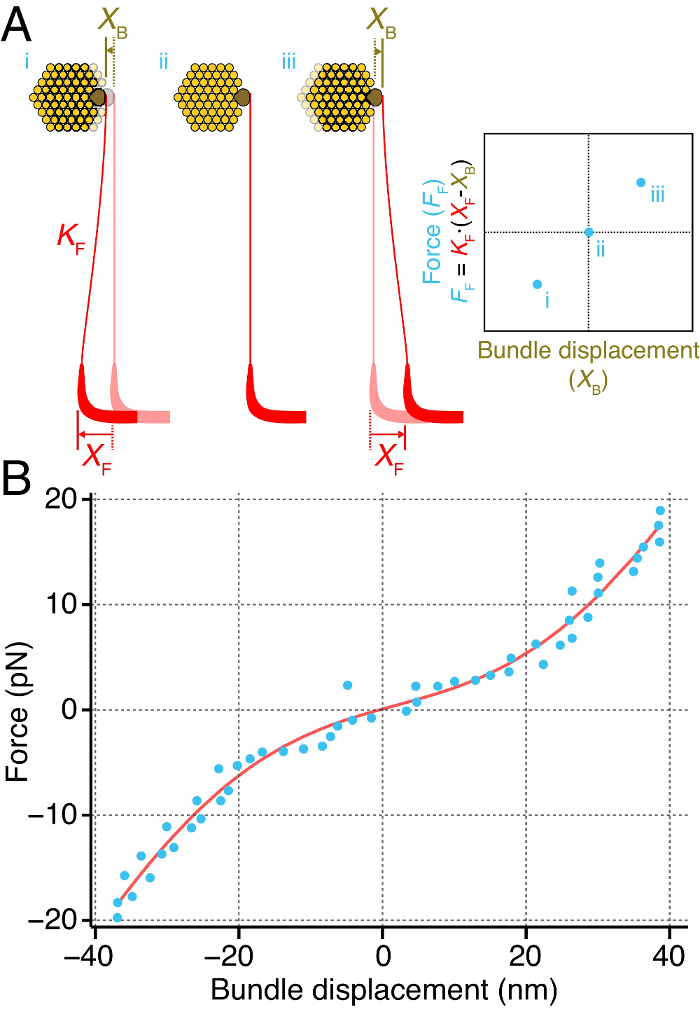
Figura 4. Calcolo di un fascio di capelli istantanea rigidità. (A) Una fibra stimolo (rosso) di rigidità K F è accoppiato to la lampadina kinociliary (marrone) di un fascio di capelli individuale (giallo). Spostando la base della fibra una distanza nota X F provoca il fascio di spostare una distanza X B. La differenza tra gli spostamenti della fibra e il fascio è proporzionale alla forza esercitata sul fascio dalla fibra stimolo, F F. Ripetendo questo attraverso una gamma di forze produce una istantanea relazione forza-spostamento (a destra), la pendenza delle quali corrisponde ad rigidità istantanea del pacco dei capelli. (B) Un pacchetto individuale è sottoposto a forzare impulsi di grandezza aumentante e lo spostamento entro i primi 50 ms dopo l'inizio dell'impulso è stata misurata (punti blu). Qui il pacco dei capelli visualizza una rigidità istantanea non lineare su un intervallo di circa 20 nm intorno alla sua posizione di riposo. La curva rossa corrisponde ad una misura alla relazione F = k * X - 60 * z * (1 / (1 + exp (- z * (X - X 0) / (k B * T))) + F 0, in cui F è la forza applicata al fascio, X è il fascio di spostamento, k = 790 ± 51 μN ∙ m -1 è il fascio di costante rigidità quando tutti i canali sono chiusi o aperti, z = 0.43 ± 0.04 pN è la forza di una singola molla gating, X 0 = 2 ± 1,9 nm è la posizione del fascio alla quale il 50% dei suoi canali sono aperti, k B è di Boltzmann costante, T è la temperatura, e F 0 = 11,7 ± 1,3 pN è una forza offset. La misura possiede un coefficiente di determinazione di 0,98. La fibra di stimolo aveva una rigidità di 107 μN ∙ m -1.
Clicca qui per vedere una versione più grande di questa figura.
es / ftp_upload / 55380 / Figure4_v5.eps "target =" _ blank "> Clicca qui per scaricare una versione vettore di questa figura.
| Soluto | Formula Peso (g / mol) | Aggiungere a 1 L | |
| perilymph artificiale | endolymph artificiale | ||
| NaCl | 58,4 | 6.54 g | 0,117 g |
| KCl | 0,149 | 0,149 g | 8.62 g |
| CaCl 2 ⦁ 2H 2 O | 147 | 2 ml di 1 M CaCl 2 stock | 250 ml di 1 M CaCl 2 stock |
| HEPES | 238,3 | 1,19 g | 1,19 g |
| D - (+) - glucosio | 180,2 | 0,541 g | 0. 541 g |
Tabella 1. Soluzioni per la dissezione e sperimentale di preparazione. Visualizzati in questa tabella sono le ricette per perilinfa artificiale e soluzioni endolymph artificiali utilizzati nella dissezione e in preparati uno o due da camera. Le soluzioni dovrebbero essere portati a pH 7,2-7,4 con circa 2 ml di NaOH (perilymph) o 2 ml di KOH (endolinfa). La forza osmotica dovrebbe leggere circa 230 mmol · kg -1 a causa della incompleta dissociazione ionica.
Discussione
All'interno sacculus del toro si trovano diverse migliaia di cellule ciliate sensorie facilmente accessibili. Qui mostriamo estrazione e preparazione del sacculus per le registrazioni uno e due da camera. Questi due preparazioni consentono entrambi gli studi micromeccanici e elettrofisiologiche di cellule ciliate ei loro fagotti associati. Poiché il tessuto può sopravvivere per diverse ore con frequente sostituzione di soluzione salina ossigenata, esperimenti possono continuare per lunghi periodi. le cellule dei capelli in queste preparazioni tipicamente rimangono vitali per la registrazione microelettrodi per un massimo di 6 ore dopo la dissezione, mentre fasci di capelli oscillano spontaneamente fino a 24 ore dopo l'estrazione.
l'estrazione di successo e montaggio del sacculus cerniere su superando numerose sfide comuni. Innanzitutto, il contatto diretto con la superficie apicale della macula sacculare dovrebbe essere evitata durante la procedura di preparazione. Il nervo sacculare fornisce una comoda maniglia per alla manipolazione sicuramento del sacculus. Una volta liberato dal resto degli organi dell'orecchio interno, sacculus dovrebbe essere trasferito utilizzando una pipetta grosso calibro rimanendo immerso nel liquido per evitare danni meccanici alla sua dell'epitelio sensoriale. La rimozione di otoconia dalla superficie maculare deve essere completato senza danni meccanici alle cellule dei capelli. Poiché il otoconia si trovano direttamente in cima alla macula, le cellule dei capelli possono essere danneggiati dal contatto accidentale tra gli strumenti di dissezione e la membrana otolitica durante la rimozione otoconia. Per evitare danni, si raccomanda che la massa gelatinosa di otoconia si terrà in un luogo lontano dalla macula e rimosso come una massa unica. Questo evita la frammentazione della massa otoconial in numerosi gruppi, ciascuno dei quali verrebbe estratto singolarmente. Se i piccoli gruppi di otoconia rimangono possono essere rimossi con una leggera pressione del fluido consegnato da una pipetta Pasteur. Una sfida finale prevede la formazione di una tenuta tra la piazza sacculus e alluminio montaggio inPreparazione a due camere. Impiegando una piazza con una perforazione abbastanza piccolo da consentire la sovrapposizione di circa 100 micron tra il sacculus e le circostanti permessi alluminio completo di tenuta del tessuto. La colla deve essere portata a contatto con circa 100 micron di tessuto saccular intorno al perimetro della macula per formare una tenuta ermetica.
La concentrazione di Ca 2+ libera è una considerazione importante nello studio delle cellule ciliate. Ca 2+ regola adattamento sia veloce e lento, determinando così la cinetica dell'apparato meccanotrasduzione e le caratteristiche dei fenomeni attivo processo del pacco dei capelli, compreso il movimento spontaneo fascio 8, 23. Calcio endolymphatic in vivo è presente a 250 micron, pertanto, la cinetica più fisiologicamente rilevanti sono valutati a questa concentrazione (Maunsell JHR, R. Jacobs, e AJ Hudspeth. Unpublisosservazioni HED 16). Tuttavia, le registrazioni di microelettrodi da cellule cigliate richiedono una concentrazione di calcio esterno superiore 2 mM per la corretta tenuta della membrana cellulare intorno al microelettrodo. È pertanto indispensabile utilizzare una soluzione salina ad alta calcio per questi esperimenti. Infine, si può desiderare di studiare gli effetti del calcio esterno su meccanotrasduzione utilizzando una varietà di concentrazioni di calcio. In questi casi, è importante ricordare che le concentrazioni di calcio sotto 1 micron di solito portare a punta-link rottura e la perdita irreversibile di trasduzione 28.
Le due preparazioni sperimentali descritte qui consentono una serie di misurazioni biofisiche di cellule cigliate. Tuttavia, ulteriori misurazioni possono essere effettuate con lievi modifiche a queste preparazioni. Nella preparazione sacculare piegato, fasci capelli sono visualizzati lateralmente. Imaging Movimento dei capelli-pacco da questo punto di vista rivela mot coerenteioni di sia a breve e alto stereocilia 29. Qui la macula sacculare è separato dalla parte in tessuto sottostante e successivamente piegata lungo l'asse definito dal nervo sacculare tale che fasci capelli rivolte verso l'esterno e sono visualizzati lateralmente alla piega. Una seconda modifica, la dissociazione dei capelli celle, consente lo studio di entrambi fascio della cellula capelli e la sua soma. Le cellule dei capelli sono dissociate meccanicamente su un vetrino per l'imaging e elettrofisiologiche di registrazione 30. Infine, le cellule dei capelli possono essere estruse dall'epitelio seguendo un protocollo simile dissociazione ma senza il passaggio di dissociazione meccanica. Questo trattamento si traduce in cellule ciliate che sporgono gradualmente dell'epitelio, fornendo l'accesso basolaterale per le registrazioni elettrofisiologiche, riducendo al minimo i danni meccanici. Queste preparazioni e le loro numerose modifiche dimostrano la versatilità del sacculus rana come sistema modello per il biofisicostudio delle cellule ciliate sensorie.
Divulgazioni
The authors declare no competing interests.
Riconoscimenti
The authors wish to acknowledge Dr. A. J. Hudspeth for funding and expertise in developing the preparations described in this paper. We also wish to thank Brian Fabella for creating and maintaining much of the custom equipment and software used in this protocol.
J. B. A. is supported by grant F30DC014215, J. D. S. is supported by grant F30DC013468, and both J. B. A. and J. D. S. are supported by grant T32GM07739 from the National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Common to both preparations | |||
| Stereo-dissection microscope | Leica | MZ6 | Other sources can be used |
| Tricaine methanesulfonate | Sigma | E10521 | Other sources can be used |
| Metal pithing rod | Fine Science Tools | 10140-01 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | |
| Glass Pasteur pipette and bulb (x2) | Fisher Scientific | 22-042816 | |
| Fine eyelash mounted on a hypodermic needle | Fisher Scientific | 22-557-172 | |
| Dow-corning vacuum grease | Fisher Scientific | 14-635-5C | |
| Syringe for vacuum grease | Fisher Scientific | 14-829-45 | Other sources can be used |
| 35 mm Petri dish (x2 - 3) | Fisher Scientific | 08-772A | Other sources can be used |
| Micropipette puller | Sutter | P-97 or P-2000 | |
| 120 V Solenoid puller | Home-made, see parts list | ||
| Sputter coater | Anatech USA | Hummer 6.2 | |
| Current source for iontophoresis | Axon Instruments | AxoClamp 2B | Other sources can be used |
| Piezoelectric actuator | Piezosystem Jena | P-150-00 | |
| Amplifier for piezoelectric actuator | Piezosystem Jena | ENV800 | |
| Borosilicate glass capillary | World Precision Instruments | 1B120F-3 | |
| Name | Company | Catalog Number | Comments |
| For one-chamber preparation | |||
| Microelectrode amplifier | Axon Instruments | AxoClamp 2B | Can be used for iontophoresis and microelectrode recordings simultaneously |
| Magnetic pins (x2) | Home-made, see parts list | ||
| Open-top chamber with magnetic sheet | Home-made, see parts list | ||
| Name | Company | Catalog Number | Comments |
| For two-chamber preparation | |||
| Upper chamber | Supplementary file 1 | ||
| Troughed lower chamber | Supplementary file 2 | ||
| Aluminum foil | Fisher Scientific | 01-213-100 | Other sources can be used |
| Mounting block | Supplementary file 3 | ||
| Wooden applicator sticks | Fisher Scientific | 23-400-112 | Other sources can be used |
| Teflon sheet | McMaster-Carr | 8545K12 | For teflon applicator |
| Cyanoacrylate glue | 3M | 1469SB | |
| Lab tissues (Kimwipes) | Fisher Scientific | 06-666A | Other sources can be used |
| Gentamicin sulfate | Sigma-Aldrich | G1914 | Other sources can be used |
| Quick-setting epoxy | McMaster-Carr | 7605A18 | |
| 18 mm glass coverslips | Fisher Scientific | 12-546 | Other sources can be used |
| Name | Company | Catalog Number | Comments |
| Saline components | |||
| NaCl | Fisher Scientific | S271-3 | Other sources can be used |
| KCl | Sigma-Aldrich | P4504-500G | Other sources can be used |
| CaCl2 • 2H2O | Fisher Scientific | 10035-04-8 | Other sources can be used |
| HEPES | Sigma-Aldrich | H3375-100G | Other sources can be used |
| D-(+)-glucose | Sigma-Aldrich | G7021 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Parts lists for home-made equipment | |||
| Solenoid puller | |||
| Solenoid | Guardian Electric | A420-065426-00 | Other sources can be used |
| Foot-pedal switch | Linemaster | T-51-SC36 | Other sources can be used |
| Pipette holder | World Precision Instruments | MEH900R | Other sources can be used |
| Coarse manipulator | Narishige Group | MM-3 | Other sources can be used |
| Platinum wire | Alfa Aesar | 25093 | Other sources can be used |
| Power supply | Leica | Z050-261 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Magnetic pins | |||
| Epoxy | McMaster-Carr | 7556A33 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
| Insect pins | Fine Science Tools | 26000-40 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Open-top magnetic chamber | |||
| Flexible magnetic strip | McMaster-Carr | 5759K75 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
Riferimenti
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of Adult Mouse Utricle and Adenovirus-mediated Supporting-cell Infection. JoVE (Journal of Visualized Experiments). (61), e3734-e3734 (2012).
- Howard, J., Hudspeth, A. J. Compliance of the hair bundle associated with gating of mechanoelectrical transduction channels in the bullfrog's saccular hair cell. Neuron. 1 (3), 189-199 (1988).
- Jaramillo, F., Hudspeth, A. J. Localization of the hair cell's transduction channels at the hair bundle's top by iontophoretic application of a channel blocker. Neuron. 7 (3), 409-420 (1991).
- Assad, J. A., Hacohen, N., Corey, D. P. Voltage dependence of adaptation and active bundle movement in bullfrog saccular hair cells. Proceedings of the National Academy of Sciences of the United States of America. 86 (8), 2918-2922 (1989).
- Benser, M. E., Issa, N. P., Hudspeth, A. J. Hair-bundle stiffness dominates the elastic reactance to otolithic-membrane shear. Hearing research. 68 (2), 243-252 (1993).
- Martin, P., Hudspeth, A. J. Active hair-bundle movements can amplify a hair cell's response to oscillatory mechanical stimuli. Proceedings of the National Academy of Sciences of the United States of America. 96 (25), 14306-14311 (1999).
- Salvi, J. D., Ó Maoiléidigh, D., Fabella, B. A., Tobin, M., Hudspeth, A. J. Control of a hair bundle's mechanosensory function by its mechanical load. Proceedings of the National Academy of Sciences. 112 (9), E1000-E1009 (2015).
- Martin, P., Bozovic, D., Choe, Y., Hudspeth, A. J. Spontaneous Oscillation by Hair Bundles of the Bullfrog's Sacculus. Journal of Neuroscience. 23 (11), 4533-4548 (2003).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. 400, 275-297 (1988).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage-and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. , (1988).
- Fisher, J. A. N., Kowalik, L., Hudspeth, A. J. Imaging electrical resonance in hair cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (4), 1651-1656 (2011).
- Patel, S. H., Salvi, J. D., Ó Maoiléidigh, D., Hudspeth, A. J. Frequency-selective exocytosis by ribbon synapses of hair cells in the bullfrog's amphibian papilla. The Journal of neuroscience : the official journal of the Society for Neuroscience. 32 (39), 13433-13438 (2012).
- Gale, J. E., Meyers, J. R., Periasamy, A., Corwin, J. T. Survival of bundleless hair cells and subsequent bundle replacement in the bullfrog's saccule. Journal of neurobiology. 50 (2), 81-92 (2002).
- Hudspeth, A. J. Mechanoelectrical transduction by hair cells of the bullfrog's sacculus. Progress in brain research. 80, 129-135 (1989).
- Hudspeth, A. J. Integrating the active process of hair cells with cochlear function. Nature Reviews Neuroscience. 15 (9), 600-614 (2014).
- Corey, D. P., Hudspeth, A. J. Response latency of vertebrate hair cells. Biophysical journal. 26 (3), 499-506 (1979).
- Cheung, E. L. M., Corey, D. P. Ca2+Changes the Force Sensitivity of the Hair-Cell Transduction Channel. Biophysical journal. 90 (1), 124-139 (2006).
- Choe, Y., Magnasco, M. O., Hudspeth, A. J. A model for amplification of hair-bundle motion by cyclical binding of Ca2+ to mechanoelectrical-transduction channels. Proceedings of the National Academy of Sciences of the United States of America. 95 (26), 15321-15326 (1998).
- Assad, J. A., Corey, D. P. An active motor model for adaptation by vertebrate hair cells. Journal of Neuroscience. 12 (9), 3291-3309 (1992).
- Crawford, A. C., Evans, M. G., Fettiplace, R. Activation and adaptation of transducer currents in turtle hair cells. The Journal of physiology. , 405-434 (1989).
- Howard, J., Hudspeth, A. J. Mechanical relaxation of the hair bundle mediates adaptation in mechanoelectrical transduction by the bullfrog's saccular hair cell. Proceedings of the National Academy of Sciences of the United States of America. 84 (9), 3064-3068 (1987).
- Purves, R. D. The release of drugs from iontophoretic pipettes. Journal of Theoretical Biology. 66 (4), 789-798 (1977).
- Tinevez, J. Y., Jülicher, F., Martin, P. Unifying the various incarnations of active hair-bundle motility by the vertebrate hair cell. Biophysical journal. 93 (11), 4053-4067 (2007).
- Ó Maoiléidigh, D., Nicola, E. M., Hudspeth, A. J. The diverse effects of mechanical loading on active hair bundles. Proceedings of the National Academy of Sciences of the United States of America. 109 (6), 1943-1948 (2012).
- Kennedy, H. J., Crawford, A. C., Fettiplace, R. Force generation by mammalian hair bundles supports a role in cochlear amplification. Nature. 433 (7028), 880-883 (2005).
- van Netten, S. M., Khanna, S. M. Stiffness changes of the cupula associated with the mechanics of hair cells in the fish lateral line. Proceedings of the National Academy of Sciences of the United States of America. 91 (4), 1549-1553 (1994).
- Bormuth, V., Barral, J., Joanny, J. F., Jülicher, F., Martin, P. Transduction channels' gating can control friction on vibrating hair-cell bundles in the ear. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7185-7190 (2014).
- Crawford, A. C., Evans, M. G., Fettiplace, R. The actions of calcium on the mechano-electrical transducer current of turtle hair cells. The Journal of physiology. , 369-398 (1991).
- Kozlov, A. S., Risler, T., Hudspeth, A. J. Coherent motion of stereocilia assures the concerted gating of hair-cell transduction channels. Nature Neuroscience. 10 (1), 87-92 (2007).
- Lumpkin, E. A., Hudspeth, A. J. Regulation of free Ca2+ concentration in hair-cell stereocilia. Journal of Neuroscience. 18 (16), 6300-6318 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon