Method Article
Physiologische Herstellung von Haarzellen aus dem Sacculus der American Bullfrog (
In diesem Artikel
Zusammenfassung
Die amerikanischen Ochsenfrosches ist (Rana catesbeiana) sacculus ermöglicht die direkte Untersuchung von Haarzellphysiologie. Hier ist die Präparation und Vorbereitung der sacculus des Ochsenfrosch für biophysikalische Studien beschrieben. Wir zeigen repräsentative Experimente aus diesen Haarzellen, einschließlich der Berechnung eines Bündels der Kraft-Weg-Beziehung und Messung seiner ungezwungenen Bewegung.
Zusammenfassung
Die Studie von Hör- und Gleichgewichts beruht auf Erkenntnissen aus biophysikalischen Studien von Modellsystemen gezogen. Ein solches Modell, das sacculus des amerikanischen Ochsenfrosches, hat eine tragende Säule des Hör- und Gleichgewichtsforschung. Studien dieses Organs haben gezeigt, wie Sinneszellen Haare aktiv Signale aus der Umgebung erfassen kann. Aufgrund dieser Untersuchungen haben wir nun ein besseres Verständnis der mechanischen Gating und Lokalisierung eines Transduktionskanäle Haarzelle, Kalzium Rolle in der mechanischen Bearbeitung, und die Identität der Haarzellströme. Das leicht zugängliche Organ weiterhin Einblick in die Funktionsweise von Haarzellen zu liefern. Hier beschreiben wir die Vorbereitung der sacculus des Ochsenfrosch für biophysikalische Studien über seine Haarzellen. Wir sind das komplette Dissektion Verfahren und bieten spezielle Protokolle für die Vorbereitung des sacculus in spezifischen Kontexten. Wir verfügen zusätzlich über repräsentative Ergebnisse dieser Zubereitung, einschließlich der Berechnung voneine momentane Kraft-Weg-Haarbündel Beziehung und Messung des Erfolgs einer spontanen Schwingung des Bundles.
Einleitung
Die acousticolateralis Organe von Säugetieren besitzen eine komplexe Architektur und liegen innerhalb einer anatomischen Nische, die nur schwer zugänglich sein kann. Zum Beispiel umfasst die Säugetier-Cochlea mit einer spiralförmigen Labyrinth und ist innerhalb der dicken zeitlichen Knochen eingebettet. Die Isolierung der Cochlea führt oft zu mechanischen Schäden an den Sinneszellen in ihm liegen und hat daher eine schwierige Aufgabe 1 erwiesen. Neurowissenschaftler haben so gedreht Systeme zu modellieren, die sich leichter aus der sanctum des Ohres extrahiert.
Eines dieser Modellsysteme, die sacculus des amerikanischen Ochsenfrosches (Rana catesbeiana), ist seit Jahrzehnten verallgemeinerbar Einblick in die Funktion des Hör- und Gleichgewichtssysteme ergab. Die sacculus ist ein Mixed-Funktion Orgel mit sensorischen Rollen in beiden niederfrequenten Gehör und seismische Sensation. Die Sinneszellen des sacculus sind die Haarzellen, spezialisierte Wandler, die mechanische Energie umwandelnin elektrische Signale innerhalb unserer Hör- und Gleichgewichtsorgane. Projizieren von der apikalen Oberfläche jeder Haarzelle ist ein mechanosensitive Haarbündel, das einen abgestuften Büschel vergrößerte Mikrovilli genannt stereocilia umfasst. Die Spitzen benachbarter Stereozilien werden durch filamentöse Spitze-link Proteine miteinander verbunden , die mechanisch Gate Ionenkanälen in Reaktion auf mechanische Reize 2, 3. Obwohl Hör- und Gleichgewichtsorgane auf verschiedene Arten von Stimuli reagieren, sie ein gemeinsames Detektionsmechanismus teilen. Diese Gemeinsamkeit zugrunde liegt, die vielen Einsichten Haarzelle Mechanotransduktion durch Studien des Ochsenfrosch sacculus gewonnen in. Zum Beispiel ist der aktive Prozess der Haarzelle wurde ausgiebig in diesem Organ 4 untersucht, 5, 6, 7, und das Haarbündel verwendet einen energieaufwendigen Prozess mechanisch zu produzierenArbeit. Nicht nur hat es sich gezeigt , dass Haarzellen aktive Arbeit 6, erzeugen aber verschiedene Mechanismen den aktiven Prozess zugrunde liegen und ein Tuning - Eigenschaften der Haarzelle haben durch Studien von Bullfrog acousticolateralis Organe enthüllt. Dazu gehören aktive Haarbündel Motilität 8 und Haarzelle elektrische Resonanz 9, 10, 11 in der sacculus und Frequenzselektivität bei der Bandsynapse der Haarzelle 12 in der Amphibie Papille.
Die Ochsenfrosch des sacculus spricht sensorischen Neurowissenschaftler aus mehreren Gründen. Im Gegensatz zu den Säugetieren Cochlea, liegt dieses Organ in der leicht zugänglichen Ohrkapsel. Zweitens Haarzellen innerhalb dieses Organ kann für mehrere Stunden unter geeigneten Bedingungen 13 gesund bleiben, 14. Dies ermöglicht experimentatIonen auf diese Zellen über lange Zeiträume relativ zu ihren Säugetier-Gegenstücke. Drittens trägt das Organ wenig Krümmung, eine einfache Handhabung ermöglicht. Viertens weist jedes Organ tausend oder mehr Haarzellen 15, die beide einen hohen Durchsatz und eine hohe Wahrscheinlichkeit der Lokalisierung eines geeigneten Satzes von Haarzellen für ein gegebenes Experiment bereitstellt. Schließlich wird die Ochsenfrosch des sacculus leicht aufgrund der geringen Dicke dieses Organs und große Größe der Haarzellen sichtbar gemacht.
Diese Eigenschaften bieten große Vielseitigkeit für die Untersuchung der Sinneszellen innerhalb der Ochsenfrosch des sacculus. Je nach Fragestellung, einer von mehreren Versuchspräparate können aus der sacculus erhalten werden. Die einfachste davon ist die Einkammer-Zubereitung. Hier ist die sacculus in einer Kammer immobilisiert gefüllt mit artifizieller Perilymphe, eine natriumreiche und hochCalciumSalzLösung. Diese Herstellung ermöglicht die Untersuchung von Haarzellströme und grundlegende Haarbündel Mechanik. Eine zweite Konfiguration ist der Zweikammer-Zubereitung, verwendet werden spontane Haarbündel Bewegungen zu studieren. Hier ist der apikalen Seite der Haarzellen ausgesetzt ist, zu einer kaliumreichen und kalkarmen Saline genannt künstliche Endolymphe, während der basolateralen Seite in artifizieller Perilymphe gebadet wird. Diese beiden Kammern imitieren die in - vivo - Anordnung von Salinen und ein Umfeld schaffen , das Haarbündel spontan zu schwingen können.
Wir beschreiben in diesem Papier die Vorbereitung des sacculus des Ochsenfrosch für biophysikalische Untersuchung ihrer sensorischen Haarzellen. Wir bieten zunächst eine detaillierte Darstellung der Isolierung dieses Organ aus dem Innenohr des Frosches. Wir beschreiben dann sowohl die Ein- und Zwei-Kammer experimentelle Präparate und umfassen repräsentative Ergebnisse für jede Konfiguration.
Protokoll
Ethikerklärung: Alle Verfahren , die von der Institutional Animal Care und Use Committee (IACUC) an der Rockefeller Universität genehmigt.
1. präexperimentellen Prespanparation
- Lösungen
- Bereiten Sie die Eugenol - Lösung (2,5 g · L -1 · kg -1 Frosch). Bereiten Sie die Salzlösungen (Tabelle 1).
HINWEIS: Für eine Ein-Kammer-Vorbereitung, Vorbereitung künstliche Perilymphe; für eine Zweikammer Vorbereitung, bereiten sowohl künstliche Perilymphe und künstliche Endolymphe.
- Bereiten Sie die Eugenol - Lösung (2,5 g · L -1 · kg -1 Frosch). Bereiten Sie die Salzlösungen (Tabelle 1).
2. Experimentelle Werkzeuge
- Herstellung von Glas Stimulation Faser
- Grenzen Sie ein Borosilicatglas Kapillare mit einer Elektrode Abzieher in einer einzeiligen Zug mit hoher Hitze und hoher Geschwindigkeit. Legen Sie die gezogen Kapillare in einem Magnet-Abzieher.
- Bringen Sie die Spitze der Kapillare zu einem Faden mit einer Glasperlebis in die Kapillare in Kontakt mit der Glasperle auf sie geschmolzen.
- Schalten Sie das Filament die Spitze der Kapillare in die Glasperle zu schmelzen. Sobald eine dünne Brücke aus Glas bildet sich zwischen der Kapillare und dem Wulst, drehen Sie den Faden und etwa zur gleichen Zeit aktivieren Sie den Magnet Abzieher ab.
HINWEIS: Dadurch wird die Glaskapillare in einem rechten Winkel zu seiner Längsachse ziehen und eine solide Faser erstellen. - Stellen Sie sicher, dass der Durchmesser der Faser nicht mehr als 0,5 bis 1 & mgr; m, und dass seine Länge nicht überschreitet 100-300 & mgr; m. Wenn die Länge dieser Dimension überschreitet der Faser, schneiden Sie es mit Iris Schere. Mit einer Schere, die bereits stumpf sind zu vermeiden, dass die Dissektionswerkzeuge zu beschädigen.
- Zur Verbesserung der optischen Kontrast, Sputter Mantel der Faser. Verwenden Sie eine Sputter-Beschichtungsvorrichtung mit einer Gold-Palladium-Quelle. Vertically laden jede Faser in eine Sputter-Beschichtungsvorrichtung mit seinem verjüngten Ende in Richtung der Quelle. Bringen der Spitze der Faser zu einer Entfernung von 1 bis 2 cm von der Gold-Palladium-Quelle.
- SchließeSputter-Beschichtungsvorrichtung der Kammer eine Dichtung zu bilden und ihn einzuschalten. spülen Sie wiederholt die Umgebungsluft mit Argon aus. Nach der Luftspülung, verringern den Druck in der Kammer auf 10 Pa (70 mTorr).
- Sputter Mantel in 10 s Pulse mit 10 s Verzögerung über einen Kurs von 120 s.
Hinweis: Um die Spitze der Faser wird über die Dauer dieses Protokolls verdunkeln, wenn die Sputterbeschichtung ein Erfolg war.
- Herstellung von scharfen Mikroelektroden
- Ziehen Sie eine Glaskapillare mit einem Innen Filament eine einzeilige Hoch Wärme ziehen mit. Elektroden sollte einen Widerstand von 100 - 300 MOhm, wenn sie mit 3 M KCl gefüllt. Füllen Sie jede Elektrode mit 3 M KCl.
- Biegung jeder Spitze der Elektrode mit der Mikroschmiede es senkrecht zu der Haarzelle apikalen Oberfläche , wenn sie in den Verstärker heads 16 montiert zu rendern.
- Herstellung von Iontophorese Pipetten
- Ziehen Sie eine Glaskapillare mit einem InnenFilament zu einer 50 M & Omega; Spitze. Füllen mit konzentrierter gelöster Stoff (zB 500 mM Gentamycinsulfat).
- Herstellung von Aluminium - Montage Quadrat
- Schneiden Sie ein 1 cm x 1 cm Quadrat aus Aluminiumfolie. Perforieren der Folie in der Mitte mit der Spitze eines Schlachtstab oder einem anderen spitzen Gegenstand. Form der Perforation so dass sie kreisförmig ist und etwa 1 mm im Durchmesser.
- Herstellung von Vakuumfett Spritze.
- Entfernen Sie den Kolben aus einer 5-ml-Spritze. Füllen Spritze von hinten mit Vakuumfett. Setzen Sie den Kolben.
- Herstellung von Polytetrafluorethylen Leimgerät
- Machen Sie einen 2 mm langen axialen Schnitt in das Ende eines hölzernen Applikatorstäbchen. Der Schlitz sollte in der Mitte des Applikators, wenn end-on betrachtet.
- Mit einer scharfen Schere oder einer Rasierklinge, schneiden Sie ein 2 mm x 4 mm Rechteck aus Polytetrafluorethylen aus einer Folie von 1 mm Dicke.
- Verwenden Sie eine Rasierklinge zu dünn einem der 2 mm langen Kanten des Polytetrafluorethylen Rechtecks. Beginnend in der Mitte des Rechtecks, reduzieren die Dicke des Rechtecks, das durch nach außen Slicing an der Spitze des Rechtecks eine Abschrägung zu bilden.
- Legen Sie das Polytetrafluorethylen Rechteck in den Holz Applikator Schlitz, so dass die abgeschrägte Kante vom Stick abgewandt ist. Bewerben 5 min Epoxy auf der Basis des Polytetrafluorethylen Rechteck, um es an Ort und Stelle zu sichern. Lassen Sie den Klebstoffapplikator für 1 h bei Raumtemperatur aushärten.
- Vorbereitung der unteren Hälfte des Zweikammerhalterung
- Maschine oder 3D - Druck die untere Hälfte der Zweikammerhalterung (Supplemental - Datei 2). Identifizieren Sie die 20 mm Durchmesser Einbau Kreis auf der unteren Fläche der Kammer.
- Tragen Sie eine dünne Schicht von Epoxid zu den Seiten höchstens 3 mm des vertieften Kreis. Tragen Sie eine 18 mm runde Glasdeckglas auf dem Epoxid. Lassen Sie Epoxy-1 zu heilenh.
3. Extraktion von Innenohr-Organe
- Anesthetize einen amerikanischen Ochsenfrosches, indem sie in einem kleinen Eimer mit Eugenol Betäubungslösung für 10 min platzieren. Stellen Sie die Lautstärke der Lösung, so dass die humero-Skapulier Gelenk liegt knapp oberhalb der Flüssigkeit-Luft-Grenzfläche des Frosches.
- Euthanize die narkotisiert Ochsenfrosch durch doppelte Schlacht.
- Fassen Sie den narkotisierten Frosch mit einem Finger oben auf der Nase und eine andere unterhalb des Kiefers und drehen den Kopf des Frosches nach vorn.
- Schnell tauchen die Schlachtstab in die Schädelhöhle durch das Foramen magnum, die an der Mittellinie zwischen der Froschhinterhaupts Prozesse zu finden ist.
- Langsam zurückziehen und die Stange, bis seine Spitze fährt vom Foramen magnum drehen. Zwingen Sie den Stab kaudal durch die Wirbelloch in das Rückenmark zu zerstören.
- Bestätigen Sie, dass der Frosch richtig doppelt despinalisiert wurde durch die Beobachtung, dass seine unteren Extremitäten verlängert werden.
- Fassen Sie den Frosch mit einem Daumen oben auf der Nase und dem ersten Finger die vomerine Zähne für eine verbesserte Stabilität zu erfassen. Enthaupten der Frosch durch das Kiefergelenk bilateral Trennen und anschließend orthogonal zur rostrokaudalen Achse schneiden. Um sicherzustellen, dass die Innenohrorgane innerhalb des Schädels intakt bleiben, stellen Sie sicher, dass der Schnitt sowohl tympana Schwanz ist.
- Mit Hilfe eines stereodissection Mikroskop, führen Sie eine Mittellinie der Gaumengewebe von den vomerine Zähne in die hinterste Ausdehnung des Gewebes (Abbildung 1A) durchschnitten.
- Sever und klar mit horizontalen Schnitten des Skalpells unter dem Gaumengewebe jeder Muskel liegen die hintere Knorpel zu offenbaren. Nach den Muskel zu entfernen, die Lutscherform des zeitlichen Knorpel beobachten die Grenze der Ohrkapsel bildet.
- Sever die Columella an ihrem Kontaktpunkt mit der Knorpel der Ohrkapsel.
- Immer wieder scheren dünne Schichten dieser Knorpel durch Shallo machenw horizontale Schnitte durch. Vermeiden Sie tiefe Einschnitte Schäden an den Innenohrorgane zu verhindern. Dies eröffnet die otic innerhalb der Lutscher Struktur des Schläfen Knorpel (1B) gefunden Kapsel. Innerhalb der Ohrkapsel sind die Froschinnenohrorgane (1C).
- Schneiden Sie die hinteren und seitlichen Ränder der Ohrkapsel, kümmert sich nicht um die Innenohrorgane zu schädigen. Während der Dissektion, fließen häufig saline über die Innenohrorgane um sicherzustellen, dass sie unter Wasser bleiben und hydratisiert.
- Suchen Sie die beiden kreisförmigen Öffnungen im Schläfenbein an der medialen Verbindung des Knorpels an der Mittellinie. Cut nach unten durch die meisten medialen Öffnung des Schläfenbeins zu Bruch.
- Machen Sie eine zweite Abwärts Schnitt durch die Ohrkapsel an ihrem postero-lateralen Kante. Entfernen Sie das Stück Knorpel zwischen diesem und dem vorherigen Schnitt Zugang zu den Innenohrorgane zur Verfügung zu stellen.
- Pry verlieren den Knorpel zwischen den Schnitten aus den Schritten 3.8 einnd 3.9 und schneiden Sie es weg von der Ohrkapsel. Diese Aktion trennt die nächste Bogengang, der dann als Handgriff für weitere Manipulationen verwendet werden kann.
- Dabei nicht die sacculus zu berühren, durchtrennen VIII th Hirnnerv.
- Halten Sie die Ampulle des nächsten Bogengang. Vorsichtig drehen Sie das Innenohr die restlichen zwei Bogengänge zu belichten. Bei jedem Kanal auszusetzen, trennen sie.
- den Nerv oder einen Bogengang ampulla halten, extrahieren das Innenohr aus dem Kopf und legen Sie sie in eine Schüssel mit kaltem Sauerstoff angereichert künstliche Perilymphe gefüllt. Entfernen des Innenohres ermöglicht die Visualisierung der Durchlässe innerhalb des Schläfenbeins durch die die Bogengänge einmal durchlaufen (Figur 1D).
HINWEIS: Wiederholen Sie diese Schritte, um das zweite Ohr zu extrahieren.
4. Ein-Kammer-Vorbereitung
- Isolierung von sacculus
- Suchen Sie den sacculus durch seine großen Whit Identifizierunge Masse von otoconia und der saccular Nerv, der oben auf sie (Abbildung 1E) liegt. Achten Sie darauf, nicht physisch die sacculus während der folgenden Schritte, um zu traumatisieren die Integrität der saccular Haarzellen zu halten.
- Schneiden Sie die Bogengänge des Innenohrs wendiger zu machen.
- Entfernen Sie die perilymphatische Zisterne die neurale Seite des sacculus liegt. Bilden sanfte Schnitte um den Umfang des Spülkastens. trennen Weiter, um die kleinen Säulen des Gewebes, die die Zisterne Membran an das neuronale Seite des sacculus überbrücken.
- Entfernen Sie die Lagena und der damit verbundenen Nerven.
- der saccular die Nerven und heben Sie vorsichtig die sacculus und die dünne Membran des otoconial sac durchgeschnitten. aus dem Sack Wie otoconia spill, befreit das sacculus von um seinen Umfang zu schneiden.
HINWEIS: Nach der sacculus Isolierung können die verbleibenden Innenohrorgane gespeichert werden, falls gewünscht. Entfernen der sacculus erleichtert Identifizierung von anderen Strukturen, wiedie Amphibien- und basilar Papillen. - Mit einer Schere oder Zange vorsichtig jede otoconia abwischen noch auf der sacculus. Achten Sie darauf, nicht die sacculus während dieses Prozesses zu berühren.
- Schneiden Sie alle verbleibenden otoconial-sac Membran von der sacculus 'Rand. Diese Membran neigt dazu, Kunststoff- und Glasoberflächen und seine Entfernung minimiert Herausforderungen im Umgang mit dem Gewebe zu halten.
- Fließt sanft saline über die sacculus mit einer Pasteurpipette alle verbleibenden otoconia (1F) zu entfernen.
HINWEIS: Wiederholen Sie diesen Vorgang für die zweite sacculus, die ein Spiegelbild des ersten ist.
- Verdauung und Montage
- Mit dem hinteren Ende einer Pasteur - Pipette mit seiner Spitze gebrochen, übertragen Sie die isolierte sacculi in eine Petrischale mit 3 ml 67 mg ∙ L -1 Protease XXIV in artifizieller Perilymphe.
HINWEIS: Diese Protease-Behandlung verdaut die Links jedes kinociliary Glühbirne zum otolithic AnbindehaltungMembran, so dass die Entfernung der Membran, ohne die Sinneshaarbündel zu beschädigen. - Inkubieren Sie das Gewebe 30 min bei 22 ° C (oder 35 min bei 21 ° C). Übertragen jedes verdaut sacculus zu einem offenen Gesicht Experimentierkammer und befestigen Sie das Gewebe mit magnetischen Pins.
- Die saccular Macula liegt direkt unterhalb der otolithic Membran und ist der Abschnitt des sacculus, die Haarzellen enthält. Identifizieren Sie es und entfernen Sie vorsichtig seine darüber liegenden otolithic Membran eine feine Wimpern mit, kümmert sich nicht um die saccular Macula zu berühren.
- Mit dem hinteren Ende einer Pasteur - Pipette mit seiner Spitze gebrochen, übertragen Sie die isolierte sacculi in eine Petrischale mit 3 ml 67 mg ∙ L -1 Protease XXIV in artifizieller Perilymphe.
5. Zwei-Kammer-Vorbereitung
- Isolierung von sacculus
- Isolieren Sie die sacculus aus den Innenohrorgane, wie in Abschnitt 4.1.
- Montage und Verdauung
- Füllen Sie den Montageblock (Supplemental - Datei 3) mit artifizieller Perilymphe und legen Sie die perforierte Aluminiumfolie auf eine Öffnung, unter Verwendung von zwei Spots von Vakuumschmieren sie an Ort und Stelle zu halten und eine schwache Dichtung bilden.
- Übertragen einer sacculus auf die Folie und in der Mitte auf der Oberseite des Lochs mit der Makula nach unten und der Nervenstumpf nach oben zeigt.
- Entfernen Sie die Kochsalzlösung die sacculus mit einem Stück verdrehten umgebenden Gewebes. Wick die Salzlösung, die Oberfläche des Aluminium-Platz rund um das sacculus zu trocknen.
- Verwenden Sie das Polytetrafluorethylen Applikator Cyanoacrylatkleber aufzubringen entlang der Grenze zwischen dem Rand der sacculus und dem Aluminium square eine dichte Abdichtung zu bilden. Sicherzustellen, dass der gesamte Umfang des sacculus mit Leim bedeckt ist.
HINWEIS: Geht zu langsam kann der Sekundenkleber über die neuronale Seite des sacculus zu kriechen und es schließlich decken. Es ist daher unerlässlich, diese Aufgabe schnell abzuschließen. - Geben Sie einen Tropfen Kochsalzlösung auf der Oberseite des montierten Gewebe den Klebstoff zu härten. Ein dünner Film des Klebers kann auf der Oberseite der Tropfen Kochsalzlösung zu bilden; entfernen Sie sie mit einer Pinzette.
- Entfernen Sie vorsichtig ter Folie aus dem Montageblock. Klappen Sie den montierten Gewebe über, so dass die Makula-Seite des sacculus nach oben gerichtet ist und schweben sie auf einer künstlichen Perilymphe gefüllten Petrischale.
- Fügen Sie einen Tropfen Protease XXIV Lösung oben auf der Makula und Inkubation für 30 min bei 22 ° C (oder 35 min bei 21 ° C). Füllen Sie den unteren Kanal des Zweikammervorrichtung (Supplemental - Datei 2) mit Perilymphe und Platz Vakuumfett um die zentrale Kammer.
- Legen Sie die Folie montiert sacculus auf der unteren Kammer mit ihren Nerven der Kammer Oberfläche zugewandt ist. Hinzufügen Fett um den Umfang der Folie.
- Legen Sie die obere Kammer (Supplemental - Datei 1) der Zubereitung auf der Folie, wobei darauf geachtet eine vollständige Abdichtung mit dem Vakuumfett zu bilden. Füllen Sie die obere Kammer mit sprudelte künstlichen Endolymphe und sanft die otolithic Membran mit einer Wimper zu entfernen.
Ergebnisse
Die sensorische Epithel der sacculus des Ochsenfrosch können in verschiedenen Konfigurationen eingesetzt werden, um die Physiologie der Haarzellen zu untersuchen. Da das Gewebe relativ flach ist, kann es sowohl in Ein- und Zweikammer Vorbereitungen montiert werden. Die Ein-Kammer-Konfiguration bietet eine einfache Einrichtung für elektrophysiologische und mikromechanischen Aufnahmen von Haarzellen. Die Zweikammer-Zubereitung simuliert statt sowohl die endolymphatischen und perilymphatische Fächer jeweils den apikalen und basalen Seiten der Haarzellen. Diese Abteile liefern zusammen ein physiologisch relevanten Umgebung für die Untersuchung von Mechanotransduktion von Haarzellen.
Die Empfindlichkeit und Transduktion Eigenschaften von Haarzellen zugrunde liegen ihre elektrischen Reaktion auf mechanische Reize. Um diese Funktionen zu untersuchen wir gleichzeitig von einem einzelnen Haar aufgezeichnet Zelle die Position der Bündel unddas Rezeptorpotential der Zelle (Abbildung 2). Wir angebracht zunächst eine flexible Glasfaser an die kinociliary Lampe eines Haarbündels Kraftimpulse anzuwenden. Wir maßen dann die Verschiebung des Haarbündel ein Dual Photodiode System 2 (2A) verwendet wird . Wir erwarben gleichzeitig das Potenzial der Haarzelle durch die Zelle mit einem scharfen Mikroelektroden Aufspießen. Wir erhalten eine Verschiebung-Wirkungs-Kurve durch die durch jeden mechanischen Reiz ausgelöst Spitzenspannungsantwort Plotten gegen die entsprechende Verschiebung der Haarbündel (2B). Die elektrische Antwort der Haarzelle sättigt sowohl für Positiv- und Negativ Verschiebung Extrema. Die Verringerung des Membranpotentials mit negativer Verschiebungsschritte zeigt das Vorhandensein einer Ruhe einwärts Mechanotransduktion Strom. Dieser Ruhestrom wird durch die Wirkung der Ca 2+ sowohl schnelle als auch langsame Adaptation 17, moduliertes 18, 19, 20, 21.
Einer Haarzelle Verhalten hängt nicht nur von seiner elektrischen Eigenschaften, sondern auch auf die Mikromechanik seiner Sinneshaarbündel. Die Zweikammerkonfiguration ahmt die Trennung von Endo- und Perilymphe in vivo, ideale Bedingungen für die Studie eines Haarbündels Mechanik bietet. Unter diesen Bedingungen und mit dem otolithic Membran entfernt, können Haarbündel spontan 6 oszillieren. Hier setzten wir die Zweikammer Vorbereitung auf die Mikromechanik der einzelnen Bündel beurteilen. Wir nahmen die spontanen Schwingungen eines Haarbündels durch seinen Schatten auf einem Dual-Fotodiode Verschiebungsmonitor (3) gegossen wird . Um die Rolle des Aminoglykosid-Antibiotikum Gentamicin auf Mechanotransduktion Beurteilung Relé wir iontophoretisch Gentamicin direkt auf das Haarbündel asierend (Abbildung 3). Die Konzentration der freigesetzten Gentamicin steigt proportional mit dem Strom durch die Mikropipette geleitet. Gentamicin hemmt ein Schwingungen des Haarbündel und induziert eine statische des Bündels in Richtung seiner hohen Seite versetzt. Diese Effekte spiegeln die Rolle von Gentamicin als Open-Kanalblocker, der den offenen Zustand der Mechanotransduktion Kanäle beibehält, während ihre Permeation Poren blockiert. Iontophorese geladener Chemikalien ermöglicht lokalisiert und quantifizierbare Freisetzung von Chemikalien in verschiedenen Konzentrationen in Abwesenheit von Fluidströmung induzierte mechanische Zerstörung und damit ideal für die Untersuchung von mechanosensitive Organellen wie das Haarbündel 22 geeignet.
Ein Haarbündel spontane Bewegung ergibt sich aus dem Zusammenspiel zwischen Anpassung und nicht - lineare Bündelsteifigkeit 7,xref "> 8, 23, 24. Diese spontane Bewegung ist eine Unterzeichnung eines aktiven Prozess des Haarbündel, die Signalenergie in mechanische Arbeit umwandelt viskosen Widerstand zu überwinden. Haarbündel gezeigt wurde , im vestibulären 2, auditiv nichtlineare momentane Steifigkeit aufweisen 25 und Seitenliniensystem 26.
Wir messen direkt die momentane Steifigkeit eines einzelnen Haarbündel aus der Ochsenfrosch des sacculus (Abbildung 4). Um dies zu erreichen, gekoppelt wir die Spitze eines flexiblen Glasfaser zu der kinociliary bulb Haarbündel (4A). Wir lieferten Kräfte auf das Haarbündel durch die Basis der Faser zu verschieben. Die ausgeübte Kraft auf das Haarbündel durch den Reiz Faser entspricht der Differenz zwischen den Verschiebungen der bas der Fasere und Spitze, durch die 2, 27 Steifigkeit der Faser multipliziert. Liefern Impulse für eine Reihe von Kräften zeigt eine Beziehung zwischen der Kraft auf das Bündel ausgeübt und die daraus resultierende Verschiebung des Bundles. Die Steigung dieser Kraft- Weg -Beziehung entspricht die momentane Steifigkeit der Haarbündel (4A).
Diese Methode erlaubt uns eine individuelle Bundles momentane Steifigkeit in Abhängigkeit von seiner Auslenkung (4B) zu messen. Die momentane Kraft-Verschiebungs-Kurve zeigt eine nichtlineare Beziehung, eine nicht-lineare Steifigkeit des Bündels über einen Bereich von etwa 20 nm um seine Ruhelage enthüllt. Außerhalb dieses Bereichs verhält sich das Haarbündel wie ein Hookesche Material, ist seine Steifigkeit linear für groß Größenordnung Ablenkungen.
Diese Ergebnisse demonstbewerten die Vielseitigkeit des Ochsenfrosch sacculus in der Studie von Haarzellphysiologie. Mit diesen und anderen Präparaten kann man Mechanotransduktion in mehreren Stufen bei der Übertragung von Informationen aus dem Bündel in Richtung des Gehirns erkunden.

Abbildung 1: Dissection des Innenohrs des Bullfrog. (A) Anzeigen der oberen Gaumen des Ochsenfrosch von seiner Bauchseite ermöglicht die Identifizierung des Eustachische Röhre (Kreis). Seitenspiegelbild der Haut, um die rechte Seite des oberen Gaumen Abdeckung zeigt die Lage des Innenohrs (gestrichelter Kasten). (B) Die Entfernung der Knorpel an der Bauchseite des Schläfenbeins Frosch öffnet die Ohrkapsel (gestrichelte Linie). (C) angezeigt , ist eine stärkere Vergrößerung Bild der Ohrkapsel, in der der sacculus, Lagena, CN VIII und SACC dere Nerven leicht identifiziert werden können. (D) Ein Blick auf die Ohrkapsel nach Entfernung der Innenohrorgane zeigt die Positionen der Bogengänge. (E) Nach dem Entfernen des isolierten Innenohrs, die sacculus, Lagena und VIII th Hirnnervs (CN VIII) können leicht identifiziert werden. (F) Die isolierte sacculus besitzt einen kurzen Stumpf des saccular Nerven- und einer otolithic Membran oben auf seiner Sinnesepithel liegen. Labels entsprechen dem (i) sacculus, (ii) Lagena, (iii) CN VIII, (iv) saccular Nerv, und (v) otolithic Membran. Achsenbeschriftungen P und A entsprechen jeweils den hinteren und vorderen Richtungen. Maßstabsbalken repräsentieren 1 cm (A, B), 1 mm (C, D, E), und 400 & mgr; m (F).
Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
s "target =" _ blank "> Bitte hier klicken, um eine Vektor-Version dieser Figur zum Download bereit.
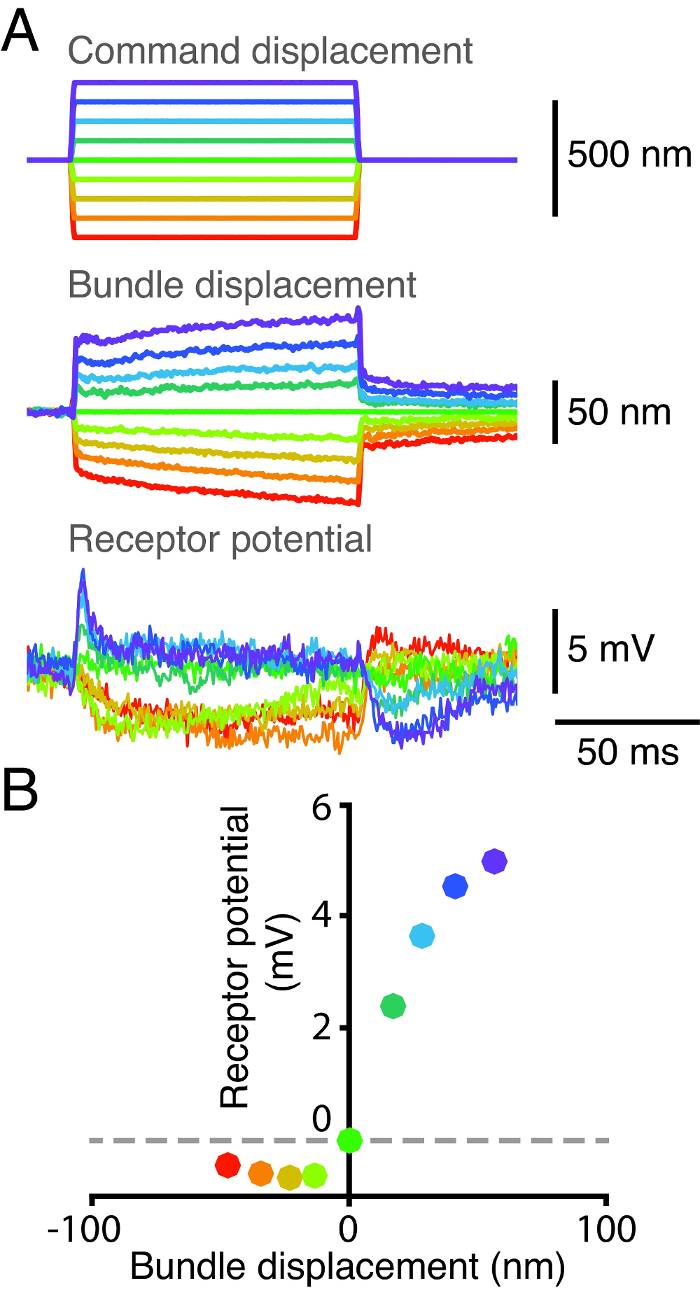
Abbildung 2: Displacement-Wirkungs-Kurve für eine Zelle Single Haar. (A) Die Spitze eines Glas Stimulus Faser wurde mit dem kinociliary bulb eines Haarbündels und der Basis der Faser wurde anschließend in neun diskreten Schritten verschoben. Der Lage der Bündel wurde auf einem Dual-Fotodiode System verfolgt und seine Rezeptorpotential wurde gleichzeitig eine Mikroelektrode, dessen Ausgang gemessen wurde über einen Verstärker in Brückenmodus geleitet. Die Spitze Widerstand der Elektrode betrug 95 M & Omega; und das Ruhemembranpotential des Bundles war -47 mV. (B) eine graphische Darstellung des receptor potential des Bundles in Abhängigkeit von seiner Verschiebung zeigt eine nicht - lineare Beziehung zwischen der Antwort des Bündels und seinePosition. Jeder Punkt entspricht dem Mittelwert Potential und mittlere Verschiebung über einen 2,5 ms Zeitfenster, beginnend mit 2,5 ms nach dem Beginn der mechanischen Stimulation. Jede Farbe steht für eine Reihe von Zeitreihen mit dem gleichen Hubraum Impuls entspricht.
Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Bitte klicken Sie hier , um eine Vektor - Version dieser Figur zum Download bereit .
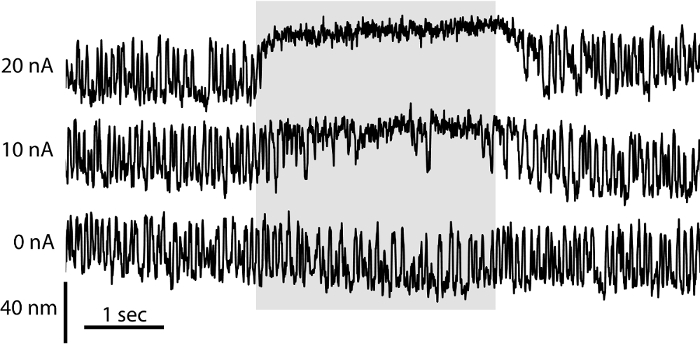
Abbildung 3: Wirkung von Gentamicin auf Spontane Haarbündel Oszillation. Die spontane Bewegung eines Haarbündels in einer Zweikammer-Zubereitung wurde unter Verwendung eines Dual-Fotodiode System aufgezeichnet. In Abwesenheit von iontophoretischen Freisetzung von Gentamicin (0 nA), das HaarBündel zeigt symmetrische Schwingungen. Da die Größe des Stroms durch eine iontophoretische Pipette mit 500 mM Gentamicinsulfat wächst (10 nA, 20 nA), die Häufigkeit der Haarbündel Exkursionen fällt in einer dosisabhängigen Art und Weise und das Bündel versetzt ist in Richtung auf seine hohe Kante länger gefüllt vergangen Zeiträume.
Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Bitte klicken Sie hier , um eine Vektor - Version dieser Figur zum Download bereit .
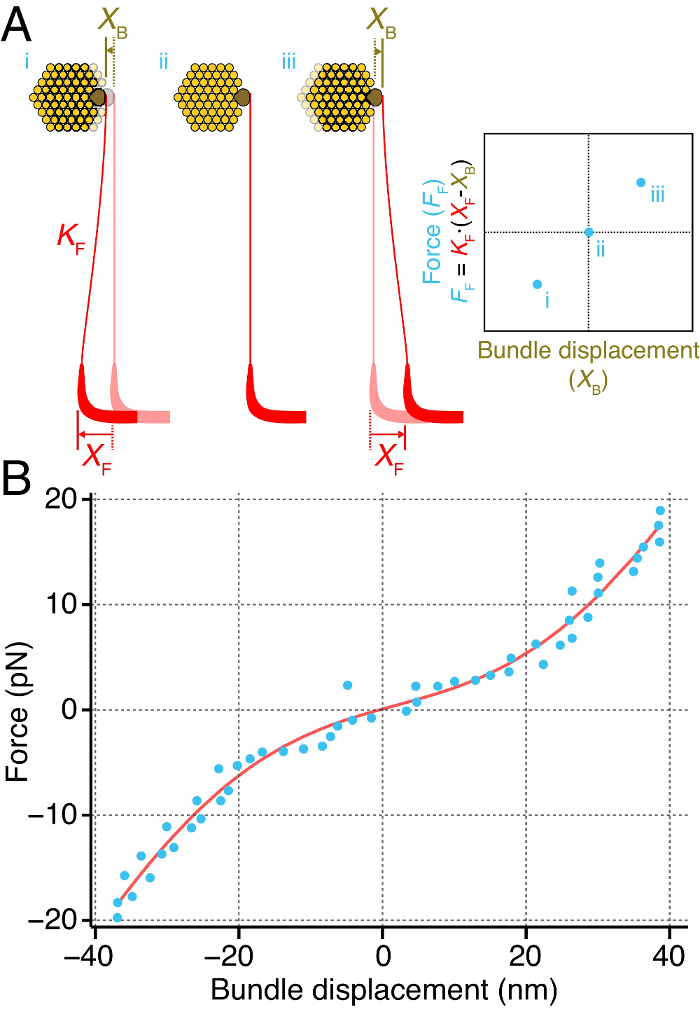
Abbildung 4. Berechnung eines Momentaner Stiffness Hair Bundle. (A) Ein Stimulus Faser (rot) der Steifigkeit K F gekoppelt to die kinociliary bulb (braun) eines einzelnen Haarbündel (gelb). Verlagern der Basis der Faser einem bekannten Abstand X F bewirkt , daß das Bündel einen Abstand X B zu bewegen. Die Differenz zwischen den Verschiebungen der Faser und dem Bündel ist proportional zu der Kraft auf das Bündel durch den Reiz Faser ausgeübt wird, F F. Die Wiederholung dieser über eine Reihe von Kräften ergibt eine momentane Kraft-Weg-Beziehung (rechts), die Steigung der dem Haar sofortige Steifigkeit des Bundles. (B) Eine Einzelbündel ausgesetzt wurde Impulsen zunehmender Größe zu zwingen und seine Verschiebung innerhalb der ersten 50 ms nach Beginn der Impuls gemessen (blaue Punkte). Hier wird das Haarbündel zeigt eine nicht-lineare Momentan Steifigkeit über einen Bereich von etwa 20 nm um seine Ruheposition. Die rote Kurve entspricht einem fit der Beziehung F = k * X - 60 * z * (1 / (1 + exp (- z * (X - X 0) / (k B * T))) + 0 F, wobei F die Kraft auf das Bündel angelegt ist, X die Verschiebung des Bündels ist, k = 790 ± 51 & mgr; N ∙ m -1 das Bündel Konstante ist Steifigkeit , wenn alle Kanäle entweder geschlossen oder geöffnet sind, z = 0,43 ± 0,04 pN ist die Kraft einer Feder einzigen Gating, X 0 = 2 ± 1,9 nm der Lage des Bündels ist , bei der 50% seiner Kanäle offen sind, k B die Boltzmann- konstante, T die Temperatur und F 0 = 11,7 ± 1,3 pN ist ein Offset - Kraft. Der Sitz besitzt einen Koeffizienten der Bestimmung von 0,98. Der Reiz Faser hatte eine Steifigkeit von 107 & mgr; N ∙ m -1.
Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
es / ftp_upload / 55380 / Figure4_v5.eps "target =" _ blank "> Bitte hier klicken, um eine Vektor-Version dieser Figur zum Download bereit.
| Solute | Formelgewicht (g / mol) | In den 1 L | |
| Künstliche Perilymphe | Künstliche Endolymphe | ||
| NaCl | 58.4 | 6,54 g | 0,117 g |
| KCl | 0,149 | 0.149 g | 8,62 g |
| CaCl 2 2H 2 O ⦁ | 147 | 2 ml 1 M CaCl 2 Lager | 250 & mgr; l von 1 M CaCl 2 Lager |
| HEPES | 238,3 | 1,19 g | 1,19 g |
| D - (+) - Glucose | 180,2 | 0,541 g | 0. 541 g |
Tabelle 1. Lösungen für Dissection und experimentelle Vorbereitung. Angezeigt werden in dieser Tabelle die Rezepte für die künstliche Perilymphe und künstliche Endolymphe Lösungen in Präparation verwendet und in Ein- oder Zweikammer-Präparate. 7,4 mit etwa 2 ml NaOH (Perilymphe) oder 2 ml KOH (Endolymphe) - Die Lösungen sollten auf pH 7,2 gebracht werden. Die osmotische Stärke sollte etwa 230 mmol · kg -1 aufgrund unvollständiger ionischen Dissoziation lesen.
Diskussion
Innerhalb der sacculus des Ochsenfrosch liegen mehrere tausend leicht zugängliche Sinneshaarzellen. Hier zeigen wir Gewinnung und Aufbereitung des sacculus für Ein- und Zweikammer-Aufnahmen. Diese beiden Präparate erlauben sowohl mikromechanischen und elektrophysiologische Untersuchungen von Haarzellen und ihre zugehörigen Bundles. Da das Gewebe für mehrere Stunden mit häufigen Austausch von Sauerstoff angereicherte Salz überleben können, können Experimente für längere Zeit fortgesetzt werden. Haarzellen in diesen Zubereitungen bleiben typischerweise fähig Mikroelektrodenaufzeichnung für bis zu 6 h nach der Sektion, während Haarbündel schwingen spontan bis zu 24 h nach der Extraktion.
Erfolgreiche Gewinnung und Lagerung der sacculus Scharniere auf mehrere gemeinsame Herausforderungen überwinden. Zunächst direkten Kontakt mit der apikalen Oberfläche der saccular Macula sollten während des Herstellungsverfahrens vermieden werden. Der saccular Nerv bietet einen bequemen Griff für sicheres Manipu-nung des sacculus. Einmal von dem Rest der Innenohrorgane befreit, sollte die sacculus mit einem großkalibrigen Pipette übertragen werden, während in der Flüssigkeit eingetaucht verbleibt, mechanische Beschädigung seiner Sinnesepithel vermeiden. Die Entfernung von otoconia von der Makula-Oberfläche ohne mechanische Schäden an Haarzellen abgeschlossen sein. Da die otoconia direkt oben auf der Makula liegen, Haarzellen können durch versehentlichen Kontakt zwischen Dissektionswerkzeuge und der otolithic Membran beim Entfernen otoconia beschädigt werden. Um Schäden zu vermeiden, empfehlen wir, dass die Gallerte von otoconia an einem Ort gehalten werden, weit weg von der Makula und als eine einzige Masse entfernt. Dies vermeidet die Fragmentierung der otoconial Masse in zahlreiche Cluster, von denen jeder einzeln extrahiert werden würde. Wenn kleine Gruppen von otoconia bleiben können sie mit sanften Flüssigkeitsdruck durch eine Pasteur-Pipette geliefert entfernt werden. Eine letzte Herausforderung beinhaltet die Bildung einer dichten Abdichtung zwischen dem sacculus und Aluminium Montageplatz in derZweikammer Vorbereitung. Der Einsatz eines Quadrats mit einer Perforation klein genug Überlappung von etwa 100 & mgr; m zwischen dem sacculus und die umliegenden Aluminium ermöglicht eine vollständige Abdichtung des Gewebes zu ermöglichen. Der Kleber sollte mit etwa 100 & mgr; m von saccular Gewebe um die Makula Perimeter, um in Kontakt gebracht werden, um eine dichte Abdichtung zu bilden.
Die Konzentration an freiem Ca 2+ ist ein wichtiger Gesichtspunkt bei der Untersuchung von Haarzellen. Ca 2+ reguliert sowohl schnelle als auch langsame Anpassung, damit die Kinetik der Mechanotransduktion Vorrichtung und die Eigenschaften des Haarbündels aktive Prozessphänomene bestimmen, einschließlich spontaner Bündelbewegungs 8, 23. Endolymphatischer Calcium in vivo ist bei 250 & mgr; M vorhanden, deshalb werden die meisten physiologisch relevanten Kinetik bei dieser Konzentration bewertet werden (Maunsell JHR, R. Jacobs und AJ Hudspeth. Unpublished Beobachtungen 16). Jedoch Mikroelektrodenaufzeichnungen von Haarzellen erfordern eine externe Calciumkonzentration von mehr als 2 mM für eine einwandfreie Abdichtung der Zellmembran um die Mikroelektrode. Es ist daher zwingend notwendig, eine hohe Calcium-Salzlösung für diese Versuche zu verwenden. Schließlich kann man wünschen, die Auswirkungen von externen Kalzium auf Mechanotransduktion zu studieren eine Vielzahl von Calciumkonzentrationen verwendet. In diesen Fällen ist es wichtig , dass Kalzium - Konzentrationen unter 1 uM führen typischerweise zu Spitze-Link Bruch und irreversiblen Verlust der Übertragungs 28 zu erinnern.
Die beiden Versuchsansätze hier beschrieben ermöglichen eine Reihe von biophysikalischen Messungen an Haarzellen. Allerdings können zusätzliche Messungen mit leichten Modifikationen an diesen Vorbereitungen getroffen werden. In der gefalteten saccular Vorbereitung, Haarbündel seitlich sichtbar gemacht. Imaging Haarbündel Bewegung von diesem Aussichtspunkt zeigt kohärente motIon sowohl kleine als auch große stereocilia 29. Hier ist die saccular Makula wird zunächst von seinem darunterliegenden Gewebe abgetrennt und anschließend entlang der Achse gefaltet durch die saccular Nerven so definiert, dass Haarbündel liegen nach außen und sind seitlich am Knick sichtbar gemacht. Eine zweite Modifikation, Haar-Zell-Dissoziation, ermöglicht die Untersuchung sowohl des Bündels Haarzelle und seine soma. Haarzellen sind auf einem Glasobjektträger für die Bildgebung und elektro Aufnahme 30 mechanisch dissoziiert. Schließlich können Haarzellen aus dem Epithel extrudiert werden durch ein ähnliches Dissoziation Protokoll folgend, aber ohne die mechanischen Dissoziierungsschritt. Diese Behandlung führt zu Haarzellen, die aus dem Epithel allmählich extrudieren, basolateralen Zugang für elektrophysiologischen Ableitungen bietet, während eine mechanische Beschädigung zu minimieren. Diese Präparate und ihre vielen Modifikationen zeigen die Vielseitigkeit des Frosches sacculus als Modellsystem für die biophysikalischenStudie von Sinneshaarzellen.
Offenlegungen
The authors declare no competing interests.
Danksagungen
The authors wish to acknowledge Dr. A. J. Hudspeth for funding and expertise in developing the preparations described in this paper. We also wish to thank Brian Fabella for creating and maintaining much of the custom equipment and software used in this protocol.
J. B. A. is supported by grant F30DC014215, J. D. S. is supported by grant F30DC013468, and both J. B. A. and J. D. S. are supported by grant T32GM07739 from the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Common to both preparations | |||
| Stereo-dissection microscope | Leica | MZ6 | Other sources can be used |
| Tricaine methanesulfonate | Sigma | E10521 | Other sources can be used |
| Metal pithing rod | Fine Science Tools | 10140-01 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | |
| Glass Pasteur pipette and bulb (x2) | Fisher Scientific | 22-042816 | |
| Fine eyelash mounted on a hypodermic needle | Fisher Scientific | 22-557-172 | |
| Dow-corning vacuum grease | Fisher Scientific | 14-635-5C | |
| Syringe for vacuum grease | Fisher Scientific | 14-829-45 | Other sources can be used |
| 35 mm Petri dish (x2 - 3) | Fisher Scientific | 08-772A | Other sources can be used |
| Micropipette puller | Sutter | P-97 or P-2000 | |
| 120 V Solenoid puller | Home-made, see parts list | ||
| Sputter coater | Anatech USA | Hummer 6.2 | |
| Current source for iontophoresis | Axon Instruments | AxoClamp 2B | Other sources can be used |
| Piezoelectric actuator | Piezosystem Jena | P-150-00 | |
| Amplifier for piezoelectric actuator | Piezosystem Jena | ENV800 | |
| Borosilicate glass capillary | World Precision Instruments | 1B120F-3 | |
| Name | Company | Catalog Number | Comments |
| For one-chamber preparation | |||
| Microelectrode amplifier | Axon Instruments | AxoClamp 2B | Can be used for iontophoresis and microelectrode recordings simultaneously |
| Magnetic pins (x2) | Home-made, see parts list | ||
| Open-top chamber with magnetic sheet | Home-made, see parts list | ||
| Name | Company | Catalog Number | Comments |
| For two-chamber preparation | |||
| Upper chamber | Supplementary file 1 | ||
| Troughed lower chamber | Supplementary file 2 | ||
| Aluminum foil | Fisher Scientific | 01-213-100 | Other sources can be used |
| Mounting block | Supplementary file 3 | ||
| Wooden applicator sticks | Fisher Scientific | 23-400-112 | Other sources can be used |
| Teflon sheet | McMaster-Carr | 8545K12 | For teflon applicator |
| Cyanoacrylate glue | 3M | 1469SB | |
| Lab tissues (Kimwipes) | Fisher Scientific | 06-666A | Other sources can be used |
| Gentamicin sulfate | Sigma-Aldrich | G1914 | Other sources can be used |
| Quick-setting epoxy | McMaster-Carr | 7605A18 | |
| 18 mm glass coverslips | Fisher Scientific | 12-546 | Other sources can be used |
| Name | Company | Catalog Number | Comments |
| Saline components | |||
| NaCl | Fisher Scientific | S271-3 | Other sources can be used |
| KCl | Sigma-Aldrich | P4504-500G | Other sources can be used |
| CaCl2 • 2H2O | Fisher Scientific | 10035-04-8 | Other sources can be used |
| HEPES | Sigma-Aldrich | H3375-100G | Other sources can be used |
| D-(+)-glucose | Sigma-Aldrich | G7021 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Parts lists for home-made equipment | |||
| Solenoid puller | |||
| Solenoid | Guardian Electric | A420-065426-00 | Other sources can be used |
| Foot-pedal switch | Linemaster | T-51-SC36 | Other sources can be used |
| Pipette holder | World Precision Instruments | MEH900R | Other sources can be used |
| Coarse manipulator | Narishige Group | MM-3 | Other sources can be used |
| Platinum wire | Alfa Aesar | 25093 | Other sources can be used |
| Power supply | Leica | Z050-261 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Magnetic pins | |||
| Epoxy | McMaster-Carr | 7556A33 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
| Insect pins | Fine Science Tools | 26000-40 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Open-top magnetic chamber | |||
| Flexible magnetic strip | McMaster-Carr | 5759K75 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
Referenzen
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of Adult Mouse Utricle and Adenovirus-mediated Supporting-cell Infection. JoVE (Journal of Visualized Experiments). (61), e3734-e3734 (2012).
- Howard, J., Hudspeth, A. J. Compliance of the hair bundle associated with gating of mechanoelectrical transduction channels in the bullfrog's saccular hair cell. Neuron. 1 (3), 189-199 (1988).
- Jaramillo, F., Hudspeth, A. J. Localization of the hair cell's transduction channels at the hair bundle's top by iontophoretic application of a channel blocker. Neuron. 7 (3), 409-420 (1991).
- Assad, J. A., Hacohen, N., Corey, D. P. Voltage dependence of adaptation and active bundle movement in bullfrog saccular hair cells. Proceedings of the National Academy of Sciences of the United States of America. 86 (8), 2918-2922 (1989).
- Benser, M. E., Issa, N. P., Hudspeth, A. J. Hair-bundle stiffness dominates the elastic reactance to otolithic-membrane shear. Hearing research. 68 (2), 243-252 (1993).
- Martin, P., Hudspeth, A. J. Active hair-bundle movements can amplify a hair cell's response to oscillatory mechanical stimuli. Proceedings of the National Academy of Sciences of the United States of America. 96 (25), 14306-14311 (1999).
- Salvi, J. D., Ó Maoiléidigh, D., Fabella, B. A., Tobin, M., Hudspeth, A. J. Control of a hair bundle's mechanosensory function by its mechanical load. Proceedings of the National Academy of Sciences. 112 (9), E1000-E1009 (2015).
- Martin, P., Bozovic, D., Choe, Y., Hudspeth, A. J. Spontaneous Oscillation by Hair Bundles of the Bullfrog's Sacculus. Journal of Neuroscience. 23 (11), 4533-4548 (2003).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. 400, 275-297 (1988).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage-and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. , (1988).
- Fisher, J. A. N., Kowalik, L., Hudspeth, A. J. Imaging electrical resonance in hair cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (4), 1651-1656 (2011).
- Patel, S. H., Salvi, J. D., Ó Maoiléidigh, D., Hudspeth, A. J. Frequency-selective exocytosis by ribbon synapses of hair cells in the bullfrog's amphibian papilla. The Journal of neuroscience : the official journal of the Society for Neuroscience. 32 (39), 13433-13438 (2012).
- Gale, J. E., Meyers, J. R., Periasamy, A., Corwin, J. T. Survival of bundleless hair cells and subsequent bundle replacement in the bullfrog's saccule. Journal of neurobiology. 50 (2), 81-92 (2002).
- Hudspeth, A. J. Mechanoelectrical transduction by hair cells of the bullfrog's sacculus. Progress in brain research. 80, 129-135 (1989).
- Hudspeth, A. J. Integrating the active process of hair cells with cochlear function. Nature Reviews Neuroscience. 15 (9), 600-614 (2014).
- Corey, D. P., Hudspeth, A. J. Response latency of vertebrate hair cells. Biophysical journal. 26 (3), 499-506 (1979).
- Cheung, E. L. M., Corey, D. P. Ca2+Changes the Force Sensitivity of the Hair-Cell Transduction Channel. Biophysical journal. 90 (1), 124-139 (2006).
- Choe, Y., Magnasco, M. O., Hudspeth, A. J. A model for amplification of hair-bundle motion by cyclical binding of Ca2+ to mechanoelectrical-transduction channels. Proceedings of the National Academy of Sciences of the United States of America. 95 (26), 15321-15326 (1998).
- Assad, J. A., Corey, D. P. An active motor model for adaptation by vertebrate hair cells. Journal of Neuroscience. 12 (9), 3291-3309 (1992).
- Crawford, A. C., Evans, M. G., Fettiplace, R. Activation and adaptation of transducer currents in turtle hair cells. The Journal of physiology. , 405-434 (1989).
- Howard, J., Hudspeth, A. J. Mechanical relaxation of the hair bundle mediates adaptation in mechanoelectrical transduction by the bullfrog's saccular hair cell. Proceedings of the National Academy of Sciences of the United States of America. 84 (9), 3064-3068 (1987).
- Purves, R. D. The release of drugs from iontophoretic pipettes. Journal of Theoretical Biology. 66 (4), 789-798 (1977).
- Tinevez, J. Y., Jülicher, F., Martin, P. Unifying the various incarnations of active hair-bundle motility by the vertebrate hair cell. Biophysical journal. 93 (11), 4053-4067 (2007).
- Ó Maoiléidigh, D., Nicola, E. M., Hudspeth, A. J. The diverse effects of mechanical loading on active hair bundles. Proceedings of the National Academy of Sciences of the United States of America. 109 (6), 1943-1948 (2012).
- Kennedy, H. J., Crawford, A. C., Fettiplace, R. Force generation by mammalian hair bundles supports a role in cochlear amplification. Nature. 433 (7028), 880-883 (2005).
- van Netten, S. M., Khanna, S. M. Stiffness changes of the cupula associated with the mechanics of hair cells in the fish lateral line. Proceedings of the National Academy of Sciences of the United States of America. 91 (4), 1549-1553 (1994).
- Bormuth, V., Barral, J., Joanny, J. F., Jülicher, F., Martin, P. Transduction channels' gating can control friction on vibrating hair-cell bundles in the ear. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7185-7190 (2014).
- Crawford, A. C., Evans, M. G., Fettiplace, R. The actions of calcium on the mechano-electrical transducer current of turtle hair cells. The Journal of physiology. , 369-398 (1991).
- Kozlov, A. S., Risler, T., Hudspeth, A. J. Coherent motion of stereocilia assures the concerted gating of hair-cell transduction channels. Nature Neuroscience. 10 (1), 87-92 (2007).
- Lumpkin, E. A., Hudspeth, A. J. Regulation of free Ca2+ concentration in hair-cell stereocilia. Journal of Neuroscience. 18 (16), 6300-6318 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten