Method Article
Un protocole pour laboratoire logement de Turquoise cyprinodonte (Nothobranchius furzeri)
Dans cet article
Résumé
Logement de laboratoire de turquoise barrés peuvent être transposés à la maison et de sensibiliser efficacement des milliers de poissons dans un système de filtration d’eau centralisée, utilisant la même infrastructure utilisée pour les installations standard de poisson-zèbre. Ici, nous détaillons une liste de procédures normalisées qui permettent aux barrés efficace entretien.
Résumé
Le développement de pratiques d’élevage en laboratoire non-modèle poissons utilisés à des fins expérimentales a grandement bénéficié de la mise en place des poissons de référence systèmes modèles, comme le poisson-zèbre et chez les sujets exposés. Ces dernières années, un poisson émergent – le cyprinodonte turquoise (Nothobranchius furzeri) – a été adopté par un nombre croissant de groupes de recherche dans les domaines de la biologie du vieillissement et de l’écologie. Avec une durée de vie en captivité de 4 à 8 mois, cette espèce est le vertébré microcebu élevé en captivité et permet à la communauté scientifique d’essai – en peu de temps – interventions expérimentales qui peuvent entraîner des modifications du rythme de vieillissement et l’espérance de vie. Compte tenu de la biologie particulière de cette espèce, caractérisée par la diapause embryonnaire, la maturation sexuelle explosive, marquée morphologique et comportemental dimorphisme sexuel - et leur durée de vie adulte relativement courte - spécial élevage pratiques soient urgents demande. Ce protocole indique un ensemble de mesures clés de l’élevage qui permettent aux barrés turquoise optimale soins de laboratoire, permettant à la communauté scientifique à adopter cette espèce comme un modèle animal de laboratoire puissant.
Introduction
Compte tenu de leur courte durée de vie et le cycle de vie rapide, barrés turquoises croissent rapidement comme un prometteur nouvel organisme modèle en biologie1,2,3. Cette espèce se caractérise par un cycle de vie unique pour un téléostéen, consistant en diapause embryonnaire, la maturation sexuelle rapide et une longue durée de vie post-reproductive Etape4,5. Des travaux récents ont contribué à élucider la biologie de cette espèce en captivité et en les sauvages6,7. Turquoises barrés vivent dans des plans d’eau douce saisonniers qui se forment pendant la saison des pluies dans la savane africaine au Zimbabwe et au Mozambique. Pendant la saison sèche, les embryons survivent dans la boue sèche en l’absence d’eau en vertu d’un stade de résistance au stress de la vie appelé la diapause.
Les cartes génétiques de cette espèce ont été généré8,9, et récemment leur génome a été séquencé et monté de10,11. Plusieurs souches de poissons de laboratoire consanguines ont été développés, et la transgénèse et génome édition via CRISPR/Cas9 sont apparues chez cette espèce, qui fait promotion turquoise fondule barré comme un organisme modèle vertébrés de laboratoire concurrentiel 12,13,14.
Même si un protocole de laboratoire a déjà été publié pour cette espèce15, dans le présent protocole, nous développons une liste exhaustive des directives du laboratoire expérimental qui visent spécifiquement les études qui examinent le vieillissement et la survie. Le présent protocole permet aux chercheurs déjà familiers avec l’élevage de poisson-zèbre et chez les sujets exposés à devenir versé dans l’élevage turquoise barrés en adoptant un certain nombre d’ajustements clés. Dans le même temps, ce protocole prévoit des chercheurs sans expérience préalable dans l’élevage de poissons avec les outils essentiels pour élever une colonie prospère de turquoise barrés.
Protocole
Poissons sont élevés à 28 ° C dans un système de recirculation de l’eau (voir paramètres de l’eau), dont l’élimination de l’eau tous les jours 10-20 %. Trois tanks de différentes tailles sont recommandés : 0,8 L et 2,8 L 9,5 L. Chaque réservoir reçoit un débit d’eau constant de 2 mL/s.
1. les réactifs préparation (non incluse dans les matériaux)
NOTE : Cyprinodonte turquoise africaine (Nothobranchius furzeri) peut être fourni sur un stock de laboratoire établi. Les embryons de résistant à la dessiccation barrés annuel peuvent être expédiés par la poste. Il est essentiel d’expédier des embryons dans la plage de température de 8 à 30 ° C.
- Préparer une solution d’acide humique (éclosion) en dissolvant 1 g/L d’acide humique en système eau. Stériliser et conserver à 4 ° C, pendant 10 semaines.
- Pour préparer l’enrichissement HUFA Artemia, s’ajoute l’enrichissement HUFA artémia hatcher tous les jours à une concentration 500 µL/L de solution d’artémia.
- Préparer la solution de bleu de méthylène en dissolvant 100 µL/L de solution de bleu de méthylène dans de l’eau système préalablement stérilisés à l’autoclave. Comme le bleu de méthylène est sensible à la lumière, conserver la solution dans des bouteilles foncées ou couvrir d’aluminium. Magasin à température ambiante.
- Préparer la fibre de noix de coco comme un substrat solid pour l’incubation de l’embryon. Vous pouvez également utiliser un filtre en papier (voir la section 1.5).
- Faire tremper la fibre de coco avec de l’eau distillée. Stériliser et conserver à 4 ° C pendant 5 semaines.
- Le jour du transfert d’embryon, préparer la boîte de Pétri avec la fibre de noix de coco humide.
- Remplir un diamètre de 90 mm boîte de Pétri avec la fibre de noix de coco sous une hotte et à proximité d’une flamme, pour réduire la contamination par les levures et les bactéries.
- Fibre de coco compact jusqu'à une hauteur de 1 cm, avec tissu stérile. Enlever la plupart de l’humidité de la fibre de noix de coco en appuyant sur une serviette en papier sur le dessus de la plaque, laisser le papier pour absorber l’excès d’eau. Faire chauffer une cuillère en métal au-dessus de la flamme et appuyez sur la totalité de la surface de la fibre de noix de coco. Cela empêche la contamination de champignons/bactéries fibre de noix de coco.
- Préparer le papier filtre comme un substrat solid pour l’incubation de l’embryon.
- Le jour du transfert d’embryons, mettre 3 couches des disques de papier filtre qui correspondent à la boîte de Pétri 90 mm. Ajouter 5 mL de solution d’acide humique pour garder l’humidité.
2. reproduction
-
Turquoise barrés pour l’entretien de la souche d’élevage
NOTE : Suite à ce protocole, la maturité sexuelle est atteinte à ~ 4 semaines après l’éclosion et la fécondité des pics entre 7 à 9 semaines. Il est essentiel de noter que la fécondité dépend de l’alimentation fréquence et qualité des aliments ; par conséquent, au moins deux tétées par jour et par réservoir de reproduction sont recommandées pour augmenter le rendement des embryons (voir la section 5.6).- Installation d’un réservoir d’élevage de 9,5 L. Remplissez-le d’eau du système et ajouter un mâle et deux femelles poisson.
- Que les mâles barrés turquoises africaines d’affichage domination pendant l’accouplement, qui pourrait conduire à un harcèlement des femmes, choisissez un mâle avec une taille légèrement plus petite que la femelle à réduire le stress accouplement et augmenter la capacité reproductrice. Mettre en place les mâles âgés de 5 semaines avec des femelles de 6/7 semaines.
- Remplir un récipient en plastique (10 x 10 x 5 cm) avec du sable autoclavé, atteignant une profondeur finale de ~ 2-3 cm et placer le bac à sable dans le centre de la cuve de la reproduction.
- Laissez turquoise barrés se reproduisent continuellement et récoltent des embryons, une fois par semaine pour l’incubation de l’embryon.
Remarque : L’utilisation de substrat de sable pose des défis aux systèmes de filtration centralisé et devrait être remplacée par des méthodes alternatives à l’avenir. Des solutions de rechange possibles pourraient être l’utilisation du poisson-zèbre, réservoirs de reproduction.
-
Sélection pour la transgénèse
Remarque : À utiliser pour les injections, les embryons doivent être synchronisées à la cellule une-étape, et pour cela, qu’ils sont prélevés immédiatement après la fécondation.- Pour la récolte d’embryons 1-cellule-étape à utiliser pour l’injection et la génération des lignées transgéniques, mis en place un réservoir d’élevage avec un mâle et deux femelles poissons (identique 2.1.).
- Deux jours avant la collecte des embryons, isoler le mâle dans une citerne individuelle et garder le mâle en contact visuel avec les femelles adultes.
- Le jour du prélèvement, ajouter le mâle et un bac à sable dans le réservoir de reproduction et les laisser se reproduire pendant 2 h.
3. embryon élevage
-
Collecte des embryons
Remarque : La collecte des embryons est interprétée par tamisage et récolte d’embryons provenant du bac à sable. Dans des conditions normales, chaque carré de sable devrait contenir de 30 à 200 embryons.- Le jour du prélèvement, retirez le réservoir d’élevage bac à sable. Vider le bac à sable dans une passoire (taille de la souche ~0.9 mm) et rincer à l’eau du système. Cela peut être fait sur un grand réservoir pour recueillir le sable pour le passage à l’autoclave.
- Partiellement, plonger la crépine dans le système eau et agiter doucement, laissant les embryons de regrouper dans le centre.
- Recueillir des embryons avec une pipette Pasteur de 10 mL.
- Transfert des embryons à un 90 mm boîte de Pétri en ~ 40 mL d’eau du système.
- Inspecter les embryons en boîte de Pétri sous un stéréomicroscope léger et supprimer ceux présentant la rupture chorion et signes d’endommagement.
- Passez directement à l’embryon de blanchiment.
NOTE : Toujours utiliser une crépine d’aspiration par la souche de poissons afin d’éviter des contaminations potentielles de croix-souche embryonnaire.
-
Embryon de blanchiment
NOTE : Embryon blanchiment empêche les microorganismes présents dans les aquariums de contaminer le milieu d’incubation.- Avant blanchiment, utiliser une pipette Pasteur jetable pour retirer l’eau du système de la boîte de Pétri contenant des embryons collectés.
- Pour empêcher la croissance fongique et bactérienne non désirée, ajouter 50 mL de fraîchement préparés H2O2 (1 % v/v dans de l’eau système autoclave) pour les embryons prélevés.
- Secouez les embryons pendant 5 min à faible vitesse en 90 mm Pétri dans 50 mL de solution.
- Enlevez H2O2 solution avec pipette Pasteur jetable et lavez les embryons trois fois pendant 5 min avec 50 mL de solution de bleu de méthylène. Enlever la solution de bleu de méthylène.
- Ajouter 50 mL d’H2O2 (1 % v/v dans de l’eau système autoclave) aux embryons et agiter pendant 5 min.
- Enlever la solution de2 H2O et laver trois fois pendant 5 min avec 50 mL de solution de bleu de méthylène.
- Incuber les embryons à 28 ° C afin d’accroître le développement des embryons synchrone, à une densité maximale de 100 embryons par 90 mm boîte de Pétri dans 40 mL de solution de bleu de méthylène.
Remarque : Ne s’étendent pas à l’incubation embryon dans la solution de blanchiment. Ceci peut endommager le chorion de l’oeuf et augmenter la mortalité des embryons. Embryon de blanchiment pourrait provoquer des changements physiques et chimiques majeurs dans le chorion de l’oeuf qui pourrait résulter en physiologie chorion altérée et le succès de l’éclosion.
-
Incubation d’embryon dans le bleu de méthylène
Remarque : Le liquide incubation dans une solution de bleu de méthylène empêche la croissance du parasite et permet la détection des embryons morts et les œufs non fécondés.- Inspecter les embryons couvés, retirer les embryons morts (teintés bleus de bleu de méthylène) de la boîte de Pétri pour prévenir la contamination fongique et bactérienne qui influent sur la survie des embryons vivants.
- Enlever l’ancienne solution de bleu de méthylène et remplacer par une solution fraîche.
- Retour de Pétri à 28 ° C incubateur (Figure 1 a). Dans les 7-10 jours, s’assurer que les embryons avancés montrent des yeux noirs visibles. Transférez ces embryons à la fibre de noix de coco ou le milieu de substrat solide du papier filtre (Figure 1 b).
- Conserver les embryons non développées dans le bleu de méthylène, contrôler au quotidien et transférer au milieu de substrat solide une fois les yeux noirs ont mis au point.
- Répéter les étapes 3.3.1-3.3.3 quotidiennement jusqu'à ce que les embryons ont des yeux noirs visibles.
NOTE : L’exposition constante d’embryons au bleu de méthylène peut induire des changements à long terme dans la physiologie des poissons adultes.
-
Transfert d’embryons à filtre en papier
NOTE : Les embryons barrés Turquoise peuvent se développer sur un substrat sec, récapitulant les conditions naturelles. En outre, l’incubation embryon sec permet aux chercheurs de synchroniser des embryons et leur éclosent le même jour.- Comme des embryons développés aura visible yeux noirs en 7-10 jours, utiliser une pipette Pasteur jetable ou fine brucelles courbée de transférer les embryons de la solution de bleu de méthylène sur une plaque de papier-filtre préalablement préparée.
- Propagation des embryons séparés de ~ 5 mm avec une pince, jusqu'à 100 embryons par plaque de 90 mm (Figure 1 b).
- Sceller la boîte de Pétri avec du parafilm.
- Incuber les embryons à 28 ° C pendant 2-3 semaines, jusqu'à ce qu’ils ont pleinement développé Iris dorés et sont prêts à couver (Figure 1).
Remarque : Ne pas prolonger l’incubation des embryons de prêt-à-trappe pendant plus de 2 semaines que leur viabilité sera considérablement réduite.
-
Transfert d’embryons à la fibre de coco
NOTE : Fibre de coco autoclavé, stérile (ou organique de la tourbe) peut servir comme un moyen de rechange valable pour l’incubation du substrat solide.- Utiliser une pipette Pasteur jetable ou fine brucelles courbée de transférer les embryons de la solution de bleu de méthylène sur une plaque de fibre de coco prêt à l’emploi.
- Étaler les embryons ~ 5 millimètres, jusqu'à 100 embryons par plaque de 90 mm (Figure 1 b).
- Sceller la boîte de Pétri avec du parafilm.
- Incuber les embryons à 28 ° C pendant 2-3 semaines, jusqu'à ce qu’ils ont pleinement développé golden Iris (par exemple dans la Figure 1).
NOTE : Pour le stockage à long terme (jusqu'à un an), transfert des embryons dans le prélèvement post 3 jours de solutions de bleu de méthylène à une plaque solide-substrat à 17 ° C. Incuber les embryons jusqu'à ce qu’ils développent des yeux noirs.
4. l’éclosion Killifish Turquoise
Remarque : Les embryons barrés Turquoise peuvent être avec succès hachurées dans une solution d’acide humique14.
- Utilisez des pinces courbes fines, transfert soigneusement 50-100 développés des embryons dans la zone de couver remplie avec la solution d’acide humique à 4 ° C. La solution d’acide humique se compose de 1 g/L d’acide humique en eau du système. Stériliser et conserver à 4 ° C, pendant 10 semaines. Assurez-vous que tous les embryons soient complètement immergées. La solution d’acide humique doit être peu profonde, pas plus de 2 cm.
NOTE : Basse température de la solution acide humique améliore l’éclosion et immersion complète des embryons dans la solution permet de synchronisé à couver. - Placez la zone de couver dans l’incubateur de l’éclosion de 28 ° C. Couvrir la zone d’incubation avec le couvercle. Pour fournir une aération suffisante, connecter boîte de couver en tube avec alimentation en air.
NOTE : Aération insuffisante durant l’incubation entraîne des taux élevés d’alevins pas en mesure de remplir la vessie natatoire (phénotype « ventre-slider », voir la Note à la section 5.1) - Dès le jour après l’éclosion, pour maintenir la qualité de l’eau adéquate dans la boîte de l’éclosion, ajouter système autoclave d’eau une fois par jour dans la proportion de 1:1, gardant une profondeur finale de 2 cm.
- Transfert des embryons non incubés à substrat solid et tenter d’incubation d’une semaine plus tard.
NOTE : Lors de l’éclosion, turquoises barrés sont facilement capables d’absorption et consomment des aliments vivants. Pour une croissance optimale, nourrir les alevins deux fois par jour avec excès, artémia fraîchement éclos (Artemia salina). Le signe de satiété complète est l’abdomen de couleur orange des alevins après 10-15 min de chaque tétée. Siphonner les excès, non consommée et décomposée de crevette à l’aide d’une pipette Pasteur sur une base quotidienne.
5. élever des poissons juvéniles et adultes
- Cinq jours après l’éclosion, déplacer juvéniles vers le système de recirculation de l’eau. À l’aide de pipettes en plastique jetables (ou une cuillère en plastique), soigneusement juvéniles de transfert cinq par réservoir 0,8 L équipés d’écran de RFY 400 µm (Figure 2).
Remarque : Il est possible qu’une partie des barrés mineurs ne sera pas ont rempli la vessie natatoire, ce qui entraîne un phénotype typique « ventre-slider », caractérisé par des poissons pas pour atteindre la bonne flottabilité, les obligeant à nager en permanence, provoquant de graves malformations chez poissons adultes. Ces poissons ne peuvent être utilisés pour des analyses de survie ou de reproduction efficace et ont besoin d’être censuré. - Nourrir les juvéniles deux fois par jour avec des artémias fraîchement écloses en excès jusqu'à 14 jours après l’éclosion. Siphonner les débris du fond de chaque réservoir tous les jours.
- 14 jours après la naissance, transfert des poissons juvéniles à réservoir 2,8 L équipé d’un écran de RFY 850 µm. Partir de là, étiquetez chaque citerne avec fish ID, indiquant la date d’éclosion, informations de souche, poisson sexe et numéro d’identification de poissons (Figure 3). Pour des analyses de survie, individuellement maison chaque poisson en citernes unique à partir de là.
- Pendant les sept jours suivants, nourrir juvéniles deux fois par jour avec environ 2 mL d’artémia par poisson. À ce stade les poissons peuvent être complétés par les vers de sang live 1-3 (dans le cas où les larves de ver de sang sont trop grands pour les poissons, les hacher en petits morceaux avec une lame de rasoir). Pour prévenir la détérioration de la qualité de l’eau, siphonner les aliments non consommés et les déchets supplémentaires deux fois par semaine.
- Après 3 semaines de l’éclosion, retirer l’écran de la RFY à l’arrière de la citerne et commencent à se nourrir chaque poisson deux fois par jour environ 2mL d’artémia et 0,5 mL de ver de sang. À ce stade, juvéniles devraient avoir atteint 1 cm de taille corporelle et doivent être capables d’ingérer le ver de sang pleine grandeur.
- À l’âge de 4 semaines, nourrir chaque poisson deux fois par jour avec environ 2mL d’artémia et 1 mL de ver de sang. Les femelles peuvent être lôgées conjointement à une densité de 3 femelles par réservoir 2,8 L.
- À ce stade, assurez-vous que le poisson atteint la maturation sexuelle complète. Vérifier la présence de grandes nageoires dorsales, anales et caudales avec signes de coloration chez les mâles et ronde abdomen plein d’oeufs chez les femelles.
Remarque : Élever des poissons adultes dans les réservoirs individuels pour les études de cohortes de survie peut affecter négativement, comportement du poisson et la santé. Logement de groupe pour les études de cohortes de survie ajoute cependant, des facteurs de confusion importantes due à l’établissement de la domination sociale et territoires mâles, conduisant à des hiérarchies sociales strictes.
6. alimentation
Remarque : Cyprinodonte de laboratoire turquoise peut être nourris une combinaison de bébé artémia (naupliid’Artemia salina ) et ver de sang (larves deChironomus spp. ). Fondule barré turquoise alevins sont nourris exclusivement de bébé artémia. Les poissons juvéniles et adultes sont nourris deux fois par jour les artémias et ver de sang (Figure 2). Idéalement, les poissons peuvent être nourris plusieurs fois par jour, dépassant les 2 tétées indiqués dans le présent protocole.
-
Culture d’artémia
- Ajouter 10 L d’eau par osmose inverse (RO) et 350 g de sel de la mer rouge à un hatcher artémia et dissoudre par l’aération avec un tube d’aération.
- Enrichir la culture avec 5 mL d’acides gras hautement insaturés (HUFA).
- Ajouter 20 g de crevette de saumure kystes dans la solution d’incubation. Inspecter qu’artémia kystes ne pas flotter à la surface de l’eau et assurer la bonne oxygénation et la circulation de la culture.
Remarque : Daily aliquotes de crevette de saumure sèche kystes peuvent être stockés à 4 ° C. - Dans l’après-midi du lendemain, fournir la culture avec une autre partie aliquote de 5 mL de HUFA.
-
Récolte d’artémia éclos
Remarque : Après ~ 36 h depuis le départ de la culture, artémia sont prêts pour la récolte (stade II phase).- Collecter 5 L de la culture dans un conteneur à l’aide du robinet sur le fond de la hatcher et laisser reposer pendant 10 min.
- Après 10 min, retirez artémia coquilles (couleur marron) sur le dessus du réservoir 5 L et filtrer l’artémia éclos (couleur orange) au travers d’une maille. Faites attention à exclure le sédiment trouvé au fond du récipient car il contient des oeufs non éclos et morts d’artémia.
- Rincez éclos artémia avec eau dans un récipient de 2 L et laisser reposer pendant 10 min.
- Après 10 min, filtrer la crevette de saumure à travers un maillage et recueillir dans 2 L d’eau RO.
- Répétez les trois étapes précédentes jusqu'à ce que la solution de crevette de saumure est exempt de coquilles de kystes et d’artémia non éclos.
- Transférer les artémias dans le conteneur de 2 L dans flacons destinés à l’alimentation.
NOTE : Culture d’artémia est assez robuste et fiable. Toutefois, pour éviter la pénurie de crevette de saumure en cas d’éclosion infructueuse, petits éclosoirs de sauvegarde (500 mL) peuvent être utilisés.
-
Mise en place la sauvegarde hatcher
- Dissoudre 17,5 g de sel de la mer rouge dans 500 mL d’eau par aération.
- Enrichir la culture avec 500 µL de HUFA.
- Ajouter 2 g de crevette de saumure kystes.
- Après 18 à 24 heures, fournir de la culture une fois de plus avec 500 µL de HUFA.
NOTE : artémia sont prêtes à être récoltées après ~ 24 h.
-
Préparation du ver de sang direct
- Immédiatement avant l’alimentation, filtrer une quantité appropriée de ver de sang à travers une passoire à l’aide d’eau RO.
Remarque : Le ver de sang direct peut être stocké à 4 ° C pendant 7 à 10 jours. - Rincez le ver de sang avec une petite quantité d’eau dans un récipient en plastique.
- Avec un Pasteur en plastique, pipette (pointe étroite enlevé), prendre le melange de ver de sang destinés à l’alimentation.
Remarque : Alimentation cyprinodonte de laboratoire colonies avec des aliments vivants provenant de sources non contrôlées s’ajoute un risque de contamination externe des parasites et des communautés microbiennes potentiellement pathogènes. À l’avenir, une alimentation de type poisson stérile ad hoc devrait être développée.
- Immédiatement avant l’alimentation, filtrer une quantité appropriée de ver de sang à travers une passoire à l’aide d’eau RO.
7. killifish laboratoire souche génotypage
Remarque : Pour faire la distinction entre les souches barrés turquoise, ainsi qu’à déterminer le sexe au sein de chaque souche, marqueurs génétiques spécifiques (microsatellites) peuvent être utilisé9 (tableau 1).
-
Prélèvement d’échantillons
- Tenez fermement le poisson dans un filet sur le dessus une éponge humide.
- Prélever 2-3 échelles allant du corps du poisson de l’opercule à la caudale à l’aide de tampons de coton.
- Choisir des échelles de l’écouvillon et le transfert de 2 ou 3 écailles dans un tube de 1 mL contenant une solution de NaOH (200 µL 0,5 mol/L, NaOH, 1 % de β-mercaptoéthanol et 0,5 % polyvinyl pyrrolidone).
- Faites tourner les tubes PCR pendant 15 s pour s’assurer que les échelles soient complètement immergées dans la solution de NaOH.
-
Isolement d’ADN génomique
- Incuber l’échantillon pendant 20 min à 95 ° C.
- Cool RT, neutraliser l’échantillon avec volume de 1/10 de 1 M Tris-HCl, pH 8,0.
- Centrifuger l’échantillon pendant 5 min à pleine vitesse.
8. paramètres de l’eau
Remarque : L’élevage d’organismes dont l’utilisation prévue est de phénotypage adulte nécessite conditions d’élevage très stables tout au long de la durée de vie de l’espèce cible. Par conséquent, mise en culture des organismes d’eau, comme la turquoise barrés, nécessite un contrôle strict des paramètres de l’eau. Recirculation de l’eau, avec quatre-étapes supplémentaires filtration de l’eau, assure une base solide pour réaliser un contrôle sur les paramètres de l’eau, fournissant tous les réservoirs dans les mêmes conditions de l’eau au fil du temps. Il est recommandé pour reconstituer l’eau du système de l’eau par osmose inverse (RO), additionné de sel marin commercial et bicarbonate de sodium.
- Programme de système de circulation eau : tout d’abord, eaux usées provenant de poissons réservoirs des flux par l’intermédiaire de filtre en métal des particules solides qui capture tous les débris de nourriture non mangée et les particules plus grosses. Filtres en métal sont rincés trois fois par semaine ; En second lieu, après la première filtration mécanique, l’eau est véhiculé dans les puisards des grandes et ensuite pompée vers un biofiltre, où les bactéries transforment l’ammoniac pour les nitrites et les nitrates ; En troisième lieu, du biofiltre, l’eau est pompée à manches de filtre de 25 µm, qui piègent les plus fines particules de taille. Enfin, l’eau s’écoule par le biais des lampes ultraviolets (UV) stérilisent l’eau des bactéries et des virus. Après ces quatre étapes, eau filtrée retourne dans les réservoirs à poisson.
- Pour réduire la croissance des micro-organismes dans les réservoirs, éviter l’accumulation de nitrates et de réduire globalement salinité, 10 à 20 % de l’eau du système est disposée sur une base quotidienne.
- Maintenir constante la température de l’eau à 28 ° C, constante de pH de l’eau dans le secteur de 7,0 à 7,5.
- Bien que barrés tolèrent toute gamme de salinité, pour éviter oodinosis, maintenir conductivité au sein de la gamme 650-710 microsiemens. Un cycle lumière/obscurité de long de l’année 12 h assure la productivité et la santé de la colonie.
NOTE : Barrés peuvent tolérer la conductivité de l’eau jusqu'à 1500 microsiemens.
Résultats
Bon élevage des barrés turquoise se traduit par survie médiane allant de 12 à 18 semaines chez la souche GRZ (par exemple la Figure 4 a). Variations de la durée médiane de survie dépendent diet, fréquence des repas et logement à des conditions de température. Résultats élevage pauvres en présentant des courbes de survie ont augmenté la mortalité précoce et répétitifs, brusques gouttes de survie pendant toute période, caractérisée par plusieurs points d’inflexion (Figure 4 b).

Figure 1 : des stades de développement embryonnaires représentatifs avec substrat respectifs d’incubation. (A) fraîchement recueillies des embryons, incubés dans une solution de bleu de méthylène dans l’incubateur à 28 ° C. (B) les embryons prêts à être transférés sur milieu solide, filtre soit fibre de papier ou de la noix de coco. (C) embryons prêts à hachurer, affichage typiques Iris dorés. La barre d’échelle est égale à 1 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
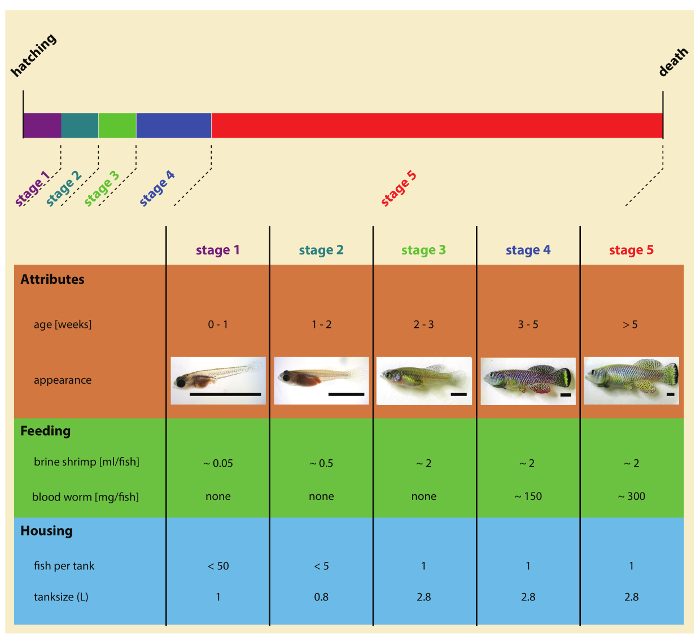
Figure 2 : étapes de turquoise barrés développement après l’éclosion. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
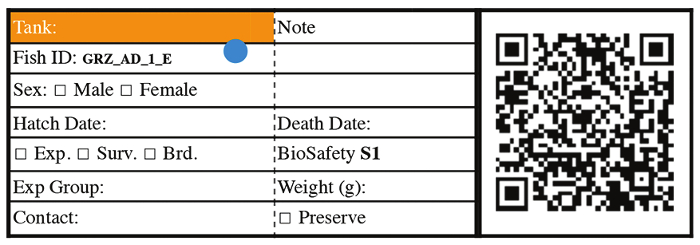
Figure 3 : étiquette d’identification de poisson représentatif pour le poisson dès phase 3. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
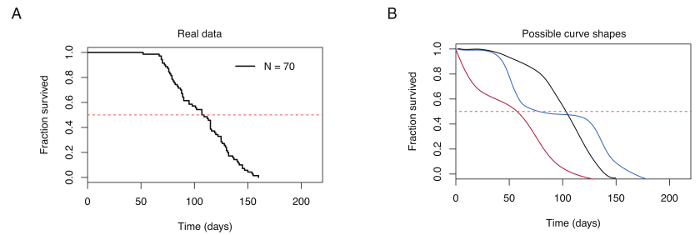
Figure 4 : courbe de survie représentatif pour 70 cyprinodonte turquoise mâle. (A) courbe de survie typique pour cyprinodonte turquoise élevés en laboratoire. (B) une comparaison des courbes de survie provenant de poissons élevés dans des conditions optimales d’élevage (noir) et de l’élevage pauvre (rouge et bleu). La ligne horizontale rouge pointillée indique 50 % de survie, courbe de survie qui se croisent à la longévité médiane (indiquée sur l’axe des abscisses). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| ID | Primer avant | Inverser l’apprêt | Classe de grandeur (bp) | ||
| * NfuSU0007 | GGCTAAGCCTTGCTGACAGA | CAGGGAGCTGAAAACCTCAG | 166 - 214 | ||
| * NfuSU0010 | CGCAGTCTGATCAAATCGTGT | TGTTTGAAGGTTCACATTCATTATC | 220 - 272 | ||
| NfuSU0016 | CATGGCTAAACCGTGATGAA | GAAGGACGCCAGCTATGAAG | 209 - 240 | ||
| NfuSU0022 | AACACAGCTCTCGTAAGGAGGTA | TTCAGACTTGTCTTACTACCATGTTT | 198 - 238 | ||
| NfuSU0027 | TCCAGCTGAATCGGTAATGA | AAACTCGAGGGTGCAATCTG | 164 - 226 | ||
| NfuSU0049 | CTGGACAAAGTGCCAATCAC | CTCCCACAGTCCCAAAACAT | 196 - 197 | ||
| NfuSU0050 | CCAGAATGAACAATACTCAGATCAA | GCAGCTTAGTTTAATGATATCACAATG | 252 - 295 | ||
| NfuSU0060 | CTAGCCACTCCCCTGGTTTA | CCGTCACGATGTGCTGATAC | 216 - 248 | ||
| NfuFLI0030 | CAGAAGCTAAAGGCCAGACG | GGGAAACAATAGGGAACCAC | 174 - 205 | ||
| * NfuFLI0091 | ACGCTGACTCTACCCAGTC | CTGCCTGCTACTGACAATG | 355 - 373 | ||
| * - des marqueurs de détermination du sexe | |||||
Tableau 1 : Les amorces de génotypage pour l’identification de la souche.
Discussion
Les auteurs décrivent un protocole d’élevage de laboratoire de killifish turquoise, y compris la collecte des embryons, incubation, ainsi que logement poissons adultes, d’élevage et d’alimentation. Notre protocole est expressément conçu pour les laboratoires qui effectuent la recherche axée sur les poissons adultes, en particulier dans les études expérimentales sur le vieillissement et la durée de vie. Fondule barré turquoise peut être déclenché sur une installation standard de poisson-zèbre ; Cependant, des aspects importants de ressources pétrolières barrés diffèrent du poisson-zèbre standard soins16. Ces rajustements comprennent la transition précoce d’un seul régime d’artémia à un régime additionné de ver de sang riche en protéines, mais aussi des mesures concrètes d’incubation de l’embryon, consistant en une étape d’incubation liquides et solides.
Étapes critiques au sein du protocole comprennent des embryons expédition 8-30 ° C plage de températures. En cas de reproduction, fécondité dépend de l’alimentation fréquence et qualité des aliments ; par conséquent, nous recommandons au moins deux tétées par jour et par reproduction de réservoir pour augmenter le rendement des embryons (voir la section 5.6.). Au cours de l’embryon de blanchiment, ne s’étendent pas d’incubation embryon dans la solution de blanchiment. Cela peut endommager le chorion de l’oeuf et la mortalité des embryons accrue. Lors de l’incubation des embryons avec le bleu de méthylène, ne pas prolonger l’incubation des embryons de prêt-à-trappe pendant plus de 2 semaines que leur viabilité sera considérablement réduite. À couver turquoise barrés, basse température de la solution acide humique améliore l’éclosion et immersion complète des embryons dans la solution permet de synchronisé à couver. Aération insuffisante durant les résultats de l’incubation des taux élevés d’alevins pas en mesure de remplir la vessie natatoire (phénotype « ventre-slider », voir les notes relatives à la section 5.1).
Limitation du protocole pour la reproduction comprend l’utilisation du substrat sable quels défis de poses à filtration systèmes centralisés et devraient être remplacés par des méthodes alternatives à l’avenir. Des solutions de rechange possibles pourraient être l’utilisation du poisson-zèbre, réservoirs de reproduction. Embryon de blanchiment pourrait provoquer des changements physiques et chimiques majeurs dans le chorion de l’oeuf qui pourrait résulter en physiologie chorion altérée et le succès de l’éclosion. L’exposition constante des embryons au bleu de méthylène peut induire des changements à long terme dans la physiologie des poissons adultes. Élevage de poissons adultes dans les réservoirs individuels pour les études de cohortes de survie peut affecter négativement la comportement du poisson et la santé. Logement de groupe pour les études de cohortes de survie ajoute cependant, des facteurs de confusion importantes due à l’établissement de la domination sociale et territoires mâles, conduisant à des hiérarchies sociales strictes. Par conséquent, nous jugeons que l’isolement des poissons mâles pour des études de survie constitue un compromis raisonnable. Alimentation laboratoire barrés colonies avec des aliments vivants provenant de sources non contrôlées ajoute un risque de contamination externe des parasites et des communautés microbiennes potentiellement pathogènes. À l’avenir, une alimentation de type poisson stérile ad hoc devrait être développée.
Les améliorations futures à ce protocole mettra l’accent sur une alimentation contrôlée, non vivants, qui mène toujours à achever la maturation sexuelle dans 3-4 semaines. En résumé, notre protocole offre l’accessibilité aux barrés turquoise laboratoire mise en culture d’une communauté scientifique.
Déclarations de divulgation
Tous les auteurs déclarent sans intérêts financiers et non financiers concurrents.
Remerciements
Nous remercions Alessandro Cellerino, Tyrone Genade, Anne Brunet, Sabrina Sharp, Mickie Powell, Simone Keil, Yumi Kim, Patrick Smith, Kai Mathar et tous les membres du laboratoire Valenzano à l’Institut Max Planck pour la biologie du vieillissement pour contribuer aux différents aspects le protocole actuel de l’élevage barrés au fil des ans.
matériels
| Name | Company | Catalog Number | Comments |
| Probe calibration buffer solution pH=7.0 | Roth | A518.1 | 1L buffer solution pH=7.0 to calibrate water system pH-electrode |
| Probe calibration buffer solution pH=4.0 | Roth | P712.1 | 1L buffer solution pH=4.0 to calibrate water system pH-electrode |
| Conductivity standard | VWR | 83607.260 | 500 mL Conductivity standard 1,413 uS/cm to calibrate water system conductivity-electrode |
| Easy Strips Test 6in1 | JBL | 2533900 | Test strips for determination chlorine values of system water |
| Ammonia Test | JBL | 2536500 | Test to determine ammonia content of system water |
| Red Sea Salt | Red Sea | 22 kg bucket | |
| Sodium hydrogen carbonate | VWR | 27780.360 | |
| Humic acid | Sigma- Aldrich | 53680-50G | |
| New HUFA Artemia enrichment | ZM Systems UK | 75g bottle | |
| Methylene blue | Roth | AE64.1 | |
| Hydrogen peroxide solution | Sigma- Aldrich | 31642-1L | 30% (w/w) |
| Coconut fiber | Dragon | ZCS010 | |
| Whatman paper | GE healthcare | 3030-690 | |
| Ethanol pure | VWR | 20821.467 | 100% |
| Silica sand | local pet shop | ||
| Artemia Eggs Premium Grade | Sanders | ||
| Bloodworm | local distributor | Poseidon Aquakultur Germany | |
| dNTPs solution mix | Biolabs | N04472 | 10mM |
| Taq DNA polymerase | Invitrogen | 18038-042 | 5U/uL |
| PCR 10x Buffer | Invitrogen | 18038-042 | |
| MgCl2 | Invitrogen | 18038-042 | 50mM |
| NaOH | Sigma- Aldrich | S8045-500g | 50mM |
| Tris-HCl, pH=8.0 solution | Sigma- Aldrich | T2694-1L | 1M |
| HCl 37% | Sigma- Aldrich | H1758-500mL | |
| Fish tanks | Aquaneering | volume: 0.8L, 2.8L, 9.5L; equipped with baffles, fry mesh and lids | |
| Orbital shaker | VWR | 89032-100 | model 5000 |
| Microbiological incubator | Thermo Scientific, Heratherm | 50125882 | model IMC18; for storage embryos in the liquid phase, set to t=27-28°C |
| Cooling Incubator | Binder | 9020-0209 | model KT115; for storage embryos in the solid phase, set to t=27-28°C |
| Hatching incubator | Thermo Scientific, Heratherm | 51028114 | model OGS180; for embryos hatching, set to t=27-28°C |
| Stereomicroscope | Leica | model M80 | |
| Breeding sand/hatching boxes | Roth | 1598.1 | 1000mL |
| Petri dish | Sarstedt | 82.1473 | 92x16mm |
| 50 mL Conical tube | Sarstedt | 62.547.254 | |
| 15 mL Conical tube | Sarstedt | 62.554.002 | |
| Disposable Plastic Pasteur pipette | Roth | EA71.1 | 2mL; For fish feeding with bloodworms, or embryos selection cut off the tip to open 3-4mm diameter |
| Serological pipette | Sarstedt | 86.1689.001 | 50mL |
| Syringe | Henke Sass Wolf | 4100-000V0 | 10mL |
| Metal strainer | fineness <1mm; for embryos collection | ||
| Tweezers | Dumont | 0508-5/45-PO | type5/45; for embryos transfer |
| 25 L Brine shrimp hatcher | Aquaneering | ZHBS25 | main hatcher |
| 500 mL Brine shrimp hatcher | JBL | 6106100 | model Artemio 1; backup hatcher |
| Narrow-mesh fish nets | JBL | ||
| Sand beaker | VWR | BURK7102-5000 | 5000mL |
| Brine shrimp separation beaker | VWR | BURK7102-2000 | 2000mL |
| Plastic zipper bag | Roth | P279.2 | for dead fish storage |
| Pipetboy | Integra | 155000 | model Pipetboy acu2 |
| Parafilm | P-Lab | P701605 | |
| Air tubing | www.zajac.de | AQ380 | 4-6 mm diameter |
| 1 L Glass bottle | VWR | 215-1595 | |
| 2 L Glass bottle | VWR | 215-1596 | |
| 500 mL Squeeze bottle | Roth | K665.1 | for fish feeding with brine shrimp |
| 120-μm brine shrimp strainer | Florida Aqua Farms | BB-PC2 | for brine shrimp/bloodworm collection |
| Finish filter socks | Aquaneering | MFVB025C | 25-μm |
| Central filtration fish housing system | Aquaneering, Techniplast, Aquatic Habitats, Aqua Schwarz |
Références
- Valenzano, D. R., Aboobaker, A., Seluanov, A., Gorbunova, V. Non-canonical aging model systems and why we need them. EMBO J. 36 (8), 959-963 (2017).
- Harel, I., Brunet, A. The African Turquoise Killifish: A Model for Exploring Vertebrate Aging and Diseases in the Fast Lane. Cold Spring Harb Symp Quant Biol. 80, 275-279 (2015).
- Smith, P., et al. Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. Elife. 6, (2017).
- Cellerino, A., Valenzano, D. R., Reichard, M. From the bush to the bench: the annual Nothobranchius fishes as a new model system in biology. Biol Rev Camb Philos Soc. 91 (2), 511-533 (2016).
- Kim, Y., Nam, H. G., Valenzano, D. R. The short-lived African turquoise killifish: an emerging experimental model for ageing. Dis Model Mech. 9 (2), 115-129 (2016).
- Blazek, R., et al. Repeated intraspecific divergence in life span and aging of African annual fishes along an aridity gradient. Evolution. 71 (2), 386-402 (2017).
- Terzibasi, E., et al. Large differences in aging phenotype between strains of the short-lived annual fish Nothobranchius furzeri. PLoS One. 3 (12), e3866 (2008).
- Kirschner, J., et al. Mapping of quantitative trait loci controlling lifespan in the short-lived fish Nothobranchius furzeri--a new vertebrate model for age research. Aging Cell. 11 (2), 252-261 (2012).
- Valenzano, D. R., et al. Mapping loci associated with tail color and sex determination in the short-lived fish Nothobranchius furzeri. Genetics. 183 (4), 1385-1395 (2009).
- Reichwald, K., et al. Insights into Sex Chromosome Evolution and Aging from the Genome of a Short-Lived Fish. Cell. 163 (6), 1527-1538 (2015).
- Valenzano, D. R., et al. The African Turquoise Killifish Genome Provides Insights into Evolution and Genetic Architecture of Lifespan. Cell. 163 (6), 1539-1554 (2015).
- Harel, I., et al. A platform for rapid exploration of aging and diseases in a naturally short-lived vertebrate. Cell. 160 (5), 1013-1026 (2015).
- Valenzano, D. R., Sharp, S., Brunet, A. Transposon-Mediated Transgenesis in the Short-Lived African Killifish Nothobranchius furzeri, a Vertebrate Model for Aging. G3. 1 (7), 531-538 (2011).
- Harel, I., Valenzano, D. R., Brunet, A. Efficient genome engineering approaches for the short-lived African turquoise killifish. Nat Protoc. 11 (10), 2010-2028 (2016).
- Polacik, M., Blazek, R., Reichard, M. Laboratory breeding of the short-lived annual killifish Nothobranchius furzeri. Nat Protoc. 11 (8), 1396-1413 (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon