Method Article
Un protocollo per laboratorio Housing di turchese Killifish (Nothobranchius furzeri)
In questo articolo
Riepilogo
Alloggiamento di laboratorio di turchese killifish può essere scalato a casa e in modo efficiente generare migliaia di singoli pesci in un sistema di filtrazione di acqua centralizzata, impiegando la stessa infrastruttura utilizzata per strutture standard zebrafish. Qui dettagliamo un elenco di procedure standardizzate che consentono killifish efficiente manutenzione.
Abstract
Lo sviluppo di pratiche di allevamento in laboratorio non-modello pesci utilizzati a fini sperimentali ha notevolmente beneficiato l'istituzione dei pesci di riferimento sistemi modello, come zebrafish e medaka. Negli ultimi anni, un pesce emergente – il turchese killifish (Nothobranchius furzeri) – è stato adottato da un numero crescente di gruppi di ricerca nei campi della biologia di invecchiamento ed ecologia. Con una durata di vita in cattività di 4-8 mesi, questa specie è il più breve durato vertebrato allevato in cattività e consente alla comunità scientifica di prova – in tempi brevi – interventi sperimentali che possono portare ad alterazioni del tasso di invecchiamento e l'aspettativa di vita. Dato l'unica biologia di questa specie, caratterizzata dalla diapausa embrionale, maturazione sessuale esplosiva, contrassegnato morfologica e comportamento dimorfismo sessuale - e loro relativamente breve durata adulto - allevamento ad hoc pratiche sono in urgente domanda. Questo protocollo segnala un insieme di misure di allevamento chiave che consentono ottimali killifish turchese cura di laboratorio, che consente alla comunità scientifica di adottare questa specie come un modello animale di laboratorio potente.
Introduzione
Data la loro vita breve e rapido ciclo di vita, turchese killifish sono in rapida crescita come un promettente nuovo organismo modello in biologia1,2,3. Questa specie è caratterizzata da un unico ciclo di vita per un teleosteo, comprensivi di diapausa embrionale, rapida maturazione sessuale e una lunga durata sui fase4,5. Lavoro recente ha contribuito a delucidare la biologia di questa specie sia in cattività che in selvatici6,7. Killifish turchese vivono in corpi di acqua dolce stagionale che si formano durante la stagione delle piogge nella savana africana in Zimbabwe e Mozambico. Durante la stagione secca, gli embrioni sopravvivono nel fango secco in assenza di acqua in virtù di una fase della vita resistente alle sollecitazioni chiamata diapausa.
Mappe genetiche per questa specie sono stati generati8,9, e recentemente il loro genoma è stato sequenziato e assemblato10,11. Sono stati sviluppati diversi ceppi di pesce inbred laboratorio e transgenesi e genoma editing tramite CRISPR/Cas9 si sono resi disponibili in questa specie, di fatto promuovere killifish turchese come organismo vertebrato modello competitivo laboratorio 12,13,14.
Anche se un protocollo di laboratorio è già stato pubblicato per questa specie15, nel presente protocollo sviluppiamo un elenco completo delle linee guida di laboratorio sperimentale che mirano in particolare a studi che indagano l'invecchiamento e la sopravvivenza. Il presente protocollo consente ai ricercatori già familiari con zebrafish e medaka nell'allevamento di diventare esperti in allevamento turchese killifish adottando un numero minimo di regolazioni chiave. Allo stesso tempo, questo protocollo fornisce ai ricercatori senza precedente esperienza in allevamento di pesce con gli strumenti essenziali per generare una fiorente colonia di killifish turchese.
Protocollo
Pesci sono allevati a 28 ° C in un sistema di ricircolo di acqua (vedi parametri dell'acqua), con eliminazione di acqua ogni giorno 10-20%. Tre serbatoi di dimensioni diverse sono raccomandati: 0,8 L, 2.8 L e L. 9,5 Ogni serbatoio riceve un flusso d'acqua costante di 2 mL/s.
1. reagenti preparazione (non incluso in materiali)
Nota: Killifish turchese africano (Nothobranchius furzeri) possono essere fornite da un magazzino di laboratorio stabilite. Gli embrioni di essiccazione-resistente killifish annuale possono essere spediti per posta. È fondamentale per spedire gli embrioni intervallo di temperatura di 8-30 ° C.
- Preparare la soluzione di acido umico (tratteggio) sciogliendo 1 g/L di acido umico nel sistema dell'acqua. Autoclave e conservare a 4 ° C fino a 10 settimane.
- Per la preparazione di arricchimento HUFA Artemia, aggiungere arricchimento HUFA salamoia di artemie giornaliera a un concentrazione di 500 µ l/L di soluzione di Artemia Salina.
- Preparare la soluzione di blu di metilene sciogliendo 100 µ l/L di soluzione di riserva del blu di metilene in acqua sistema precedentemente sterilizzati nell'autoclave. Poiché il blu di metilene è sensibile alla luce, mantenere la soluzione in bottiglie scure, o coprire con pellicola. Conservare a RT.
- Preparare la fibra di cocco come un substrato solido per l'incubazione di embrione. In alternativa, utilizzare un filtro di carta (Vedi punto 1.5).
- Fibra di cocco presoak con acqua distillata. Autoclave e conservare a 4 ° C fino a 5 settimane.
- Il giorno del trasferimento dell'embrione, preparare Petri con fibra di cocco umido.
- Riempire un diametro di 90 mm di Petri con fibra di cocco in una cappa e accanto a una fiamma, per ridurre la contaminazione da lieviti e batteri.
- Fibra di cocco compatto ad un'altezza di 1 cm, con tessuto sterile. Rimuovere la maggior parte dell'umidità dalla fibra di cocco premendo un tovagliolo di carta sopra la piastra, lasciando la carta per assorbire l'acqua in eccesso. Scaldare un cucchiaio di metallo sopra la fiamma e premere verso il basso su tutta la superficie della fibra di cocco. Questo impedisce la contaminazione fungina/batterica fibra di cocco.
- Preparare la carta da filtro come un substrato solido per l'incubazione di embrione.
- Il giorno del trasferimento embrionale, posizionare 3 strati di carta da filtro dischi che corrispondono di Petri di 90 mm. Aggiungere 5 mL di soluzione di acido umico per mantenere l'umidità.
2. allevamento
-
Killifish turchese per la manutenzione di ceppo di allevamento
Nota: A seguito di questo protocollo, maturità sessuale viene raggiunta a ~ 4 settimane post-schiusa e fecondità cime tra 7-9 settimane. È importante notare che la fecondità dipende alimentazione frequenza e la qualità del cibo; almeno due poppate al giorno per allevamento serbatoio si raccomanda pertanto di aumentare il rendimento di embrioni (vedere paragrafo 5.6.)- Installazione di un serbatoio di allevamento di 9,5 L. Riempire con acqua di sistema e aggiungere un maschio e femminile due pesci.
- Come visualizzare killifish turchese africano maschio dominante durante l'accoppiamento, che potrebbe condurre a molestie di femmine, scegliere un maschio con una dimensione corporea leggermente più piccolo rispetto a quello femminile per ridurre lo stress degli amori e aumentare la capacità riproduttiva. Impostare 5-settimana-vecchi maschi con le femmine 6/7-settimana-vecchio.
- Riempire un contenitore di plastica (10 x 10 x 5 cm) con sabbia in autoclave, raggiungendo una profondità finale di ~ 2-3 cm e posizionare il contenitore di sabbia al centro della vasca di allevamento.
- Lasciate che turchese killifish razza continuamente e raccogliere embrioni una volta a settimana per l'incubazione di embrione.
Nota: L'uso di sabbia substrato pone sfide ai sistemi di filtrazione centralizzato e dovrebbe essere sostituito in futuro da metodi alternativi. Possibili alternative potrebbero essere l'uso di zebrafish allevamento serbatoi.
-
Allevamento per transgenesi
Nota: Gli embrioni da utilizzare per le iniezioni devono essere sincronizzati in uno-cella-fase, e questo richiede che sono stati raccolti immediatamente dopo la fecondazione.- Per raccogliere una cella fasi embrioni da utilizzare per la generazione di linee transgeniche e di iniezione, è possibile impostare un serbatoio di allevamento con un maschio e due pesce femmina (stesso 2.1.).
- Due giorni prima del prelievo degli embrioni, isolare il maschio in un singolo serbatoio e mantenere l'uomo in contatto visivo con le femmine adulte.
- Il giorno della raccolta, aggiungere nel contenitore di allevamento il maschio e una scatola di sabbia e lasciarli a deporre le uova per 2 h.
3. embrione allevamento
-
Raccolta degli embrioni
Nota: La raccolta degli embrioni viene eseguita di setacciatura e di raccolta di embrioni dalla casella di sabbia. In condizioni normali, ogni contenitore di sabbia dovrebbe contenere da 30 a 200 embrioni.- Il giorno della raccolta, è necessario rimuovere scatola di sabbia dal serbatoio dell'allevamento. Svuotare il contenitore di sabbia in un colino (dimensione ceppo di ~0.9 mm) e risciacquare con acqua dell'impianto. Questo può essere fatto sopra un grande serbatoio per raccogliere sabbia per sterilizzazione in autoclave.
- Parzialmente immergere il filtro in acqua dell'impianto e agitare delicatamente, lasciando che gli embrioni per raggruppare insieme al centro.
- Raccogliere gli embrioni con una pipetta Pasteur da 10 mL.
- Trasferire gli embrioni in un 90mm di Petri in ~ 40 mL di acqua dell'impianto.
- Ispezionare gli embrioni nella piastra di Petri sotto un luce stereomicroscopio e rimuovere quelli che presenta corion rotto e segni di danni.
- Procedere direttamente all'embrione candeggio.
Nota: Utilizzare sempre un filtro al ceppo di pesce al fine di evitare potenziali contaminazioni croce-ceppo dell'embrione.
-
Embrione di candeggio
Nota: Lo sbiancamento dell'embrione impedisce microrganismi presenti nelle vasche dei pesci da contaminare i media di incubazione.- Prima del candeggio, utilizzare una pipetta Pasteur monouso per togliere l'acqua dell'impianto di Petri contenenti embrioni raccolti.
- Per prevenire la crescita di fungo e batterica indesiderata, aggiungere 50 mL di preparati H2O2 (1% v/v in acqua sistema autoclavato) agli embrioni raccolti.
- Agitare gli embrioni per 5 min a bassa velocità di Petri di 90 mm in 50 mL di soluzione.
- Soluzione di H2O2 con pipetta Pasteur di rimuovere e lavare gli embrioni tre volte per 5 min con 50 mL di soluzione di blu di metilene. Rimuovere la soluzione di blu di metilene.
- Aggiungere 50 mL di H2O2 (1% v/v in acqua sistema autoclavato) agli embrioni e agitare per 5 min.
- Rimuovere la soluzione di H2O2 e lavare tre volte per 5 min con 50 mL di soluzione di blu di metilene.
- Incubare gli embrioni a 28 ° C per aumentare lo sviluppo di embrioni sincrono, a una densità massima di 100 embrioni per 90 millimetri di Petri in 40 mL di soluzione di blu di metilene.
Nota: Non si estendono incubazione dell'embrione nella soluzione sbianca. Questo può causare danni al corion dell'uovo e aumentare la mortalità embrionale. Candeggio embrione potrebbe causare grandi cambiamenti chimico-fisici in corion dell'uovo che potrebbe tradursi in fisiologia alterata corion e da cova di successo.
-
Incubazione di embrione in blu di metilene
Nota: Incubazione liquido in soluzione di blu di metilene impedisce la crescita del parassita e consente il rilevamento di embrioni morti e uova non fertilizzate.- Ispezionare gli embrioni incubati, rimuovendo eventuali embrioni morti (macchiati blu di metilene) da di Petri per prevenire contaminazioni batteriche e fungine che influenzano la sopravvivenza degli embrioni sani dal vivo.
- Rimuovere la vecchia soluzione di blu di metilene e sostituirli con soluzione fresca.
- Ritorno di Petri a incubatore di 28 ° C (Figura 1A). Entro 7-10 giorni, garantire che gli embrioni sviluppati mostrano visibili gli occhi neri. Trasferire questi embrioni per la fibra di cocco o il mezzo di substrato solido di carta da filtro (Figura 1B).
- Conservare gli embrioni non sviluppati in blu di metilene, monitorare quotidianamente e trasferire a substrato solido terreno una volta hanno sviluppato occhi neri.
- Ripetere passaggi 3.3.1-3.3.3 ogni giorno fino a quando gli embrioni hanno occhi neri visibili.
Nota: La costante esposizione degli embrioni al blu di metilene può indurre cambiamenti a lungo termine in fisiologia di pesci adulti.
-
Trasferimento di embrioni di carta da filtro
Nota: Gli embrioni killifish turchese possono svilupparsi su un substrato secco, ricapitolare le condizioni naturali. Inoltre, incubazione di embrione asciutto consente ai ricercatori di sincronizzare gli embrioni e li si schiudono nello stesso giorno.- Come embrioni sviluppati avrà occhi neri visibili entro 7-10 giorni, è possibile utilizzare una pipetta Pasteur o Pinzette curve bene per trasferire gli embrioni dalla soluzione di blu di metilene su un piatto di carta filtro precedentemente preparata.
- Diffondere gli embrioni distanza di ~ 5 mm con il forcipe, fino a 100 embrioni per piastra di 90 mm (Figura 1B).
- Sigillare la capsula di Petri con parafilm.
- Incubare gli embrioni a 28 ° C per 2-3 settimane, fino a quando si sono completamente sviluppati dorate iridi e sono pronti per la cova (Figura 1).
Nota: Non prolungare l'incubazione di pronto-a-tratteggio embrioni per più di 2 settimane in quanto riducono drammaticamente la loro sopravvivenza.
-
Trasferimento di embrioni di fibra di cocco
Nota: Cocco sterile, sterilizzato nell'autoclave fibra (o muschio di torba biologica) può essere utilizzato come mezzo alternativo valido per incubazione del substrato solido.- Utilizzare una pipetta Pasteur o Pinzette curve bene per trasferire gli embrioni dalla soluzione di blu di metilene su una lastra di fibra di cocco di ready-to-use.
- Diffondere gli embrioni ~ 5 mm apart, fino a 100 embrioni per piastra di 90 mm (Figura 1B).
- Sigillare la capsula di Petri con parafilm.
- Incubare gli embrioni a 28 ° C per 2-3 settimane, fino a quando sono completamente sviluppate dorate iridi (ad esempio in Figura 1).
Nota: Per l'archiviazione a lungo termine (fino a un anno), trasferire gli embrioni a collezione post 3-days da soluzioni di blu di metilene in un piatto solido-substrato a 17 ° C. Incubare gli embrioni fino a quando si sviluppano gli occhi neri.
4. da cova Killifish turchese
Nota: Gli embrioni killifish turchese possono essere covati con successo in una soluzione di acido umico14.
- Usando la pinzetta curva bene, trasferimento con cura 50-100 sviluppato embrioni nella scatola schiusa riempito con la soluzione di acido umico a 4 ° C. La soluzione di acido umico è costituito da acido umico di 1 g/L in acqua dell'impianto. Autoclave e conservare a 4 ° C fino a 10 settimane. Assicurarsi che tutti gli embrioni sono completamente immersi. La soluzione di acido umico deve essere superficiale, non più profondo di 2 cm.
Nota: Bassa temperatura della soluzione di acido umico migliora schiusa e completa immersione degli embrioni nella soluzione consente schiusa sincronizzato. - Posizionare la casella di schiusa in incubatrice cova 28 ° C. Coprire la casella da cova con il coperchio. Per fornire sufficiente aerazione, collegare scatola schiusa di tubi con aria di alimentazione.
Nota: Non sufficiente areazione durante l'incubazione si traduce in elevati tassi di fry non in grado di riempire la vescica gassosa (fenotipo "pancia-slider", vedere la nota nella sezione 5.1) - Dal giorno dopo la schiusa, per mantenere la qualità dell'acqua adeguata nella finestra di schiusa, aggiungere sistema autoclave acqua una volta al giorno nella proporzione di 1:1, mantenendo una profondità finale di 2 cm.
- Trasferire gli embrioni unhatched torna al substrato solido e tentare da cova una settimana più tardi.
Nota: Al momento della schiusa, turchese killifish sono facilmente in grado di assorbimento e consumare cibo vivo. Per una crescita ottimale, feed RFI due volte al giorno con Artemia salina appena schiusi in eccesso (Artemia salina). Il segno di piena sazietà è addomi arancione di friggere dopo 10-15 min di ogni poppata. Sifone fuori l'eccesso, non vengono consumata e decomposta Artemia utilizzando una pipetta Pasteur su base giornaliera.
5. allevamento dei pesci giovanili e adulti
- A cinque giorni post-schiusa, spostare i giovani al sistema di ricircolo dell'acqua. Utilizzando pipette di plastica usa e gettare (o un cucchiaio di plastica), con attenzione i giovani di trasferimento cinque per 0,8 L serbatoio dotato di schermo di 400 µm fry (Figura 2).
Nota: È possibile che una parte di killifish giovanile non hanno riempito la vescica gassosa, risultante in un fenotipo tipico "pancia-slider", caratterizzato da pesce non raggiungendo il corretto assetto, costringendoli a nuotare continuamente, causando gravi malformazioni in pesci adulti. Questi pesci non possono essere utilizzati per le analisi di sopravvivenza o per allevamento efficiente e bisogno di essere censurato. - Juveniles mangime due volte al giorno con Artemia salina appena schiusi in eccesso fino a 14 giorni post-schiusa. Sifone fuori detriti dalla parte inferiore di ogni serbatoio ogni giorno.
- A 14 giorni di età, trasferimento di novellame a 2,8 litri dotata di schermo fry 850 µm. Da questo punto in poi, etichettare ogni serbatoio con ID pesce, indicando data di tratteggio, ceppo informazioni, pesce genere e numero di identificazione del pesce (Figura 3). Per le analisi di sopravvivenza, casa individualmente ogni pesce in vasche singole da questo punto in poi.
- Per i 7 giorni seguenti, feed juveniles due volte al giorno con ~ 2 mL di gambero di salamoia al pesce. In questa fase il pesce può essere completato con 1-3 dal vivo sangue worms (nel caso in cui le larve del verme di sangue sono troppo grandi per il pesce, tagliarle in pezzi più piccoli con una lama di rasoio). Per evitare il deterioramento della qualità dell'acqua, sifone fuori avanzi di cibo e rifiuti ulteriori due volte a settimana.
- Dopo 3 settimane dalla schiusa, rimuovere fry schermo dalla parte posteriore del serbatoio e iniziano a nutrirsi da ogni pesce due volte al giorno ~ 2mL di Artemia e 0,5 mL di verme di sangue. In questa fase, i giovani dovrebbero aver raggiunto 1 cm nella dimensione corporea e dovrebbero essere in grado di ingerire verme di sangue full-size.
- A 4 settimane di età, feed ogni pesce due volte al giorno con ~ 2mL di Artemia salina e 1 mL di verme di sangue. Le femmine possono essere co-alloggiate ad una densità di fino a 3 femmine per carro armato 2,8 L.
- In questa fase assicurarsi che pesce raggiunge la piena maturazione sessuale. Verificare la presenza di grandi pinne dorsale, anale e caudale con segni di colorazione nei maschi e rotonda addome pieni di uova nelle femmine.
Nota: Allevamento dei pesci adulti in singoli serbatoi per studi di coorte di sopravvivenza può influenzare negativamente il comportamento pesce e salute. Tuttavia, la stabulazione in gruppo per studi di coorte di sopravvivenza aggiunge significativi fattori di confusione dovuto all'istituzione di dominanza sociale e territori maschi, portando a rigorose gerarchie sociali.
6. alimentazione
Nota: Killifish laboratorio turchese può essere alimentato una combinazione di naupli di Artemia (naupli diArtemia salina ) e blood worm (larve diChironomus spp. ). Killifish turchese fry sono alimentati esclusivamente naupli di Artemia. Giovanili e adulti pesci sono nutriti due volte al giorno sia Artemia salina e vite senza fine di sangue (Figura 2). Idealmente, pesce può essere alimentato più volte al giorno, superando le 2 poppate indicato nel presente protocollo.
-
Coltura di artemie
- Aggiungere 10 L di acqua di osmosi inversa (RO) e 350 g di sali del mar rosso una salamoia di artemie e scioglierli da aerazione con un tubo di aerazione.
- Arricchire la cultura con 5 mL di acidi grassi altamente insaturi (HUFA).
- Aggiungere 20 g di cisti di Artemia nella soluzione di schiusa. Controllare che le cisti di Artemia non galleggiare sulla superficie dell'acqua e garantire la corretta ossigenazione e la circolazione della cultura.
Nota: Le aliquote giornaliere delle cisti di Artemia Salina asciutto possono essere conservate a 4 ° C. - Il pomeriggio del giorno successivo, è necessario fornire la cultura con un'altra aliquota di 5 mL di HUFA.
-
Raccolta schiusi di Artemia
Nota: Dopo ~ 36 h dalla partenza cultura, gambero di salamoia sono pronte per la raccolta (instar II fase).- Raccogliere 5 L della cultura in un contenitore usando il rubinetto sul fondo del hatcher e lasciate riposare per 10 min.
- Dopo 10 min, rimuovere gusci di gambero di salamoia (colore marrone) dalla parte superiore del contenitore 5L e filtrare l'Artemia tratteggiato (colore arancione) attraverso una maglia. Prestare attenzione per escludere il sedimento trovato nella parte inferiore del contenitore in quanto contiene uova non schiuse e morto di Artemia.
- Risciacquo schiuso gambero di salamoia con acqua RO in un contenitore da 2 litri e lasciate riposare per 10 min.
- Dopo 10 min, filtrare nuovamente attraverso una maglia di Artemia e raccogliere in 2 L di acqua RO.
- Ripetere i tre passaggi precedenti finché gambero di salamoia soluzione è libero da gusci di cisti e gambero di salamoia non-covato.
- Trasferimento di Artemia dal contenitore 2L in bottiglie squeeze per l'alimentazione.
Nota: Coltura di Artemia è abbastanza robusto e affidabile. Tuttavia, per evitare la carenza di Artemia in caso di infruttuoso schiusa, possono essere utilizzati più piccole schiuse backup (500 mL).
-
Impostare il backup hatcher
- Sciogliere 17,5 g di sali del mar rosso in 500 mL di acqua RO di aerazione.
- Arricchire la propria cultura con 500 µ l di HUFA.
- Aggiungere 2 g di cisti di Artemia.
- Dopo 18-24 h, fornire la cultura ancora una volta con 500 µ l di HUFA.
Nota: gambero di salamoia sono pronte per il raccolto dopo ~ 24 h.
-
Preparazione di verme di sangue vivo
- Immediatamente prima dell'alimentazione, è possibile filtrare una quantità appropriata di verme di sangue attraverso un colino utilizzando acqua RO.
Nota: Verme di sangue vivo può essere memorizzato a 4 ° C per 7-10 giorni. - Sciacquare il verme di sangue con una piccola quantità di acqua RO in un contenitore di plastica.
- Con una plastica Pasteur pipetta (punta stretta rimosso), prenda la miscela di verme di sangue per l'alimentazione.
Nota: Alimentazione killifish laboratorio colonie con cibo vivo da fonti non controllate aggiunge un rischio di contaminazioni esterne da parassiti e comunità microbiche potenzialmente patogene. In futuro, dovrebbe essere sviluppato un feed pesce sterile ad hoc.
- Immediatamente prima dell'alimentazione, è possibile filtrare una quantità appropriata di verme di sangue attraverso un colino utilizzando acqua RO.
7. killifish laboratorio ceppo genotipizzazione
Nota: Per distinguere tra ceppi killifish turchese, nonché a determinare il sesso all'interno di ogni ceppo, marcatori specifici genetiche (microsatelliti) possono essere usato9 (tabella 1).
-
Campionamento
- Tenere saldamente il pesce in una rete nella parte superiore la spugna bagnata.
- Scale 2-3 dal corpo di pesce dall'opercolo alla pinna caudale utilizzando tamponi di cotone del tampone.
- Pick scale dal tampone e transfer di 2-3 scale in un tubo di 1 mL contenente soluzione di NaOH (200 µ l 0,5 mol/L di NaOH, 1% β-mercaptoetanolo e 0,5% pirrolidone polivinilico).
- Girare i tubi PCR per 15 s per assicurarsi che le scale sono completamente immersi nella soluzione di NaOH.
-
Isolamento di DNA genomic
- Incubare il campione per 20 min a 95 ° C.
- Raffreddare a temperatura ambiente, neutralizzare il campione con 1/10 di volume di 1 M Tris-HCl, pH 8.0.
- Centrifugare il campione per 5 min a piena velocità.
8. acqua parametri
Nota: Allevamento di organismi il cui impiego previsto è adulto phenotyping richiede condizioni di allevamento altamente stabile durante tutto il ciclo di vita delle specie bersaglio. Di conseguenza, la coltura di organismi acquatici, quali turchese killifish, necessita di rigoroso controllo dei parametri dell'acqua. Ricircolo di acqua, con quattro passaggi aggiuntivi filtrazione dell'acqua, garantisce una solida base per raggiungere il controllo di parametri dell'acqua, fornendo tutti i carri armati con le stesse condizioni di acqua nel corso del tempo. Si raccomanda di ricostituire l'acqua dell'impianto da acqua ad osmosi inversa (RO), aggiunto con sale marino commerciale e bicarbonato di sodio.
- Schema di sistema di circolazione dell'acqua: in primo luogo, acque reflue da pesce serbatoi flussi attraverso filtro metallico di particelle solide che cattura tutti i residui di cibo non consumato e le particelle più grandi. Filtri metallici vengono sciacquati tre volte a settimana; In secondo luogo, dopo il primo filtraggio meccanico, acqua è convogliata in grandi vasche e quindi pompato ad un biofiltro, dove batteri convertono ammoniaca in nitriti e nitrati; In terzo luogo, dal biofiltro, l'acqua viene pompata verso 25 µm filtri a maniche, che intrappolano le particelle di dimensioni più fini. Infine, l'acqua scorre attraverso lampade ultraviolette (UV) che sterilizzare l'acqua da batteri e virus. A seguito di questi quattro passaggi, acqua filtrata restituisce ai serbatoi di pesce.
- Per ridurre la crescita di microrganismi nei serbatoi, prevenire l'accumulo di nitrati e ridurre nel complesso salinità, 10-20% dell'acqua dell'impianto è disposta su una base quotidiana.
- Mantenere costante la temperatura dell'acqua a 28 ° C, costante di pH dell'acqua all'interno della gamma di 7.0-7.5.
- Anche se Killi tollerano la vasta gamma di salinità, per evitare oodinosis, mantenere conducibilità all'interno della gamma 650-710 micro-Siemens. Un ciclo di luce/buio di anno-lungo 12 h garantisce la produttività e la salute della Colonia.
Nota: Killifish può tollerare la conduttività dell'acqua fino a 1500 micro-Siemens.
Risultati
Allevamento corretto killifish turchese si traduce in sopravvivenza mediana compresa tra 12-18 settimane nel ceppo GRZ (ad es. la Figura 4A). Variazioni di sopravvivenza mediana dipendono dalla dieta, alimentazione frequenza e temperatura condizioni abitative. Risultati di allevamento poveri in curve di sopravvivenza che presenta aumentato mortalità precoce e ripetitivi, improvvisi gocce di sopravvivenza nel corso del tempo, caratterizzata da diversi punti di flesso (Figura 4B).

Figura 1: rappresentante stadi di sviluppo embrionale con substrato incubazione rispettivi. (A) appena raccolti embrioni, incubati in soluzione di blu di metilene nell'incubatore a 28 ° C. (B) gli embrioni pronti per essere trasferito al mezzo solido, filtrare fibra di carta o di cocco. (C) embrioni pronto a schiudersi, visualizzazione tipiche dorate iridi. La barra della scala è pari a 1 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
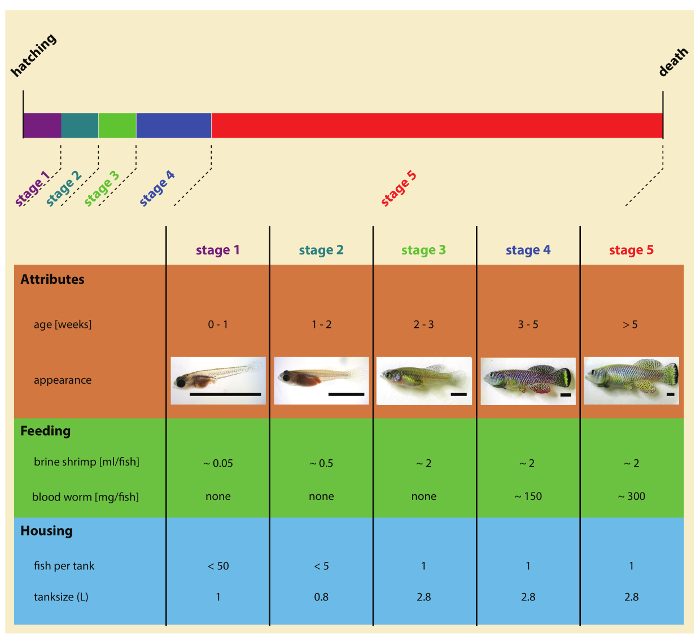
Figura 2: fasi del turchese killifish post-schiusa sviluppo. Clicca qui per visualizzare una versione più grande di questa figura.
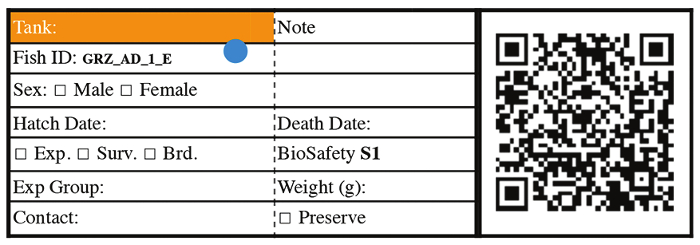
Figura 3: tag ID pesce rappresentativo per pesce fin dalla fase 3. Clicca qui per visualizzare una versione più grande di questa figura.
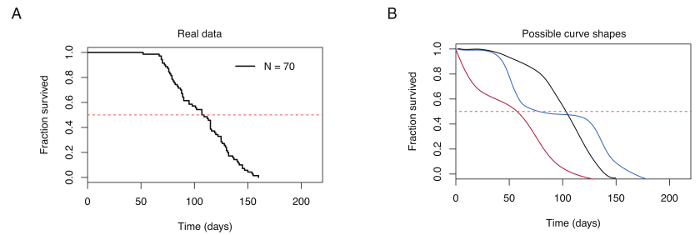
Figura 4: curva di sopravvivenza rappresentativo per 70 Killi turchese maschi. (A) curva di sopravvivenza tipico per laboratorio-generato turchese killifish. (B) confronto delle curve di sopravvivenza ottenuti da pesci allevati in condizioni ottimali di allevamento (nero) e allevamento povero (rosso e blu). La linea orizzontale rossa tratteggiata indica 50% sopravvivenza, curva di sopravvivenza che si intersecano a durata mediana (indicata sull'asse x). Clicca qui per visualizzare una versione più grande di questa figura.
| ID | Forward primer | Reverse primer | Intervallo di grandezza (bp) | ||
| * NfuSU0007 | GGCTAAGCCTTGCTGACAGA | CAGGGAGCTGAAAACCTCAG | 166 - 214 | ||
| * NfuSU0010 | CGCAGTCTGATCAAATCGTGT | TGTTTGAAGGTTCACATTCATTATC | 220 - 272 | ||
| NfuSU0016 | CATGGCTAAACCGTGATGAA | GAAGGACGCCAGCTATGAAG | 209 - 240 | ||
| NfuSU0022 | AACACAGCTCTCGTAAGGAGGTA | TTCAGACTTGTCTTACTACCATGTTT | 198 - 238 | ||
| NfuSU0027 | TCCAGCTGAATCGGTAATGA | AAACTCGAGGGTGCAATCTG | 164 - 226 | ||
| NfuSU0049 | CTGGACAAAGTGCCAATCAC | CTCCCACAGTCCCAAAACAT | 196 - 197 | ||
| NfuSU0050 | CCAGAATGAACAATACTCAGATCAA | GCAGCTTAGTTTAATGATATCACAATG | 252 - 295 | ||
| NfuSU0060 | CTAGCCACTCCCCTGGTTTA | CCGTCACGATGTGCTGATAC | 216 - 248 | ||
| NfuFLI0030 | CAGAAGCTAAAGGCCAGACG | GGGAAACAATAGGGAACCAC | 174 - 205 | ||
| * NfuFLI0091 | ACGCTGACTCTACCCAGTC | CTGCCTGCTACTGACAATG | 355 - 373 | ||
| * - marcatori di determinazione del sesso | |||||
Tabella 1: Gli iniettori di genotipizzazione per l'identificazione del ceppo.
Discussione
Descriviamo un protocollo per la coltura di laboratorio di killifish turchese, tra cui la raccolta degli embrioni, incubazione, come pure la custodia di pesci adulti, allevamento e alimentazione. Il nostro protocollo destinato specificamente ai laboratori che effettuano ricerca incentrata su pesci adulti, in particolare per gli studi sperimentali su invecchiamento e durata. Killifish turchese può essere generato su un impianto di zebrafish standard; Tuttavia, importanti aspetti di allevamento killifish differiscono da standard zebrafish cura16. Queste modifiche includono una transizione precoce da una dieta di Artemia solo ad una dieta completata con verme di sangue ricco di proteine, come pure i passaggi specifici dell'incubazione di embrione, costituito da una fase di incubazione liquidi ed asciutti.
Fasi critiche all'interno del protocollo includono spedizioni embrioni intervallo di temperatura di 8-30 ° C. In caso di allevamento, fecondità dipende dall'alimentazione di frequenza e la qualità del cibo; Pertanto, si consiglia almeno due poppate al giorno per allevamento serbatoio per aumentare la resa di embrioni (vedere paragrafo 5.6.). Durante lo sbiancamento dell'embrione, non si estendono incubazione dell'embrione nella soluzione sbianca. Ciò potrebbe causare danni al corion dell'uovo e dell'embrione aumentata mortalità. Quando incubando gli embrioni con blu di metilene, non prolungare la incubazione di pronto-a-tratteggio embrioni per più di 2 settimane in quanto riducono drammaticamente la loro sopravvivenza. Da cova killifish turchese, bassa temperatura della soluzione di acido umico migliora schiusa e completa immersione degli embrioni nella soluzione consente schiusa sincronizzato. Non sufficiente areazione durante i risultati di incubazione in elevati tassi di fry non in grado di riempire la vescica gassosa (fenotipo "pancia-slider", vedere le note nella sezione 5.1).
Limitazione del protocollo per l'allevamento comprende l'uso del substrato sabbia che pone sfide ai sistemi di filtrazione centralizzati e dovrebbero essere sostituiti in futuro da metodi alternativi. Possibili alternative potrebbero essere l'uso di zebrafish allevamento serbatoi. Candeggio embrione potrebbe causare grandi cambiamenti chimico-fisici in corion dell'uovo che potrebbe tradursi in fisiologia alterata corion e da cova di successo. L'esposizione costante degli embrioni al blu di metilene può indurre cambiamenti a lungo termine in fisiologia di pesci adulti. Allevamento dei pesci adulti in singoli serbatoi per studi di coorte di sopravvivenza può influenzare negativamente il comportamento dei pesci e salute. Tuttavia, la stabulazione in gruppo per studi di coorte di sopravvivenza aggiunge significativi fattori di confusione dovuto all'istituzione di dominanza sociale e territori maschi, portando a rigorose gerarchie sociali. Di conseguenza, noi giudichiamo che l'isolamento dei pesci maschi per studi di sopravvivenza è un compromesso ragionevole. Colonie di killifish laboratorio d'alimentazione con cibo vivo da fonti non controllate aggiungere un rischio di contaminazioni esterne da parassiti e comunità microbiche potenzialmente patogene. In futuro, dovrebbe essere sviluppato un feed pesce sterile ad hoc.
Futuri miglioramenti al presente protocollo si concentreranno su una dieta controllata, non-live, che conduce ancora a completare la maturazione sessuale entro 3-4 settimane. In sintesi, il nostro protocollo offre accessibilità alla turchese killifish laboratorio coltura ad una comunità ampia scientifica.
Divulgazioni
Tutti gli autori non dichiarano concorrenti interessi finanziari e non finanziari.
Riconoscimenti
Vi ringraziamo Alessandro Cellerino, Tyrone Genade, Anne Brunet, Sabrina Sharp, Mickie Powell, Simone Keil, Yumi Kim, Patrick Smith, Kai Mathar e tutti i membri del laboratorio Valenzano presso l'Istituto Max Planck per la biologia dell'invecchiamento per contribuire a diversi aspetti del protocollo attuale Killi allevamento nel corso degli anni.
Materiali
| Name | Company | Catalog Number | Comments |
| Probe calibration buffer solution pH=7.0 | Roth | A518.1 | 1L buffer solution pH=7.0 to calibrate water system pH-electrode |
| Probe calibration buffer solution pH=4.0 | Roth | P712.1 | 1L buffer solution pH=4.0 to calibrate water system pH-electrode |
| Conductivity standard | VWR | 83607.260 | 500 mL Conductivity standard 1,413 uS/cm to calibrate water system conductivity-electrode |
| Easy Strips Test 6in1 | JBL | 2533900 | Test strips for determination chlorine values of system water |
| Ammonia Test | JBL | 2536500 | Test to determine ammonia content of system water |
| Red Sea Salt | Red Sea | 22 kg bucket | |
| Sodium hydrogen carbonate | VWR | 27780.360 | |
| Humic acid | Sigma- Aldrich | 53680-50G | |
| New HUFA Artemia enrichment | ZM Systems UK | 75g bottle | |
| Methylene blue | Roth | AE64.1 | |
| Hydrogen peroxide solution | Sigma- Aldrich | 31642-1L | 30% (w/w) |
| Coconut fiber | Dragon | ZCS010 | |
| Whatman paper | GE healthcare | 3030-690 | |
| Ethanol pure | VWR | 20821.467 | 100% |
| Silica sand | local pet shop | ||
| Artemia Eggs Premium Grade | Sanders | ||
| Bloodworm | local distributor | Poseidon Aquakultur Germany | |
| dNTPs solution mix | Biolabs | N04472 | 10mM |
| Taq DNA polymerase | Invitrogen | 18038-042 | 5U/uL |
| PCR 10x Buffer | Invitrogen | 18038-042 | |
| MgCl2 | Invitrogen | 18038-042 | 50mM |
| NaOH | Sigma- Aldrich | S8045-500g | 50mM |
| Tris-HCl, pH=8.0 solution | Sigma- Aldrich | T2694-1L | 1M |
| HCl 37% | Sigma- Aldrich | H1758-500mL | |
| Fish tanks | Aquaneering | volume: 0.8L, 2.8L, 9.5L; equipped with baffles, fry mesh and lids | |
| Orbital shaker | VWR | 89032-100 | model 5000 |
| Microbiological incubator | Thermo Scientific, Heratherm | 50125882 | model IMC18; for storage embryos in the liquid phase, set to t=27-28°C |
| Cooling Incubator | Binder | 9020-0209 | model KT115; for storage embryos in the solid phase, set to t=27-28°C |
| Hatching incubator | Thermo Scientific, Heratherm | 51028114 | model OGS180; for embryos hatching, set to t=27-28°C |
| Stereomicroscope | Leica | model M80 | |
| Breeding sand/hatching boxes | Roth | 1598.1 | 1000mL |
| Petri dish | Sarstedt | 82.1473 | 92x16mm |
| 50 mL Conical tube | Sarstedt | 62.547.254 | |
| 15 mL Conical tube | Sarstedt | 62.554.002 | |
| Disposable Plastic Pasteur pipette | Roth | EA71.1 | 2mL; For fish feeding with bloodworms, or embryos selection cut off the tip to open 3-4mm diameter |
| Serological pipette | Sarstedt | 86.1689.001 | 50mL |
| Syringe | Henke Sass Wolf | 4100-000V0 | 10mL |
| Metal strainer | fineness <1mm; for embryos collection | ||
| Tweezers | Dumont | 0508-5/45-PO | type5/45; for embryos transfer |
| 25 L Brine shrimp hatcher | Aquaneering | ZHBS25 | main hatcher |
| 500 mL Brine shrimp hatcher | JBL | 6106100 | model Artemio 1; backup hatcher |
| Narrow-mesh fish nets | JBL | ||
| Sand beaker | VWR | BURK7102-5000 | 5000mL |
| Brine shrimp separation beaker | VWR | BURK7102-2000 | 2000mL |
| Plastic zipper bag | Roth | P279.2 | for dead fish storage |
| Pipetboy | Integra | 155000 | model Pipetboy acu2 |
| Parafilm | P-Lab | P701605 | |
| Air tubing | www.zajac.de | AQ380 | 4-6 mm diameter |
| 1 L Glass bottle | VWR | 215-1595 | |
| 2 L Glass bottle | VWR | 215-1596 | |
| 500 mL Squeeze bottle | Roth | K665.1 | for fish feeding with brine shrimp |
| 120-μm brine shrimp strainer | Florida Aqua Farms | BB-PC2 | for brine shrimp/bloodworm collection |
| Finish filter socks | Aquaneering | MFVB025C | 25-μm |
| Central filtration fish housing system | Aquaneering, Techniplast, Aquatic Habitats, Aqua Schwarz |
Riferimenti
- Valenzano, D. R., Aboobaker, A., Seluanov, A., Gorbunova, V. Non-canonical aging model systems and why we need them. EMBO J. 36 (8), 959-963 (2017).
- Harel, I., Brunet, A. The African Turquoise Killifish: A Model for Exploring Vertebrate Aging and Diseases in the Fast Lane. Cold Spring Harb Symp Quant Biol. 80, 275-279 (2015).
- Smith, P., et al. Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. Elife. 6, (2017).
- Cellerino, A., Valenzano, D. R., Reichard, M. From the bush to the bench: the annual Nothobranchius fishes as a new model system in biology. Biol Rev Camb Philos Soc. 91 (2), 511-533 (2016).
- Kim, Y., Nam, H. G., Valenzano, D. R. The short-lived African turquoise killifish: an emerging experimental model for ageing. Dis Model Mech. 9 (2), 115-129 (2016).
- Blazek, R., et al. Repeated intraspecific divergence in life span and aging of African annual fishes along an aridity gradient. Evolution. 71 (2), 386-402 (2017).
- Terzibasi, E., et al. Large differences in aging phenotype between strains of the short-lived annual fish Nothobranchius furzeri. PLoS One. 3 (12), e3866 (2008).
- Kirschner, J., et al. Mapping of quantitative trait loci controlling lifespan in the short-lived fish Nothobranchius furzeri--a new vertebrate model for age research. Aging Cell. 11 (2), 252-261 (2012).
- Valenzano, D. R., et al. Mapping loci associated with tail color and sex determination in the short-lived fish Nothobranchius furzeri. Genetics. 183 (4), 1385-1395 (2009).
- Reichwald, K., et al. Insights into Sex Chromosome Evolution and Aging from the Genome of a Short-Lived Fish. Cell. 163 (6), 1527-1538 (2015).
- Valenzano, D. R., et al. The African Turquoise Killifish Genome Provides Insights into Evolution and Genetic Architecture of Lifespan. Cell. 163 (6), 1539-1554 (2015).
- Harel, I., et al. A platform for rapid exploration of aging and diseases in a naturally short-lived vertebrate. Cell. 160 (5), 1013-1026 (2015).
- Valenzano, D. R., Sharp, S., Brunet, A. Transposon-Mediated Transgenesis in the Short-Lived African Killifish Nothobranchius furzeri, a Vertebrate Model for Aging. G3. 1 (7), 531-538 (2011).
- Harel, I., Valenzano, D. R., Brunet, A. Efficient genome engineering approaches for the short-lived African turquoise killifish. Nat Protoc. 11 (10), 2010-2028 (2016).
- Polacik, M., Blazek, R., Reichard, M. Laboratory breeding of the short-lived annual killifish Nothobranchius furzeri. Nat Protoc. 11 (8), 1396-1413 (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon