Method Article
Um protocolo para laboratório habitação de turquesa Killifish (Nothobranchius furzeri)
Neste Artigo
Resumo
Habitação de laboratório de turquesa killies podem ser escalados para casa e eficientemente criar milhares de peixes individuais em um sistema de filtragem de água centralizado, empregando a mesma infraestrutura utilizada para instalações padrão do zebrafish. Aqui detalhamos uma lista de procedimentos padronizados que permitem a manutenção eficiente killies.
Resumo
O desenvolvimento de práticas de produção animal em laboratório não-modelo peixe utilizados para fins experimentais muito beneficiou a criação de peixes de referência sistemas modelo, tais como o zebrafish e medaka. Nos últimos anos, um peixe emergente – os killies turquesa (Nothobranchius furzeri) – tem sido adotado por um número crescente de grupos de pesquisa nos campos da biologia do envelhecimento e ecologia. Com uma extensão de vida em cativeiro de 4 a 8 meses, esta espécie é o enfase vertebrados criados em cativeiro e permite que a comunidade científica para teste – em um curto período de tempo – intervenções experimentais que podem levar a alterações da taxa de envelhecimento e a expectativa de vida. Dada a biologia exclusiva desta espécie, caracterizada por diapausa embrionária, maturação sexual explosiva, marcado dimorfismo sexual morfológico e comportamental - e sua expectativa de vida relativamente curta adulta - criação ad hoc , as práticas são em urgente demanda. Este protocolo relata um conjunto de medidas de criação de chave que permitem ideal killies turquesa cuidados de laboratório, permitindo que a comunidade científica adoptar esta espécie como um modelo animal de laboratório poderoso.
Introdução
Dada a sua curta duração e ciclo de vida rápido, killies turquesas estão crescendo rapidamente como um promissor novo organismo modelo em biologia1,2,3. Esta espécie é caracterizada por um ciclo de vida exclusivo para um teleósteos, consistindo de diapausa embrionária, rápida maturação sexual e uma duração prolongada pós-reprodutivo estágio4,5. Trabalhos recentes tem contribuído para elucidar a biologia desta espécie em cativeiro e no selvagem6,7. Turquesas killies vivem em corpos de água doce sazonal que se formam durante a estação chuvosa na savana africana em Zimbabwe e Moçambique. Durante a estação seca, embriões sobrevivem na lama seca na ausência de água em virtude de um estágio de vida resistente ao estresse chamado diapausa.
Mapas de genética desta espécie foram gerados8,9, e recentemente seu genoma foi sequenciado e montado10,11. Desenvolveram-se várias cepas de peixes do laboratório puras e transgênese e genoma edição via CRISPR/Cas9 tornaram-se disponíveis nesta espécie, de fato promover killies turquesa como um organismo de vertebrados modelo competitivo de laboratório 12,13,14.
Embora um protocolo do laboratório já tenha sido publicado por esta espécie de15, no presente protocolo, nós desenvolvemos uma lista abrangente das orientações do laboratório experimental que visam especificamente a estudos que investigam o envelhecimento e sobrevivência. O presente protocolo permite que pesquisadores já familiarizados com a criação do zebrafish e medaka tornar-se versado na criação de killifish turquesa através da adopção de um número mínimo de ajustes chaves. Ao mesmo tempo, este protocolo fornece pesquisadores sem experiência prévia em criação de peixes com as ferramentas essenciais para criar uma próspera colônia de killies turquesa.
Protocolo
Peixes são disparados a 28 ° C em um sistema de recirculação de água (ver parâmetros de água), com eliminação de água diária de 10-20%. Três tamanhos diferentes de tanque são recomendados: 0,8 L, 2,8 L e L. 9,5 Cada tanque recebe um fluxo constante de água de 2 mL/s.
1. reagentes preparação (não incluída em materiais)
Nota: Killies turquesa Africana (Nothobranchius furzeri) podem ser fornecidos de um estoque de laboratório estabelecidas. Os embriões de dessecação-resistente killies anuais podem ser enviados pelo correio. É fundamental enviar embriões na faixa de temperatura de 8-30 ° C.
- Prepare a solução de ácido húmico (incubação) pela dissolução de 1 g/L ácido húmico em sistema de água. Autoclave e loja a 4 ° C por até 10 semanas.
- Para a preparação de enriquecimento HUFA Artemia, adicione enriquecimento HUFA a artémia hatcher diariamente em uma concentração de 500 µ l/L da solução de artémia.
- Prepare a solução de azul de metileno dissolvendo-se 100 µ l/L da solução de azul de metileno em água sistema previamente autoclavados. Desde que o azul de metileno é sensível à luz, manter a solução em garrafas escuras, ou cobrir com papel alumínio. Loja em RT.
- Prepare a fibra de coco como um substrato sólido para a incubação de embriões. Como alternativa, use um papel de filtro (consulte a seção 1.5).
- Presoak fibra de coco com água destilada. Autoclave e loja a 4 ° C por até 5 semanas.
- No dia da transferência de embriões, prepare a placa de Petri com fibra de coco úmido.
- Encha um prato de Petri de 90-mm de diâmetro com fibra de coco sob uma coifa e ao lado de uma chama, para reduzir a contaminação por fungos e bactérias.
- Fibra de coco compacto para uma altura de 1 cm, com tecido estéril. Remova a maioria da umidade desde a fibra de coco pressionando um papel toalha em cima da placa, deixando o papel para absorver o excesso de água. Aqueça uma colher de metal sobre a chama e pressione para baixo sobre toda a superfície da fibra de coco. Isso evita a contaminação de fungos/bactérias de fibra de coco.
- Prepare o papel de filtro como um substrato sólido para a incubação de embriões.
- No dia da transferência de embriões, coloque 3 camadas de papel de filtro de discos que cabem o prato de Petri de 90 mm. Adicione 5 mL da solução de ácido húmico para manter a umidade.
2. criação de animais
-
Reprodução de killies turquesa para a manutenção da tensão
Nota: Na sequência deste protocolo, maturidade sexual é alcançada em ~ 4 semanas pós eclosão e fecundidade picos entre 7-9 semanas. É importante notar que a fecundidade depende de alimentação, frequência e qualidade dos alimentos; Portanto, pelo menos duas refeições por dia por tanque de reprodução são recomendadas para aumentar o rendimento de embriões (veja seção 5.6).- Instalação de um tanque de criação de 9,5 L. Encha com água do sistema e adicionar dois peixe fêmea e um macho.
- Como machos africanos turquesas killies exibir dominância durante o acasalamento, que pode levar ao assédio de fêmeas, escolha um macho com um tamanho de corpo ligeiramente menor do que a fêmea para reduzir o estresse de acasalamento e aumentar a saída reprodutiva. Configure a 5 semanas de idade machos com fêmeas de 6/7 semanas de idade.
- Encher um recipiente de plástico (10 x 10 x 5 cm) com areia esterilizada, atingindo uma profundidade final de ~ 2-3 cm e colocar a caixa de areia no centro do tanque de reprodução.
- Deixe turquesa killifish reproduzem continuamente e colheita de embriões uma vez por semana para a incubação de embriões.
Nota: O uso de substrato areia apresenta desafios para os sistemas de filtragem centralizado e deve ser substituído por métodos alternativos no futuro. Possíveis alternativas poderiam ser a utilização de tanques de criação de zebrafish.
-
Reprodução de transgênese
Nota: Embriões a ser usado para injeções precisam ser sincronizado a um-célula-fase, e isto exige que eles são recolhidos imediatamente após a fecundação.- Colher os embriões de uma célula etapas a ser usado para injeção e geração das linhas transgénicas, configure um tanque de criação com um macho e duas peixe feminino (mesmo que 2.1.).
- Dois dias antes da colheita de embriões, isolar o macho em um tanque individual e manter o macho em contato visual com as fêmeas adultas.
- No dia da coleta, adicionar o macho e uma caixa de areia para o aquário e deixá-los spawn para 2h.
3. embrião Husbandry
-
Colheita de embriões
Nota: Colheita de embriões é realizada por peneiramento e colheita de embriões da caixa de areia. Em condições normais, cada caixa de areia deve conter de 30 a 200 embriões.- No dia da coleta, remova a caixa de areia do tanque de reprodução. Esvaziar a caixa de areia em um coador (tamanho de estirpe ~0.9 mm) e enxágue com água do sistema. Isso pode ser feito ao longo de um grande tanque para coletar areia para esterilização em autoclave.
- Parcialmente submergir o filtro de água do sistema e agite suavemente, deixando os embriões para agrupar-se no centro.
- Colete embriões com uma pipeta Pasteur de 10 mL.
- Transferi os embriões para uma placa de Petri em ~ 40 mL de água do sistema de 90mm.
- Inspecione os embriões em placa de Petri sob um microscópio de luz e remover aqueles que apresentam ruptura córion e sinais de danos.
- Vá direto ao embrião branqueamento.
Nota: Use sempre um filtro por estirpe de peixe para evitar possíveis contaminações de embrião Cruz-tensão.
-
Embrião de branqueamento
Nota: Embrião branqueamento impede que microrganismos presentes em aquários de contaminar a mídia de incubação.- Antes do branqueamento, use uma pipeta Pasteur descartável para remover a água do sistema da caixa de Petri contendo embriões coletados.
- Para impedir o crescimento de fungo e bactérias indesejado, adicione 50 mL de preparada na hora H2O2 (1% v/v em água esterilizada sistema) para os embriões coletados.
- Agite os embriões por 5 min a baixa velocidade em pratos de Petri de 90 mm em 50 mL de solução.
- Remover a solução de H2O2 com a pipeta Pasteur descartável e lavar embriões por 5 min com 50 mL de solução de azul de metileno por três vezes. Remova a solução de azul de metileno.
- Adicionar 50 mL de H2O2 (1% v/v em água esterilizada sistema) para embriões e agitar durante 5 min.
- Remover a solução de H2O2 e lavar três vezes por 5 min com 50 mL de solução de azul de metileno.
- Incube os embriões a 28 ° C, para aumentar o desenvolvimento de embriões síncronas, com uma densidade máxima de 100 embriões por 90 mm placa de Petri em 40 mL de solução de azul de metileno.
Nota: Não se estendem incubação de embriões na solução de branqueamento. Isto pode causar danos ao córion ovo e aumentar a mortalidade de embriões. Branqueamento de embrião pode causar grandes mudanças físico-químicas no córion ovo que pode resultar na fisiologia do córion alterada e o sucesso da incubação.
-
Incubação de embriões em azul de metileno
Nota: Líquida incubação em solução de azul de metileno impede o crescimento do parasita e permite a detecção de ovos não fertilizados e embriões mortos.- Inspecione os embriões incubados, retirar o prato de Petri para evitar a contaminação bacteriana e fúngica que afetam a sobrevivência de embriões saudáveis ao vivo qualquer embriões mortos (manchados de azuis por azul de metileno).
- Remover a velha solução de azul de metileno e substituir com solução fresca.
- Retorno de Petri para incubadora de 28 ° C (figura 1A). Dentro de 7-10 dias, certifique-se de que os embriões desenvolvidos mostram visíveis olhos negros. Transferi estes embriões para a fibra de coco ou meio de substrato sólido de papel de filtro (figura 1B).
- Manter embriões subdesenvolvidos em azul de metileno, monitorar diariamente e transferir para o meio de substrato sólido, uma vez que desenvolveram olhos negros.
- Repita etapas 3.3.1-3.3.3 diariamente até os embriões têm visível de olhos negros.
Nota: A exposição constante de embriões de azul de metileno pode induzir mudanças de longo prazo em fisiologia de peixes adultos.
-
Transferência de embrião para o papel de filtro
Nota: Embriões killies turquesa podem desenvolver em um substrato seco, sintetizando as condições naturais. Além disso, incubação de embriões seca permite que pesquisadores sincronizar os embriões e chocar no mesmo dia.- Como embriões desenvolvidos terá visíveis olhos negros dentro de 7-10 dias, use uma pipeta Pasteur descartável ou pinças curvas bem para transferência de embriões a partir da solução de azul de metileno em um prato de papel de filtro previamente preparado.
- Espalhe embriões afastados de ~ 5 mm com pinças, até 100 embriões por placa de 90 mm (figura 1B).
- Selo da placa de Petri com parafilme.
- Incube os embriões a 28 ° C durante 2-3 semanas, até que eles desenvolveram plenamente as íris douradas e estão prontos para incubação (Figura 1).
Nota: Não prolonga a incubação de embriões de pronto-a-porta por mais de 2 semanas como sua viabilidade será drasticamente reduzida.
-
Transferência de embriões, a fibra de coco
Nota: Fibra de coco autoclavado, estéril (ou musgo de turfa orgânico) pode ser usado como um meio alternativo válido para a incubação de substrato sólido.- Use uma pipeta Pasteur descartável ou pinças curvas bem para transferência de embriões a partir da solução de azul de metileno em uma placa de fibra de coco de ready-to-use.
- Espalhe os embriões ~ 5mm separado, até 100 embriões por placa de 90 mm (figura 1B).
- Selo da placa de Petri com parafilme.
- Incube embriões a 28 ° C durante 2-3 semanas, até que eles desenvolveram plenamente íris douradas (por exemplo, na Figura 1).
Nota: Para armazenamento a longo prazo (até um ano), transferência de embriões na coleção de post de 3-dias de soluções de azul de metileno em uma chapa de substrato sólido a 17 ° C. Incube os embriões até desenvolvem olhos negros.
4. incubação Killifish turquesa
Nota: Embriões killies turquesa podem ser aquecidos com êxito em uma solução de ácido húmico14.
- Usando uma pinça curva bem, transferência cuidadosamente 50-100 desenvolvido embriões na caixa para incubação preenchida com a solução de ácido húmico a 4 ° C. A solução de ácido húmico consiste de 1 g/L ácido húmico na água do sistema. Autoclave e loja a 4 ° C por até 10 semanas. Certifique-se de que todos os embriões são completamente imerso. A solução de ácido húmico deve ser superficial, não mais que 2 cm.
Nota: Baixa temperatura da solução de ácido húmico melhora para incubação e imersão completa dos embriões na solução permite sincronizado para incubação. - Coloque a caixa de incubação para a incubadora de incubação de 28 ° C. Cubra a caixa com a tampa de incubação. Para fornecer aeração suficiente, ligar para incubação caixa pela tubagem com suprimento de ar.
Nota: Não é suficiente arejamento durante a incubação resulta em altas taxas de alevinos não é capazes de encher a bexiga de gás (fenótipo "barriga-slider", ver nota na secção 5.1) - A partir do dia após a eclosão, para manter a qualidade de água suficiente na caixa para incubação, adicione água esterilizada sistema uma vez por dia na proporção de 1:1, mantendo uma profundidade final de 2 cm.
- Transferência de embriões unhatched volta ao substrato sólido e tentativa para incubação de uma semana depois.
Nota: Após a eclosão, killies turquesas são facilmente capazes de absorção e consomem comida viva. Para o crescimento ideal, alimente frite duas vezes por dia com excesso artémia recém eclodidas (Artemia salina). O sinal de saciedade completa é as cor laranja abdomes de alevinos após 10-15 min de cada mamada. Sifão para fora a excesso, não consumidas e decomposta artémia usando uma pipeta Pasteur em uma base diária.
5. criação de peixes juvenis e adultos
- Cinco dias após a incubação, avançar juvenis para o sistema de recirculação de água. Juvenis de transferência cinco usando pipetas plásticas descartáveis (ou uma colher de plástico), cuidadosamente por 0,8 L tanque equipado com tela de fritar 400 µm (Figura 2).
Nota: É possível que uma porção de killies juvenil não ter preenchido a bexiga de gás, resultando em um fenótipo típico "barriga-slider", caracterizado por um peixe, não atingindo a flutuabilidade adequada, forçando-os a nadar continuamente, causando graves malformações em peixes adultos. Estes peixes não podem ser usados para ensaios de sobrevivência ou para reprodução eficiente e precisam ser censurado. - Juvenis ração duas vezes por dia com artémia recém eclodidos em excesso até 14 dias após a eclosão. Sifão para fora os detritos do fundo de cada tanque diariamente.
- Com 14 dias de idade, transferência juvenis para 2,8 L tanque equipado com uma tela de fritar 850 µm. A partir deste momento, rotule cada tanque com peixes ID, indicando a data de escotilha, informações de tensão, gênero de peixe e número de identificação de peixes (Figura 3). Para os ensaios de sobrevivência, casa individualmente cada peixe em tanques único a partir deste momento.
- Para os 7 dias seguintes, alimente os juvenis duas vezes por dia com ~ 2 mL de artémia por peixe. Nesta fase o peixe pode ser suplementada com minhocas de sangue vivo de 1-3 (no caso das larvas de vermes de sangue são grandes demais para os peixes, pique-os em pequenos pedaços com uma lâmina de barbear). Para evitar a deterioração da qualidade da água, sifão para fora restos de comida e resíduos adicionais, duas vezes por semana.
- Após 3 semanas de incubação, remove a tela de fritar na parte de trás do tanque e começam a alimentar cada peixe duas vezes por dia ~ 2mL de artémia e 0,5 mL de minhoca de sangue. Nesta fase, juvenis devem ter chegado a 1 cm de tamanho corporal e devem ser capazes de ingerir o verme de sangue em tamanho real.
- Em 4 semanas de idade, alimente cada peixe duas vezes por dia com ~ 2mL de artémia e 1 mL de minhoca de sangue. As fêmeas podem ser alojadas co em uma densidade de até 3 fêmeas por tanque 2,8 L.
- Nesta fase certifique-se de que o peixe atingir completa maturação sexual. Verificar a presença de grandes barbatanas dorsais, Anais e caudais com sinais de coloração nos machos e redonda abdomes cheias de ovos nas fêmeas.
Nota: Criar peixes adultos em tanques individuais para estudos de coorte de sobrevivência pode afetar negativamente saúde e comportamento dos peixes. No entanto, Alojamento em grupo para estudos de coorte de sobrevivência adiciona fatores de confundimento significativos devido ao estabelecimento de dominância social e territórios masculinos, levando a rígidas hierarquias sociais.
6. alimentação
Nota: Killies laboratório turquesa podem ser alimentado a uma combinação de artémia (náuplios deArtemia salina ) e minhoca de sangue (larvas deChironomus spp. ). Frite killies turquesa é alimentados exclusivamente a artémia. Peixes juvenis e adultos são alimentados duas vezes por dia tanto artémia como minhoca de sangue (Figura 2). Idealmente, peixes podem ser alimentados várias vezes ao dia, excedendo as 2 alimentações indicado no presente protocolo.
-
Cultivo de camarão de água salgada
- Adicionar 10 L de água de osmose reversa (RO) e 350 g de sal de mar vermelho para um hatcher artémia e dissolver por aeração com um tubo de aeração.
- Enriquece a cultura com 5 mL de ácidos graxos altamente insaturados (HUFA).
- Adicione 20 g de cistos de artêmias para a solução de incubação. Inspecione que cistos de artêmias não flutuam na superfície da água e assegurar a adequada oxigenação e circulação da cultura.
Nota: Alíquotas diárias de cistos de artêmias secas podem ser armazenadas a 4 ° C. - Na tarde do dia seguinte, fornecemos a cultura com outra alíquota de 5 mL de HUFA.
-
Colheita de artémia hachurada
Nota: Após ~ 36 h da cultura inicial, artémia estão prontopara para a colheita (fase II de ínstar).- Coletar 5 L da cultura em um recipiente usando a torneira na parte inferior do hatcher e deixe descansar por 10 min.
- Depois de 10 min, remover os escudos de artémia (cor marrom) da parte superior do recipiente de 5 L e filtrar a hachurado artémia (cor laranja), através de uma malha. Preste atenção para excluir os sedimentos encontrados no fundo do recipiente que contém ovos não eclodidos e artémia morta.
- Enxágue hachurada artémia com água do RO em um recipiente de 2 L e deixe descansar por 10 min.
- Depois de 10 min, filtrar artémia novamente através de uma malha e recolher em 2 L de água do RO.
- Repita os três passos anteriores até solução de artémia é livre de conchas de cistos e artêmias não-nascidos.
- Transferi artémia do recipiente 2 L em garrafas de aperto para a alimentação.
Nota: Cultivo de camarão de água salgada é bastante robusto e confiável. No entanto, para evitar a escassez de artémia no caso de incubação malsucedida, nascedouros de backup menores (500 mL) podem ser usados.
-
Configurando o backup hatcher
- Dissolva a 17,5 g de sal de mar vermelho em 500 mL de água do RO por aeração.
- Enriquece a cultura com 500 µ l de HUFA.
- Adicione 2 g de cistos de artêmias.
- Após 18-24 h, fornece a cultura mais uma vez com 500 µ l de HUFA.
Nota: a artémia estão prontos para colheita após ~ 24 h.
-
Preparação de verme de sangue vivo
- Imediatamente antes da alimentação, filtre uma quantidade adequada de verme de sangue através de um filtro usando água do RO.
Nota: A minhoca de sangue vivo pode ser armazenada a 4 ° C por 7-10 dias. - Enxágue o verme de sangue, com uma pequena quantidade de água do RO em um recipiente plástico.
- Com uma plástica Pasteur pipeta (ponta estreita removida), pegar a mistura de verme de sangue para a alimentação.
Nota: Alimentar killies laboratório colônias com alimento vivo de fontes não-controladas acrescenta um risco de contaminações externas de comunidades microbianas potencialmente patogênicas e parasitas. No futuro, um alimento para peixes estéril ad hoc deve ser desenvolvido.
- Imediatamente antes da alimentação, filtre uma quantidade adequada de verme de sangue através de um filtro usando água do RO.
7. killifish laboratório cepa genotipagem
Nota: Para distinguir entre cepas de killies turquesa, bem como para determinar o sexo dentro de cada estirpe, marcadores genéticos específicos (microssatélites) podem ser usado9 (tabela 1).
-
Amostragem
- Segure o peixe com segurança em uma rede no topo esponja molhada.
- Amostra 2-3 escalas de corpo peixe desde o opérculo até a nadadeira caudal, usando cotonetes.
- Escolher as escalas da zaragatoa e transferir escalas de 2-3 em um tubo de 1 mL contendo solução de NaOH (200 µ l 0,5 mol/L de NaOH, polivinil pirrolidona 0,5% e 1% de β-Mercaptoetanol).
- Girar os tubos PCR por 15 s para certificar-se que escalas são completamente imersa na solução de NaOH.
-
Isolamento de DNA genômico
- Incubar a amostra por 20 min a 95 ° C.
- Cool na RT, neutralizar a amostra com volume de 1/10 de 1 M Tris-HCl, pH 8,0.
- Centrifugar a amostra por 5 min na velocidade máxima.
8. parâmetros de água
Nota: A criação de organismos cuja utilização é adulta fenotipagem requer condições de maneio altamente estável durante todo o período de vida da espécie-alvo. Portanto, cultivo de organismos de água, tais como turquesa killies, exige controle rigoroso dos parâmetros de água. Recirculação de água, com quatro-etapas adicionais de filtração de água, garante uma base robusta para alcançar o controle sobre os parâmetros da água, fornecendo todos os tanques com as mesmas condições de água ao longo do tempo. Recomenda-se reconstituir a água do sistema de água de osmose reversa (RO), adicionada com sal marinho comercial e bicarbonato de sódio.
- Esquema de sistema de circulação de água: em primeiro lugar, águas residuais de peixe tanques fluxos através de filtro de metal de partículas sólidas que capta todos os restos de comida un-comido e partículas maiores. Filtros metálicos são lavados três vezes por semana; Em segundo lugar, após a primeira filtragem mecânica, água é veiculada em grandes depósitos e então bombeada para um Biofiltro, onde as bactérias convertem amónia, nitritos e nitratos; Em terceiro lugar, partir o Biofiltro, a água é bombeada para as mangas do filtro 25 µm, que armadilha mais finas partículas de tamanho. Finalmente, a água flui através de lâmpadas ultravioleta (UV) para que esterilizar água de bactérias e vírus. Depois destas quatro etapas, a água filtrada retorna para os tanques de peixes.
- Para reduzir o crescimento de microorganismos em tanques, evitar a acumulação de nitratos e reduzir globalmente salinidade, 10-20% da água do sistema é descartada em uma base diária.
- Manter constante de temperatura de água a 28 ° C, constante de pH de água dentro do intervalo de 7,0 a 7,5.
- Embora killies toleram uma ampla gama de salinidade, para evitar oodinosis, manter condutividade dentro da gama 650-710 micro-Siemens. Um ciclo de luz/escuro de 12 h anos garante produtividade e saúde da colônia.
Nota: Killifish pode tolerar a condutividade de água até 1500 micro-Siemens.
Resultados
Criação adequada de turquesa killies resulta na sobrevida média variando entre 12-18 semanas na estirpe GRZ (por exemplo, Figura 4A). Variações de sobrevida mediana dependem de dieta, frequência de alimentação e as condições de temperatura de alojamento. Resultados de criação pobre em curvas de sobrevivência apresentando aumentaram a mortalidade precoce e repetitivas, súbitas gotas de sobrevivência ao longo do tempo, caracteriza-se por vários pontos de inflexão (Figura 4B).

Figura 1: estádios de desenvolvimento embrionários representativos com substrato de incubação respectivos. (A) recém coletados embriões, incubados em solução de azul de metileno na incubadora a 28 ° C. (B) pronto para ser transferido para um meio sólido, embriões também filtro de fibra de papel ou coco. (C) embriões pronto para ser chocado, exibindo o típicas íris douradas. Barra de escala é igual a 1 mm. clique aqui para ver uma versão maior desta figura.
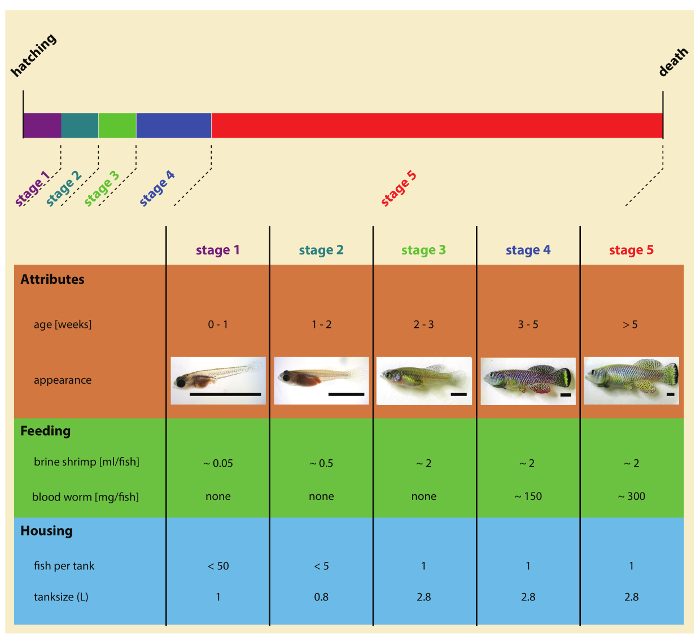
Figura 2: estágios de turquesa killies pós-incubação desenvolvimento. Clique aqui para ver uma versão maior desta figura.
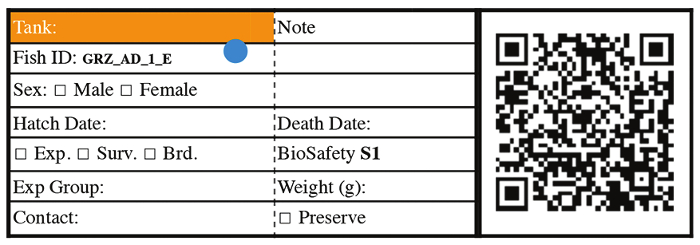
Figura 3: etiqueta de identificação representativa de peixe para peixe de fase 3 em diante. Clique aqui para ver uma versão maior desta figura.
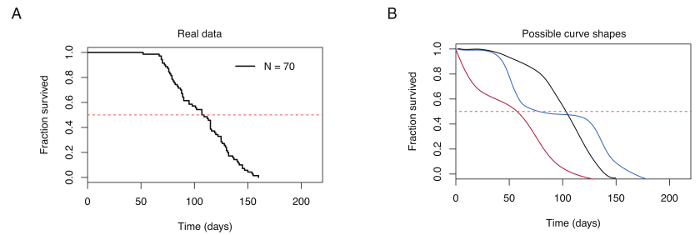
Figura 4: curva representativa de sobrevivência para 70 masculinos turquesas killies. (A) curva de sobrevivência típico para laboratório-gerado turquesa killies. (B) comparação de curvas de sobrevivência obtidos de peixes criados sob condições ideais de criação (preto) e pecuária pobre (vermelho e azul). Linha horizontal tracejada vermelha indica 50% de sobrevivência, curva de sobrevivência se cruzam no tempo de vida médio (indicado no eixo x). Clique aqui para ver uma versão maior desta figura.
| ID | Cartilha para a frente | Primeira demão reversa | Faixa de tamanho (bp) | ||
| * NfuSU0007 | GGCTAAGCCTTGCTGACAGA | CAGGGAGCTGAAAACCTCAG | 166 - 214 | ||
| * NfuSU0010 | CGCAGTCTGATCAAATCGTGT | TGTTTGAAGGTTCACATTCATTATC | 220 - 272 | ||
| NfuSU0016 | CATGGCTAAACCGTGATGAA | GAAGGACGCCAGCTATGAAG | 209 - 240 | ||
| NfuSU0022 | AACACAGCTCTCGTAAGGAGGTA | TTCAGACTTGTCTTACTACCATGTTT | 198 - 238 | ||
| NfuSU0027 | TCCAGCTGAATCGGTAATGA | AAACTCGAGGGTGCAATCTG | 164 - 226 | ||
| NfuSU0049 | CTGGACAAAGTGCCAATCAC | CTCCCACAGTCCCAAAACAT | 196 - 197 | ||
| NfuSU0050 | CCAGAATGAACAATACTCAGATCAA | GCAGCTTAGTTTAATGATATCACAATG | 252 - 295 | ||
| NfuSU0060 | CTAGCCACTCCCCTGGTTTA | CCGTCACGATGTGCTGATAC | 216 - 248 | ||
| NfuFLI0030 | CAGAAGCTAAAGGCCAGACG | GGGAAACAATAGGGAACCAC | 174 - 205 | ||
| * NfuFLI0091 | ACGCTGACTCTACCCAGTC | CTGCCTGCTACTGACAATG | 355 - 373 | ||
| * - marcadores de determinação do sexo | |||||
Tabela 1: Primers de genotipagem para identificação da estirpe.
Discussão
Descreveremos um protocolo para laboratório de cultivo de killies turquesa, incluindo a colheita de embriões, incubação, bem como a carcaça de peixes adultos, reprodução e alimentação. Nosso protocolo destina-se especificamente aos laboratórios que realizam pesquisas focadas em peixes adultos, em particular em estudos experimentais sobre envelhecimento e vida útil. Killies turquesa podem ser gerado em uma instalação padrão do zebrafish; no entanto, aspectos importantes da criação de killifish diferem dos cuidados de zebrafish padrão16. Essas adaptações incluem transição precoce de uma dieta só de artémia para uma dieta suplementada com verme de sangue rico em proteínas, bem como as etapas específicas na incubação de embriões, consistindo de uma fase de incubação líquidas e secas.
Passos críticos dentro do protocolo incluem transporte de embriões na faixa de temperatura de 8-30 ° C. Em caso de reprodução, fecundidade depende da alimentação, frequência e qualidade dos alimentos; Portanto, recomendamos pelo menos duas refeições por dia por reprodução tanque para aumentar o rendimento de embriões (ver secção 5.6.). Durante o clareamento de embrião, não se estendem incubação de embriões na solução de branqueamento. Isso pode causar danos ao córion ovo e embrião maior mortalidade. Quando incubando embriões com azul de metileno, não prolonga a incubação de embriões de pronto-a-porta por mais de 2 semanas como sua viabilidade será drasticamente reduzida. Para incubação killies turquesa, baixa temperatura da solução de ácido húmico melhora para incubação e imersão completa dos embriões na solução permite sincronizado para incubação. Não é suficiente arejamento durante os resultados de incubação em altas taxas de alevinos não é capazes de encher a bexiga de gás (fenótipo "barriga-slider", ver notas na secção 5.1).
Limitação do protocolo para reprodução inclui o uso do substrato areia quais desafios de poses para centralizada de sistemas de filtragem e devem ser substituídos por métodos alternativos no futuro. Possíveis alternativas poderiam ser a utilização de tanques de criação de zebrafish. Branqueamento de embrião pode causar grandes mudanças físico-químicas no córion ovo que pode resultar na fisiologia do córion alterada e o sucesso da incubação. Constante exposição dos embriões ao azul de metileno pode induzir mudanças de longo prazo em fisiologia de peixes adultos. Criar peixes adultos em tanques individuais para estudos de coorte de sobrevivência pode afetar negativamente saúde e comportamento dos peixes. No entanto, Alojamento em grupo para estudos de coorte de sobrevivência adiciona fatores de confundimento significativos devido ao estabelecimento de dominância social e territórios masculinos, levando a rígidas hierarquias sociais. Portanto, julgamos que o isolamento de peixe masculino para estudos de sobrevivência é um compromisso razoável. Colônias de killies laboratório alimentação com alimento vivo de fontes não-controlados adicionar um risco de contaminações externas de comunidades microbianas potencialmente patogênicas e parasitas. No futuro, um alimento para peixes estéril ad hoc deve ser desenvolvido.
Futuras melhorias para este protocolo incidirá sobre uma dieta controlada, não-vivo, que ainda leva para completar a maturação sexual dentro de 3-4 semanas. Em resumo, nosso protocolo oferece acessibilidade para turquesa killies laboratório de cultivo de uma comunidade científica ampla.
Divulgações
Todos os autores declaram não concorrentes interesses financeiros e não financeiros.
Agradecimentos
Agradecemos Alessandro Cellerino, Tyrone Genade, Anne Brunet, Sabrina Sharp, Mickie Powell, Simone Keil, Yumi Kim, Patrick Smith, Kai Mathar e todos os membros do laboratório Valenzano no Instituto Max Planck de biologia do envelhecimento contribuem para diferentes aspectos o protocolo de criação de killifish actual ao longo dos anos.
Materiais
| Name | Company | Catalog Number | Comments |
| Probe calibration buffer solution pH=7.0 | Roth | A518.1 | 1L buffer solution pH=7.0 to calibrate water system pH-electrode |
| Probe calibration buffer solution pH=4.0 | Roth | P712.1 | 1L buffer solution pH=4.0 to calibrate water system pH-electrode |
| Conductivity standard | VWR | 83607.260 | 500 mL Conductivity standard 1,413 uS/cm to calibrate water system conductivity-electrode |
| Easy Strips Test 6in1 | JBL | 2533900 | Test strips for determination chlorine values of system water |
| Ammonia Test | JBL | 2536500 | Test to determine ammonia content of system water |
| Red Sea Salt | Red Sea | 22 kg bucket | |
| Sodium hydrogen carbonate | VWR | 27780.360 | |
| Humic acid | Sigma- Aldrich | 53680-50G | |
| New HUFA Artemia enrichment | ZM Systems UK | 75g bottle | |
| Methylene blue | Roth | AE64.1 | |
| Hydrogen peroxide solution | Sigma- Aldrich | 31642-1L | 30% (w/w) |
| Coconut fiber | Dragon | ZCS010 | |
| Whatman paper | GE healthcare | 3030-690 | |
| Ethanol pure | VWR | 20821.467 | 100% |
| Silica sand | local pet shop | ||
| Artemia Eggs Premium Grade | Sanders | ||
| Bloodworm | local distributor | Poseidon Aquakultur Germany | |
| dNTPs solution mix | Biolabs | N04472 | 10mM |
| Taq DNA polymerase | Invitrogen | 18038-042 | 5U/uL |
| PCR 10x Buffer | Invitrogen | 18038-042 | |
| MgCl2 | Invitrogen | 18038-042 | 50mM |
| NaOH | Sigma- Aldrich | S8045-500g | 50mM |
| Tris-HCl, pH=8.0 solution | Sigma- Aldrich | T2694-1L | 1M |
| HCl 37% | Sigma- Aldrich | H1758-500mL | |
| Fish tanks | Aquaneering | volume: 0.8L, 2.8L, 9.5L; equipped with baffles, fry mesh and lids | |
| Orbital shaker | VWR | 89032-100 | model 5000 |
| Microbiological incubator | Thermo Scientific, Heratherm | 50125882 | model IMC18; for storage embryos in the liquid phase, set to t=27-28°C |
| Cooling Incubator | Binder | 9020-0209 | model KT115; for storage embryos in the solid phase, set to t=27-28°C |
| Hatching incubator | Thermo Scientific, Heratherm | 51028114 | model OGS180; for embryos hatching, set to t=27-28°C |
| Stereomicroscope | Leica | model M80 | |
| Breeding sand/hatching boxes | Roth | 1598.1 | 1000mL |
| Petri dish | Sarstedt | 82.1473 | 92x16mm |
| 50 mL Conical tube | Sarstedt | 62.547.254 | |
| 15 mL Conical tube | Sarstedt | 62.554.002 | |
| Disposable Plastic Pasteur pipette | Roth | EA71.1 | 2mL; For fish feeding with bloodworms, or embryos selection cut off the tip to open 3-4mm diameter |
| Serological pipette | Sarstedt | 86.1689.001 | 50mL |
| Syringe | Henke Sass Wolf | 4100-000V0 | 10mL |
| Metal strainer | fineness <1mm; for embryos collection | ||
| Tweezers | Dumont | 0508-5/45-PO | type5/45; for embryos transfer |
| 25 L Brine shrimp hatcher | Aquaneering | ZHBS25 | main hatcher |
| 500 mL Brine shrimp hatcher | JBL | 6106100 | model Artemio 1; backup hatcher |
| Narrow-mesh fish nets | JBL | ||
| Sand beaker | VWR | BURK7102-5000 | 5000mL |
| Brine shrimp separation beaker | VWR | BURK7102-2000 | 2000mL |
| Plastic zipper bag | Roth | P279.2 | for dead fish storage |
| Pipetboy | Integra | 155000 | model Pipetboy acu2 |
| Parafilm | P-Lab | P701605 | |
| Air tubing | www.zajac.de | AQ380 | 4-6 mm diameter |
| 1 L Glass bottle | VWR | 215-1595 | |
| 2 L Glass bottle | VWR | 215-1596 | |
| 500 mL Squeeze bottle | Roth | K665.1 | for fish feeding with brine shrimp |
| 120-μm brine shrimp strainer | Florida Aqua Farms | BB-PC2 | for brine shrimp/bloodworm collection |
| Finish filter socks | Aquaneering | MFVB025C | 25-μm |
| Central filtration fish housing system | Aquaneering, Techniplast, Aquatic Habitats, Aqua Schwarz |
Referências
- Valenzano, D. R., Aboobaker, A., Seluanov, A., Gorbunova, V. Non-canonical aging model systems and why we need them. EMBO J. 36 (8), 959-963 (2017).
- Harel, I., Brunet, A. The African Turquoise Killifish: A Model for Exploring Vertebrate Aging and Diseases in the Fast Lane. Cold Spring Harb Symp Quant Biol. 80, 275-279 (2015).
- Smith, P., et al. Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. Elife. 6, (2017).
- Cellerino, A., Valenzano, D. R., Reichard, M. From the bush to the bench: the annual Nothobranchius fishes as a new model system in biology. Biol Rev Camb Philos Soc. 91 (2), 511-533 (2016).
- Kim, Y., Nam, H. G., Valenzano, D. R. The short-lived African turquoise killifish: an emerging experimental model for ageing. Dis Model Mech. 9 (2), 115-129 (2016).
- Blazek, R., et al. Repeated intraspecific divergence in life span and aging of African annual fishes along an aridity gradient. Evolution. 71 (2), 386-402 (2017).
- Terzibasi, E., et al. Large differences in aging phenotype between strains of the short-lived annual fish Nothobranchius furzeri. PLoS One. 3 (12), e3866 (2008).
- Kirschner, J., et al. Mapping of quantitative trait loci controlling lifespan in the short-lived fish Nothobranchius furzeri--a new vertebrate model for age research. Aging Cell. 11 (2), 252-261 (2012).
- Valenzano, D. R., et al. Mapping loci associated with tail color and sex determination in the short-lived fish Nothobranchius furzeri. Genetics. 183 (4), 1385-1395 (2009).
- Reichwald, K., et al. Insights into Sex Chromosome Evolution and Aging from the Genome of a Short-Lived Fish. Cell. 163 (6), 1527-1538 (2015).
- Valenzano, D. R., et al. The African Turquoise Killifish Genome Provides Insights into Evolution and Genetic Architecture of Lifespan. Cell. 163 (6), 1539-1554 (2015).
- Harel, I., et al. A platform for rapid exploration of aging and diseases in a naturally short-lived vertebrate. Cell. 160 (5), 1013-1026 (2015).
- Valenzano, D. R., Sharp, S., Brunet, A. Transposon-Mediated Transgenesis in the Short-Lived African Killifish Nothobranchius furzeri, a Vertebrate Model for Aging. G3. 1 (7), 531-538 (2011).
- Harel, I., Valenzano, D. R., Brunet, A. Efficient genome engineering approaches for the short-lived African turquoise killifish. Nat Protoc. 11 (10), 2010-2028 (2016).
- Polacik, M., Blazek, R., Reichard, M. Laboratory breeding of the short-lived annual killifish Nothobranchius furzeri. Nat Protoc. 11 (8), 1396-1413 (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados