Method Article
Протокол для лабораторных жилья из бирюзы Пецилиевые рыбы (Nothobranchius furzeri)
В этой статье
Резюме
Лаборатория корпус из бирюзы, которую Пецилиевые рыбы может масштабироваться до дома и эффективно поднять тысячи отдельных рыб в централизованной воды система фильтрации, используя ту же инфраструктуру, используемые для стандартных данио рерио зал. Здесь мы подробно список стандартизированных процедур, которые позволяют эффективно Пецилиевые рыбы обслуживания.
Аннотация
Развитие практики земледелия в лаборатории-модель рыб, используемых для экспериментальных целей извлекла большую пользу из создания ссылок рыбы модели систем, таких как данио рерио и оризии. В последние годы возникающих рыбы – бирюзовый Пецилиевые рыбы (Nothobranchius furzeri) – была принята растущее количество исследовательских групп в областях биологии старения и экологии. С неволе продолжительность жизни 4-8 месяцев этот вид shortest-lived позвоночных, поднятые в неволе и позволяет научное сообщество теста – в короткое время – экспериментальных мероприятий, которые могут привести к изменению скорости старения и продолжительность жизни. Учитывая уникальный биологии этого вида, характеризуется Эмбриональная диапауза, взрывных полового созревания, отмеченные морфологических и поведенческих половой диморфизм - и их сравнительно короткий взрослой жизни - ad hoc земледелия практики находятся в срочных спроса. Этот протокол сообщает набор ключевых животноводства мер, которые позволяют оптимальное бирюзовый Пецилиевые рыбы уход лаборатории, позволяя научное сообщество принять этот вид как модель мощного лабораторных животных.
Введение
Учитывая короткий промежуток жизни и быстрого жизненного цикла, бирюзовый Пецилиевые рыбы быстро растут как многообещающие новые модели организм в биологии1,2,3. Этот вид характеризуется уникальным жизненного цикла для костистых, состоящий из Эмбриональная диапауза, быстрого полового созревания и продлила жизнь продуктивного этапа4,5. Недавняя работа способствовала изучение биологии этого вида, как в неволе, так и в диких6,7. Бирюзовый Пецилиевые рыбы живут в сезонных пресноводных водоемах формы во время сезона дождей в Африканской Саванны в Зимбабве и Мозамбике. Во время сухого сезона эмбрионы выжить в сухой грязи в отсутствие воды силу стресс устойчивостью жизни этап, называемый диапаузу.
Генетические карты для этого вида были созданные8,9, и недавно их геном была последовательной и собран в10,11. Были разработаны несколько инбредных лаборатории рыбы штаммов, и трансгенез и геном редактирования через ТРИФОСФАТЫ/Cas9 стали доступны в этот вид, де-факто содействие бирюзовый Пецилиевые рыбы как конкурентоспособной Лаборатория позвоночных модельный организм 12,,1314.
Хотя протокол лабораторных уже опубликован для этого вида15, в настоящем протоколе мы разрабатываем полный перечень руководящих принципов экспериментальной лаборатории, которые специально направлены на исследования, которые расследуют старения и выживания. Настоящий Протокол позволяет исследователям уже знакомы с данио рерио и оризии стать разбираются в животноводстве бирюзовый Пецилиевые рыбы, приняв минимальное количество основных корректировок. В то же время этот протокол обеспечивает исследователей без предварительного опыта в животноводстве рыбы с необходимыми инструментами для повышения процветающей колонии бирюзовый Пецилиевые рыбы.
протокол
Рыбы поднимаются на 28 ° C в системе рециркуляции воды (см. параметры воды), с 10-20% ежедневно водоотведения. Рекомендуется использовать три различных танк размеры: 0,8 Л, 2.8 L и 9,5 л Каждый танк получает постоянный воды 2 мл/сек.
1. реагенты подготовка (не включены в материалы)
Примечание: Африканский бирюзовый Пецилиевые рыбы (Nothobranchius furzeri) может предоставляться из установленных лабораторных запасов. Ежегодный Пецилиевые рыбы сушки устойчивые эмбрионы могут быть отправлены по почте. Важно, чтобы корабль эмбрионов в диапазоне температур 8-30 ° C.
- Готовят раствор гуминовых кислот (штриховка), растворяя гуминовые кислоты 1 г/Л в системе воды. Автоклавы и хранить при 4 ° C до 10 недель.
- Для приготовления HUFA Artemia обогащения, добавьте HUFA обогащения артемии Хэтчер ежедневно в концентрации 500 мкл/Л раствора артемии.
- Готовят раствор метиленового синего, растворяя 100 мкл/Л Стоковый раствор метиленового синего в воде ранее газобетона системы. Так как метиленовый синий свет чувствительных, сохранить решение в темных бутылках, или накрыть фольгой. Магазин на RT.
- Подготовьте кокосового волокна как твердый субстрат для инкубации зародыш. Альтернативно используйте фильтр бумага (см. раздел 1.5).
- Замачивают кокосовое волокно с дистиллированной водой. Автоклавы и хранить при 4 ° C на срок до 5 недель.
- В день передачи эмбриона Подготовьте чашку Петри с влажной кокосового волокна.
- Заполните диаметром 90-мм Петри с кокосовое волокно под зонт и рядом с пламя, чтобы уменьшить загрязнение, дрожжей и бактерий.
- Компактная кокосовое волокно на высоту до 1 см, стерильной салфеткой. Удалите большую часть влаги из кокосового волокна, нажав бумажное полотенце поверх плиты, позволяя бумаги, чтобы поглотить излишки воды. Тепла металлической ложкой над пламенем и нажмите вниз на всей поверхности кокосового волокна. Это предотвращает кокосового волокна грибковых/бактериального загрязнения.
- Подготовьте документ фильтр как твердый субстрат для инкубации зародыш.
- В день передачи эмбрионов место 3 слоя фильтровальной бумаги дисков, которые соответствуют Петри 90 мм. Добавьте 5 мл раствора гуминовые кислоты сохранить влажность.
2. Разведение
-
Разведение бирюзовый Пецилиевые рыбы для обслуживания штамм
Примечание: После этого протокола, половая зрелость достигается в ~ 4 недель после вылупления и плодовитость пиков между 7-9 недель. Важно отметить, что плодовитость зависит от питания Частота и качество продуктов питания; Таким образом по крайней мере два кормления на разведение танк в день рекомендуется для повышения доходности эмбрионов (см. раздел 5.6.)- Установки размножения танк 9,5 Л. Заполнение системы водой и добавьте один мужчина и две девушки рыбы.
- Как мужчины африканского бирюзовый Пецилиевые рыбы отображения доминирование во время спаривания, которые могли бы привести к притеснения женщин, выберите мужчина с размером чуть меньше тела чем самка уменьшить спаривания стресс и увеличить репродуктивного вывода. Настройка 5-недельных самцов с 6/7-недельных самок.
- Заполнить пластиковый контейнер (10 x 10 x 5 см) с газобетона песком, достижения окончательного глубина ~ 2-3 см и коробка песка в центре размножения танка.
- Пусть бирюза Пецилиевые рыбы породы непрерывно и урожай эмбрионов для инкубации зародыш раз в неделю.
Примечание: Использование песка субстрата создает проблемы для систем централизованного фильтрации и должны быть заменены альтернативными методами в будущем. Возможных вариантов может быть использование данио рерио Животноводство танков.
-
Разведение для трансгенез
Примечание: Эмбрионов для инъекции должны быть синхронизированы на стадии одной ячейки, и это требует, что они собираются, сразу же после оплодотворения.- Чтобы урожай одномоментная клеток эмбрионов для инъекций и создания трансгенных линий, установите разведения танк с один мужчина и две женщины рыбы (так же, как 2.1.).
- За два дня до коллекции эмбриона, изолировать мужчин в отдельные емкости и держать мужчин в визуальный контакт с взрослых самок.
- В день сбора добавить мужчин и коробка песка бак размножения и пусть они икру 2 h.
3. эмбриона животноводства
-
Эмбрион коллекция
Примечание: Эмбриона коллекции выполняется путем просеивания и уборки эмбрионов от коробка песка. При нормальных условиях каждая коробка песка должен содержать от 30 до 200 эмбрионов.- В день сбора удалите коробка песка из резервуара для размножения. Очистить поле песка в сито (штамм размером ~0.9 мм) и промойте водой системы. Это можно сделать через большой резервуар для сбора песок для автоклавирования.
- Частично погружайте фильтр в системе воды и вихревой мягко, позволяя эмбрионов в группу вместе, в центре.
- Собирайте эмбрионов с 10 мл пипетка Пастера.
- Трансфер эмбрионов до 90 мм Петри в ~ 40 мл воды системы.
- Осмотрите эмбрионов в Петри под стереомикроскопом света и удалить эти представления разрыва хориона и признаки повреждения.
- Перейти непосредственно к отбеливанию эмбриона.
Примечание: Всегда используйте один фильтр на штамм рыбы с целью предотвращения потенциальных загрязнений кросс штамм эмбриона.
-
Эмбрион отбеливания
Примечание: Эмбриона отбеливания предотвращает микроорганизмов, присутствующих в баках рыб от загрязняющих инкубации СМИ.- До отбеливания, используйте одноразовые пипетки Пастера для удаления системы воды из Петри, содержащий собранные эмбрионов.
- Чтобы предотвратить нежелательные грибковых и бактериальных роста, добавьте 50 мл свежеприготовленные H2O2 (1% v/v в воде газобетона системы) собранных эмбрионов.
- Встряхните эмбрионов за 5 мин на низкой скорости в Петри 90 мм в 50 мл раствора.
- Удаление H2O2 решения с одноразовой пипетки Пастера и мыть эмбрионов три раза за 5 мин с 50 мл раствора метиленового синего. Удалите раствор метиленового синего.
- Добавьте 50 мл (1% v/v в воде газобетона системы) H2O2 эмбрионов и трясти за 5 мин.
- Удаление H2O2 решения и стирать три раза за 5 мин с 50 мл раствора метиленового синего.
- Инкубируйте эмбрионов на 28 ° C для увеличения синхронный эмбрионов развития, при максимальной плотности 100 эмбрионов за 90 мм Петри в 40 мл раствора метиленового синего.
Примечание: Не распространяются инкубации зародыш в отбеливающий раствор. Это может привести к повреждению яйцо хориона и увеличения смертности эмбрионов. Эмбрион отбеливание может вызвать основных физико химических изменений в яйцо Хорио, которая может привести к измененным Хорион физиологии и инкубационные успех.
-
Инкубации зародыш в Метиленовый синий
Примечание: Жидкость инкубации в раствор метиленового синего предотвращает рост паразита и позволяет обнаружение мертвых зародышей и неоплодотворенных яиц.- Осмотрите инкубирован эмбрионов, удаление любых мертвых эмбрионов (запятнана синий Метиленовый синий) из Петри блюдо, чтобы предотвратить грибковые и бактериальные загрязнения, которые влияют на выживание живых здоровых эмбрионов.
- Удалите старый раствор метиленового синего и заменить свежий раствор.
- Возвращение Петри в инкубатор 28 ° C (рис. 1A). В течение 7-10 дней убедитесь, что развитых эмбрионов Показать видны черные глаза. Передача этих эмбрионов кокосового волокна или твердый субстрат средний фильтр-бумаги (рис. 1B).
- Сохранить неразвитой эмбрионов в метиленовым синим, ежедневно контролировать и передать средне твердый субстрат, когда черные глаза разработали.
- Повторите шаги 3.3.1-3.3.3 ежедневно эмбрионы были видны черные глаза.
Примечание: Постоянное воздействие эмбрионов Метиленовый синий может вызывать долгосрочные изменения в физиологии взрослых рыб.
-
Перенос эмбрионов в фильтровальную бумагу
Примечание: Бирюзовый Пецилиевые рыбы эмбрионы могут развиваться на сухой субстрат, изложив природных условий. Кроме того сухие эмбриона инкубации позволяет исследователям для синхронизации эмбрионов и Люк их в тот же день.- У развитых эмбрионов будут видны черные глаза в течение 7-10 дней, используйте одноразовые пипетки Пастера или тонкой Изогнутый пинцет для переноса эмбрионов с раствор метиленового синего на тарелку ранее готовы картоны.
- Спред эмбрионов ~ 5 мм друг от друга с щипцами, до 100 эмбрионов за 90 мм пластины (рис. 1B).
- Уплотнение Петри с парафина.
- Инкубируйте эмбрионов на 28 ° C на 2-3 недели, до тех пор, пока они полностью разработали Золотой ирисы и готовы для штриховки (рис. 1 c).
Примечание: Не затягивать инкубации готов к Люк эмбрионы дольше, чем 2 недели, как их жизнеспособность будет резко сокращено.
-
Перенос эмбрионов для кокосового волокна
Примечание: Газобетона, стерильные кокосового волокна (или органический торф) может использоваться как действительный альтернативные средства для инкубации твердый субстрат.- Используйте одноразовые пипетки Пастера или тонкой Изогнутый пинцет для переноса эмбрионов с раствор метиленового синего на готовые к использованию кокосового волокна пластину.
- Распространения эмбрионов ~ 5 мм друг от друга, до 100 эмбрионов за 90 мм пластины (рис. 1B).
- Уплотнение Петри с парафина.
- Инкубируйте эмбрионов на 28 ° C на 2-3 недели, до тех пор, пока они полностью разработали Золотой ирисы (например, на рисунке 1 c).
Примечание: Для длительного хранения (до одного года), передавать эмбрионов в 3-дневный пост коллекции от решения метиленовым синим твердый субстрат пластины на 17 ° C. Инкубируйте эмбрионов до тех пор, пока они разрабатывают черные глаза.
4. инкубационные бирюзовый Пецилиевые рыбы
Примечание: Бирюзовый Пецилиевые рыбы эмбрионы могут успешно вылупились в гуминовые кислоты раствор14.
- С помощью тонкой Изогнутый пинцет, передача тщательно 50-100 развитых эмбрионов в поле штриховкой, наполненный гуминовые кислоты раствор при 4 ° C. Гуминовые кислоты раствор состоит из гуминовые кислоты 1 г/Л в воде системы. Автоклавы и хранить при 4 ° C до 10 недель. Убедитесь, что все эмбрионы полностью погружены. Гуминовые кислоты раствор должен быть мелкой, не глубже, чем 2 см.
Примечание: Низкая температура гуминовые кислоты раствор улучшает штриховки и полное погружение эмбрионов в решении позволяет синхронизированные штриховкой. - Поместите поле штриховки в инкубатор штриховкой 28 ° C. Покрывают поле штриховки с крышкой. Поставлять достаточно аэрации, подключите по НКТ с подачей воздуха штриховкой.
Примечание: Не достаточно аэрации во время инкубации приводит к высоким уровнем СРЮ не в состоянии заполнить газового пузыря («живот слайдер» фенотипа, см. Примечание в разделе 5.1) - На следующий день после вылупления для поддержания надлежащего качества воды в поле штриховкой, добавьте газобетона системы воды один раз в день в пропорции 1:1, сохраняя окончательный глубина 2 см.
- Переноса эмбрионы соперниц обратно на твердом субстрате и попытка штриховки на неделю позже.
Примечание: После вылупления, бирюзовый Пецилиевые рыбы способны легко поглощения и потребляют живой пищи. Для оптимального роста кормить мальков два раза в день с избыток недавно вылупившиеся артемии (Artemia salina). В знак полного насыщения является оранжевого цвета животы СРЮ после каждого кормления 10-15 минут. Сифон, избыток, недоеденные и разложившихся артемии с помощью пипетки Пастера на ежедневной основе.
5. привлечение несовершеннолетних и взрослых рыб
- На пять дней после вылупления переместите несовершеннолетних в системе рециркуляции воды. Используя одноразовые пластиковые пипетки (или пластиковой ложкой), тщательно передачи пять несовершеннолетних за 0,8 Л бак с экраном Фрай 400 мкм (рис. 2).
Примечание: Вполне возможно, что часть несовершеннолетних Пецилиевые рыбы не заполнили газового пузыря, привело типичных «живот ползунок» фенотип, характеризуется рыбы, не достигнув надлежащего плавучести, заставляя их непрерывно плавать, вызывая тяжелые пороки развития в взрослых рыб. Эти рыбы не могут быть использованы для выживания анализов или эффективного разведения и должны подвергаться цензуре. - Выкармливают птенцов два раза в день с свеже насиженным артемии в избытке до 14 дней после вылупления. Сифон мусора из нижней части каждого танка ежедневно.
- В возрасте 14 дней передачи молоди 2,8 Л бак оснащен экраном Фрай 850 мкм. С этого момента пометьте каждый танк с ID рыба, указанием Люк Дата, штамм информацию, Пол рыбы и рыбы идентификационный номер (рис. 3). Для выживания анализов индивидуально дом каждой рыбы в одной емкости с этого момента.
- На следующие 7 дней выкармливают птенцов два раза в день с ~ 2 мл артемии в рыбы. На этом этапе рыбы могут быть дополнены червей живой крови 1-3 (в случае, если личинки червя крови слишком велики для рыбы, нарезать их на более мелкие куски с лезвием бритвы). Для предотвращения ухудшения качества воды, сифон недоеденные продовольствия и дополнительных отходов дважды в неделю.
- После 3 недель от штриховкой удалите Фрай экран из задней части танка и начать кормить каждой рыбы два раза в день ~ 2 мл артемии и 0,5 мл крови червя. На данном этапе несовершеннолетние должны достигли тела размером 1 см и должен быть способен глотая полноразмерным кровь червя.
- На 4-недельного возраста кормят ~ 2 мл артемии и 1 мл крови червя каждой рыбы два раза в день. Самки могут совместно размещены на плотности до 3 самки за 2,8 Л бак.
- На этом этапе обеспечить, что рыбы достигают полного полового созревания. Проверка на наличие больших спинной, Анальный и хвостовой плавники с признаками окраска самцов и круглых животы полной яиц в женщин.
Примечание: Повышение взрослых рыб в отдельные емкости для выживания когортных исследований может негативно сказаться на поведение рыб и здоровье. Однако Группа жилье для выживания когортных исследований добавляет значительные отягощающих факторов благодаря созданию социального господства и мужской территорий, ведущих к строгим социальной иерархии.
6. питание
Примечание: Лаборатория бирюзовый Пецилиевые рыбы можно скармливать сочетание ребенка артемии (науплийартемии Салина ) и кровь червя (Chironomus spp. личинок). Бирюзовый Пецилиевые рыбы Фрай питаются исключительно ребенка артемии. Несовершеннолетних и взрослых рыб кормят два раза в день артемии и кровь червя (рис. 2). В идеале рыба может быть использована несколько раз в день, превышает 2 кормления указывается в настоящем Протоколе.
-
Культивировании артемии
- Добавить 10 Л воды обратного осмоса (RO) и 350 g Красного моря соли в рассоле креветки Хатчер и растворить аэрации с трубки аэрации.
- Обогащают культуру с 5 мл высоко ненасыщенных жирных кислот (HUFA).
- Добавьте 20 г цисты артемии в раствор штриховкой. Проверьте, что цисты артемии не плавают на поверхности воды и обеспечить надлежащее оксигенации и распространение культуры.
Примечание: Ежедневно аликвоты сухой артемии кисты могут храниться при 4 ° C. - Во второй половине следующего дня питания культуры с другой Алиготе 5 мл HUFA.
-
Заготовка насиженным артемии
Примечание: После ~ 36 ч от начала культуры, рассоле креветки готовы для сбора урожая (instar II фаза).- Собирать 5 L культуры в контейнере с помощью крана на нижней части инкубатора и пусть сидят в течение 10 мин.
- После 10 минут удалите артемии снарядов (коричневого цвета) из верхней части контейнера 5 Л и фильтровать насиженным артемии (оранжевый цвет) через сетку. Обратите внимание на исключения в отложениях найдены в нижней части контейнера, как она содержит не вынашивали яйца и мертвых артемии.
- Промойте вылупились артемии с воды RO в 2 Л контейнер и пусть сидят в течение 10 мин.
- После 10 минут фильтр артемии снова через сетку и собирать в 2 Л воды RO.
- Повторите предыдущие три шага, до тех пор, пока решение артемии свободен от не вылупились кисты и артемии снарядов.
- Передача артемии от 2 Л контейнер в сжать бутылки для кормления.
Примечание: Культивировании артемии является достаточно прочной и надежной. Однако чтобы избежать нехватки артемии в случае неудачной штриховкой, можно использовать меньше резервного копирования выводные (500 мл).
-
Настройка резервного копирования Хэтчер
- Растворите 17,5 г Красного моря соли в 500 мл воды RO аэрации.
- Обогащают культуру с 500 мкл HUFA.
- Добавьте 2 g цисты артемии.
- После 18-24 ч поставка культуры еще раз с 500 мкл HUFA.
Примечание: рассоле креветки готовы пожинать после ~ 24 h.
-
Подготовка живая кровь червя
- Непосредственно до кормления, фильтр соответствующее количество крови червя через сито с помощью Обратноосмотическая вода.
Примечание: Червь живой крови могут храниться при температуре 4 ° C для 7-10 дней. - Промойте кровь червя с небольшим количеством воды RO в пластиковый контейнер.
- С пластиковой Пастер пипетки (узкий кончик удалены), занимают кровь червя смесь для кормления.
Примечание: Питание лаборатории Пецилиевые рыбы колоний с живой пищи от ООН контролируемых источников добавляет риск для внешних загрязнений от паразитов и потенциально патогенных микробных сообществ. В будущем должны разрабатываться канал специальных стерильных рыбы.
- Непосредственно до кормления, фильтр соответствующее количество крови червя через сито с помощью Обратноосмотическая вода.
7. Пецилиевые рыбы лаборатории штамм генотипирования
Примечание: Различать среди штаммов бирюзовый Пецилиевые рыбы, а также для определения пола в пределах каждого штамма, конкретных генетических (микроспутника) маркеры можно использоваться9 (Таблица 1).
-
Отбор проб
- Надежно удерживайте рыбы в сетку верхней части влажной губкой.
- Тампоном 2-3 весы из тела рыбы из крышечки на хвостовой плавник с помощью ватных тампонов.
- Весы от тампона и весы 2-3 в 1 мл, содержащих раствор NaOH (200 мкл 0,5 моль/Л NaOH, β-меркаптоэтанол 1% и 0,5% поливинил пирролидона).
- Спин трубы ПЦР для 15 s, чтобы убедиться, что весы полностью погружен в растворе NaOH.
-
Геномная ДНК изоляции
- Проинкубируйте образцы для 20 мин при 95 ° C.
- Cool на RT, нейтрализации образца с 1/10 объема 1 М трис-HCl, рН 8.0.
- Центрифугуйте образцы для 5 минут на полной скорости.
8. параметры воды
Примечание: Земледелие организмов, которых используется взрослых фенотипирование требует условий высокостабильных животноводства на протяжении всей жизни целевых видов. Таким образом культивирования водных организмов, таких как бирюзовый Пецилиевые рыбы, требует строгого контроля параметров воды. Рециркуляции воды, с дополнительные четыре шаги фильтрация воды, обеспечивает надежную основу для достижения контроля над параметры воды, обеспечивая все танки на тех же условиях воды с течением времени. Рекомендуется для воссоздания системы воды от обратного осмоса (RO) воды, добавил с коммерческой морской соли и натрия бикарбоната.
- Схема системы циркуляции воды: во-первых, сточные воды от рыбы цистерны потоков через твердые частицы металла фильтр, который захватывает все остатки пищи не едят и крупных частиц. Металлические фильтры промывают три раза в неделю; Во-вторых после первой механической фильтрации, вода в больших грязевиков и затем закачивается в биофильтр, где бактерии конвертировать аммиака, нитритов и нитратов; В-третьих от биофильтр, вода перекачивается до 25 мкм фильтр рукава, которые ловушку точного размера частиц. Наконец вода течет через ультрафиолетового (УФ) лампы, которые стерилизации воды от бактерий и вирусов. После этих четырех шагов фильтрованная вода возвращается в рыбы цистерны.
- Чтобы уменьшить рост микроорганизмов в цистернах, предотвратить накопление нитратов и уменьшить общего соленость, 10-20% воды, системы удаляется на ежедневной основе.
- Поддержание постоянной температуры воды на 28 ° C, вода рН константа в пределах 7.0 до 7,5.
- Хотя Пецилиевые рыбы терпеть широкий спектр солености, чтобы избежать oodinosis, поддерживать теплопроводности в пределах диапазона 650-710 микро Siemens. Свет/темно цикла год 12 h обеспечивает колонии здоровья и производительности.
Примечание: Пецилиевые рыбы может терпеть проводимости воды до 1500 микро Siemens.
Результаты
Бирюзовый Пецилиевые рыбы правильного хозяйствования приводит медиана выживаемости колеблется от 12-18 недель в ГРЗ деформации (например, рис. 4A). Вариации медиана выживаемости зависит от диеты, частота кормления и жилищных условий температуры. Результаты бедных животноводства в кривых выживания представляя более ранней смертности и повторяющихся, внезапных капель выживание на протяжении времени, характеризуется несколько точек перегиба (рис. 4B).

Рисунок 1: представитель эмбриональной стадии развития с соответствующими инкубации субстрата. (A) свеже собранных эмбрионов, инкубировали в раствор метиленового синего в инкубаторе на 28 ° C. (B) эмбрионов, готовы к переходу на твердом носителе, либо фильтр бумага или кокосового волокна. (C) эмбрионов готовы быть вылупились, отображение типичных Золотой ирисов. Линейки шкалы равно 1 мм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
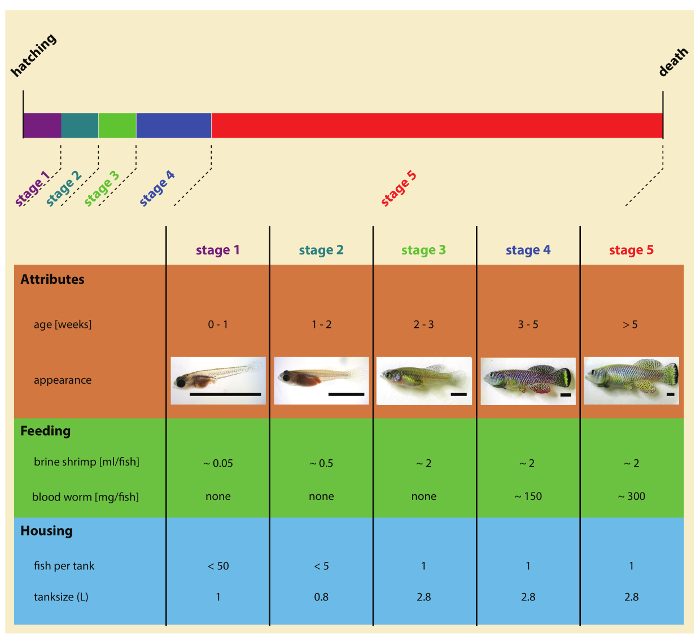
Рисунок 2: этапы бирюзовый Пецилиевые рыбы после инкубационного развития. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3: представитель рыбы ID тега для рыб от стадии 3 года. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
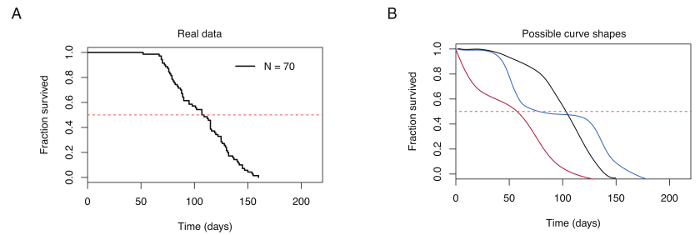
Рисунок 4: представитель выживания кривой для 70 мужчин бирюзовый Пецилиевые рыбы. (A) типичными выживания кривая для лаборатории рейз бирюзовый Пецилиевые рыбы. (B) Сравнение кривых выживания, полученных из рыбы, поднятые в условиях оптимального земледелия (черный) и бедных животноводства (красный и синий). Пунктирная красная горизонтальная линия показывает 50% выживания, пересекающихся кривая выживания на средний срок (указан на оси x). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| ID | Форвард грунтовка | Обратный грунтовка | Размер диапазона (bp) | ||
| * NfuSU0007 | GGCTAAGCCTTGCTGACAGA | CAGGGAGCTGAAAACCTCAG | 166 - 214 | ||
| * NfuSU0010 | CGCAGTCTGATCAAATCGTGT | TGTTTGAAGGTTCACATTCATTATC | 220 - 272 | ||
| NfuSU0016 | CATGGCTAAACCGTGATGAA | GAAGGACGCCAGCTATGAAG | 209 - 240 | ||
| NfuSU0022 | AACACAGCTCTCGTAAGGAGGTA | TTCAGACTTGTCTTACTACCATGTTT | 198 - 238 | ||
| NfuSU0027 | TCCAGCTGAATCGGTAATGA | AAACTCGAGGGTGCAATCTG | 164 - 226 | ||
| NfuSU0049 | CTGGACAAAGTGCCAATCAC | CTCCCACAGTCCCAAAACAT | 196 - 197 | ||
| NfuSU0050 | CCAGAATGAACAATACTCAGATCAA | GCAGCTTAGTTTAATGATATCACAATG | 252 - 295 | ||
| NfuSU0060 | CTAGCCACTCCCCTGGTTTA | CCGTCACGATGTGCTGATAC | 216 - 248 | ||
| NfuFLI0030 | CAGAAGCTAAAGGCCAGACG | GGGAAACAATAGGGAACCAC | 174 - 205 | ||
| * NfuFLI0091 | ACGCTGACTCTACCCAGTC | CTGCCTGCTACTGACAATG | 355 - 373 | ||
| * - секс определение маркеров | |||||
Таблица 1: Генотипирования Праймеры для идентификации напряжения.
Обсуждение
Мы описываем протокол для лабораторных культивирование бирюзовый Пецилиевые рыбы, включая коллекции эмбриона, инкубаторов, а также взрослых рыб жилья, разведения и кормления. Наш протокол предназначен для лабораторий, которые проводят исследования сосредоточены на взрослых рыб, в частности для экспериментальных исследований по вопросам старения и продолжительность жизни. Бирюзовый Пецилиевые рыбы может быть поднят на стандартный данио рерио фонда; Однако важные аспекты разведения Пецилиевые рыбы отличаются от стандартных данио рерио ухода16. Эти изменения включают скорейшего перехода от артемии только диеты диеты дополнена богатой белком крови червя, а также конкретные шаги в инкубации эмбрион, состоящий из жидких и сухих инкубации стадии.
Важнейшие шаги в рамках Протокола включают доставку эмбрионов в диапазоне температур 8-30 ° C. При разведении, плодовитость зависит от питания Частота и качество продуктов питания; Поэтому мы рекомендуем по крайней мере два кормлений в день на разведение емкость для повышения доходности эмбрионов (см. раздел 5.6). Во время отбеливания эмбриона, не распространяется инкубации зародыш в отбеливающий раствор. Это может привести к повреждению яйцо хориона и смертности рост эмбриона. При инкубации эмбрионов с метиленовым синим, не затягивать инкубации готов к Люк эмбрионы дольше, чем 2 недели, как их жизнеспособность будет резко сокращено. Для штриховки бирюзовый Пецилиевые рыбы, низкая температура гуминовые кислоты раствор улучшает штриховки и полное погружение эмбрионов в решении позволяет синхронизированные штриховкой. Не достаточно аэрации во время инкубации результаты в высоких темпов СРЮ не в состоянии заполнить газового пузыря («живот слайдер» фенотипа, см в разделе 5.1).
Ограничение, накладываемое протоколом для разведения включает в себя использование песка субстрата, который создает проблемы для централизованной системы фильтрации и должны быть заменены альтернативными методами в будущем. Возможных вариантов может быть использование данио рерио Животноводство танков. Эмбрион отбеливание может вызвать основных физико химических изменений в яйцо Хорио, которая может привести к измененным Хорион физиологии и инкубационные успех. Постоянное воздействие эмбрионов Метиленовый синий может вызывать долгосрочные изменения в физиологии взрослых рыб. Повышение взрослых рыб в отдельные емкости для выживания когортных исследований может негативно сказаться на поведение рыб и здоровье. Однако Группа жилье для выживания когортных исследований добавляет значительные отягощающих факторов благодаря созданию социального господства и мужской территорий, ведущих к строгим социальной иерархии. Таким образом мы оцениваем, что изоляция мужчин рыбы для выживания исследования является разумным компромиссом. Питание лаборатории Пецилиевые рыбы колоний с живой пищи от ООН контролируемых источников добавлять риск для внешних загрязнений от паразитов и потенциально патогенных микробных сообществ. В будущем должны разрабатываться канал специальных стерильных рыбы.
Будущего совершенствования этот протокол будет сосредоточена на диете управляемой, не живут, который по-прежнему приводит к завершению полового созревания в течение 3-4 недель. В целом наш протокол предлагает доступ к бирюзовой Пецилиевые рыбы Лаборатория культивирования к широким научным сообществом.
Раскрытие информации
Все авторы заявить не конкурирующие интересы финансовых и нефинансовых.
Благодарности
Мы благодарим Alessandro Cellerino, Тайрон Genade, Энн Брюне, Сабрина Sharp, Микки Пауэлл, Симоне Keil, Юми Ким, Патрик Смит, Кай Mathar и всех членов Валенцано лаборатории в институте Макса Планка по биологии старения за вклад в различные аспекты текущего протокола животноводства Пецилиевые рыбы с годами.
Материалы
| Name | Company | Catalog Number | Comments |
| Probe calibration buffer solution pH=7.0 | Roth | A518.1 | 1L buffer solution pH=7.0 to calibrate water system pH-electrode |
| Probe calibration buffer solution pH=4.0 | Roth | P712.1 | 1L buffer solution pH=4.0 to calibrate water system pH-electrode |
| Conductivity standard | VWR | 83607.260 | 500 mL Conductivity standard 1,413 uS/cm to calibrate water system conductivity-electrode |
| Easy Strips Test 6in1 | JBL | 2533900 | Test strips for determination chlorine values of system water |
| Ammonia Test | JBL | 2536500 | Test to determine ammonia content of system water |
| Red Sea Salt | Red Sea | 22 kg bucket | |
| Sodium hydrogen carbonate | VWR | 27780.360 | |
| Humic acid | Sigma- Aldrich | 53680-50G | |
| New HUFA Artemia enrichment | ZM Systems UK | 75g bottle | |
| Methylene blue | Roth | AE64.1 | |
| Hydrogen peroxide solution | Sigma- Aldrich | 31642-1L | 30% (w/w) |
| Coconut fiber | Dragon | ZCS010 | |
| Whatman paper | GE healthcare | 3030-690 | |
| Ethanol pure | VWR | 20821.467 | 100% |
| Silica sand | local pet shop | ||
| Artemia Eggs Premium Grade | Sanders | ||
| Bloodworm | local distributor | Poseidon Aquakultur Germany | |
| dNTPs solution mix | Biolabs | N04472 | 10mM |
| Taq DNA polymerase | Invitrogen | 18038-042 | 5U/uL |
| PCR 10x Buffer | Invitrogen | 18038-042 | |
| MgCl2 | Invitrogen | 18038-042 | 50mM |
| NaOH | Sigma- Aldrich | S8045-500g | 50mM |
| Tris-HCl, pH=8.0 solution | Sigma- Aldrich | T2694-1L | 1M |
| HCl 37% | Sigma- Aldrich | H1758-500mL | |
| Fish tanks | Aquaneering | volume: 0.8L, 2.8L, 9.5L; equipped with baffles, fry mesh and lids | |
| Orbital shaker | VWR | 89032-100 | model 5000 |
| Microbiological incubator | Thermo Scientific, Heratherm | 50125882 | model IMC18; for storage embryos in the liquid phase, set to t=27-28°C |
| Cooling Incubator | Binder | 9020-0209 | model KT115; for storage embryos in the solid phase, set to t=27-28°C |
| Hatching incubator | Thermo Scientific, Heratherm | 51028114 | model OGS180; for embryos hatching, set to t=27-28°C |
| Stereomicroscope | Leica | model M80 | |
| Breeding sand/hatching boxes | Roth | 1598.1 | 1000mL |
| Petri dish | Sarstedt | 82.1473 | 92x16mm |
| 50 mL Conical tube | Sarstedt | 62.547.254 | |
| 15 mL Conical tube | Sarstedt | 62.554.002 | |
| Disposable Plastic Pasteur pipette | Roth | EA71.1 | 2mL; For fish feeding with bloodworms, or embryos selection cut off the tip to open 3-4mm diameter |
| Serological pipette | Sarstedt | 86.1689.001 | 50mL |
| Syringe | Henke Sass Wolf | 4100-000V0 | 10mL |
| Metal strainer | fineness <1mm; for embryos collection | ||
| Tweezers | Dumont | 0508-5/45-PO | type5/45; for embryos transfer |
| 25 L Brine shrimp hatcher | Aquaneering | ZHBS25 | main hatcher |
| 500 mL Brine shrimp hatcher | JBL | 6106100 | model Artemio 1; backup hatcher |
| Narrow-mesh fish nets | JBL | ||
| Sand beaker | VWR | BURK7102-5000 | 5000mL |
| Brine shrimp separation beaker | VWR | BURK7102-2000 | 2000mL |
| Plastic zipper bag | Roth | P279.2 | for dead fish storage |
| Pipetboy | Integra | 155000 | model Pipetboy acu2 |
| Parafilm | P-Lab | P701605 | |
| Air tubing | www.zajac.de | AQ380 | 4-6 mm diameter |
| 1 L Glass bottle | VWR | 215-1595 | |
| 2 L Glass bottle | VWR | 215-1596 | |
| 500 mL Squeeze bottle | Roth | K665.1 | for fish feeding with brine shrimp |
| 120-μm brine shrimp strainer | Florida Aqua Farms | BB-PC2 | for brine shrimp/bloodworm collection |
| Finish filter socks | Aquaneering | MFVB025C | 25-μm |
| Central filtration fish housing system | Aquaneering, Techniplast, Aquatic Habitats, Aqua Schwarz |
Ссылки
- Valenzano, D. R., Aboobaker, A., Seluanov, A., Gorbunova, V. Non-canonical aging model systems and why we need them. EMBO J. 36 (8), 959-963 (2017).
- Harel, I., Brunet, A. The African Turquoise Killifish: A Model for Exploring Vertebrate Aging and Diseases in the Fast Lane. Cold Spring Harb Symp Quant Biol. 80, 275-279 (2015).
- Smith, P., et al. Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. Elife. 6, (2017).
- Cellerino, A., Valenzano, D. R., Reichard, M. From the bush to the bench: the annual Nothobranchius fishes as a new model system in biology. Biol Rev Camb Philos Soc. 91 (2), 511-533 (2016).
- Kim, Y., Nam, H. G., Valenzano, D. R. The short-lived African turquoise killifish: an emerging experimental model for ageing. Dis Model Mech. 9 (2), 115-129 (2016).
- Blazek, R., et al. Repeated intraspecific divergence in life span and aging of African annual fishes along an aridity gradient. Evolution. 71 (2), 386-402 (2017).
- Terzibasi, E., et al. Large differences in aging phenotype between strains of the short-lived annual fish Nothobranchius furzeri. PLoS One. 3 (12), e3866 (2008).
- Kirschner, J., et al. Mapping of quantitative trait loci controlling lifespan in the short-lived fish Nothobranchius furzeri--a new vertebrate model for age research. Aging Cell. 11 (2), 252-261 (2012).
- Valenzano, D. R., et al. Mapping loci associated with tail color and sex determination in the short-lived fish Nothobranchius furzeri. Genetics. 183 (4), 1385-1395 (2009).
- Reichwald, K., et al. Insights into Sex Chromosome Evolution and Aging from the Genome of a Short-Lived Fish. Cell. 163 (6), 1527-1538 (2015).
- Valenzano, D. R., et al. The African Turquoise Killifish Genome Provides Insights into Evolution and Genetic Architecture of Lifespan. Cell. 163 (6), 1539-1554 (2015).
- Harel, I., et al. A platform for rapid exploration of aging and diseases in a naturally short-lived vertebrate. Cell. 160 (5), 1013-1026 (2015).
- Valenzano, D. R., Sharp, S., Brunet, A. Transposon-Mediated Transgenesis in the Short-Lived African Killifish Nothobranchius furzeri, a Vertebrate Model for Aging. G3. 1 (7), 531-538 (2011).
- Harel, I., Valenzano, D. R., Brunet, A. Efficient genome engineering approaches for the short-lived African turquoise killifish. Nat Protoc. 11 (10), 2010-2028 (2016).
- Polacik, M., Blazek, R., Reichard, M. Laboratory breeding of the short-lived annual killifish Nothobranchius furzeri. Nat Protoc. 11 (8), 1396-1413 (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены