Method Article
Utilisant l’imagerie 18F-FDG TEP/CT et histologie Quantitative pour mesurer des changements dynamiques dans le métabolisme du Glucose dans des modèles murins de cancer du poumon
Dans cet article
Résumé
Dans ce protocole, nous décrivons comment utiliser [18F]-2-fluoro-2-deoxy-D-glucose tomographie par émission de positons et la tomodensitométrie (18F-FDG TEP/CT) d’imagerie pour mesurer la réponse métabolique de tumeur à la thérapie ciblée MLN0128 dans un Kras/Lkb1 souris mutante modèle de cancer du poumon et couplée d’imagerie à haute résolution ex vivo autoradiographie et histologie quantitative.
Résumé
Une caractéristique des tumeurs avancées est un commutateur à la glycolyse aérobie qui est facilement mesurable par [imagerie de tomographie par émission de positrons (18F-FDG PET) F]-2-fluoro-2-deoxy-D-glucose18. Des mutations dans le proto-oncogène KRAS et le gène suppresseur de tumeur LKB1 sont des événements fréquents dans le cancer du poumon qui animent hypermétabolique, croissance tumorale glycolytique. Un chemin critique, régulation de la croissance et le métabolisme de ces tumeurs est la cible mécaniste de la voie de la rapamycine (mTOR), qui peut être ciblée efficacement en utilisant des inhibiteurs de kinase mTOR catalytique sélective. L’inhibiteur de mTOR MLN0128 supprime la glycolyse dans les souris porteuses de tumeurs présentant des mutations co Kras et Lkb1, dénommées KL souris. La réponse de la thérapie chez les souris KL est d’abord mesurée par 18F-FDG PET et une tomodensitométrie (CT) d’imagerie avant et après la livraison du MLN0128. En utilisant 18F-FDG TEP/CT, les chercheurs sont capables de mesurer des changements dynamiques dans le métabolisme du glucose dans les modèles de souris génétiquement modifiées (edged) de cancer du poumon suite à une intervention thérapeutique avec les thérapies ciblées. Elle est suivie de ex vivo autoradiographie et une analyse immunohistochimique quantitative (qIHC) à l’aide de logiciels morphométriques. L’utilisation de qIHC permet la détection et la quantification de nets changements dans les profils de biomarqueurs après traitement ainsi que la caractérisation des pathologies tumorales distinctes. Le couplage de l’imagerie TEP à l’histologie quantitative est une stratégie efficace pour identifier des réponses métaboliques et thérapeutiques in vivo dans des modèles murins de la maladie.
Introduction
Notre recherche a porté sur les enquêtes et ciblant les cancers présentant des mutations dans la kinase de foie B1 (LKB1, également dénommé STK11) cancers mutant1. LKB1 est un suppresseur de tumeur maître qui réprime mTOR complexe 1 (mTORC1) grâce à l’activation de la kinase AMP (AMPK) menant à la régulation de la croissance et le métabolisme. Par conséquent, la perte de LKB1 entraîne une activation mTORC1 effrénée, l’activation de la résultante de HIF1-alpha un phénotype métabolique glycolytique, communément appelé l’effet Warburg2,3,4. LKB1 mutations inactivant mener directement au développement d’un syndrome de prédisposition rare cancer familial connu comme le syndrome de Peutz-Jeghers Syndrome (PJS) qui se caractérise par le développement des polypes gastro-intestinale bénignes, appelée hamartomes5 , 6 , 7. en outre, LKB1 fréquemment co se transforme avec oncogène KRAS entraînant hypermétabolique et poumon humain agressif des tumeurs8,9.
Les maladies liées à Lkb1 sont modélisés aisément chez la souris. L’inactivation hétérozygote de Lkb1 chez la souris conduit au développement d’hamartomes avec exactitude modeling PJS10,11,12,13. En outre, des mutations de Lkb1 qui sont modélisées aisément chez la souris avec précision récapitulent des phénotypes de cancer du poumon, peau, du pancréas et du sein14. La mutation Co de Kras/Lkb1 dans le tissu pulmonaire des souris transgéniques, à l’aide d’une Cre recombinase médiée par l’activation de l’oncogène KrasG12D allèle et bialléliques suppression de Lkb1, conduit à la formation de tumeurs agressives et métastatique du poumon15 ,,16. La caractérisation des KrasG12D; Lkb1- / - (KL) des tumeurs pulmonaires isolés de souris montre ces tumeurs ont une activation mTORC1 élevé et sont hautement glycolytiques, à l’aide de deux mesures de métabolite directe du glucose et du lactate ou de mesure de la consommation [18F] -2- fluoro-2-désoxy-D-glucose (18F-FDG) par émission de positons (TEP) avec la tomodensitométrie (TDM) 17. L’hyper mTORC1-activation dans les tumeurs mutants LKB1 fournit une justification claire pour tester les deux inhibiteurs de la kinase allostérique et catalytique de mTOR pour traiter ces cancers.
Dans une étude précédente, nous avons démontré que la rapamycine d’inhibiteur allostérique mTORC1 (RAPA) avec succès inhibait la croissance d’et de la glycolyse dans de tumeurs gastro-intestinales (GI) en utilisant un Lkb1+/- modèle de souris transgénique de PJS3. RAPA est actuellement approuvé comme traitement en monothérapie pour le traitement du carcinome rénal, mais a montré une efficacité limitée dans NSCLC18,19,20. RAPA est un inhibiteur allostérique mTORC1 et peut être amélioré par le développement d’inhibiteurs de la kinase catalytique génération mTOR qui offrent une inhibition plus presque complète des complexes mTOR 1 et 2 (mTORC1 et mTORC2, respectivement)21. Médicaments tels que les MLN0128 sont désormais évalués dans les études précliniques et des essais cliniques de phase précoce22,23. Une étude récente de notre laboratoire a démontré que le MLN0128 est un inhibiteur de mTOR puissant dans des lignées cellulaires tumorales humaines de poumon et in vivo dans KL edged du poumon Cancer du15,16. MLN0128 a supprimé le poumon tumeur croissance et glucose métabolisme dans ces souris24.
Dans cette étude, nous profitons des modèles bien caractérisés adénoviraux de souris induite par le Cre de cancer du poumon, initié par un oncogène conditionnellement activés de Lox-Stop-Lox-KRASG12D 15,25. Ces souris KrasG12D ont été croisés avec des souris ayant les allèles floxed de Lkb1 (Lkb1L/L) pour générer le KrasG12D; Lkb1L/L (KL) souris16. Suite à la livraison par voie nasale des adéno - ou lentivirus exprimant une recombinase Cre, les souris KL développent des lésions précoces par induction tumorale après 4 semaines. En 6 semaines, les tumeurs dans le passage de la souris KL de tumeurs adénomateux à un phénotype plus malin et agressive de tumeur typique des carcinomes du poumon et en 8 à 10 semaines, les souris développent des carcinomes franches avec un 100 % pénétrance16,26.
Les deux TEP/CT immunohistochimie quantitative et d’imagerie peut-être être utilisée pour déterminer les réponses moléculaires et métaboliques ainsi que les réponses thérapeutiques dans les tumeurs suivant la livraison de ciblé thérapies telles que la MLN012817, 26,,27. Décrit ici est un protocole expérimental qui utilise 18F-FDG PET imaging pour mesurer la réponse métabolique à une thérapie ciblée MLN0128. Couplage TEP avec histologie quantitative permet la mesure de la réponse moléculaire à l’inhibition de mTOR, ainsi que la quantification de la charge de la tumeur et l’histologie de la tumeur.
Protocole
Toutes les procédures décrites dans le protocole ont été approuvés par les soins des animaux institutionnels et utilisent le Comité (IACUC) à l’Université de Californie à Los Angeles.
1. 18F-FDG TEP et CT d’imagerie chez les souris
ATTENTION : Utilisez un équipement de protection lors de la manipulation de radioactivité. Suivre toutes les procédures réglementaires applicables lors de la manipulation de radioactivité.
- Placez la cage avec les souris pour être copié sur un lit douillet à 37 ° C 1 h avant les 18injection F-FDG pour réduire la consommation de graisse brune de 18F-FDG.
Remarque : Les souris pendant 4-16 h le jeûne permet de réduire la consommation myocardique de 18F-FDG. - Peser la souris et noter son poids.
- Anesthésier la souris à l’aide de 2-3 % isoflurane dans l’oxygène à 0,5 - 2 L/min pendant 2-3 min à l’aide d’une chambre d’anesthésie maintenue à 37 ° C. Veiller à ce que la souris a été anesthésiée en pinçant l’orteil ; aucune réaction ne sera observé si la souris a été anesthésiée. Appliquer pommade ophtalmique sur les yeux afin d’empêcher toute sécheresse durant l’anesthésie.
- Diluer 18F-FDG (période radioactive de 109 min) dans une solution saline stérile à une concentration d’injection ajusté de carie-corrigé de 70-75 µCi/100 µL.
Remarque : Suivez la dose recommandée de 18F du fabricant de l’appareil de TEP pour l’imagerie scanner optimale. - Dessiner µCi de 70-75 avec une seringue à insuline avec une aiguille de 28 G, mesurer la dose de radioactivité à l’aide d’un calibrateur de dose et d’enregistrer la mesure et l’heure. Placer la seringue dans un support de seringue de plomb.
Remarque : La quantité de radioactivité 18F-FDG dans chaque dose est mesurée avec un étalon de la dose, qui est calibré par rapport à un matériau de référence, comme le césium-137, conformément aux protocoles du fabricant. Le temps de la lecture est également enregistré pour déterminer la correction de la carie. - Piquer l’extrémité distale de la queue de la souris et mesurer la glycémie de la souris avec un glucomètre.
- Chaud la queue pendant 1-2 min avec de la gaze imbibée dans l’eau chaude. Essuyer la queue avec de l’isopropanol 70 % à se dilater la veine caudale juste avant l’injection. Administrer 100 µL de 18F-FDG (la totalité du volume de la seringue) avec un bolus injection via la queue latérale de la veine et enregistrer le temps d’injection. Mesurer la dose restante dans la seringue à l’aide de l’étalon de la dose et noter la mesure et l’heure.
Remarque : Il y aura certains montant de gauche de la sonde dans la seringue. L’utilisation de seringues à insuline est préférable seringues connectés à aiguilles via Luer les verrous en raison de la diminution de la quantité de la dose, pris au piège dans l’aiguille de la seringue/après que l’injection a été administrée. - Placez votre souris injectée dans la chambre de l’anesthésie sous isoflurane de 1,5 à 2 % à 37 ° C, afin de permettre à la sonde d’être distribué via circulation systémique de la souris pendant 1 h avant le TEP-scan.
Remarque : Il peut être bénéfique vider la vessie avant la numérisation afin de permettre une plus facile 18visualisation F-FDG PET des tumeurs implantées dans les flancs inférieurs de la souris. - Après 1 h, placez la souris dans une chambre d’imagerie sous anesthésie isoflurane-coiffe et à 37 ° C et garantir à ses membres en place avec sparadrap en position couchée.
- Placez la chambre d’imagerie dans le scanner TEP/CT.
- Acquérir les PET et tomodensitogrammes tel que décrit dans le manuel du scanner TEP/CT28.
Remarque : Les images de PET sont acquis pour 600 s avec une fenêtre d’énergie de keV 150-650, reconstruit à l’aide de maximisation de l’espérance de maximum de vraisemblance avec corrections pour l’atténuation des photons, sa normalisation détecteur et décomposition de radio-isotopes (une correction de dispersion a été pas appliquée). Les images de CT sont acquises en mode continu pour 50 s en utilisant un 50 kVp, source de rayons x 200 µA et un détecteur à écran plat et ils sont reconstruits à l’aide de l’algorithme Feldkamp. - Après que la TEP/CT est terminée, retirez la souris de la chambre d’imagerie et lui permettre de récupérer dans sa cage. Contrôler la souris jusqu'à ce qu’il a entièrement repris connaissance et peut maintenir décubitus sternal.
- Importer les images reconstituées de la TEP/CT dans le logiciel de l’AMIDE en cliquant sur fichier, puis ouvrir, sélectionnez le fichier approprié.
- Convertir les données de l’animal à l’unité de dose injecté pour cent par gramme (%ID/g) en entrant la dose au moment de l’injection après que comptabilité pour n’importe quelle dose résiduelle à gauche dans la seringue ou à l’unité de valeur normalisée de l’absorption (SUV) en entrant en outre du sujet poids. Pour ce faire, faites un clic droit sur l’ensemble de données de PET et localisez le champ %ID/g dans l’onglet Basic Info Enter les %ID/g enregistrés précédemment.
- Dessiner le régions d’intérêt (ROIs) sur les tumeurs et les tissus normaux (foie, muscle, poumons, cœur, cerveau et la graisse sous-cutanée). Pour ce faire, cliquez sur modifier, sélectionnez Ajouter ROI, sélectionnez ROI forme et nommez le retour sur investissement. Tirer des ROIs dans les tumeurs et tissus et ajuster leurs dimensions pour couvrir le tissu d’intérêt dans les 3 axes.
Remarque : Pour tenir compte des différences de PET sonde biodistribution entre animaux, les valeurs de retour sur investissement de tumeur peuvent être normalisées davantage aux valeurs de retour sur investissement du foie, un organe bien perfusé avec une activité glycolytique minimale représentant 18F-FDG en circulation. ROI des analyses de la tumeur et les tissus normaux sont réalisées sur la même souris. Les lésions de tumeurs pulmonaires peuvent souvent être identifiées par 18F-FDG PET puisque la 18F-FDG la rétention dans un poumon normale est relativement faible. CT est également utilisé pour identifier les lésions, en particulier les lésions qui sont 18F-FDG non-avid. Une analyse ex vivo des poumons isolés contribue également à localiser les lésions tumorales.
2. 18F-FDG autoradiographie
- Préparer la souris d’imagerie sur 18F-FDG en suivant les étapes 1.1-1.12, sauf maintenant, diluées 18F-FDG dans du sérum physiologique stérile à une concentration d’injection de carie-corrigé ajusté de 1 000 µCi/200 µL.
Remarque : Des doses plus élevées de 18F-FDG sont utilisées pour l’autoradiographie pour tenir compte de traitement de temps et une détection optimale des échantillons supplémentaires par des plaques de phosphore. - Euthanasier la souris via une inhalation létale d’isoflurane à 5 % ou de CO2 (une procédure agréée IACUC).
NOTE : Dislocation cervicale ne doit pas être utilisée car cela pourrait endommager le tissu pulmonaire. - Problèmatique de la souris avec la surface ventrale exposée et vaporisez-le avec éthanol à 70 % de mat ses cheveux avant l’incision.
- Ouvrez la cavité thoracique en appliquant une incision médiane, coupant le diaphragme et les parois de la poitrine. Exposer la trachée en enlevant soigneusement la glande salivaire. Placer la pince bulldog sur la trachée comme près de la mâchoire que possible, assurant un ajustement serré sur la trachée. Place une aiguille 23 G attaché à une seringue de 3 mL à l’intérieur de la trachée sous la pince bulldog et injecter environ 2 mL d’une solution (Optimal coupe température : Phosphate Buffered Saline) de OCT:PBS (1:1).
NOTE : OCT est très visqueux et est mélangé avec du PBS pour permettre une injection plus facilement dans les poumons. - Retirer l’aiguille de la trachée et utiliser des pinces afin de serrer sur le point d’injection pour éviter toute fuite de la solution OCT:PBS.
- Retirez délicatement les poumons de la cavité thoracique et séparer le lobe gauche du reste des poumons. Placer le lobe gauche en cryomold étiqueté rempli avec quelques gouttes d’OCT. Une fois que le lobe pulmonaire est à l’intérieur du moule, remplir le cryomold vers le haut avec OCT.
- Répéter l’opération avec la moitié droite des poumons.
Remarque : Si le signal de 18F-FDG au coeur devrait être élevé ou si les tumeurs pulmonaires sont situés à proximité du cœur, il pourrait être bénéfique enlever le cœur afin d’éviter toute fuite de traceur. Alternativement, ensemble poumons peuvent être incorporées dans un seul cryomold. Il est important d’éviter les bulles d’air lorsque vous travaillez avec OCT. - À l’aide de longues pinces, placez le cryomold préparé dans un contenant de mousse en polystyrène extrudé à cellules fermées contenant un mélange de glace sèche et isopentane.
Remarque : Ce mélange doit être à-70 ° C environ avant de placer le cryomold dedans pour la congélation. Après durcissement, le composé OCT devient blanc. Si plusieurs échantillons sont traités dans le même temps, les échantillons congelés en OCT cryomolds peuvent être stockées temporairement sur la glace sèche. - Retirer le bloc congelé de la cryomold et montez-la sur un cryostat pour le sectionnement. Le bloc à une épaisseur de 4 µm à l’aide de lames microtome (34°/80 mm, profil haut) de l’article. Transférer les coupes de tissus sur une lame de verre qui a été conservée à température ambiante.
- Placez les lames porte-objets sur un plaque-images au phosphore. Placer la plaque dans la cassette et refermez délicatement pour éviter que des diapositives de se déplacer. Stocker la cassette dans un congélateur à-20 ° C pour l’exposition de la plaque, généralement pendant la nuit.
Remarque : Les plaques et les cassettes doivent être préalablement refroidie à-20 ° C avant utilisation. Placer les échantillons à-80 ° C est également acceptable. - Après l’exposition, retirer les diapositives de la plaque et lire la plaque sur le lecteur d’image.
- Les diapositives peuvent être enveloppés dans une pellicule plastique et conservés à-80 ° C, ou ils peuvent être préparés à l’hématoxyline et éosine coloration ou immunohistochimie.
3. les tissus pulmonaires de récolte pour histologie
- Suivez les étapes de 2.2 à 2.4, sauf maintenant, au lieu d’utiliser la solution OCT:PBS, injecter 2 ou 3 mL de formol tamponné normale de 10 % pour fixer les poumons.
- Retirer l’aiguille de la trachée et utiliser des pinces pour fixer sur le point d’injection pour éviter toute fuite de la formaline. Retirez délicatement les poumons de la cavité thoracique et les placer dans un tube conique de 50 mL contenant environ 20 mL de formol tamponné normale de 10 % pendant 16 à 24 heures assurer une fixation complète.
Remarque : Les poumons de fixation permet pour la préservation des caractéristiques anatomiques optimales. - Le lendemain, transférer les poumons fixes de la formaline 70 % d’éthanol et de préparer les poumons pour être placé dans une cassette de tissu.
- Préparer les poumons pour histologie en disséquant avec soin les lobes avec des ciseaux pour couper à des points de branche entre 5 lobes, numérotées de 1 à 5, comme illustré à la Figure 1Det placez-les dans une orientation de non-cumul dans la cassette de tissu. Placez un coussin de mousse délicatement sur le tissu pulmonaire pour maintenir l’orientation intact.
- Stocker les lobes pulmonaires disséqué dans l’éthanol à 70 % jusqu'à ce que l’enrobage de paraffine.
- Paraffine-intégrer le tissu en cassettes et couper 4 coupes épaisses µm pour la coloration, à l’aide de procédures standards.
4. tissu Segmentation et Quantification à l’aide de logiciels commerciaux
- Hématoxyline image et éosine (H & E) poumon coupes à un grossissement de X 1,25 à l’aide d’un système d’imagerie multispectral commercial de colorées.
- Convertir les images aux cubes de l’image numérique et de charger des bibliothèques de spectral pré-faites (cliquez sur fichier, puis sur Charger Spectral Library) pour H & E.
Remarque : Les bibliothèques spectrales ont été élaborées à l’avance par l’acquisition d’images spectrales de sections de poumon individuellement colorés, une section colorée uniquement avec l’éosine et l’autre ne colorés à l’hématoxyline, qui ont été enregistrés dans une bibliothèque spectrale propriétaire open-source fichier (.csl). Le système d’imagerie a fonctionnement logiciel qui acquiert une image à chaque longueur d’onde qui est nécessaire (tel que défini par le protocole d’acquisition). Ces images (le « cube d’image ») sont stockées dans un format de fichier multispectral propriétaire open source (.im3). Les spectres sont extraites du cube de l’image en utilisant le logiciel morphométriques et stockées dans des fichiers séparés bibliothèque spectrale. - Spectralement unmix le pseudo-couleur H & images E des poumons tout en cliquant sur le bouton Unmix .
NOTE : Déconvolution prend moins de 1 s. Le nombre de pixels dans chaque type de tissu ont été quantifié à l’aide de logiciels d’analyse morphométrique image. - Visualiser chaque cube image en convertissant les données multispectrales en l’équivalent image de 3 couleurs (rouge, vert, bleu) à l’aide de la réponse de couleur de longueur d’onde dépendant de le œil convolé avec l’intensité de chaque image.
Remarque : Les 3 images qui en résultent sont affichés sous forme d’image couleur 24 bits standard. - Pseudo-couleur chaque image non mélangé en réduisant cette image dans un utilisateur choisi couleur (par exemple, rouge, vert, violet, etc.) et ajoute qu’ensemble avec les autres images non mélangés Pseudo-aléatoire couleurs en image une couleur de 24 bits standard.
- Utilisez les paramètres par défaut pour toutes les analyses.
Remarque : en général, car ce type de segmentation repose sur une évaluation visuelle des résultats (c.-à-d., une évaluation de la façon dont la segmentation sur les images en dehors de la formation définie œuvres), il est important de répartir correctement les images en formation, test et validation ensembles. - Commencer avec 2-3 images comme un ensemble de formation (10-15 pour les échantillons de biopsie humaine), train sur ceux jusqu'à ce que les résultats semblent bonnes et ensuite appliquent cet algorithme à un autre 2-3 images. Ensuite, appliquez l’algorithme qui en résulte pour l’ensemble de validation complète.
NOTE : Très probablement, une rééducation sera nécessaire. - Analyser la zone tumorale dans les sections de poumon entier en calculant le nombre de pixels total pour les tumeurs de Pseudo-couleurs rouges en lobes 1-5 de chaque souris.
Remarque : Les tissus normaux a Pseudo-couleur vert et sang/navires étaient Pseudo-aléatoire couleurs rose tel qu’illustré à la Figure 3. La charge tumorale moyenne pour chaque groupe de traitement a été calculée en mesurant le nombre de pixels total pour chaque souris dans le groupe de traitement.
Résultats
18 F-FDG TEP a été réalisée sur des souris KL et ont montré que les tumeurs chez ces souris sont hautement glycolytiques comme indiqué par une consommation élevée de 18F-FDG (Figure 1A), être d’accord avec les études publiées antérieurement26, 29. Une résection des poumons entiers ont révélé la présence de plusieurs tumeurs (Figure 1B). Poumons de souris peuvent être divisées en 5 lobes distincts représentés dans les Figures 1 et D 1. Lobes 1-5 ont été marqués sur des poumons sectionnées qui ont été colorées avec H & E ou du glucose transporteur 1 (Glut1) (Figure 1D). Glut1 est un principal transporteur de glucose et 18F-FDG et de son expression et localisation à la membrane plasmique des cellules tumorales directement corrélée avec 18F-FDG SUV29. Une analyse de résolution plus élevée de Glut1 coloration (X 40) à 18F-FDG-avid, tumeurs du poumon montre une expression élevée et la localisation d’un transporteur à la membrane plasmique (Figure 1D).
En raison de la résolution limitée de TEP, TEP/CT et tissus autoradiographie ont été effectuées. Une résolution plus élevée d’autoradiographie pourrait identifier plus petites tumeurs et/ou l’hétérogénéité de la tumeur 18distribution F-FDG. Après l’induction de tumeurs, l’imagerie 18F-FDG TEP/CT a été réalisée sur des souris KL (Figure 2A) suivis par l’autoradiographie sur poumons isolés de ces souris (Figures 2 b et 2C). Comme on le voit dans les Figures 2 b et 2C, l’autoradiographie identifié deux tumeurs plus petites supplémentaires qui se sont révélés positifs pour 18F-FDG et pourtant ne sont pas facilement visibles de PET. Autoradiographie, les lames avec des tissus pourraient également être utilisés pour le marquage immunohistochimique (IHC) de bioactif. H & E de coloration pour les tumeurs ont confirmé la présence de tumeurs dans le lobe gauche (Figure 2D).
Ensuite, 18F-FDG TEP a été exécuté le traités MLN0128 KrasG12D; Lkb1- / - souris pour utiliser 18F-FDG comme biomarqueur fonctionnel du métabolisme du glucose dans les tumeurs du poumon (Figure 3). Nous avons identifié qu’un traitement avec MLN0128 robuste inhibe la mTORC1 de signalisation et de la glycolyse comme indiqué par une consommation réduite de 18F-FDG (Figures 3 a et 3 b). Ces résultats concordent avec les études précliniques évaluant MLN0128 dans KL souris que précédemment publiées par notre laboratoire17,27. Enfin, l’IHC coloration a été réalisée sur les tumeurs (Figure 3C). Les tumeurs ont été colorées avec des anticorps contre phospho-S6, qui est un substrat conservé de mTORC1 et est utilisé pour indiquer une activation mTORC1 soit pour H & E (P-S6) vs inactivation (S6). Figure 3 C présente une inhibition robuste de P-S6 par MLN0128 KL tumeurs comparées à ceux traités par un véhicule, qui est d’accord avec les travaux déjà publiés,17. En plus de KRAS, oncogènes pilotes tels que le récepteur du facteur de croissance épidermique (EGFR) soutiennent le métabolisme glycolytique dans les tumeurs du poumon aussi bien. Par conséquent, nous avons vérifié si l’inhibition du mutant constitutivement actif EGFR à l’erlotinib a supprimé le métabolisme de 18F-FDG dans les xénogreffes de souris. Figures 3D et 3F montrent que la ligne de tumeur du poumon humain HCC827, qui recèle d’une mutation EGFR del19, a montré une consommation significativement réduite 18F-FDG après cinq jours de traitement de l’erlotinib.
Enfin, l’analyse morphométrique tissu déroulée sur poumons sectionnés et les tumeurs du poumon pour quantifier le fardeau tumoral total aussi bien quant à différencier les pathologies tumorales qui comprenait le sous-type de tissus, de nécrose, de vaisseaux sanguins du tissu pulmonaire normale et l’espace aérien. L’edged KL a développé une maladie complexe et pathologiquement hétérogène qui s’est présentée avec les tumeurs du poumon des histopathologies variables. Il s’agit d’adénocarcinomes (ADC) et les carcinomes épidermoïdes (SCC)-cette hétérogénéité rend le traitement de ce cancer un formidable défi. Figure 4 A montre un lobe de poumon tachée H & E unique avec deux grosses tumeurs présentes. Les images de grossissement plus élevés, illustrés à la Figure 4B identifient un normale nécrose du poumon, les navires et l’espace aérien et tumeur ainsi que l’adénocarcinome, caractérisée par une structure papillaire bien définie et un carcinome épidermoïde. Figure 4 C représente la Pseudo-coloration du lobe pulmonaire et tumeur à l’aide de logiciels morphométriques Inform. Figure 4 D indique les pourcentages de poumon normal, les vaisseaux et pathologies individuelles telles que la nécrose tumorale et sous-types de tumeurs qui segmenté adénocarcinome bien différencié du carcinome spinocellulaire.

Figure 1 : Métaboliquement active KrasG12D; Lkb1- / - (KL) mutant poumon tumeurs sont 18F-FDG positive et expresse des niveaux élevés du transporteur de glucose 1 (Glut1). Panneaux A et B montrent une projection d’intensité maximale [aussi dénommée une image (3D) 3-dimensional] du 18F-FDG-PET et analyse de CT sur certaines souris KL FDG-avid hébergeant des tumeurs pulmonaires squameuses. Montré sont (A) une reconstruction 3D et (B) des vues transversales, sagittales et coronales de tumeur pulmonaire (t). (C) ce panneau montre une histologie pulmonaire entier de la souris KL photographiée sur panneaux A et B, soit colorés pour H & E (panneau supérieur) ou avec un anticorps spécifique pour Glut1 (panneau inférieur). Les lobes pulmonaires sont numérotés. La barre d’échelle = 2 mm. (D) ce diagramme représente l’orientation et le nombre de lobes chez les souris (panneau supérieur) et plus haut résolution 40 X photos des tumeurs H & E ou Glut1-teinté de diapositives montrés le panneau C pour H & E (panneau central) ou colorées avec un anticorps spécifique pour Glut1 (panneau inférieur). La barre d’échelle = 25 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
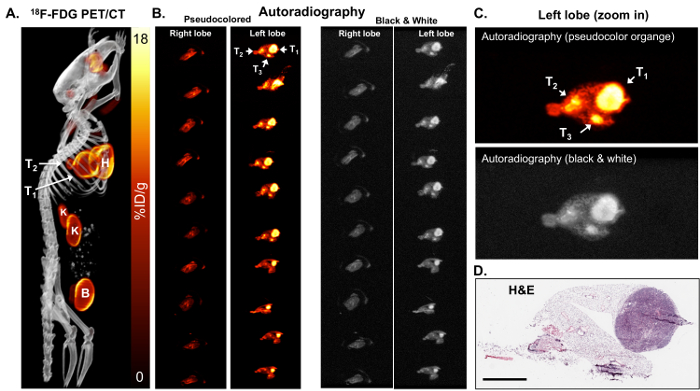
Figure 2 : 18 L’autoradiographie F-FDG peut identifier des tumeurs de petites taille qui sont métaboliquement actifs. (A) montre cette image de F-FDG TEP/CT 18 18F-FDG-avid tumeurs chez une souris KL montrée comme une image de projection de l’intensité maximale. T1 et T2 = tumeurs, H = cœur, B = la vessie, K = les reins. (B), ce panneau indique l’autoradiographie ex vivo sur des coupes sériées des lobes du poumon droit et gauche de la souris. Les poumons dans les panneaux gauche et droite sont identiques. Les poumons dans les panneaux de gauche sont pseudo de couleur orange. Les poumons dans les panneaux de droite sont colorés en noir et blanc. Les tumeurs (T1, T2 et T3) sont indiqués par des flèches. (C) c’est une vue agrandie de la pseudocolored d’autoradiographie orange (panneau supérieur) et le noir et blanc (panneau inférieur). (D) ce panneau montre la coloration H & E de la tranche supérieure du lobe gauche indiqué dans le groupe B. La barre d’échelle = 200 µm s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
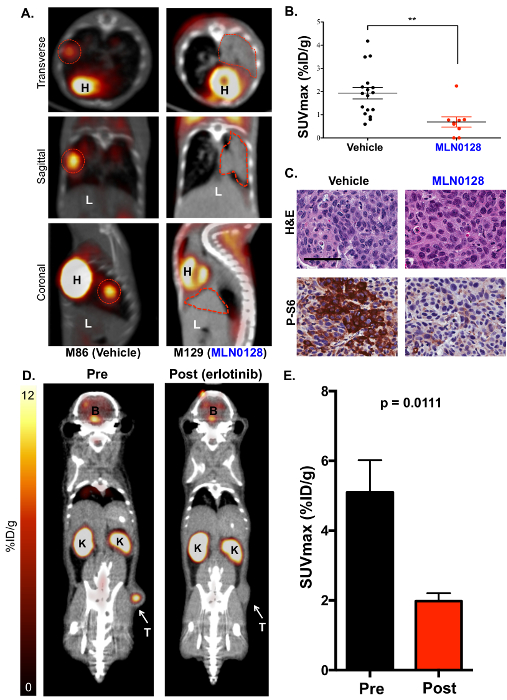
Figure 3 : L’inhibiteur de mTOR MLN0128 supprime la consommation de glucose dans les tumeurs du poumon des souris KL tel que détecté par 18F-FDG PET (A) ce panneau montre représentant 18F-FDG TEP/CT images de KL souris traitées avec un véhicule (18F-FDG avid, à gauche) ou MLN0128 (18F-FDG non-avid, à droite). Le transverse (panneau supérieur), coronale (panneau central) et sagittal (panneau inférieur) vues sont affichées. Les tumeurs sont décrits avec des lignes rouges ; H = cœur, L = le foie. (B), ce panneau indique une quantification des SUVmax (%ID/g) entre les tumeurs traitées véhicule - et MLN0128. (C) ce panneau montre la coloration H & E et P-S6 de coupes de poumon entier de KL souris traitées avec le véhicule ou MLN0128. La barre d’échelle = 25 µm. (D), ce panneau affiche représentant 18F-FDG-PET et images CT des xénogreffes EGFR HCC827 (del19) préalables et post-erlotinib traitement. La tumeur (T) est indiquée par une flèche, K = le rein, B = le cerveau. (E), ce panneau indique une quantification de le SUVmax (%ID/g) pour HCC827 xénogreffes avant et après le traitement de l’erlotinib. n = 10/groupe de tumeurs. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Charge tumorale et l’histologie de la tumeur sont quantifiés à l’aide de logiciels morphométriques.
(A), ce panneau affiche la coloration H & E d’un lobe de poumon de souris unique avec une tumeur prélevée d’une souris KL. (B) ces images de résolution supérieure illustrent le carcinome épidermoïde (en haut à gauche), le poumon normal, les vaisseaux et l’espace aérien (en haut à droite) et l’adénocarcinome papillaire bien différencié (en bas à gauche) et nécrose (en bas à droite). (C), ce panneau indique la pseudocoloring de l’H & E colorés poumon lobe à l’aide de logiciels morphométriques. (D) ce panneau montre les pourcentages pour le poumon des pathologies lobe et tumeur mesurées par Inform. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Cet article décrit une approche expérimentale basée sur l’imagerie qui utilise l’imagerie 18F-FDG TEP/CT avec qIHC afin de mesurer les réponses métaboliques et moléculaires dans les tumeurs du poumon suite à la livraison de l’inhibiteur de mTOR MLN0128. MLN0128 a effectivement réduit le 18consommation F-FDG, indiquant une réponse métabolique importante dans les tumeurs. En reliant l’imagerie TEP/CT à l’immunohistochimie, nous avons pu spatialement, registre des tumeurs sectionnés pour les images 3D de la TEP/CT et effectuer un examen détaillé des tumeurs tout à un niveau cellulaire et moléculaire. Cela a permis de confirmer que le MLN0128 inhibe la signalisation mTOR, confirmant ainsi une réaction moléculaire sur la cible à la drogue dans les tumeurs. Enfin, en tirant parti de l’histologie quantitative, nous étions en mesure de cartographier et pathologies tumorales distincts séparés, tels que de la masse tumorale globale de nécrose de tumeur, définissent adénocarcinome de carcinomes épidermoïdes et complément l’imagerie microPET.
MicroPET est actuellement limitée par une résolution spatiale d’environ 1 mm. En outre, 18conservation F-FDG dans certains tissus peuvent être affectés par divers facteurs, dont la glycémie à jeun, le type et la durée d’exposition anesthésique, la température de l’environnementale et la santé générale de l’animal, qui peut-être avoir une incidence 18 F-FDG pharmacocinétique30. Ces paramètres ont été optimisés pour ce protocole, mais doivent être optimisés pour chaque modèle animal. Études de reproductibilité de 18F-FDG imagerie des tumeurs sous-cutanées chez la souris montrent un coefficient de variation pour la %ID/g moyenne d’environ 15 %, ce qui suggère que la réponse thérapeutique de tumeur d’une souris individuelle évalués par 18 F-FDG PET doit être supérieure à ce seuil à être considérés comme fiables et significatifs31.
La distribution cellulaire et subcellulaire même des marqueurs peut être évaluée par autoradiographie de tissu avec les sections ensuite colorées et enregistré conjointement avec qIHC. A enregistrement PET avec CT permet une image d’animal de compagnie à mettre dans un contexte anatomique ; C’est extrêmement précieux, même avec un contraste faible tissus mous. Le manque de contraste des tissus mous par le CT peut être surmonté avec l’imagerie par résonance magnétique (IRM). En outre, les biomarqueurs pour l’imagerie de fluorescence peuvent être utilisés pour évaluer la glycolyse in vivo, mais absorption de photons et dispersion dans la cavité pulmonaire peut-être affecter la sensibilité précis quantification ou détection32. En résumé, utilisant l’imagerie TEP/CT animaux avec histologie quantitative fournit une carte précise et en temps réel de la biologie tumorale suite à une intervention thérapeutique.
Imagerie multispectrale (MSI) est applicable dans toutes les situations où une image couleur peut être utilisée. À tout le moins, MSI fournit les mêmes informations qu’une image couleur, et pour certaines applications, MSI peut fournir plus d’informations sur les propriétés spectrales d’un échantillon qu’une image de simple large bande trois couleurs (RGB). En règle générale, les limitations de MSI sont ceux de l’imagerie couleur, sauf que MSI est plus lente et prend plus de temps pour acquérir des images. Le logiciel morphométriques a été utilisé pour obtenir des résultats de segmentation reproductible et précis pour les images et est décrite dans la Table des matières. Il y a des autres produits disponibles dans le commerce qui peuvent être utilisés pour la segmentation des tissus et la quantification de l’histologie.
La complexité du métabolisme du cancer s’étend au-delà de l’effet Warburg et glucose métabolisme33,34. Il est fort probable que les tumeurs s’adaptera facilement aux traitements en monothérapie qui inhibent la glycolyse. La dépendance sur le métabolisme des acides aminés a été bien documentée dans le cancer, et il est prévu que les tumeurs s’appuient sur une foule d’amino acids tels que la glutamine, glycine et de la sérine, mais aussi d’autres métabolites tels que les acides gras libres35,36, 37. En plus de 18F-FDG, sondes telles que 18F - et 11C-intitulée glutamine, choline, acétate de 1-(2'-désoxy-2'-fluoroarabinofuranosyl) cytosine (AEC) et fluorothymidine (FLT) ont été utilisé avec succès pour image aminoacide, nucléotides et le métabolisme des lipides dans des modèles animaux de cancer38,39,40,41. Automatisation et micro-échelle traceur radiochimie technologies couplées avec une résolution supérieure, supérieures tomographes TEP de sensibilité améliorera l’accessibilité de PET pour mesurer les différentes procédures biologiques42,43. La compréhension du métabolisme augmente, il est logique que le répertoire des radiotraceurs PET augmentera ainsi, permettant aux chercheurs et médecins au métabolisme de tumeur non invasive profil.
L’utilisation de l’histologie quantitative et d’imagerie TEP/CT répond à un besoin clinique, qui est à traduire rapidement les découvertes de banc en pratique clinique. Pour ce faire, les chercheurs doivent être capables de mesurer avec précision la réponse thérapeutique ainsi que l’acquisition de la résistance aux médicaments, dont l’imagerie TEP/CT permet. En outre, l’analyse TEP/CT et immunohistochimique des tumeurs du poumon sont utilisés comme norme de soins pour les patients et sont donc directement traduisible en pratique clinique. Ce qui est important, l’imagerie TEP/CT identifie facilement des tumeurs résistantes aux traitements, que les chercheurs peuvent isoler et interroger à un niveau moléculaire afin de mieux comprendre les mécanismes de la maladie. Il s’agit d’un processus itératif qui a permis de mieux comprendre les mécanismes de résistance et de concevoir des stratégies thérapeutiques plus efficaces pour la traduction clinique.
Déclarations de divulgation
Kevin P. Francis est un employé de Perkin Elmer. James Mansfield est un actionnaire public d’actions PerkinElmer, Inc. (ICP) sur le NASDAQ. Les auteurs n’ont rien d’autre à divulguer.
Remerciements
Nous remercions l’Université de Californie Los Angeles Crump préclinique Imaging Technology Center pour leur aide avec l’imagerie TEP/CT, des souris, le translationnelle laboratoire de pathologie Core et Core de statistiques à l’Université de Californie à Los Angeles David Geffen School of Medicine pour l’assistance dans la préparation d’échantillons de tumeurs et d’analyse. Financement, David B. Shackelford a été pris en charge par l’ILEC et KL2 translationnelle Science Award accorder des numéros KL2TR000122 et UL1TR000124 à la David Geffen School of Medicine à l’UCLA et par le département de défense Lung Cancer Research Programme translationnelle Recherche partenariat W81XWH-13-1-0459 et ACS RSG-16-234-01-TBG. Sean T. Bailey a été soutenu par une subvention de formation T32 NIH HL072752 par le biais de la David Geffen School of Medicine à l’UCLA. Anthony Jones est pris en charge par le programme de formation biologie cellulaire tumorale UCLA (USHHS Ruth L. Kirschstein institutionnel National Research Service Award # T32 CA009056). Gihad Abdelhady est pris en charge par un R01CA208642 de supplément diversité NIH/NCI.
matériels
| Name | Company | Catalog Number | Comments |
| G8 PET/CT | Perkin Elmer | CLS139564 | Used for 18F-FDG PET and CT imaging of mice |
| Axio Imager.M2 | Zeiss | 490020-0003-000 | Acquiring images of FFPE lung tumor sections |
| Inform software | Perkin Elmer | CLS135781 | Morphometric used for image analysis of tumor pathologies |
| Glut1 antibody | Alpha Diagnostics | GT12-A | IHC staining of FFPE lung tumor sections |
| Phospho-S6 Ribosomal Protein (Ser235/236) (D57.2.2E) XP™ Rabbit mAb | Cell Signaling Technologies | 4858 | IHC staining of FFPE lung tumor sections |
| MX35 Premier microtome blades | Thermo Fisher Scientific | 3051835 | Microtome blades for sectioning tissue for autoradiography |
Références
- Shackelford, D. B., Shaw, R. J. The LKB1-AMPK pathway: metabolism and growth control in tumour suppression. Nature Reviews Cancer. 9 (8), 563-575 (2009).
- Shaw, R. J., et al. The LKB1 tumor suppressor negatively regulates mTOR signaling. Cancer Cell. 6 (1), 91-99 (2004).
- Shackelford, D. B., et al. mTOR and HIF-1alpha-mediated tumor metabolism in an LKB1 mouse model of Peutz-Jeghers syndrome. Proceedings of the National Academy of Sciences of the United States of America. 106 (27), 11137-11142 (2009).
- Faubert, B., et al. Loss of the tumor suppressor LKB1 promotes metabolic reprogramming of cancer cells via HIF-1alpha. Proceedings of the National Academy of Sciences of the United States of America. 111 (7), 2554-2559 (2014).
- Hemminki, A. The molecular basis and clinical aspects of Peutz-Jeghers syndrome. Cellular and Molecular Life Sciences. 55, 735-750 (1999).
- Hemminki, A., et al. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. Nature. 391 (6663), 184-187 (1998).
- Sanchez-Cespedes, M. A role for LKB1 gene in human cancer beyond the Peutz-Jeghers syndrome. Oncogene. 26 (57), 7825-7832 (2007).
- Sanchez-Cespedes, M., et al. Inactivation of LKB1/STK11 is a common event in adenocarcinomas of the lung. Cancer Research. 62 (13), 3659-3662 (2002).
- Ding, L., et al. Somatic mutations affect key pathways in lung adenocarcinoma. Nature. 455 (7216), 1069-1075 (2008).
- Ylikorkala, A., et al. Vascular abnormalities and deregulation of VEGF in Lkb1-deficient mice. Science. 293 (5533), 1323-1326 (2001).
- Bardeesy, N., et al. Loss of the Lkb1 tumour suppressor provokes intestinal polyposis but resistance to transformation. Nature. 419 (6903), 162-167 (2002).
- Miyoshi, H., et al. Gastrointestinal hamartomatous polyposis in Lkb1 heterozygous knockout mice. Cancer Research. 62 (8), 2261-2266 (2002).
- Jishage, K., et al. Role of Lkb1, the causative gene of Peutz-Jegher's syndrome, in embryogenesis and polyposis. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8903-8908 (2002).
- Shackelford, D. B. Unravelling the connection between metabolism and tumorigenesis through studies of the liver kinase B1 tumour suppressor. Journal of Carcinogenesis. 12, 16 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- Ji, H., et al. LKB1 modulates lung cancer differentiation and metastasis. Nature. 448 (7155), 807-810 (2007).
- Momcilovic, M., et al. Heightening energetic stress selectively targets LKB1-deficient non-small cell lung cancers. Cancer Research. 75 (22), 4910-4922 (2015).
- Wislez, M., et al. Inhibition of mammalian target of rapamycin reverses alveolar epithelial neoplasia induced by oncogenic K-ras. Cancer Research. 65 (8), 3226-3235 (2005).
- Liang, M. C., et al. TSC1 loss synergizes with KRAS activation in lung cancer development in the mouse and confers rapamycin sensitivity. Oncogene. 29 (11), 1588-1597 (2010).
- Hudes, G., et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. The New England Journal of Medicine. 356 (22), 2271-2281 (2007).
- Wander, S. A., Hennessy, B. T., Slingerland, J. M. Next-generation mTOR inhibitors in clinical oncology: how pathway complexity informs therapeutic strategy. The Journal of Clinical Investigation. 121 (4), 1231-1241 (2011).
- Pourdehnad, M., et al. Myc and mTOR converge on a common node in protein synthesis control that confers synthetic lethality in Myc-driven cancers. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11988-11993 (2013).
- Hsieh, A. C., et al. The translational landscape of mTOR signalling steers cancer initiation and metastasis. Nature. 485 (7396), 55-61 (2012).
- Momcilovic, M., et al. Heightening energetic stress selectively targets LKB1-deficient non-small cell lung cancers. Cancer Research. 75 (22), 4910-4922 (2015).
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature Reviews Cancer. 7 (9), 645-658 (2007).
- Shackelford, D. B., et al. LKB1 inactivation dictates therapeutic response of non-small cell lung cancer to the metabolism drug phenformin. Cancer Cell. 23 (2), 143-158 (2013).
- Momcilovic, M., et al. Targeted Inhibition of EGFR and Glutaminase Induces Metabolic Crisis in EGFR Mutant Lung Cancer. Cell Reports. 18 (3), 601-610 (2017).
- Goodwin, J., et al. The distinct metabolic phenotype of lung squamous cell carcinoma defines selective vulnerability to glycolytic inhibition. Nature Communications. 8, 15503 (2017).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- Dandekar, M., Tseng, J. R., Gambhir, S. S. Reproducibility of 18F-FDG microPET studies in mouse tumor xenografts. Journal of Nuclear Medicine. 48 (4), 602-607 (2007).
- Luker, G. D., Luker, K. E. Optical imaging: current applications and future directions. Journal of Nuclear Medicine. 49 (1), 1-4 (2008).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324 (5930), 1029-1033 (2009).
- Vander Heiden, M. G., DeBerardinis, R. J. Understanding the intersections between metabolism and cancer biology. Cell. 168 (4), 657-669 (2017).
- Zhang, W. C., et al. Glycine decarboxylase activity drives non-small cell lung cancer tumor-initiating cells and tumorigenesis. Cell. 148 (1-2), 259-272 (2012).
- Possemato, R., et al. Functional genomics reveal that the serine synthesis pathway is essential in breast cancer. Nature. 476, 346-350 (2011).
- Sullivan, L. B., et al. Supporting aspartate biosynthesis is an essential function of respiration in proliferating cells. Cell. 162 (7360), 552-563 (2015).
- Hassanein, M., et al. Preclinical evaluation of 4-[(18)F]fluoroglutamine PET to assess ASCT2 expression in lung cancer. Molecular Imaging and Biology. 18 (1), 18-23 (2016).
- Qu, W., et al. Preparation and characterization of L-[5-11C]-glutamine for metabolic imaging of tumors. Journal of Nuclear Medicine. 53 (1), 98-105 (2012).
- Venneti, S., et al. Glutamine-based PET imaging facilitates enhanced metabolic evaluation of gliomas in vivo. Science Translational Medicine. 7 (274), 217 (2015).
- Gambhir, S. S. Molecular imaging of cancer with positron emission tomography. Nature Reviews Cancer. 2 (9), 683-693 (2002).
- Keng, P. Y., et al. Micro-chemical synthesis of molecular probes on an electronic microfluidic device. Proceedings of the National Academy of Sciences of the United States of America. 109 (3), 690-695 (2012).
- Lazari, M., et al. ELIXYS - a fully automated, three-reactor high-pressure radiosynthesizer for development and routine production of diverse PET tracers. EJNMMI Research. 3 (1), 52 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon