Method Article
Utilizzando 18F-FDG PET/CT Imaging e l'istologia quantitativa per misurare i cambiamenti dinamici nel metabolismo del glucosio in modelli murini di cancro ai polmoni
In questo articolo
Riepilogo
In questo protocollo, descriviamo come utilizzare [18F]-2-fluoro-2-deoxy-D-glucose tomografia a emissione di positroni e la tomografia computata (18F-FDG PET/CT) imaging per misurare la risposta metabolica del tumore per la terapia mirata MLN0128 in un Kras/Lkb1 topo mutante modello di cancro ai polmoni e accoppiato con autoradiografia ex vivo ad alta risoluzione e l'istologia quantitativa di imaging.
Abstract
Un segno distintivo di tumori in stadio avanzati è un interruttore per glicolisi aerobica che prontamente è misurata da [18formazione immagine di tomografia a emissione di positroni (18F-FDG PET) del F]-2-fluoro-2-deoxy-D-glucose. Co-mutazioni nel proto-oncogene KRAS e gene soppressore del tumore LKB1 sono frequenti eventi nel cancro polmonare che guidano hypermetabolic, crescita tumorale glicolitico. Un percorso critico che regolano la crescita ed il metabolismo di questi tumori è la destinazione meccanicistica del pathway rapamycin (mTOR), che possono essere efficacemente mirati usando inibitori della chinasi mTOR catalitica selettiva. L'inibitore di mTOR MLN0128 sopprime la glicolisi in topi che sopportano i tumori con co-mutazioni Kras e Lkb1, indicate come topi KL. La risposta di terapia nei topi di KL è misurata prima di 18F-FDG PET e la tomografia computata (CT prima e dopo la consegna del MLN0128 di imaging). Utilizzando 18F-FDG PET/CT, i ricercatori sono in grado di misurare i cambiamenti dinamici nel metabolismo del glucosio in modelli murini geneticamente (GEMM) di cancro del polmone dopo un intervento terapeutico con terapie mirate. Questa è seguita da autoradiografia ex vivo e un'analisi di immunohistochemical quantitativa (qIHC) utilizzando software morfometrica. L'uso di qIHC permette il rilevamento e la quantificazione dei distinti cambiamenti nei profili biomarcatore seguendo il trattamento così come la caratterizzazione delle patologie tumorali distinti. L'accoppiamento di imaging PET alla istologia quantitativa è una strategia efficace per identificare le risposte metaboliche e terapeutiche in vivo in modelli murini di malattia.
Introduzione
La nostra ricerca si è concentrata su uno studio e targeting per tumori con mutazioni nella chinasi del fegato B1 (LKB1, noto anche come STK11) mutante cancri1. LKB1 è un oncosoppressore master che reprime mTOR complesso 1 (mTORC1) attraverso l'attivazione della chinasi AMP (AMPK) che conduce alla regolazione della crescita e il metabolismo. Di conseguenza, la perdita di LKB1 conduce ad un'attivazione di mTORC1 sfrenato, l'attivazione della risultante HIF1-alfa in un fenotipo metabolico glicolitico, comunemente indicato come il Warburg effetto2,3,4. Mutazioni inattivanti LKB1 direttamente portano allo sviluppo di una sindrome di pre-disposizione cancro familiare raro conosciuto come sindrome di Peutz-Jeghers sindrome (PJS) che è caratterizzata dallo sviluppo di polipi gastrointestinali benigni noto come amartomi5 , 6 , 7. Inoltre, LKB1 frequentemente co-muta con oncogene KRAS conseguente hypermetabolic e tumori del polmone umano aggressivo8,9.
Malattie correlate Lkb1 prontamente sono modellati in topi. L'inattivazione eterozigote di Lkb1 in topi porta allo sviluppo di amartomi accuratamente modellazione PJS10,11,12,13. Inoltre, mutazioni Lkb1 che prontamente sono modellate in topi con precisione ricapitolano fenotipi di cancro del polmone, pelle, pancreas e al seno14. La co-mutazione di Kras/Lkb1 nel tessuto polmonare dei topi transgenici, utilizzando un Cre ricombinasi-mediata attivazione dell'oncogene KrasG12D allele e biallelica eliminazione di Lkb1, provoca la formazione di tumori aggressivi e metastatico del polmone15 ,16. La caratterizzazione di KrasG12D; Lkb1- / - tumori del polmone (KL) isolati da topi dimostrano questi tumori hanno un'attivazione di mTORC1 alta e sono altamente glicolitici, utilizzando entrambe le misurazioni diretto metabolita di glucosio e lattato o misurazione del consumo di [18F] -2- fluoro-2-deoxy-D-glucosio (18F-FDG) di tomografia ad emissione di positroni (PET) con tomografia computata (CT) 17. MTORC1 iper-attivazione in LKB1 mutante tumori fornisce una spiegazione razionale chiara per il test entrambi inibitori della chinasi allosterico e catalitica di mTOR per il trattamento di questi tumori.
In uno studio precedente, abbiamo dimostrato che la rapamicina inibitore allosterico mTORC1 (RAPA) con successo ha inibito la crescita di e la glicolisi in tumori gastrointestinali (GI) utilizzando un Lkb1+ /- modello di topo transgenico di PJS3. RAPA è attualmente approvato come terapia singolo agente per il trattamento del carcinoma renale ma ha mostrato efficacia limitata in NSCLC18,19,20. RAPA è un inibitore allosterico mTORC1 e può essere migliorato tramite lo sviluppo di inibitori di chinasi catalitica di mTOR di nuova generazione che offrono un'inibizione quasi completa più dei complessi mTOR 1 e 2 (mTORC1 e mTORC2, rispettivamente)21. Farmaci come MLN0128 sono ora in corso di valutazione in studi preclinici e fase in anticipo studi clinici22,23. Uno studio recente dal nostro laboratorio hanno dimostrato che MLN0128 è un inibitore di mTOR potente in linee cellulari di tumore del polmone umano e in vivo in KL GEMM di polmone cancro15,16. MLN0128 soppresso il metabolismo della crescita e del glucosio del tumore del polmone in questi topi24.
In questo studio, approfittiamo dei modelli ben caratterizzati adenoviral Cre-indotta del mouse del cancro del polmone avviata da un condizionalmente attivato Lox-Stop-Lox-KRASG12D oncogene15,25. Questi topi di KrasG12D furono incrociati con topi avendo floxed alleli di Lkb1 (Lkb1L/L) per generare KrasG12D; Lkb1L/L (KL) topi16. Dopo la consegna intranasale di adeno - o lentivirus che esprimono Cre ricombinasi, i KL i topi sviluppano lesioni precoci di induzione del post-tumore 4 settimane. Da 6 settimane, i tumori nel cambiamento topi KL da tumori adenomatosi ad un fenotipo più maligno tumore aggressivo tipico di carcinomi del polmone e da 8-10 settimane, i topi sviluppano carcinomi franchi con un 100% penetranza16,26.
Entrambi PET/CT imaging e quantitativa immunohistochemistry può essere utilizzata per determinare le risposte molecolari e metaboliche come pure le risposte terapeutiche nei tumori dopo la consegna di mirate terapie come MLN012817, 26,27. Descritto qui è un protocollo sperimentale che utilizza 18F-FDG PET imaging per misurare la risposta metabolica ad una terapia mirata a MLN0128. Imaging PET con istologia quantitativa di accoppiamento consente la misurazione della risposta molecolare ad inibizione di mTOR, così come la quantificazione del carico del tumore e l'istologia del tumore.
Protocollo
Tutte le procedure descritte nel protocollo sono state approvate per la cura degli animali istituzionale e utilizzano Comitato (IACUC) presso l'Università di California, Los Angeles.
1. 18F-FDG PET e CT Imaging in topi
Attenzione: Utilizzare dispositivi di protezione durante la manipolazione di radioattività. Seguire tutte le procedure regolamentari applicabili quando si maneggia la radioattività.
- Posizionare la gabbia con i topi per essere stampato su un letto caldo a 37 ° C 1 h prima del 18iniezione di F-FDG per ridurre il consumo di grasso marrone di 18F-FDG.
Nota: I topi per 4-16 h di digiuno può aiutare a ridurre il consumo del miocardio di 18F-FDG. - Pesare il mouse e registrare il suo peso.
- Anestetizzare il mouse usando 2-3% isoflurane in ossigeno a 0,5 - 2 L/min per 2-3 minuti utilizzando una camera di anestesia mantenuta a 37 ° C. Assicurarsi che il mouse è stato anestetizzato pizzicando la punta; Nessuna reazione sarà osservato se il mouse è stato anestetizzato. Applicare unguento oftalmico agli occhi per prevenire qualsiasi secchezza durante l'anestesia.
- Diluire 18F-FDG (periodo di dimezzamento radioattivo 109 min) in soluzione salina sterile ad una concentrazione di iniezione di decadimento-corretto rettificato di 70-75 µ Ci/100 µ l.
Nota: Seguire la dose consigliata 18F del produttore dello scanner PET per l'imaging scanner ottimale. - Disegnare il 70-75 µ ci con una siringa da insulina con un ago 28 G, misurare la dose di radioattività utilizzando un calibratore di dose e registrare la misurazione e l'ora. Posizionare la siringa in un supporto di siringa di piombo.
Nota: La quantità di radioattività di 18F-FDG in ogni dose è misurata con un calibratore di dose, che è calibrato contro un materiale standard di riferimento, come il cesio-137, secondo i protocolli del produttore. Il tempo della lettura è registrato anche per determinare la correzione di decadimento. - Pungere l'estremità distale della coda del mouse e misurare il glucosio nel sangue del mouse con un glucometro.
- Caldo la coda per 1-2 min con una garza imbevuto in acqua tiepida. Pulire la coda con 70% di isopropanolo per dilatare la vena caudale appena prima dell'iniezione. Amministrare 100 µ l di 18F-FDG (l'intero volume nella siringa) con un bolo iniezione tramite la coda laterale della vena e registrare il tempo di iniezione. La restante dose nella siringa utilizzando il calibratore di dose di misurare e registrare la misurazione e l'ora.
Nota: Ci sarà qualche quantità di sonda rimasto nella siringa. È preferibile l'uso di siringhe per insulina siringhe connesso a aghi via Luer serrature a causa della quantità in diminuzione della dose intrappolata in ago della siringa dopo l'iniezione è stata somministrata. - Posizionare il mouse iniettato nella camera di anestesia tenuta sotto isoflurane 1.5-2% a 37 ° C per permettere alla sonda di essere distribuita tramite circolazione sistemica del mouse per 1 h prima della scansione PET.
Nota: Potrebbe essere utile per svuotare la vescica prima della scansione per consentire un più facile 18visualizzazione di F-FDG PET dei tumori impiantati nei fianchi inferiori del mouse. - Dopo 1 h, posizionare il mouse in una camera di imaging anestesia isoflurano cono di naso e a 37 ° C e fissare gli arti in posizione con nastro medico in posizione supina.
- Posizionare la camera di formazione immagine nello scanner PET/CT.
- Acquisire le scansioni PET e CT come descritto nei PET/CT scanner manuale28.
Nota: Le immagini PET sono acquisite per 600 s con una finestra di energia di keV 150-650, ricostruito usando massimazione di aspettativa massima verosimiglianza con correzioni per attenuazione del fotone, rivelatore normalizzazione e deperimento del radioisotopo (era una correzione di dispersione non applicate). Le immagini di CT sono acquisite in modo continuo per 50 s con un 50 kVp, sorgente di raggi x 200 µA e un rilevatore di piatto e si sono ricostruiti utilizzando l'algoritmo Feldkamp. - Una volta completata la PET/CT, rimuovere il mouse dal vano di imaging e consentirle di recuperare nella sua gabbia. Monitorare il mouse finché ha completamente ripreso conoscenza e può mantenere il decubito sternale.
- Importare le immagini PET/CT ricostruite nel software di AMMIDE facendo clic su File, quindi Aprie selezionando il file appropriato.
- Convertire i dati di PET per l'unità di dose iniettata per cento per grammo (%ID/g) inserendo la dose al momento della iniezione dopo contabili per qualsiasi dose residua rimasto nella siringa, o per l'unità del valore standardizzato di assorbimento (SUV) inserendo inoltre del soggetto peso. Per effettuare questa operazione, fare clic destro sul PET set di dati e individuare il campo di %ID/g sulla scheda Info di base immettere il %ID/g registrato in precedenza.
- Disegnare le regioni di interesse (ROI) sui tumori e tessuti normali (fegato, muscolo, polmone, cuore, cervello e grasso sottocutaneo). Per effettuare questa operazione, fare clic su modifica, selezionare Aggiungi ROI, selezionare ROI forma e dare il ROI di un nome. Disegnare ROIs sopra tumori e tessuti e regolare le dimensioni per coprire il tessuto di interesse in tutti i 3 assi.
Nota: Per tenere conto delle differenze in PET sonda biodistribuzione tra animali, tumore ROI può essere ulteriormente normalizzati a valori ROI del fegato, un organo ben irrorato con minima attività glicolitica che rappresenta 18F-FDG in circolazione. Analisi ROI del tumore e i tessuti normali sono eseguite sul mouse stesso. Lesioni del tumore del polmone sono generalmente identificate da 18F-FDG PET dal momento che la ritenzione di 18F-FDG in un polmone normale è relativamente bassa. CT è usato anche per identificare le lesioni, in particolare le lesioni che sono 18F-FDG non-avid. Un'analisi ex vivo dei polmoni isolati aiuta anche a localizzare lesioni tumorali.
2. 18F-FDG autoradiografia
- Preparare il mouse per l'imaging con 18F-FDG eseguendo i passaggi 1.1-1.12, tranne ora, diluire 18F-FDG in soluzione salina sterile ad una concentrazione di iniezione di decadimento-corretto rettificato di 1.000 µ ci/200 µ l.
Nota: Le dosi elevate di 18F-FDG sono utilizzate per autoradiografia per tenere conto per ulteriore esempio tempo di elaborazione e una rilevazione ottima di piastre al fosforo. - Eutanasia il mouse tramite un letale inalazione di isoflurane al 5% o di CO2 (una procedura IACUC-approvato).
Nota: Dislocazione cervicale non deve essere utilizzata come questo può danneggiare il tessuto polmonare. - Appuntare giù il mouse con la superficie ventrale esposta e spruzzarlo con etanolo al 70% di mat giù i capelli prima dell'incisione.
- Aprire la cavità toracica applicando un'incisione del midline, tagliando via il diaframma e rimuovendo le pareti del torace. Esporre la trachea rimuovendo con attenzione la ghiandola salivaria. Posizionare il bulldog morsetto sulla trachea come vicino la mascella come possibile, garantendo una perfetta aderenza sulla trachea. Posto un ago di 23 G collegato ad una siringa da 3 mL all'interno della trachea di sotto del morsetto del bulldog e iniettare ~ 2 mL di soluzione (ottimale taglio temperatura: tampone fosfato isotonico) OCT:PBS (1:1).
Nota: OCT è molto viscoso ed è mescolato con PBS per consentire una più facile iniezione nei polmoni. - Rimuovere l'ago dalla trachea e utilizzare pinze per serrare il punto di iniezione per evitare qualsiasi fuoriuscita della soluzione OCT:PBS.
- Con attenzione rimuovere i polmoni dalla cavità toracica e il lobo di sinistra di separato dal resto dei polmoni. Posto il lobo di sinistra in cryomold con etichetta riempito con poche gocce di OCT. Una volta che il lobo del polmone è all'interno dello stampo, riempire il cryomold verso l'alto con OCT.
- Ripetere la stessa procedura con la metà destra dei polmoni.
Nota: Se il segnale di 18F-FDG nel cuore dovrebbe essere alta o se i tumori del polmone sono situati vicino al cuore, potrebbe essere utile rimuovere il cuore al fine di evitare eventuali perdite di tracciante. In alternativa, polmoni intero possono essere incorporati in una singola cryomold. È importante evitare bolle d'aria quando si lavora con OCT. - Mediante pinze lunghe, inserire il cryomold preparato in un contenitore chiuso-cellula di polistirene espanso estruso contenente una miscela di ghiaccio secco e isopentano.
Nota: Questa miscela dovrebbe essere a circa-70 ° C prima di mettere il cryomold in esso per congelamento. Dopo l'indurimento, il composto di OCT diventerà bianco. Se campioni multipli sono trattati allo stesso tempo, i campioni congelati in OCT cryomolds possono essere immagazzinati temporaneamente il ghiaccio secco. - Rimuovere il blocco congelato dal cryomold e montarlo su un criostato per il sezionamento. Sezione del blocco con uno spessore di 4 µm utilizzando lame microtomo (34°/80 mm, profilo alto). Trasferire le sezioni di tessuto in una lastra di vetro che sia stata conservata a temperatura ambiente.
- Posizionare i vetrini su un piastra di imaging di fosforo. Posizionare la piastra nella cassetta e chiuderla delicatamente per impedire lo spostamento di diapositive. Conservare la cassetta in un congelatore a-20 ° C per l'esposizione di piastra, generalmente durante la notte.
Nota: Le piastre e le cassette devono essere pre-raffreddate a-20 ° C prima dell'uso. Ponendo i campioni a-80 ° C è accettabile. - Dopo l'esposizione, è necessario rimuovere le diapositive dalla piastra e leggere la piastra sul lettore di immagine.
- Le diapositive possono essere avvolto in involucro di plastica e conservate a-80 ° C, o possono essere preparate per ematossilina ed eosina o immunohistochemistry.
3. raccolta del tessuto polmonare per istologia
- Seguire i passaggi 2.2-2.4, ma ora, invece di utilizzare la soluzione di OCT:PBS, iniettare 2-3 mL di formalina tamponata al 10% normale risolvere i polmoni.
- Rimuovere l'ago dalla trachea e utilizzare pinze per serrare il punto di iniezione per evitare qualsiasi fuoriuscita di formalina. Con attenzione rimuovere i polmoni dalla cavità toracica e inserirli in una provetta conica 50 mL contenente ~ 20 mL di formalina tamponata al 10% normale per 16-24 h per garantire un fissaggio completo.
Nota: I polmoni di fissaggio permette per la conservazione delle caratteristiche anatomiche ottimale. - Il giorno successivo, trasferire i polmoni fissi da formalina al 70% di etanolo e preparare i polmoni per essere collocato in una cassetta di tessuto.
- Preparare i polmoni per l'istologia dissecando attentamente lobi con le forbici per tagliare in punti di ramo tra 5 lobi, numerati 1-5 come mostrato in Figura 1,De metterli in un orientamento non sovrapposte nella cassetta del tessuto. Posizionare un tappetino in gomma delicatamente il tessuto polmonare di mantenere intatto l'orientamento.
- Conservare i lobi del polmone dissecato in etanolo al 70% fino a quando l'inclusione in paraffina.
- Paraffina-incorpora il tessuto in cassette e tagliare 4 µm spessore sezioni per la colorazione, utilizzando le procedure standard.
4. tessuto segmentazione e quantificazione mediante Software commerciale
- Eosina (H & E) e immagine macchiato sezioni del polmone ad un ingrandimento X 1,25 utilizzando un sistema di imaging multispettrale commerciale.
- Convertire le immagini in cubi di immagine digitale e caricare librerie spettrali precostruite (fare clic su File, quindi su Caricamento libreria spettrale) per H & E.
Nota: Le librerie spettrali sono state sviluppate in anticipo con l'acquisizione di immagini spettrali da sezioni singolarmente macchiato del polmone, una sezione colorati solo con eosina e l'altro solo colorate con ematossilina, che sono stati salvati in una libreria spettrale proprietaria di open source file. (CSL). Il sistema di imaging ha funzionamento del software che acquisisce un'immagine a ogni lunghezza d'onda che è necessario (come definito dal protocollo di acquisizione). Quelle immagini (il "cubo di immagine") sono memorizzati in un formato di file multispettrali proprietario di open source (.im3). Spettri sono estratte dal cubo immagine utilizzando il software morfometriche e memorizzati in file di libreria spettrale separata. - Unmix spettralmente il pseudo-colore H & E immagini dei polmoni interi facendo clic sul pulsante Unmix .
Nota: Unmixing prende meno di 1 s. Il numero di pixel in ogni tipo di tessuto sono stato quantificato utilizzando software di analisi morfometrica. - Visualizzare ogni cubo immagine convertendo i dati multispettrali nell'equivalente 3 colori (rosso, verde e blu) immagine utilizzando risposta dipendente dalla lunghezza d'onda di colore dell'occhio convoluzione con l'intensità di ogni immagine.
Nota: Le 3 immagini risultanti vengono visualizzate come un'immagine di colore di 24 bit standard. - Pseudo-colore ogni immagine non miscelati ridimensionando l'immagine in una scelta dall'utente (ad es., rosso, verde, viola, ecc.) di colore e aggiungere che, insieme con le altre immagini non miscelate pseudo-colorate nell'immagine di un colore di 24 bit standard.
- Utilizzare le impostazioni predefinite per tutte le analisi.
Nota: In generale, dal momento che questo tipo di segmentazione si basa su una valutazione visiva dei risultati (cioè, una valutazione di quanto bene la segmentazione sulle immagini di fuori della formazione set funziona), è importante dividere correttamente le immagini in formazione, test e validazione insiemi. - Iniziare con 2-3 immagini come un set di training (10-15 per i campioni di biopsia umana), treno su quelli fino a guardare bene i risultati, quindi applicano tale algoritmo per immagini di un altro 2-3. Quindi, applicare l'algoritmo risultante al set completo di convalida.
Nota: È molto probabile che alcuni riqualificazione saranno necessari. - Analizzare l'area del tumore in sezioni del polmone intero calcolando il numero di pixel totali per i tumori di pseudo-colorati rossi nei lobi 1-5 di ogni mouse.
Nota: Il tessuto normale è stato pseudo-colorato verde e sangue/sangue vasi erano pseudo-colorate rosa come mostrato nella Figura 3. Il peso medio del tumore per ciascun gruppo di trattamento è stato calcolato misurando il numero di pixel totali per ogni mouse nel gruppo di trattamento.
Risultati
18 F-FDG PET imaging è stata eseguita su KL topi e ha dimostrato che i tumori in questi topi erano altamente glicolitici come mostrato da un consumo elevato 18F-FDG (Figura 1A), concordando con gli studi precedentemente pubblicati26, 29. Una resezione di interi polmoni ha rivelato la presenza di parecchi tumori (Figura 1B). I polmoni del mouse possono essere suddivisa in 5 lobi separati rappresentati nelle figure 1 e D 1. 1-5 lobi sono stati etichettati sui polmoni sezionati che erano macchiati con H & E o glucosio transporter 1 (Glut1) (Figura 1D). GLUT1 è un trasportatore primario di glucosio e 18F-FDG e la sua espressione e localizzazione alla membrana plasmatica delle cellule del tumore direttamente correlare con 18F-FDG SUV29. Un'analisi di risoluzione superiore di Glut1 macchiatura (40 X) in 18F-FDG-avid tumori del polmone mostra un'elevata espressione e la localizzazione del trasportatore sulla membrana plasmatica (Figura 1D).
A causa della limitata risoluzione dell'imaging PET, PET/CT sia tessuto autoradiografia sono stati effettuati. La risoluzione più alta di autoradiografia potrebbe identificare i tumori più piccoli e/o eterogeneità del tumore 18distribuzione F-FDG. Dopo l'induzione del tumore, 18F-FDG PET/CT imaging è stata eseguita su topi KL (Figura 2A) seguiti da autoradiografia su polmoni isolati da questi topi (figure 2B e 2C). Come si vede nelle figure 2B e 2C, l'autoradiografia identificato due ulteriori più piccoli tumori che erano positivi per 18F-FDG ancora non erano facilmente visibili da PET. In seguito autoradiografia, le diapositive con il tessuto potrebbero essere utilizzate anche per la colorazione immunoistochimica (IHC) di biomarker(s). H & E che macchia per i tumori ha confermato la presenza di tumori nel lobo di sinistra (Figura 2D).
Successivamente, 18F-FDG PET imaging è stata eseguita su MLN0128-trattati KrasG12D; Lkb1- / - topi al fine di utilizzare 18F-FDG come biomarcatore funzionale del metabolismo del glucosio nei tumori del polmone (Figura 3). Abbiamo identificato che un trattamento con MLN0128 robustamente inibita la segnalazione di mTORC1 e glicolisi come mostrato da un consumo ridotto 18F-FDG (figure 3A e 3B). Questi risultati concordano con gli studi preclinici valutare MLN0128 nei topi KL come precedentemente pubblicati dal nostro laboratorio17,27. Infine, IHC macchiatura è stata effettuata sui tumori (Figura 3C). I tumori sono stati macchiati per H & E o con anticorpi fosfo-S6, che è un substrato conservato di mTORC1 e viene utilizzata per indicare un'attivazione di mTORC1 (P-S6) vs inattivazione (S6). Figura 3 C Mostra una robusta inibizione di P-S6 di MLN0128 in KL tumori rispetto a quelli trattati con un veicolo, che concorda con lavoro precedentemente pubblicato17. Oltre a KRAS, driver oncogeno come il recettore del fattore di crescita epidermico (EGFR) supportano il metabolismo glicolitico nei tumori del polmone come bene. Di conseguenza, abbiamo verificato se l'inibizione di EGFR di mutante costitutivamente attivo con erlotinib ha soppresso il metabolismo di 18F-FDG negli xenotrapianti del mouse. Figure 3D e 3E mostrano che la linea del tumore del polmone umano HCC827, che ospita una mutazione di EGFR del19, ha mostrato un consumo notevolmente ridotto 18F-FDG dopo cinque giorni di trattamento di erlotinib.
Infine, è stata eseguita l'analisi morfometrica del tessuto polmoni sezionati e tumori del polmone a quantificare l'onere totale del tumore come pure da differenziare patologie tumorali che comprendeva sottotipo dei tessuti, necrosi, i vasi sanguigni dal tessuto polmonare normale e lo spazio aereo. Il GEMM KL hanno sviluppato una malattia complessa e patologico eterogenea che si è presentato con i tumori del polmone di histopathologies diverse. Questi includono gli adenocarcinomi (ADC) e cellule squamose (SCC)-questa eterogeneità rende il trattamento di questo cancro una sfida formidabile. Figura 4 A Mostra un singolo lobo del polmone macchiato, H & E, con due grandi tumori presenti. Le immagini di ingrandimento superiore illustrate nella Figura 4B identificano un normale necrosi polmonare, vasi e lo spazio aereo e del tumore come pure l'adenocarcinoma, caratterizzata da una struttura papillare ben definita e un carcinoma di cellule squamous. Figura 4 C rappresenta la pseudo-colorazione del lobo del polmone e del tumore utilizzando software morfometrica Inform. Figura 4 D Mostra le percentuali di polmone normale, vasi e patologie individuali come fattore di necrosi tumorale e sottotipi di tumore che segmentato adenocarcinoma bene-differenziato da carcinoma di cellule squamous.

Figura 1 : Metabolicamente attivo KrasG12D; Lkb1- / - (KL) mutante polmone tumori sono 18F-FDG positivo ed esprimere alti livelli del trasportatore 1 del glucosio (Glut1). Pannelli A e B mostrano una proiezione di massima intensità [noto anche come un'immagine 3-dimensionale (3D)] del 18F-FDG-PET e CT analisi su alcuni topi FDG-avid KL che harboring tumori squamosi del polmone. Vengono mostrati (A) una ricostruzione 3D e visualizzazioni di trasversale, sagittale e coronale (B) dei tumori del polmone come (T). (C) questo pannello mostra un'istologia del polmone intero del mouse KL imaged in pannelli A e B, o macchiato per H & E (pannello superiore) o con un anticorpo specifico per Glut1 (pannello inferiore). I lobi del polmone sono numerati. La barra della scala = 2 mm. (D) questo diagramma rappresenta l'orientamento e il numero di lobi nei topi (pannello superiore) e immagini ad alta risoluzione 40 X dei tumori H & E - o Glut1-macchiate dalle diapositive visualizzate nel pannello C per H & E (pannello centrale) o macchiato con un anticorpo specifico per Glut1 (pannello inferiore). La barra della scala = 25 µm. Clicca qui per visualizzare una versione più grande di questa figura.
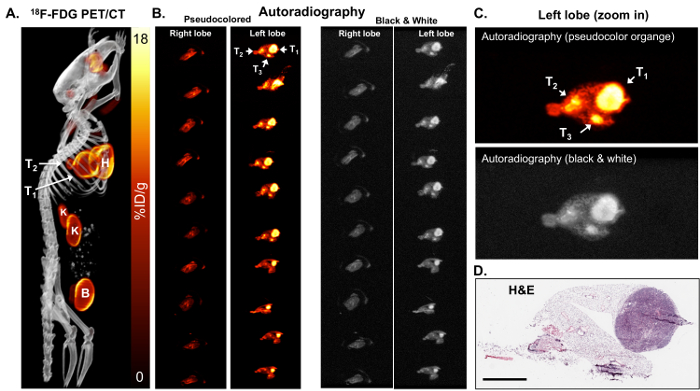
Figura 2: 18 Autoradiografia di F-FDG in grado di identificare piccoli tumori che sono metabolicamente attivi. (A) questa immagine di F-FDG PET/CT 18Mostra 18F-FDG-avid tumori in un mouse KL visualizzato come un'immagine di massima intensità di proiezione. T1 e T2 = tumori, H = cuore, B = vescica, K = i reni. (B), questo pannello mostra l'autoradiografia ex vivo su sezioni di serie dei lobi del polmone destro e sinistro del mouse. I polmoni nei pannelli di sinistro e destro sono identici. I polmoni nei pannelli a sinistra sono pseudo colorata arancione. I polmoni nei pannelli di destro sono colorati in bianco e nero. I tumori (T1, T2 e T3) sono indicati con le frecce. (C) Questa è una vista ingrandita del pseudocolored di autoradiografia arancione (pannello superiore) e in bianco e nero (pannello inferiore). (D) questo pannello mostra la colorazione H & E della sezione superiore del lobo di sinistra indicato nel pannello B. La barra della scala = 200 µm Clicca qui per visualizzare una versione più grande di questa figura.
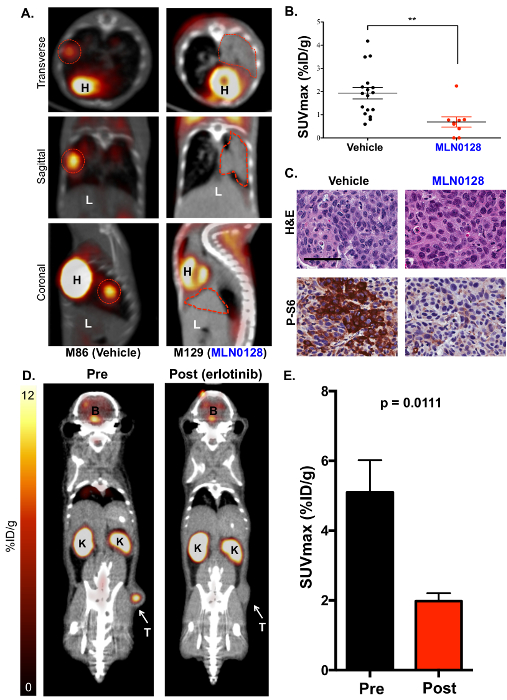
Figura 3 : L'inibitore di mTOR MLN0128 sopprime il consumo del glucosio nei tumori del polmone di topi KL come rilevato da 18F-FDG PET. (A) questo pannello mostra rappresentante 18immagini di F-FDG PET/CT di KL topi trattati con un veicolo (18F-FDG avid, sinistra) o MLN0128 (18F-FDG non-avid, destra). La trasversale (pannello superiore), coronale (pannello centrale) e sagittale (pannello inferiore) viste sono mostrate. I tumori sono delineati con linee rosse; H = cuore, L = il fegato. (B), questo pannello mostra una quantificazione di SUVmax (%ID/g) fra i tumori trattati con veicolo e MLN0128. (C) questo pannello mostra la colorazione H & E e P-S6 di sezioni del polmone intero da KL topi trattati con veicolo o MLN0128. La barra della scala = 25 µm. (D), questo pannello spettacoli rappresentante 18F-FDG-PET e immagini di CT degli xenotrapianti HCC827 EGFR (del19) pre- e post-erlotinib trattamento. Il tumore (T) è indicato con una freccia, K = rene, B = il cervello. (E), questo pannello mostra una quantificazione di SUVmax (%ID/g) per gli xenotrapianti HCC827 prima e dopo il trattamento di erlotinib. n = 10 tumori/gruppo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Carico del tumore e l'istologia del tumore sono quantificati utilizzando software morfometrica.
(A), questo pannello mostra la colorazione H & E di un lobo del polmone del mouse con un tumore raccolti da un mouse KL. (B) queste immagini ad alta risoluzione mostrano il carcinoma di cellule squamous (in alto a sinistra), polmone normale, i vasi sanguigni e lo spazio di aria (in alto a destra) e l'adenocarcinoma papillare bene-differenziato (in basso a sinistra) e necrosi (in basso a destra). (C) questo pannello mostra il pseudocoloring di H & colorati del polmone lobo utilizzando software morfometrica. (D) questo pannello mostra le percentuali per il polmone di singola patologie del lobo e tumore misurati da Inform. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo articolo viene descritto un approccio sperimentale basato su formazione immagine che utilizzava la formazione immagine 18F-FDG PET/CT con qIHC al fine di misurare entrambe le risposte metaboliche e molecolari nei tumori del polmone dopo la consegna dell'inibitore mTOR MLN0128. MLN0128 efficacemente ridotto 18consumo di F-FDG, che indica una significativa risposta metabolica nei tumori. Collegando la formazione immagine di PET/CT a immunohistochemistry, siamo riusciti a nello spazio del registro tumori sezionati per le immagini 3D di PET/CT ed eseguire un esame dettagliato dei tumori tutto a livello cellulare e molecolare. Questo ha permesso di confermare che il MLN0128 ha inibito la segnalazione del mTOR, confermando così una risposta molecolare on target al farmaco nei tumori. Infine, approfittando dell'istologia quantitativa, siamo stati in grado di mappare e patologie tumorali di distinti separati, come massa complessiva del tumore da necrosi del tumore, definiscono l'adenocarcinoma da carcinomi a cellule squamose e completano microPET imaging.
MicroPET è attualmente limitato da una risoluzione spaziale di circa 1 mm. Inoltre, 18ritenzione di F-FDG in determinati tessuti può essere influenzata da vari fattori, tra cui i livelli del glucosio del plasma, il tipo e la durata dell'esposizione anestetica, la temperatura ambientale e la salute generale dell'animale, che può avere un impatto 18 F-FDG farmacocinetica30. Questi parametri sono stati ottimizzati per questo protocollo, ma dovrebbero essere ottimizzati per ogni modello animale. Gli studi di riproducibilità di 18F-FDG imaging dei tumori sottocutanei in topi dimostrano un coefficiente di variazione per la %ID/g media di circa il 15%, suggerendo che la risposta terapeutica di tumore di un mouse singolo valutati da 18 F-FDG PET dovrebbe essere superiore a questa soglia per essere considerato affidabile e significativa31.
La distribuzione cellulare e subcellulare anche di traccianti PET può essere valutata mediante autoradiografia del tessuto con le sezioni successivamente macchiato e co-registrato con qIHC. Co-registrazione PET con CT permette un'immagine PET da mettere in un contesto anatomico; Questo è estremamente prezioso, anche con contrasto basso e morbido del tessuto. La mancanza di contrasto dei tessuti molli di CT può essere superata con la formazione immagine a risonanza magnetica (MRI). Inoltre, biomarcatori per l'imaging di fluorescenza possono essere utilizzati per valutare la glicolisi in vivo, ma assorbimento di fotoni e dispersione nella cavità del polmone può influenzare l'accurata quantificazione o rilevamento sensibilità32. In sintesi, utilizzando animale intero imaging PET/TC con istologia quantitativa fornisce una mappa accurata e in tempo reale di biologia del tumore dopo l'intervento terapeutico.
L'imaging multispettrale (MSI) è applicabile in qualsiasi situazione in cui potrebbe essere utilizzato un immagine a colori. Perlomeno, MSI fornisce le stesse informazioni di un'immagine a colori, e per alcune applicazioni, MSI può fornire che informazioni più dettagliate sulle proprietà spettrali di un campione di una semplice immagine di banda larga a tre colori (RGB). In generale, le limitazioni di MSI sono quelle di colore imaging, tranne che è più lento e richiede più tempo per acquisire immagini MSI. Il software morfometrica è stato utilizzato per ottenere risultati riproducibili, accurata segmentazione per le immagini e descritto in Tabella materiali. Ci sono ulteriori prodotti disponibili in commercio che possono essere utilizzati per la segmentazione dei tessuti e la quantificazione dell'istologia.
La complessità del metabolismo tumorale si estende oltre l'effetto Warburg e glucosio metabolismo33,34. È molto probabile che i tumori prontamente si adattano ai trattamenti di singolo agente che inibiscono la glicolisi. L'affidamento su metabolismo degli aminoacidi è stata ben documentata in cancro, e si prevede che i tumori si basano su una serie di aminoacidi come la glutammina, glicina e serina, come pure altri metaboliti quali gli acidi grassi liberi35,36, 37. Oltre 18F-FDG, sonde come 18F - e 11C-etichetta glutamina, colina, acetato, 1-(2'-deossi-2'-fluoroarabinofuranosyl) citosina (FAC) e fluorothymidine (FLT) hanno usato con successo a immagine dell'amminoacido, nucleotide e metabolismo dei lipidi in modelli animali di cancro38,39,40,41. Microscala tracciante radiochimica tecnologie di automazione e accoppiati con maggiore risoluzione, scanner di PET sensibilità superiore migliorerà l'accessibilità dell'animale domestico per misurare varie procedure biologiche42,43. Come la comprensione del metabolismo aumenta, è logico che il repertorio di radiotraccianti PET aumenterà pure, permettendo i ricercatori e i medici non invadente metabolismo del tumore di profilo.
L'utilizzo dell'istologia quantitativa e di imaging PET/CT risolve una necessità clinica, che è di tradurre rapidamente scoperte panca in uso clinico. A tale scopo, i ricercatori devono essere in grado di misurare con precisione la risposta terapeutica, come pure la resistenza acquisita ai farmaci, quale formazione immagine di PET/CT consente. Inoltre, l'analisi PET/CT e immunohistochemical dei tumori del polmone sono utilizzati come standard di cura per i pazienti e, quindi, sono direttamente traducibili in pratica clinica. D'importanza, formazione immagine di PET/CT identifica facilmente tumori resistenti alla terapia, cui i ricercatori possono isolare e interrogare a livello molecolare al fine di comprendere meglio i meccanismi della malattia. Si tratta di un processo iterativo che ha reso possibile per meglio comprendere i meccanismi di resistenza e progettare strategie terapeutiche più efficaci per la traduzione clinica.
Divulgazioni
Kevin P. Francis è un dipendente della Perkin Elmer. James Mansfield è un azionista pubblico delle azioni di PerkinElmer, Inc (PKI) sul NASDAQ. Gli autori hanno nient'altro da divulgare.
Riconoscimenti
Si ringrazia l'Università di California Los Angeles' Crump preclinici Imaging Technology Center per la loro assistenza con l'imaging PET/CT dei topi, il traslazionale laboratorio di patologia Core e Core Statistiche presso la University of California Los Angeles' David Geffen School of Medicine per la loro assistenza con la preparazione del campione del tumore e l'analisi. Per il finanziamento, David B. Shackelford è stata sostenuta dalla CTSI e KL2 traslazionale Science Award concedere numeri KL2TR000122 e UL1TR000124 presso la David Geffen School of Medicine presso la UCLA e dal dipartimento di difesa del polmone cancro ricerca programma traslazionale Ricerca Partnership W81XWH-13-1-0459 e ACS RSG-16-234-01-TBG. Sean T. Bailey è stata sostenuta da una sovvenzione di formazione T32 NIH HL072752 attraverso la David Geffen School of Medicine alla UCLA. Anthony Jones è supportato dal programma di formazione biologia delle cellule di tumore UCLA (USHHS Ruth L. Kirschstein istituzionale nazionale ricerca Service Award # T32 CA009056). Gihad Abdelhady è supportato da un R01CA208642 di supplemento di diversità NIH/NCI.
Materiali
| Name | Company | Catalog Number | Comments |
| G8 PET/CT | Perkin Elmer | CLS139564 | Used for 18F-FDG PET and CT imaging of mice |
| Axio Imager.M2 | Zeiss | 490020-0003-000 | Acquiring images of FFPE lung tumor sections |
| Inform software | Perkin Elmer | CLS135781 | Morphometric used for image analysis of tumor pathologies |
| Glut1 antibody | Alpha Diagnostics | GT12-A | IHC staining of FFPE lung tumor sections |
| Phospho-S6 Ribosomal Protein (Ser235/236) (D57.2.2E) XP™ Rabbit mAb | Cell Signaling Technologies | 4858 | IHC staining of FFPE lung tumor sections |
| MX35 Premier microtome blades | Thermo Fisher Scientific | 3051835 | Microtome blades for sectioning tissue for autoradiography |
Riferimenti
- Shackelford, D. B., Shaw, R. J. The LKB1-AMPK pathway: metabolism and growth control in tumour suppression. Nature Reviews Cancer. 9 (8), 563-575 (2009).
- Shaw, R. J., et al. The LKB1 tumor suppressor negatively regulates mTOR signaling. Cancer Cell. 6 (1), 91-99 (2004).
- Shackelford, D. B., et al. mTOR and HIF-1alpha-mediated tumor metabolism in an LKB1 mouse model of Peutz-Jeghers syndrome. Proceedings of the National Academy of Sciences of the United States of America. 106 (27), 11137-11142 (2009).
- Faubert, B., et al. Loss of the tumor suppressor LKB1 promotes metabolic reprogramming of cancer cells via HIF-1alpha. Proceedings of the National Academy of Sciences of the United States of America. 111 (7), 2554-2559 (2014).
- Hemminki, A. The molecular basis and clinical aspects of Peutz-Jeghers syndrome. Cellular and Molecular Life Sciences. 55, 735-750 (1999).
- Hemminki, A., et al. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. Nature. 391 (6663), 184-187 (1998).
- Sanchez-Cespedes, M. A role for LKB1 gene in human cancer beyond the Peutz-Jeghers syndrome. Oncogene. 26 (57), 7825-7832 (2007).
- Sanchez-Cespedes, M., et al. Inactivation of LKB1/STK11 is a common event in adenocarcinomas of the lung. Cancer Research. 62 (13), 3659-3662 (2002).
- Ding, L., et al. Somatic mutations affect key pathways in lung adenocarcinoma. Nature. 455 (7216), 1069-1075 (2008).
- Ylikorkala, A., et al. Vascular abnormalities and deregulation of VEGF in Lkb1-deficient mice. Science. 293 (5533), 1323-1326 (2001).
- Bardeesy, N., et al. Loss of the Lkb1 tumour suppressor provokes intestinal polyposis but resistance to transformation. Nature. 419 (6903), 162-167 (2002).
- Miyoshi, H., et al. Gastrointestinal hamartomatous polyposis in Lkb1 heterozygous knockout mice. Cancer Research. 62 (8), 2261-2266 (2002).
- Jishage, K., et al. Role of Lkb1, the causative gene of Peutz-Jegher's syndrome, in embryogenesis and polyposis. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8903-8908 (2002).
- Shackelford, D. B. Unravelling the connection between metabolism and tumorigenesis through studies of the liver kinase B1 tumour suppressor. Journal of Carcinogenesis. 12, 16 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- Ji, H., et al. LKB1 modulates lung cancer differentiation and metastasis. Nature. 448 (7155), 807-810 (2007).
- Momcilovic, M., et al. Heightening energetic stress selectively targets LKB1-deficient non-small cell lung cancers. Cancer Research. 75 (22), 4910-4922 (2015).
- Wislez, M., et al. Inhibition of mammalian target of rapamycin reverses alveolar epithelial neoplasia induced by oncogenic K-ras. Cancer Research. 65 (8), 3226-3235 (2005).
- Liang, M. C., et al. TSC1 loss synergizes with KRAS activation in lung cancer development in the mouse and confers rapamycin sensitivity. Oncogene. 29 (11), 1588-1597 (2010).
- Hudes, G., et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. The New England Journal of Medicine. 356 (22), 2271-2281 (2007).
- Wander, S. A., Hennessy, B. T., Slingerland, J. M. Next-generation mTOR inhibitors in clinical oncology: how pathway complexity informs therapeutic strategy. The Journal of Clinical Investigation. 121 (4), 1231-1241 (2011).
- Pourdehnad, M., et al. Myc and mTOR converge on a common node in protein synthesis control that confers synthetic lethality in Myc-driven cancers. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11988-11993 (2013).
- Hsieh, A. C., et al. The translational landscape of mTOR signalling steers cancer initiation and metastasis. Nature. 485 (7396), 55-61 (2012).
- Momcilovic, M., et al. Heightening energetic stress selectively targets LKB1-deficient non-small cell lung cancers. Cancer Research. 75 (22), 4910-4922 (2015).
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature Reviews Cancer. 7 (9), 645-658 (2007).
- Shackelford, D. B., et al. LKB1 inactivation dictates therapeutic response of non-small cell lung cancer to the metabolism drug phenformin. Cancer Cell. 23 (2), 143-158 (2013).
- Momcilovic, M., et al. Targeted Inhibition of EGFR and Glutaminase Induces Metabolic Crisis in EGFR Mutant Lung Cancer. Cell Reports. 18 (3), 601-610 (2017).
- Goodwin, J., et al. The distinct metabolic phenotype of lung squamous cell carcinoma defines selective vulnerability to glycolytic inhibition. Nature Communications. 8, 15503 (2017).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- Dandekar, M., Tseng, J. R., Gambhir, S. S. Reproducibility of 18F-FDG microPET studies in mouse tumor xenografts. Journal of Nuclear Medicine. 48 (4), 602-607 (2007).
- Luker, G. D., Luker, K. E. Optical imaging: current applications and future directions. Journal of Nuclear Medicine. 49 (1), 1-4 (2008).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324 (5930), 1029-1033 (2009).
- Vander Heiden, M. G., DeBerardinis, R. J. Understanding the intersections between metabolism and cancer biology. Cell. 168 (4), 657-669 (2017).
- Zhang, W. C., et al. Glycine decarboxylase activity drives non-small cell lung cancer tumor-initiating cells and tumorigenesis. Cell. 148 (1-2), 259-272 (2012).
- Possemato, R., et al. Functional genomics reveal that the serine synthesis pathway is essential in breast cancer. Nature. 476, 346-350 (2011).
- Sullivan, L. B., et al. Supporting aspartate biosynthesis is an essential function of respiration in proliferating cells. Cell. 162 (7360), 552-563 (2015).
- Hassanein, M., et al. Preclinical evaluation of 4-[(18)F]fluoroglutamine PET to assess ASCT2 expression in lung cancer. Molecular Imaging and Biology. 18 (1), 18-23 (2016).
- Qu, W., et al. Preparation and characterization of L-[5-11C]-glutamine for metabolic imaging of tumors. Journal of Nuclear Medicine. 53 (1), 98-105 (2012).
- Venneti, S., et al. Glutamine-based PET imaging facilitates enhanced metabolic evaluation of gliomas in vivo. Science Translational Medicine. 7 (274), 217 (2015).
- Gambhir, S. S. Molecular imaging of cancer with positron emission tomography. Nature Reviews Cancer. 2 (9), 683-693 (2002).
- Keng, P. Y., et al. Micro-chemical synthesis of molecular probes on an electronic microfluidic device. Proceedings of the National Academy of Sciences of the United States of America. 109 (3), 690-695 (2012).
- Lazari, M., et al. ELIXYS - a fully automated, three-reactor high-pressure radiosynthesizer for development and routine production of diverse PET tracers. EJNMMI Research. 3 (1), 52 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon