Method Article
Utilizando 18F-FDG PET-CT Imaging e histologia quantitativa para medir mudanças dinâmicas no metabolismo glicose em modelos de Mouse de câncer de pulmão
Neste Artigo
Resumo
Neste protocolo, descrevemos como utilizar [18F]-2-fluoro-2-deoxy-D-glucose tomografia por emissão de pósitrons e tomografia computadorizada (18F-FDG PET-CT), imagem latente para medir a resposta metabólica do tumor para a terapia-alvo MLN0128 em um Kras/Lkb1 rato mutante modelo de câncer de pulmão e juntamente com autoradiografia ex vivo de alta resolução e histologia quantitativa de imagem.
Resumo
Uma característica dos tumores avançados é um interruptor de glicólise aeróbica que é facilmente medido pelo [imagem de emissão de positrões (18F-FDG PET) de18F]-2-fluoro-2-deoxy-D-glucose. Co de mutações no proto-oncogene o KRAS e o gene supressor de tumor LKB1 são eventos frequentes no câncer de pulmão que impulsionam o hipermetabolismo, o crescimento do tumor glicolítico. Um caminho crítico que regulam o crescimento e o metabolismo destes tumores é o alvo mecanicista da via rapamicina (mTOR), que pode efetivamente ser alvo usando inibidores de quinase mTOR catalítica selectiva. O inibidor de mTOR MLN0128 suprime a glicólise em ratos com tumores com mutações co Kras e Lkb1, conhecidos como ratos KL. A resposta terapêutica em ratos KL primeiro é medida por 18F-FDG PET e tomografia computadorizada (CT) de imagens antes e após a entrega do MLN0128. Utilizando 18F-FDG PET-CT, os pesquisadores são capazes de medir mudanças dinâmicas no metabolismo glicose em modelos do rato geneticamente modificados (GEMMs) de câncer de pulmão após uma intervenção terapêutica com terapias alvo. Isto é seguido por autoradiografia ex vivo e uma análise quantitativa imuno-histoquímica (qIHC) usando o software morfométricos. O uso de qIHC permite a detecção e quantificação de mudanças distintas nos perfis do biomarcador após o tratamento, bem como a caracterização de patologias distintas do tumor. O acoplamento das imagens de PET para histologia quantitativa é uma estratégia eficaz para identificar respostas metabólicas e terapêuticas na vivo em modelos do rato da doença.
Introdução
Nossa pesquisa centrou-se em investigação e direcionamento cancros com mutações da quinase de fígado B1 (LKB1, também conhecido como STK11) cânceres mutante1. LKB1 é um supressor de tumor mestre que reprime o mTOR complexo 1 (mTORC1) através da ativação da quinase do AMP (AMPK) levando a regulação do crescimento e metabolismo. Portanto, a perda de LKB1 leva a uma ativação mTORC1 desenfreado, a ativação de a resultante de HIF1-alfa em um fenótipo de metabolismo glicolítico comumente referido como o efeito Warburg2,3,4. Mutações de inactivar LKB1 levam directamente para o desenvolvimento de uma síndrome de pré-disposição familiar de câncer raro conhecido como Peutz-Jeghers, síndrome de (PJS) que se caracteriza pelo desenvolvimento de pólipos gastrointestinais benignos, conhecido como hamartomas5 , 6 , 7. Além disso, LKB1 frequentemente co sofre mutações com KRAS oncogênica resultando em hipermetabolismo e tumores de pulmão humano agressivo8,9.
Doenças relacionadas com a Lkb1 são facilmente modeladas em camundongos. A inactivação heterozigota de Lkb1 em ratos leva ao desenvolvimento de hamartomas com precisão modelagem PJS11,de10,12,13. Além disso, Lkb1 mutações que são facilmente modeladas em camundongos com precisão recapitular fenótipos de câncer de pulmão, pele, pâncreas e mama14. A mutação co de Kras/Lkb1 no tecido pulmonar de ratos transgênicos, usando uma Cre recombinase mediada por ativação da oncogênica KrasG12D alelo e biallelic exclusão de Lkb1, resulta na formação de tumores de pulmão metastático e agressivo15 ,16. A caracterização de KrasG12D; Lkb1- / - (KL) tumores de pulmão isolados de ratos mostra estes tumores têm uma ativação de alta mTORC1 e são altamente glicolíticas, usando ambas as medições de metabólito direto de glicose e lactato ou medição do consumo de [18F] -2- fluoro-2-deoxy-D-glicose (18F-FDG) por emissão de positrões (PET) com a tomografia computadorizada (CT) 17. A mTORC1 hiperativação em tumores mutantes LKB1 fornece uma clara lógica para testar ambos inibidores da quinase alostéricos e catalítica de mTOR para tratar desses cânceres.
Em um estudo anterior, demonstrámos que a rapamicina de inibidor alostérico mTORC1 (RAPA) com sucesso inibiu o crescimento de e glicólise em tumores gastrointestinais (GI), usando um modelo do Lkb1+ rato transgénico de PJS3. RAPA é atualmente aprovado como uma terapia de agente único para o tratamento do carcinoma de células renais, mas mostrou eficácia limitada em NSCLC18,19,20. RAPA é um inibidor alostérico mTORC1 e pode ser melhorado pelo desenvolvimento de inibidores de cinase catalítica mTOR de última geração que proporcionam uma inibição mais quase completa dos complexos mTOR 1 e 2 (mTORC1 e mTORC2, respectivamente)21. Drogas como MLN0128 agora estão sendo avaliadas em estudos pré-clínicos e clínicos de fase inicial22,23. Um estudo recente do nosso laboratório demonstrou que o MLN0128 é um inibidor potente mTOR em linhas de células de tumor de pulmão humano e na vivo em KL GEMMs de câncer de pulmão15,16. MLN0128 suprimido o pulmão tumor crescimento e glicose metabolismo estes ratos24.
Neste estudo, aproveitamos dos modelos bem caracterizadas do mouse induzida por Cre adenovírus de câncer de pulmão, iniciada por um condicionalmente registrados Lox-Stop-Lox-KRASG12D do oncogene15,25. Esses KrasG12D ratos foram cruzados com camundongos, tendo floxed alelos de Lkb1 (Lkb1L/L) para gerar KrasG12D; Lkb1L/L (KL) ratos16. Após a entrega intranasal de adeno - ou lentivirus expressando Cre recombinase, os ratos KL desenvolvem as lesões iniciais por indução de tumor após 4 semanas. Por seis semanas, os tumores na alteração KL ratos de tumores Adenomatosos a um fenótipo mais maligno, agressivo tumor típico de carcinomas do pulmão e por 8-10 semanas, os ratos desenvolvem carcinomas de franca com uma penetrância de 100%16,26.
Ambos os PET/CT immunohistochemistry quantitativa e de imagem pode ser utilizado para determinar as respostas metabólicas e moleculares, bem como as respostas terapêuticas nos tumores após a entrega do alvo terapias como MLN012817, 26,,27. Aqui descrito é um protocolo experimental que utiliza 18F-FDG PET imagem para medir a resposta metabólica para uma terapia MLN0128-alvo. Imagens de PET com histologia quantitativa de acoplamento permite a medição da resposta molecular a inibição de mTOR, bem como a quantificação da carga do tumor e da histologia do tumor.
Protocolo
Todos os procedimentos descritos no protocolo foram aprovados pelo cuidado animal institucional e usam o Comité (IACUC) na Universidade da Califórnia, Los Angeles.
1. 18F-FDG PET e CT Imaging em ratos
Atenção: Use equipamentos de proteção quando manusear a radioactividade. Siga todos os procedimentos regulamentares aplicáveis ao manusear a radioactividade.
- Coloque a gaiola com os ratos para ser fotografada em uma cama quente a 37 ° C, 1 h antes da injeção de F-FDG para reduzir o consumo de gordura marrom de 18F-FDG a 18.
Nota: Os ratos para 4-16 h o jejum pode ajudar a reduzir o consumo miocárdico de 18F-FDG. - Pesar o mouse e registar o seu peso.
- Anestesiar o mouse usando 2-3% de isoflurano em oxigênio em 0,5 - 2 L/min para 2-3 min utilizando uma câmara de anestesia mantida a 37 ° C. Certifique-se de que o rato tem sido anestesiado por beliscar o dedo do pé; nenhuma reação será observado se o mouse tem sido anestesiado. Aplica a pomada oftálmica nos olhos para evitar qualquer ressecamento durante a anestesia.
- Dilua 18F-FDG (109 min Half-Life radioativo) em solução salina estéril em uma concentração de injeção ajustada de decadência-corrigido de 70-75 µCi/100 µ l.
Nota: Siga a dose recomendada 18F do fabricante do scanner PET para geração de imagens de scanner ideal. - Desenhar a 70-75 µCi com uma seringa de insulina com agulha 28g, medir a dose de radioatividade usando um calibrador de dose e registrar a medição e o tempo. Coloque a seringa em um suporte de seringa de chumbo.
Nota: A quantidade de radioatividade de 18F-FDG em cada dose é medida com um calibrador de dose, que é calibrado contra um material de referência padrão, tais como o césio-137, de acordo com os protocolos do fabricante. O tempo da leitura também é registrado para determinar a correção de decadência. - Pique a extremidade distal da cauda do rato e medir a glicose no sangue do rato com um glicosímetro.
- Quente a cauda para 1-2 min com uma gaze embebido em água morna. Limpe o rabo com 70% de isopropanol para dilatar a veia da cauda pouco antes da injeção. Administre 100 µ l de 18F-FDG (todo o volume na seringa) com um bólus injeção através da cauda lateral veia e registrar o tempo de injeção. Medir a dose restante na seringa usando o calibrador de dose e registrar a medição e o tempo.
Nota: Haverá alguma quantidade de esquerda de sonda na seringa. O uso de seringas de insulina é preferido por seringas ligadas ao agulhas via Luer bloqueios devido à diminuição da quantidade de presos na seringa/agulha após a injeção tem sido administrada a dose. - Colocar o mouse injetado na câmara de anestesia sob isoflurano 1,5-2% a 37 ° C, para permitir que a sonda a ser distribuído através de circulação de sistêmica do rato para 1h antes da tomografia.
Nota: Pode ser benéfico para esvaziar a bexiga antes da digitalização para permitir uma mais fácil 18visualização F-FDG PET dos tumores implantados nos flancos inferiores do mouse. - Depois de 1 h, posicione o mouse em uma câmara de imagens sob anestesia de isoflurano cone do nariz e a 37 ° C e proteger seus membros no lugar com fita adesiva médica em posição supina.
- Coloque a câmara de imagem no scanner PET/CT.
- Adquira os exames PET e CT conforme descrito no manual do PET/CT scanner,28.
Nota: As imagens de PET são adquiridas por 600 s com uma janela de energia de 150-650 keV, reconstruídos com maximização da probabilidade máxima expectativa com correções para atenuação de fóton, a normalização do detector e decaimento de radioisótopos (foi uma correção de dispersão Não aplicado). As imagens de CT são adquiridas em um modo contínuo para 50 s usando um 50 kVp, fonte de raios-x 200 µA e um detector de tela plana e eles são reconstruídos usando o algoritmo de Fernandez. - Depois que o PET/CT é concluída, retire o mouse da câmara de imagem e permitir que recuperar em sua jaula. Monitore o mouse até que recuperou plenamente a consciência e pode manter a prostração esternal.
- Importe as imagens reconstruídas de PET/CT para software de AMIDA clicando em arquivo, em seguida, aberto, e selecionando o arquivo apropriado.
- Converter os dados de PET para a unidade de dose por cento-injetado por grama (%ID/g), inserindo a dose no momento da injeção, após contabilizar qualquer dose residual deixado na seringa, ou para a unidade de valor de absorção padronizado (SUV), adicionalmente, inserindo o assunto peso. Para fazer isso, clique com botão direito sobre o conjunto de dados de PET e localize o campo %ID/g na guia de Informação básica Enter o %ID/g gravado anteriormente.
- Desenhe o regiões de interesse (ROIs) sobre os tumores e tecidos normais (fígado, músculo, pulmão, coração, cérebro e gordura subcutânea). Para fazer isso, clique em Editar, selecione Adicionar ROI, selecione a forma ROI e nomeie o ROI. Desenhar ROIs sobre tumores e tecidos e ajuste suas dimensões para cobrir o tecido de interesse em todos os 3 eixos.
Nota: Para compensar diferenças de PET sonda biodistribuição entre animais, valores ROI do tumor podem ser ainda mais normalizadas com valores ROI do fígado, um órgão bem perfundido com atividade mínima glicolítico, representando 18F-FDG em circulação. Análises ROI do tumor e tecidos normais são executadas no mouse mesmo. Lesões de tumor de pulmão geralmente são identificadas por 18F-FDG PET, desde que a retenção de F-FDG 18em um pulmão normal é relativamente baixa. CT é usado também para identificar lesões, especialmente lesões que são 18F-FDG não-ávido. Uma análise ex vivo dos pulmões isolados também ajuda a localizar as lesões do tumor.
2. 18F-FDG autoradiografia
- Prepare o mouse para a imagem latente com 18F-FDG seguindo as etapas 1.1-1.12, exceto agora, diluído 18F-FDG em soro fisiológico estéril a uma concentração de 1.000 µ l µCi/200 injeção ajustada de decadência-corrigido.
Nota: Doses maiores de 18F-FDG são usados por autoradiografia a conta para amostra adicional processamento tempo e uma deteção ideal por placas de fósforo. - Eutanásia o rato através de uma inalação letal de isoflurano em 5% ou pelo CO2 (um procedimento aprovado IACUC).
Nota: Deslocamento Cervical não deve ser usado como isto pode danificar o tecido pulmonar. - Segure o mouse com a superfície ventral exposta e pulverizá-la com 70% de etanol à esteira para baixo de seu cabelo antes da incisão.
- Abra a cavidade torácica, aplicando uma incisão, retirar o diafragma e removendo as paredes do peito. Expor a traqueia removendo cuidadosamente a glândula salivar. Coloque a pinça bulldog na traqueia como perto da mandíbula, quanto possível, garantindo um ajuste apertado na traqueia. Lugar uma agulha 23G anexado a uma seringa de 3 mL dentro da traqueia abaixo da braçadeira de buldogue e injetar ~ 2 mL de solução (ideal corte temperatura: fosfato Buffered Saline) OCT:PBS (1:1).
Nota: OCT é muito viscoso e é misturado com PBS para permitir uma injeção mais fácil para os pulmões. - Retire a agulha da traqueia e usar fórceps para fixar o ponto de injeção para evitar qualquer vazamento da solução OCT:PBS.
- Cuidadosamente Retire os pulmões da cavidade torácica e separar o lóbulo esquerdo do resto dos pulmões. Coloque o lobo esquerdo na rotulado cryomold preenchido com algumas gotas de out. Quando o lobo do pulmão é dentro do molde, encha o cryomold para o topo com OCT.
- Repita o mesmo procedimento com a metade direita dos pulmões.
Nota: Se o sinal de 18F-FDG no coração é esperado para ser alta, ou se os tumores de pulmão estão localizados perto do coração, pode ser benéfico remover o coração a fim de evitar qualquer vazamento de marcador. Alternativamente, os pulmões inteiras podem ser incorporados em um único cryomold. É importante evitar bolhas de ar quando se trabalha com OCT. - Usando pinça longa, coloque o cryomold preparado em um recipiente de poliestireno extrudido de célula fechada, contendo uma mistura de gelo seco e o isopentano.
Nota: Esta mistura deve ser a cerca de-70 ° C antes de colocar o cryomold nele para o congelamento. Após o endurecimento, o composto OCT vai se tornar branco. Se múltiplas amostras são processadas ao mesmo tempo, as amostras congeladas em OCT cryomolds podem ser armazenadas temporariamente em gelo seco. - Retire o bloco congelado a cryomold e montá-lo em um criostato para corte. Seção do bloco em uma espessura de 4 µm usando lâminas do micrótomo (34°/80 mm, alto perfil). Transferi as secções de tecido para uma lâmina de vidro que foi armazenada à temperatura ambiente.
- Coloque as lâminas de amostra para uma placa de imagem de fósforo. Coloque a placa na gaveta e fechar suavemente para impedir a mudança de slides. Guarde a fita em um congelador-20 ° C para a exposição da placa, geralmente durante a noite.
Nota: As placas e fitas precisam ser previamente refrigerada até-20 ° C antes do uso. Colocar as amostras a-80 ° C também é aceitável. - Após a exposição, retire as lâminas da placa e ler a placa sobre o leitor de imagem.
- Os slides podem ser embrulhados em filme plástico e armazenados a-80 ° C, ou eles podem ser preparados por hematoxilina & eosina coloração ou imuno-histoquímica.
3. a colheita de tecido pulmonar para histologia
- Siga os passos 2.2-2.4, exceto agora, em vez de usar a solução de OCT:PBS, injetar 2-3 mL de normal formol a 10% tamponada para consertar os pulmões.
- Retire a agulha da traqueia e usar fórceps para fixar no ponto de injeção para evitar qualquer vazamento da formalina. Cuidadosamente Retire os pulmões da cavidade torácica e colocá-los em um tubo cônico de 50 mL, contendo 20 mL de 10% de formalina tamponada normal para 16-24 h garantir uma fixação completa.
Nota: Os pulmões de fixação permite a preservação das características anatômicas ideais. - No dia seguinte, transferir os pulmões fixos de formalina a 70% de etanol e preparar os pulmões para ser colocado em uma fita de tecido.
- Preparar os pulmões para histologia cuidadosamente dissecando lóbulos usando uma tesoura para cortar em pontos de ramificação entre 5 lóbulos, numerados de 1 a 5 como mostrado na Figura 1,De colocá-los em uma orientação não-sobreposição na fita de tecido. Coloque uma almofada de espuma suavemente sobre o tecido pulmonar para manter a orientação intacto.
- Armazene os lóbulos pulmonares dissecado em etanol a 70% até a incorporação de parafina.
- Parafina-incorporar o tecido em fitas e cortar 4 µm de espessura seções para a coloração, usando os procedimentos padrão.
4. tecido segmentação e quantificação usando Software comercial
- Imagem de hematoxilina e eosina (H & E) manchadas de seções de pulmão em uma ampliação X 1,25, usando um sistema de imageamento multiespectral comercial.
- Converter as imagens para cubos de imagem digital e carregar bibliotecas de espectral pré-fabricados (clique em arquivo, em seguida, Carregar a biblioteca espectral) para a H & E.
Nota: As bibliotecas espectrais foram desenvolvidas com antecedência através da aquisição de imagens espectrais de seções de pulmão isoladamente manchada, uma seção, corada com eosina e outra só corados com hematoxilina, que foram salvos em uma biblioteca espectral proprietária de código-fonte aberto arquivo (.csl). O sistema de imagens tem software operacional que adquire uma imagem em cada comprimento de onda que é necessário (conforme definido pelo protocolo de aquisição). Essas imagens (o "cubo de imagem") são armazenadas em um formato de arquivo de imagens multiespectrais proprietário aberto (.im3). Espectros são extraídos do cubo de imagem usando o software morfométricos e armazenados em arquivos de biblioteca espectral separada. - Espectralmente atrás o pseudo cor H & imagens E dos pulmões inteira clicando no botão Unmix .
Nota: Desagregação leva menos de 1 s. O número de pixels em cada tipo de tecido foram quantificado usando software de Análise morfométrica imagem. - Visualize cada cubo de imagem, convertendo os dados multiespectrais na equivalente 3 cores (vermelha, verde, azul) de imagem usando a resposta de cor de comprimento de onda dependente do olho integrada com a intensidade de cada imagem.
Nota: 3 imagens resultantes são exibidas como uma imagem padrão de 24 bits de cor. - Pseudo cor cada imagem misturada por escala essa imagem em um usuário-escolhido cor (por exemplo, vermelho, verde, roxo, etc.) e adicionar isso junto com as outras imagens misturadas pseudo coloridas na imagem de um padrão de 24-bits de cores.
- Use as configurações padrão para todas as análises.
Nota: em geral, uma vez que este tipo de segmentação depende de uma avaliação visual dos resultados (ou seja, uma avaliação de quão bem a segmentação nas imagens fora do treinamento conjunto de obras), é importante dividir corretamente as imagens em formação, teste e validação de moda. - Comece com 2-3 imagens como um conjunto de treinamento (10-15 para amostras de biópsia humana), trem sobre aqueles até que os resultados, boas aparência e em seguida, aplicar esse algoritmo para outro imagens de 2-3. Em seguida, aplica o algoritmo resultante para o conjunto de validação completa.
Nota: Provavelmente, alguns reciclagem serão necessários. - Analise a área de tumor nas seções de pulmão inteiro calculando-se a contagem de pixels total para os tumores de pseudo coloridos vermelhos nos lobos 1-5 de cada rato.
Nota: O tecido normal foi pseudo colorido verde e sangue/sangue navios foram pseudo cores-de-rosa como mostrado na Figura 3. O fardo de tumor média para cada grupo de tratamento foi calculado medindo-se a contagem de pixels total para cada mouse no grupo de tratamento.
Resultados
18 F-FDG PET imaging foi realizado em ratos KL e demonstrou que os tumores nestes ratos eram altamente glicolíticas, como mostrado por um consumo elevado de 18F-FDG (Figura 1A), concordando com estudos publicados anteriormente26, 29. Uma ressecção de toda pulmões revelou a presença de vários tumores (Figura 1B). Os pulmões do mouse podem ser divididos em 5 lóbulos separados representados nas figuras 1 e 1 D. Lóbulos de 1-5 foram rotulados em pulmões seccionados que foram corados com H & E ou glicose transportador 1 (Glut1) (Figura 1D). GLUT1 é um principal transportador de glicose e 18F-FDG e sua expressão e localização para a membrana plasmática de células tumorais correlacionar diretamente com 18F-FDG SUV29. Uma análise de resolução mais alta de Glut1 coloração (40 X) 18F-FDG-ávido tumores de pulmão mostra uma expressão elevada e localização do transportador na membrana plasmática (Figura 1D).
Devido a limitada resolução das imagens de PET, realizaram-se tanto o PET/CT e o tecido autoradiografia. Quanto maior a resolução da autoradiografia pode identificar tumores menores e/ou heterogeneidade do tumor 18distribuição F-FDG. Após a indução de tumor, foi a imagem de F-FDG PET-CT 18KL ratos(Figura 2), seguidos por autoradiografia no pulmão isolado destes ratos (figuras 2B e 2C). Como pode ser visto nas figuras 2B e 2C, a autoradiografia identificados dois tumores menores adicionais que foram positivos para 18F-FDG, no entanto, não eram facilmente visível pelo animal de estimação. Autoradiografia, na sequência os slides com tecido também podem ser usados para a coloração imuno-histoquímica (IHC) de biomarker(s). H & E mancha para os tumores confirmou a presença de tumores no lobo esquerdo (Figura 2D).
Em seguida, imagens de F-FDG PET 18realizou-se na MLN0128-tratados KrasG12D; Lkb1- / - ratos para utilizar 18F-FDG como biomarcador funcional do metabolismo da glicose em tumores de pulmão (Figura 3). Identificamos que um tratamento com MLN0128 robustamente inibiu a mTORC1 sinalização e glicólise como mostrado por um consumo reduzido de 18F-FDG (Figs. 3A e 3B). Estes resultados concordam com estudos pré-clínicos avaliação MLN0128 em camundongos KL como previamente publicados pelo nosso laboratório de17,27. Por último, IHC coloração foi realizada sobre os tumores (Figura 3C). Tumores foram corados por H & E ou com anticorpos contra phospho-S6, que é um substrato conservado de mTORC1 e é usado para indicar uma ativação de mTORC1 (P-S6) vs inactivação (S6). Figura 3 C mostra uma inibição robusta de P-S6 pela MLN0128 em KL tumores em comparação com aqueles tratados com um veículo, que concorda com o trabalho anteriormente publicado17. Além de KRAS, oncogênicos drivers como o receptor do fator de crescimento epidérmico (EGFR) apoiar o metabolismo glicolítico em tumores de pulmão também. Portanto, nós testamos se a inibição de mutante constitutivamente ativo EGFR com erlotinib suprimido o metabolismo de 18F-FDG em xenografts rato. Figuras 3D e 3E mostram que a linha de tumor de pulmão humano HCC827, que abriga uma mutação de del19 do EGFR, mostrou um consumo significativamente reduzida 18F-FDG após cinco dias de tratamento de erlotinib.
Por último, tecido a Análise morfométrica foi realizada em pulmões secionados e tumores de pulmão para quantificar a carga total do tumor, bem como para diferenciar patologias de tumor que incluiu subtipo de tecido, necrose, os vasos sanguíneos do tecido pulmonar normal e o espaço aéreo. Os KL GEMMs desenvolveram uma doença complexa e heterogênea patologicamente que apresentou-se com tumores de pulmão de diferentes histopathologies. Estes incluem o adenocarcinoma (ADC) e carcinomas espinocelulares (SCC)-Esta heterogeneidade faz o tratamento de câncer um desafio formidável. Figura 4 A mostra um único H & E lóbulo pulmonar manchada com dois grandes tumores presentes. As imagens de alta ampliação mostradas na Figura 4B identificam uma necrose pulmonar, vasos e do espaço aéreo e tumor normal, bem como o adenocarcinoma, caracterizada por uma estrutura papilar bem definida e um carcinoma de células escamosas. Figura 4 C representa a coloração pseudo do lóbulo pulmonar e tumor usando software morfométricos de Inform. Figura 4 D mostra as percentagens de pulmão normal, vasos e patologias individuais tais como tumor necrose e subtipos de tumor que segmentado adenocarcinoma bem diferenciado do carcinoma de células escamosas.

Figura 1 : Metabolicamente ativos KrasG12D; Lkb1- / - (KL) tumores de pulmão mutantes são 18F-FDG positiva e expressa níveis elevados do transportador de glicose 1 (Glut1). Painéis A e B mostram uma projeção de intensidade máxima [também referida como imagem 3-dimensional (3D)] da 18F-FDG-PET CT análise em alguns ratos de FDG-ávido KL abrigando tumores de pulmão escamosas. São mostrados (A) uma reconstrução 3D e (B) vista transversal, sagital e coronal de pulmão tumor(s) (t). (C) este painel mostra uma histologia de pulmão inteiro do mouse KL fotografada em painéis A e B, ou manchado por H & E (painel superior) ou com um anticorpo específico para Glut1 (painel inferior). Os lobos do pulmão estão contados. Barra de escala = 2 mm. (D) este diagrama representa a orientação e o números de lóbulos nos ratos (painel superior) e imagens de alta resolução 40 X dos tumores H & E ou Glut1-manchadas dos slides mostrados no painel C por H & E (painel central) ou manchada com um anticorpo específico para Glut1 (painel inferior). Barra de escala = 25 µm. clique aqui para ver uma versão maior desta figura.
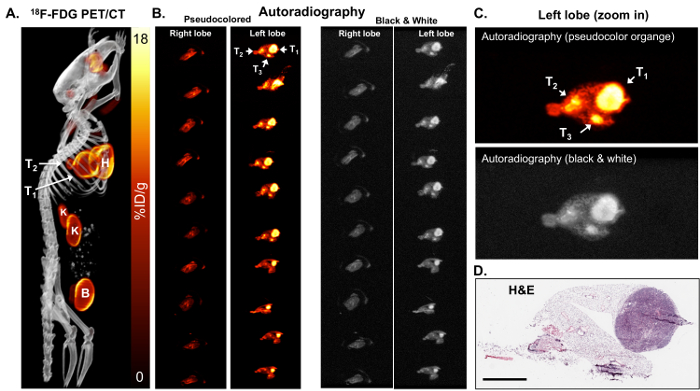
Figura 2: 18 Autoradiografia F-FDG pode identificar tumores pequenos que são metabolicamente ativos. (A) esta imagem de F-FDG PET-CT 18mostra 18F-FDG-ávido tumores em um rato KL mostrado como uma imagem de projeção de intensidade máxima. T1 e T2 = tumores, H = coração, B = bexiga, K = os rins. (B), este painel mostra a autoradiografia ex vivo na série seções dos lóbulos pulmonares direito e esquerdo do mouse. Os pulmões nos painéis da esquerda e direito são idênticos. Os pulmões nos painéis da esquerda são pseudo cor laranja. Os pulmões nos painéis da direito são coloridos em preto e branco. Os tumores (T1, T2 e T3) são indicados com setas. (C) esta é uma vista ampliada do pseudocolored de autoradiografia laranja (painel superior) e preto e branco (painel inferior). (D) este painel mostra a coloração H & E da fatia superior do lobo esquerdo mostrado no painel B. Barra de escala = 200 µm clique aqui para ver uma versão maior desta figura.
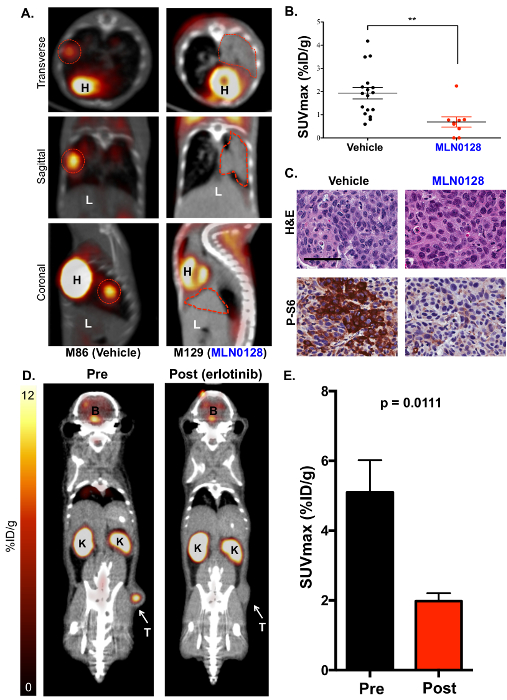
Figura 3 : O inibidor de mTOR MLN0128 suprime consumo de glicose em tumores de pulmão de camundongos KL detectadas por 18F-FDG PET. (A) este painel mostra representativa 18F-FDG PET-CT imagens de KL camundongos tratados com um veículo (18F-FDG ávido, à esquerda) ou MLN0128 (18F-FDG não-ávido, certo). A transversal (painel superior), coronal (painel central) e sagital (painel inferior) vistas são mostradas. Os tumores são descritos com linhas vermelhas; H = coração, L = o fígado. (B), este painel mostra uma quantificação de SUVmax (%ID/g) entre os veículo e MLN0128-tratada com tumores. (C) este painel mostra a coloração H & E e P-S6 de seções de todo pulmão de ratos KL tratados com veículo ou MLN0128. Barra de escala = 25 µm. (D), este painel mostra representativa 18F-FDG-PET e CT imagens de xenografts HCC827 EGFR (del19) pré e post-erlotinib tratamento. O tumor (T) é indicado com uma seta, K = rim, B = o cérebro. (E), este painel mostra uma quantificação da SUVmax (%ID/g) para HCC827 xenografts antes e após o tratamento de erlotinib. n = 10/grupo de tumores. Clique aqui para ver uma versão maior desta figura.

Figura 4 : Peso do tumor e da histologia do tumor são quantificados utilizando software morfométricos.
(A), este painel mostra a coloração H & E de um lóbulo do pulmão único rato com um tumor coletada de um rato KL. (B) essas imagens de alta resolução mostram o carcinoma de células escamosas (superior esquerdo), o pulmão normal, os vasos e o espaço de ar (superior direito) e o adenocarcinoma papilar bem diferenciado (inferior esquerdo) e necrose (canto inferior direito). (C), este painel mostra o pseudocoloring do H & manchadas E pulmão lobo usando software morfométricos. (D) este painel mostra as percentagens para o pulmão individual do lóbulo e tumor patologias medidas pela Inform. Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo descreveu uma abordagem experimental que utilizou imagens de 18F-FDG PET-CT com qIHC para medir as respostas metabólicas e moleculares em tumores de pulmão após a entrega do inibidor mTOR MLN0128 baseada em imagem. MLN0128 efetivamente reduzido a 18consumo de F-FDG, indicando uma resposta metabólica significativa em tumores. Vinculando imagens de PET/CT para imuno-histoquímica, conseguimos espacialmente registrar secionadas tumores nas imagens 3D de PET/CT e realizar um exame detalhado dos tumores inteiro em um nível celular e molecular. Isto tornou possível confirmar que MLN0128 inibiu a sinalização mTOR, confirmando assim uma resposta molecular no alvo para a droga em tumores. Por último, tirando proveito da histologia quantitativa, fomos capazes de mapear e patologias de tumor distintas separadas, tais como global massa tumoral de necrose de tumor, definem adenocarcinoma de carcinomas espinocelulares e complementam de imagem microPET.
MicroPET é atualmente limitado por uma resolução espacial de aproximadamente 1 mm. Além disso, 18retenção F-FDG em certos tecidos pode ser afetado por vários fatores, incluindo os níveis de glicose do plasma, o tipo e duração da exposição anestésica, a temperatura ambiente e a saúde geral do animal, que pode afetar 18 F-FDG farmacocinética30. Estes parâmetros foram otimizados para este protocolo, mas devem ser otimizados para cada modelo animal. Estudos de reprodutibilidade de 18F-FDG imagem de tumores subcutâneos em ratos demonstram um coeficiente de variação para a %ID/g média de cerca de 15%, sugerindo que a resposta terapêutica do tumor de um rato individual avaliados por 18 F-FDG PET deve ser maior do que esse limite para ser considerado confiável e significativa31.
A celular e subcellular mesmo distribuição dos marcadores de PET pode ser avaliada por autoradiografia de tecido com as seções posteriormente coradas e co registrado com qIHC. Co registo PET com CT permite que uma imagem de PET ser colocado em um contexto anatômico; Isto é extremamente valioso, mesmo com contraste de tecidos moles baixa. A falta de contraste de tecidos moles pela CT pode ser superada com imagens de ressonância magnética (MRI). Além disso, biomarcadores para a imagem latente de fluorescência podem ser utilizadas para avaliar a glicólise na vivo, mas a absorção de fótons e dispersão na cavidade pulmonar pode afetar a exata quantificação ou detecção sensibilidade32. Em resumo, utilizar imagens de PET/CT todo animal com histologia quantitativa fornece um mapa exato e em tempo real da biologia do tumor após intervenção terapêutica.
Geração de imagens multiespectral (MSI) é aplicável em qualquer situação onde uma imagem de cor pode ser usada. Pelo menos, MSI fornece as mesmas informações como uma imagem de cor, e para algumas aplicações, MSI pode fornecer que informações mais detalhadas sobre as propriedades espectrais de uma amostra do que uma simples imagem banda larga três cores (RGB). Em geral, as limitações do MSI são aqueles de cor da imagem latente, exceto que MSI é mais lento e leva mais tempo para adquirir imagens. O software morfométricas foi usado para obter resultados reprodutíveis, precisa de segmentação para as imagens e é descrito na Tabela de materiais. Existem outros produtos comercialmente disponíveis que podem ser usados para segmentação de tecido e a quantificação da histologia.
A complexidade do metabolismo do câncer se estende para além do efeito Warburg e glicose metabolismo33,34. É altamente provável que tumores prontamente irão adaptar-se aos tratamentos de agente único que inibem a glicólise. A dependência no metabolismo de aminoácidos tem sido bem documentada em câncer, e espera-se que tumores dependem de uma série de amino acids como glutamina, glicina, serina, bem como outros metabólitos, tais como ácidos graxos livres35,36, 37. Além de 18F-FDG, sondas como 18F - e 11C-rotulado glutamina, colina, acetato, 1-(2'-Deoxy-2'-fluoroarabinofuranosyl) citosina (FAC) e fluorothymidine (FLT) tem sido usada com sucesso para imagem de aminoácido, nucleotídeo e metabolismo de lipídios em modelos animais de câncer38,39,40,41. Automação e microescala rastreador radioquímica as tecnologias juntamente com maior resolução, scanners de PET maiores sensibilidade irão melhorar a acessibilidade do animal de estimação para medir vários procedimentos biológicos42,43. Como a compreensão do metabolismo aumenta, é lógico que o repertório de radiotracers PET aumentará também, permitindo que os pesquisadores e médicos de forma não invasiva metabolismo de tumor de perfil.
A utilização de histologia quantitativa e de imagens de PET/CT aborda uma necessidade clínica, que é para traduzir rapidamente descobertas de bancada para uso clínico. Para fazer isso, pesquisadores devem ser capazes de medir com precisão a resposta terapêutica, bem como a resistência adquirida às drogas, o que permite que imagens de PET/CT. Além disso, a análise de PET/CT e imuno-histoquímica de tumores de pulmão são utilizados como padrão de cuidados para os pacientes e portanto, são diretamente traduzíveis na prática clínica. Importante, imagens de PET/CT prontamente identifica tumores resistente a terapia, que pesquisadores podem isolar e interrogar a nível molecular, a fim de melhor compreender os mecanismos da doença. Este é um processo iterativo que tornou possível para melhor compreender os mecanismos de resistência e projetar estratégias terapêuticas mais eficazes para a tradução clínica.
Divulgações
Kevin P. Francis é um empregado da Perkin Elmer. James Mansfield é acionista público de ações da PerkinElmer, Inc (PKI) na NASDAQ. Os autores não têm mais nada para divulgar.
Agradecimentos
Agradecemos a Universidade da California Los Angeles' Crump Preclinical Imaging Technology Center para sua assistência com as imagens de PET/CT dos ratos, o laboratório de núcleo de patologia translacional e núcleo de estatísticas para a Universidade da Califórnia em Los Angeles David Geffen School of Medicine por sua assistência com a preparação de amostras do tumor e análise. Para financiamento, David B. Shackelford foi apoiado pelo CTSI e prêmio de ciência translacional KL2 conceder números KL2TR000122 e UL1TR000124 para o David Geffen School of Medicine na UCLA e pelo departamento de defesa pulmão câncer pesquisa programa translacional W81XWH-13-1-0459 parceria de pesquisa e ACS RSG-16-234-01-TBG. Sean T. Bailey foi suportado por um fundo de formação T32 NIH HL072752 através de David Geffen School of Medicine na UCLA. Anthony Jones é suportado pelo programa de treinamento de biologia de célula do Tumor UCLA (USHHS Ruth L. Kirschstein institucional National Research Service Award # T32 CA009056). Gihad Abdelhady é suportado por um R01CA208642 de suplemento de diversidade de NIH/ICN.
Materiais
| Name | Company | Catalog Number | Comments |
| G8 PET/CT | Perkin Elmer | CLS139564 | Used for 18F-FDG PET and CT imaging of mice |
| Axio Imager.M2 | Zeiss | 490020-0003-000 | Acquiring images of FFPE lung tumor sections |
| Inform software | Perkin Elmer | CLS135781 | Morphometric used for image analysis of tumor pathologies |
| Glut1 antibody | Alpha Diagnostics | GT12-A | IHC staining of FFPE lung tumor sections |
| Phospho-S6 Ribosomal Protein (Ser235/236) (D57.2.2E) XP™ Rabbit mAb | Cell Signaling Technologies | 4858 | IHC staining of FFPE lung tumor sections |
| MX35 Premier microtome blades | Thermo Fisher Scientific | 3051835 | Microtome blades for sectioning tissue for autoradiography |
Referências
- Shackelford, D. B., Shaw, R. J. The LKB1-AMPK pathway: metabolism and growth control in tumour suppression. Nature Reviews Cancer. 9 (8), 563-575 (2009).
- Shaw, R. J., et al. The LKB1 tumor suppressor negatively regulates mTOR signaling. Cancer Cell. 6 (1), 91-99 (2004).
- Shackelford, D. B., et al. mTOR and HIF-1alpha-mediated tumor metabolism in an LKB1 mouse model of Peutz-Jeghers syndrome. Proceedings of the National Academy of Sciences of the United States of America. 106 (27), 11137-11142 (2009).
- Faubert, B., et al. Loss of the tumor suppressor LKB1 promotes metabolic reprogramming of cancer cells via HIF-1alpha. Proceedings of the National Academy of Sciences of the United States of America. 111 (7), 2554-2559 (2014).
- Hemminki, A. The molecular basis and clinical aspects of Peutz-Jeghers syndrome. Cellular and Molecular Life Sciences. 55, 735-750 (1999).
- Hemminki, A., et al. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. Nature. 391 (6663), 184-187 (1998).
- Sanchez-Cespedes, M. A role for LKB1 gene in human cancer beyond the Peutz-Jeghers syndrome. Oncogene. 26 (57), 7825-7832 (2007).
- Sanchez-Cespedes, M., et al. Inactivation of LKB1/STK11 is a common event in adenocarcinomas of the lung. Cancer Research. 62 (13), 3659-3662 (2002).
- Ding, L., et al. Somatic mutations affect key pathways in lung adenocarcinoma. Nature. 455 (7216), 1069-1075 (2008).
- Ylikorkala, A., et al. Vascular abnormalities and deregulation of VEGF in Lkb1-deficient mice. Science. 293 (5533), 1323-1326 (2001).
- Bardeesy, N., et al. Loss of the Lkb1 tumour suppressor provokes intestinal polyposis but resistance to transformation. Nature. 419 (6903), 162-167 (2002).
- Miyoshi, H., et al. Gastrointestinal hamartomatous polyposis in Lkb1 heterozygous knockout mice. Cancer Research. 62 (8), 2261-2266 (2002).
- Jishage, K., et al. Role of Lkb1, the causative gene of Peutz-Jegher's syndrome, in embryogenesis and polyposis. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8903-8908 (2002).
- Shackelford, D. B. Unravelling the connection between metabolism and tumorigenesis through studies of the liver kinase B1 tumour suppressor. Journal of Carcinogenesis. 12, 16 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- Ji, H., et al. LKB1 modulates lung cancer differentiation and metastasis. Nature. 448 (7155), 807-810 (2007).
- Momcilovic, M., et al. Heightening energetic stress selectively targets LKB1-deficient non-small cell lung cancers. Cancer Research. 75 (22), 4910-4922 (2015).
- Wislez, M., et al. Inhibition of mammalian target of rapamycin reverses alveolar epithelial neoplasia induced by oncogenic K-ras. Cancer Research. 65 (8), 3226-3235 (2005).
- Liang, M. C., et al. TSC1 loss synergizes with KRAS activation in lung cancer development in the mouse and confers rapamycin sensitivity. Oncogene. 29 (11), 1588-1597 (2010).
- Hudes, G., et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. The New England Journal of Medicine. 356 (22), 2271-2281 (2007).
- Wander, S. A., Hennessy, B. T., Slingerland, J. M. Next-generation mTOR inhibitors in clinical oncology: how pathway complexity informs therapeutic strategy. The Journal of Clinical Investigation. 121 (4), 1231-1241 (2011).
- Pourdehnad, M., et al. Myc and mTOR converge on a common node in protein synthesis control that confers synthetic lethality in Myc-driven cancers. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11988-11993 (2013).
- Hsieh, A. C., et al. The translational landscape of mTOR signalling steers cancer initiation and metastasis. Nature. 485 (7396), 55-61 (2012).
- Momcilovic, M., et al. Heightening energetic stress selectively targets LKB1-deficient non-small cell lung cancers. Cancer Research. 75 (22), 4910-4922 (2015).
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature Reviews Cancer. 7 (9), 645-658 (2007).
- Shackelford, D. B., et al. LKB1 inactivation dictates therapeutic response of non-small cell lung cancer to the metabolism drug phenformin. Cancer Cell. 23 (2), 143-158 (2013).
- Momcilovic, M., et al. Targeted Inhibition of EGFR and Glutaminase Induces Metabolic Crisis in EGFR Mutant Lung Cancer. Cell Reports. 18 (3), 601-610 (2017).
- Goodwin, J., et al. The distinct metabolic phenotype of lung squamous cell carcinoma defines selective vulnerability to glycolytic inhibition. Nature Communications. 8, 15503 (2017).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- Dandekar, M., Tseng, J. R., Gambhir, S. S. Reproducibility of 18F-FDG microPET studies in mouse tumor xenografts. Journal of Nuclear Medicine. 48 (4), 602-607 (2007).
- Luker, G. D., Luker, K. E. Optical imaging: current applications and future directions. Journal of Nuclear Medicine. 49 (1), 1-4 (2008).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324 (5930), 1029-1033 (2009).
- Vander Heiden, M. G., DeBerardinis, R. J. Understanding the intersections between metabolism and cancer biology. Cell. 168 (4), 657-669 (2017).
- Zhang, W. C., et al. Glycine decarboxylase activity drives non-small cell lung cancer tumor-initiating cells and tumorigenesis. Cell. 148 (1-2), 259-272 (2012).
- Possemato, R., et al. Functional genomics reveal that the serine synthesis pathway is essential in breast cancer. Nature. 476, 346-350 (2011).
- Sullivan, L. B., et al. Supporting aspartate biosynthesis is an essential function of respiration in proliferating cells. Cell. 162 (7360), 552-563 (2015).
- Hassanein, M., et al. Preclinical evaluation of 4-[(18)F]fluoroglutamine PET to assess ASCT2 expression in lung cancer. Molecular Imaging and Biology. 18 (1), 18-23 (2016).
- Qu, W., et al. Preparation and characterization of L-[5-11C]-glutamine for metabolic imaging of tumors. Journal of Nuclear Medicine. 53 (1), 98-105 (2012).
- Venneti, S., et al. Glutamine-based PET imaging facilitates enhanced metabolic evaluation of gliomas in vivo. Science Translational Medicine. 7 (274), 217 (2015).
- Gambhir, S. S. Molecular imaging of cancer with positron emission tomography. Nature Reviews Cancer. 2 (9), 683-693 (2002).
- Keng, P. Y., et al. Micro-chemical synthesis of molecular probes on an electronic microfluidic device. Proceedings of the National Academy of Sciences of the United States of America. 109 (3), 690-695 (2012).
- Lazari, M., et al. ELIXYS - a fully automated, three-reactor high-pressure radiosynthesizer for development and routine production of diverse PET tracers. EJNMMI Research. 3 (1), 52 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados