Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Homogène Time-resolved Förster Resonance Energy axée sur le transfert test pour la détection de l’insulinosécrétion
Dans cet article
Résumé
Nous présentons ici homogène temps résolu vous inquiétez (HTRF) comme une méthode efficace pour la détection rapide de l’insuline sécrétée par les cellules.
Résumé
La détection de la sécrétion d’insuline est cruciale pour élucider des mécanismes de sécrétion régulée ainsi comme dans les études de métabolisme. Bien que nombreux dosages d’insuline ont existé pendant des décennies, l’avènement récent de la technologie de Förster Resonance Energy Transfer (HTRF) résolue en temps homogène a considérablement simplifié de ces mesures. Il s’agit d’un dosage rapid, rentable, reproductible et robuste optique dépendant des anticorps conjugués à des fluorophores lumineux dont les émissions de longue durée qui facilite la résolution temporelle Förster Resonance Energy Transfer. En outre, HTRF insuline détection est prête pour le développement des essais de criblage à haut débit. Ici, nous utilisons HTRF pour détecter la sécrétion d’insuline dans les cellules de l’INS-1E, une lignée de cellules dérivées d’insulinome de rat. Cela nous permet d’estimation du niveau basal de l’insuline et leurs modifications en réponse à la stimulation de la glycémie. En outre, nous utilisons ce système de détection de l’insuline pour confirmer le rôle de la dopamine comme un régulateur négatif de la sécrétion d’insuline stimulée par le glucose (GSIS). De manière similaire, les autres de la dopamine D2-agonistes des récepteurs et quinpirole bromocriptine, GSIS de réduire d’une manière dose-dépendante. Nos résultats mettent en évidence l’utilité du format de dosage d’insuline HTRF pour déterminer le rôle de nombreux médicaments GSIS et leurs profils pharmacologiques.
Introduction
La régulation du métabolisme énergétique est affinée par une hormone anabolisante majeure, l’insuline. L’insuline est synthétisée et libérée par les cellules bêta du pancréas en réponse à des niveaux accrus de glucose extracellulaire. L’insuline libérée déclenche l’absorption du glucose par les tissus sensibles à l’insuline1,2. Physiologiquement, cela est lié à l’élévation de la concentration de glucose après un repas, suivi par la sécrétion de l’insuline pour réguler l’absorption du glucose. Troubles de l’homéostasie du glucose conduisent à des déficiences métaboliques qui a abouti à la résistance à l’insuline et, finalement, dans la survenue du diabète de type 2 pour2,3,4.
Bien que la sécrétion d’insuline a été particulièrement étudiée, ses mécanismes réglementaires restent mal compris. Un secteur critique de l’enquête a été l’identification de nouveaux modulateurs de la sécrétion d’insuline par les cellules bêta5,6,7,8. Ces études nécessitent une meilleure compréhension de la relation de couplage entre la stimulation de glucose et de la sécrétion d’insuline. Par conséquent, la capacité de surveiller avec précision et de quantifier les niveaux de sécrétion d’insuline stimulée par le glucose (GSIS) a été déterminante. A ce jour, cependant, seulement un nombre limité de méthodes était disponible pour permettre la quantification du GSIS utilisant des lignées de cellules sécrétrices d’insuline et/ou d’îlots pancréatiques. L’un est dosage radio-immunologique (RIA), qui utilise des anticorps et l’insuline radio-isotope-tag. Les principales limites de cette approche incluent des questions de sécurité en raison de la manipulation et l’élimination des matières radioactives. En outre, cette méthode est beaucoup de travail, impliquant plusieurs lavage long et les étapes d’incubation. Immuno enzymatique (ELISA) est une autre approche de coûteuse et fastidieuse qui utilise des anticorps pour la détection de l’insuline. Variation dans l’affinité de l’anticorps et l’efficacité de la reconnaissance de l’insuline sont des facteurs de cette méthode limitant et peuvent influer sur la reproductibilité des résultats. ELISA ni RIA a été conçu pour des expériences de haut débit. AlphaScreen est un dosage homogène utilisé pour détecter et mesurer les taux de sécrétion d’insuline. AlphaScreen technologie est basée sur la transformation de l’oxygène ambiant en un état singulet excité d’oxygène qui peut réagir avec des espèces de chimiluminescence, ayant pour résultat la génération de chimiluminescence. Parce que le dosage est homogène, d'entre les étapes de lavage associées à la RIA et ELISA sont éliminés. Cependant, l’instabilité du signal dû à la nature de la réaction est un facteur limitant qui peut-être affecter la lecture du test. () TR-pince, mis au point par9Heyduk et ses collègues, est une autre approche homogène à la mesure de l’insuline basée sur la liaison des deux anticorps distincts aux épitopes différents sur la molécule d’insuline. Les anticorps sont chaque ADN bicaténaire chimiquement lié à double avec court porte-à-faux complémentaires de l’ADN échoués unique. Liaison des anticorps à l’insuline les réunit et conduit à un double brin DNA bicaténaire. Chaque anticorps est également associé à un fluorophore donneur ou accepteur respectif, et l’association de la DNA bicaténaire regroupe ces fluorophores pour générer le transfert d’énergie de résonance Förster (FRET). Une des limites possibles de TR-TENAILLE, cependant, repose avec la frette lui-même. L’incapacité à dissiper rapidement la fluorescence de fond au cours de la réaction de la frette peut conduire à des niveaux relativement élevés de fluorescence de fond et un faible rapport signal sur bruit dans le dosage. Par conséquent, un besoin existe toujours pour un dosage fiable, robuste et rentable pour quantifier le GSIS d’une manière de haut débit.
Les progrès récents en biophysique ont abouti à l’élaboration d’un test de transfert (HTRF) fondé homogène de fluorescence résolue en temps énergie résonance. Plus précisément, alors que le transfert de l’énergie dans le dosage pourrait qualifier axée sur la frette, avec plus de précision, que HTRF s’appuie sur la luminescence énergétique résonance transfert (vu)10 qui est le transfert d’énergie non radiatif entre le donneur et l’accepteur espèces de12,11,13. Cette distinction est importante, depuis le moment où une fluorescence ou trempe la base frette interaction est très différent qu’il est pour vu, bien que les mêmes types de déclenchement peuvent être utilisés pour le FRET et vu. En outre, l’utilisation des terres rares lanthanide cryptate composés comme l’europium ou cryptate de terbium à HTRF produit fluorescence longue demi-vie12,14. Cela offre l’avantage unique de l’introduction d’un temps de retard (µsec) entre l’excitation du donneur et la mesure de l’émission de l’accepteur (c.-à-d., résolution temporelle assay). Ce délai permet de suffisamment de temps pour la fluorescence de fond se dissipe avant la mesure de la fluorescence d’émission accepteur. Par conséquent, l’affichage est exempt de fluorescence non spécifiques et ainsi, un rapport signal sur bruit élevé est atteint (Figure 1). En outre, le caractère homogène de HTRF élimine la nécessité d’étapes de lavage pour laver les espèces non liés, rendant le dosage bien plus rapide que ELISA ou méthodes axées sur la RIA.
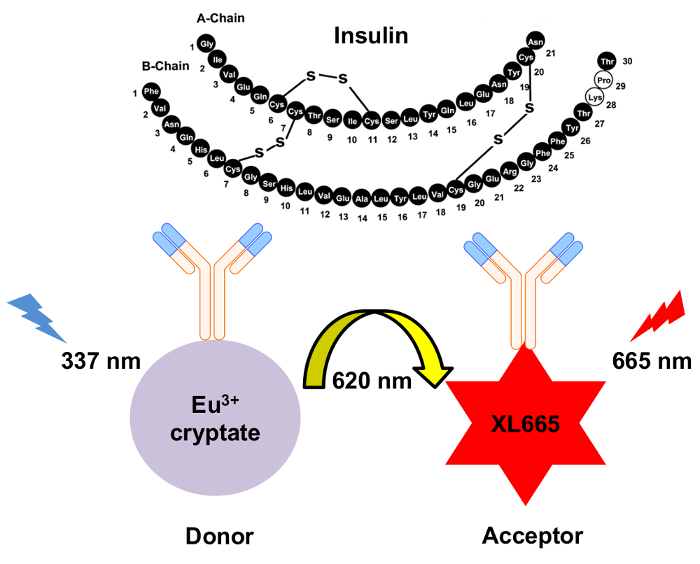
Figure 1 : schéma du mécanisme de détection de l’insuline HTRF. Deux anticorps monoclonaux indépendamment générés spécifiquement reconnaître et lier à l’insuline à des sites distincts. Ces anticorps sont conjugués à l’accepteur XL665 ou le donneur de cryptate d’europium. Excitation du donneur à 337 résultats nm dans l’émission à 620 nm. Le transfert d’énergie qui en résulte provoque la XL665 émettre une longueur d’onde plus longues, 665 nm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Ici, nous fournissons un protocole détaillé afin d’utiliser une approche axée sur les HTRF pour déterminer les niveaux de GSIS de cellules INS-1E, un bien établie insulino-sécrétrices cellules bêta dérivé rat insulinome cellule ligne15. En outre, ce test peut servir pour identifier le profil pharmacologique de régulateurs moléculaires de la sécrétion d’insuline. Nous appliquons ce dosage insuline basée sur HTRF afin d’examiner la dopamine D2-comme la régulation des récepteurs de GSI. Croissant d’études ont révélé que la dopamine, un neurotransmetteur est un régulateur important du GSIS8,16,17,18,19,20, 21 , 22. la dopamine affecte GSIS autocrine/paracrine négativement par des actions sur la dopamine D2-comme des récepteurs (D2, D3, récepteurs de4 D) exprimée à la surface de cellules pancréatiques bêta8 , 16 , 19. à l’aide de ce test, nous confirmer le rôle de la dopamine comme un régulateur négatif du GSIS et démontrer que la dopamine D2-bromocriptine agonistes du récepteur et quinpirole également réduire GSIS.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. INS-1E cellules : entretien et placage
- Maintenir les INS-1E cellules dans un incubateur à2 ˚C/5% CO 37 humidifié et cultivées avec milieu RPMI 1640 additionnée de 5 % (v/v) inactivés par la chaleur sérum de veau fœtal, 2 mM de L-glutamine, 10 mM HEPES, pyruvate de sodium 1 mM, 100 U/mL de pénicilline/streptomycine solution, 50 µM β-mercaptoéthanol. Culture de cellules en milieu RPMI 1640 complet de 10 mL (par assiette), jusqu'à ce qu’ils atteignent la confluence de 80 à 90 %, quand ils peuvent être trypsinisées et subcultures ou utilisées pour le dosage de la sécrétion de l’insuline.
- Jour 1 : Aspirer les médias et laver les cellules une fois avec 5 mL de PBS préchauffé. Ajouter 0,5 mL de trypsine (0,025 %) dilué 1:1 dans 0,5 mL de PBS pour trypsinize les cellules et incuber pendant 3-4 min à 37 ° c. Désactiver la trypsine en ajoutant 9 mL de milieu complet et cellules de transfert dans un tube à centrifuger 15 mL de pipetage.
- Cellules de granule par centrifugation et Resuspendre le culot dans environ 5 mL de milieu frais.
- Prenez 10 µL de cellules remises en suspension et mélanger avec 10 µL colorant vital bleu Trypan pour vérifier la viabilité des cellules. Compter les cellules vivantes et mortes de 10 µL de ce mélange à l’aide d’un hémocytomètre. Niveau de viabilité doit être supérieur à 90 %. Diluer les cellules remises en suspension dans les supports neufs à 1 million de cellules / mL.
- Semences 0,5 mL INS-1E cellules / puits dans une poly-L-Lysine pré-enrobé plaque 24 puits, à une densité de 500 000 cellules par puits.
- Jour 2 : Retirez les supports 18 à 24 h après inoculation et ajouter 500 µL/puits de RPMI 1640 les supports neufs. Incuber les cellules d’un autre 24 heures afin de permettre aux cellules à se remettre complètement de l’étape préalable de passaging. Ce délai supplémentaire permet les cellules à se répandre sur la plaque de culture de tissus.
2. insuline sécrétion Assay (jour 3)
- Préparer le tampon KRB : 132,2 mM NaCl, 3,6 mM KCl, 5 mM NaHCO3, 0,5 mM NaH2PO4, 0,5 mM MgCl2, 1,5 mM CaCl2et 0,001 g/mL d’albumine sérique bovine (BSA), pH 7,4.
- Aspirer les médias des cellules et laver deux fois avec du PBS préchauffé.
- Pour l’étape de jeûne de glucose, ajouter 450 µL/puits KRB (contenant BSA) sans glucose pendant 1 h à 37 ˚C/5% CO2.
- Au cours de l’étape de jeûne de glucose, préparer des dilutions de la drogue (s) en Karbovanets contenant 200 mM Glucose (concentration x 10).
- Préparer les médicaments à 10 fois la concentration finale en Karbovanets additionné de 200 mM de glucose (également 10 x la concentration en glucose test final). Si le stock de drogue (plus l’ajouté 10 x glucose) est dans le DMSO, s’assurer que le pourcentage de DMSO est maintenue uniforme tout au long de l’essai (idéalement final pourcentage inférieur à 0,1 % DMSO).
- Pour les traitements dopaminergiques et quinpirole, utiliser une gamme de concentrations de drogue test final de 100 µM à 100 heures (du plus élevé au plus faible concentration), avec le dernier point de la relation dose-effet ne contenant aucun médicament. Pour la bromocriptine, utiliser une gamme de concentrations d’essai final de 10 µM à 22:00, avec le dernier point de la réaction étant le contrôle de la drogue.
- Après la famine de glucose, ajouter des dilutions sériées de médicament à l’essai pour produire une dose-réponse.
- Ajouter 50 µL/puits de chaque dilution sérielle dans les puits correspondants (dosage total volume 500 µL).
- Pour l’étape de la stimulation de glucose, incuber les cellules avec des dilutions successives drogue respectifs (en présence de glucose 20 mM) pendant 90 min à 37 ˚C/5% CO2. Comprendre une série de puits de contrôle : (1) la stimulation avec 20 mM de glucose seul en l’absence de toute drogue supplémentaire et (2) les cellules qui sont stimulés ni drogue ni de glucose (qui prévoit un taux basal de sécrétion).
- Après l’étape de la stimulation, retirer délicatement le surnageant (usage directement ou conserver à 4 ° c).
Remarque : Une étape de centrifugation douce supplémentaire 5 min (600 x g, 1 min) peut-être être introduite à ce stade pour enlever toutes les cellules restantes dans les surnageants de dosage.
3. HTRF pour mesurer la sécrétion d’insuline
- Diluer dosage surnageants 01:10 dans KRB (sans BSA), préférablement en plaques 96 puits clair.
- Préparer la courbe d’étalonnage d’insuline pour le dosage de l’insuline HTRF (tableau 1).
| Solution d’étalon 500 ng/ml | Dilutions successives | Travail [insuline] ng/ml |
| STD 7 | 30 µl stock + 140 µl KRB | 150 |
| STD 6 | 30 µl STD 7 + 45 µl KRB | 60 |
| STD 5 | 30 µl STD 6 + 45 µl KRB | 24 |
| STD 4 | 30 µl STD 5 + 45 µl KRB | 9.6 |
| STD 3 | 30 µl STD 4 + 45 µl KRB | 3,84 |
| STD 2 | 30 µl STD 3 + 45 µl KRB | 1,54 |
| STD 1 | 30 µl STD 2 + 45 µl KRB | 0,61 |
| STD 0 | KRB 45 µl | 0 |
| Remarque : STD Stock est 500 ng/ml | ||
Le tableau 1. Dilutions successives pour faire la courbe standard de l’insuline.
- Ajouter les échantillons de la courbe d’étalonnage et les surnageants de dosage dilué à la plaque HTRF. La mesure de l’insuline sécrétée par HTRF peut être effectuée dans un 96 puits ou un format de plaque 384 puits, gardant à l’esprit que le volume de dosage doit être réajusté. Utilisation 10 µL/puits échantillon en blancs 96 puits moitié-zone plaques ou 5 µL/puits dans une plaque 384 puits blanche de faible volume, fond rond (voir Table des matières).
- Préparer le mélange d’anticorps dans le tampon de détection (voir Table des matières) chez un donneur de 1:2 (cryptate) / ratio accepteur (XL-665).
NOTE : Encore des détails spécifiques sur le test HTRF sont disponibles chez le constructeur. - Ajouter le mélange de l’anticorps à l’essai à 30 µL/puits (pour un format 96 puits-plaque test) ou 15 µL/puits (pour un format d’essai de plaque 384 puits).
- Sceller la plaque et incuber à température ambiante.
- Lire la plaque après 2 h, 4 h ou une nuit d’incubation avec l’anticorps utilisant le lecteur de plaque et le module optique HTRF (337 665 620 nm) (voir la Table des matières et des instructions du fabricant). Définir le début de l’intégration à 60 µs et le temps d’intégration à 400 µs. utilisation 200 clignote par puits.
Remarque : Ces paramètres étaient fondées sur l’utilisation de notre lecteur particulier. La lecture à 620 nm et 665 nm peut-être varier entre les différents instruments. C’est une des raisons pour lesquelles que nous vous suggérons d’utiliser le ratio 665/620. Dans le calcul de ce ratio, n’importe quel différences potentielles de lecteur à lecteur normaliseront et fournissent des valeurs cohérentes, quelle que soit l’instrument utilisé pour mesurer la HTRF.
4. normalisation et analyse des données
- Calculer les concentrations d’insuline des puits dosage par extrapolation de ratiométrique lectures de fluorescence (665 nm/620 nm) à une seconde ordonnance quadratique polynomiale courbe (Figure 2).

Figure 2 : Courbe d’étalonnage insuline. Stock d’insuline humaine de concentrations connues a été utilisé pour générer la courbe standard de l’insuline. Les ratios HTRF qui en résulte (665 nm / 620 nm) ont comploté contre les concentrations d’insuline. Les données ont été meilleur ajustement à une courbe polynomiale quadratique de deuxième ordre (R2 = 0.99996). Il s’agit d’une courbe standard. Barres d’erreur = SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Avec les données extrapolées en ng/mL d’insuline sécrétée, normaliser (insuline sécrétée en réponse à l’augmentation des concentrations du ligand) à la valeur moyenne des puits % d’analyses sécrétion maximale d’insuline (20 mM glucose seul État).
- L’ajustement de la courbe (R2) d’une expérience simple permet de calculer la variation intra-plaque. Au sein de l’expérience, dérivé les doublons intra-expérimentales, permettant le calcul l’erreur-type de la moyenne pour l’ajustement de la courbe des valeurs individuelles de2 R.
- Pour déterminer la variation inter-plaques, utiliser les données d’au moins trois expériences différentes pour calculer l’écart-type de la moyenne pour la valeur de2 R de la courbe collective.
Access restricted. Please log in or start a trial to view this content.
Résultats
Nous avons validé notre essai HTRF de l’insuline en générant une courbe standard de l’insuline à l’aide de l’insuline humaine purifiée normes de concentrations prédéfinies (Figure 2). Génération de la courbe standard nous ont permis d’extrapoler les lectures de fluorescence ratiométrique et donc à déterminer les niveaux d’insuline sécrétée en réponse aux traitements médicamenteux (Figure 2). La variat...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le dosage de l’insuline HTRF décrit ici vous propose un système rapid et efficace permettant de mesurer la sécrétion d’insuline d’un système de base de cellules cultivée. Parmi ses avantages les plus importants, ce test offre un signal faible bruit de fond en raison du rapport signal-bruit élevé. En outre, nous avons confirmé que le signal HTRF est stable pendant de longues périodes (> 24h)7. Néanmoins, comme les anticorps monoclonaux de liaison de l’insuline d’atteindre rapid...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous remercions Nicolas Pierre (Cisbio Bioassays) pour obtenir des conseils utiles et Dr Pierre Maechler (Université de Genève) pour offrir généreusement cellules INS-1E. Ce travail a été financé par le Department of Defense (grant PR141292 à Z.F.) et John F. et Nancy A. Emmerling Fund de la Fondation de Pittsburgh (à Z.F.).
Remerciements
Les auteurs n’ont rien à divulguer.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
Références
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684(2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432(2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon