Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure de la rigidité des substrats souples en Silicone pour mécanobiologie études utilisant un Microscope à Fluorescence Widefield
Dans cet article
Résumé
Substrats avec raideur dans la gamme kilopascal sont utiles pour étudier la réponse des cellules à physiologiquement pertinente micro-environnement rigidité. À l’aide d’un microscope à fluorescence widefield juste, le module de Young des gels de silicone souple peut être déterminé en utilisant une mise en retrait avec une sphère adaptée.
Résumé
Des tissus mous dans le corps humain ont généralement des raideurs dans la gamme kilopascal (kPa). En conséquence, les substrats flexibles silicone et hydrogel sont est avérés pour être utiles substrats de culture de cellules dans un micro-environnement physique qui reproduit partiellement des conditions in vivo . Nous présentons ici un protocole simple pour la caractérisation des modules de Young des substrats d’élastiques linéaires isotropes, généralement utilisés pour les études de mécanobiologie. Le protocole consiste à préparer un substrat de silicone souple sur une boîte de Pétri ou silicone rigide, revêtement de la surface supérieure du substrat silicone avec perles fluorescentes, à l’aide d’une sphère à l’échelle du millimètre en retrait de la surface supérieure (par gravité), imagerie de la fluorescence Perles à la surface du silicone en retrait à l’aide d’un microscope à fluorescence et d’analyser les images qui en résultent pour calculer le module de Young du substrat silicone. Couplage de la surface supérieure du substrat avec une protéine de la matrice extracellulaire de modules (outre les perles fluorescentes) permet le substrat de silicone pour être facilement utilisables pour le placage de la cellule et les études ultérieures à l’aide d’expériences de microscopie de force de traction. L’utilisation du silicone rigide, au lieu d’une boîte de Pétri, comme la base de la silicone souple, permet l’utilisation de mécanobiologie études impliquant les tronçon externe. Un avantage spécifique de ce protocole est qu’un microscope widefield à fluorescence, qui est couramment disponible dans nombreux laboratoires, est l’équipement principal nécessaire pour cette procédure. Nous démontrons ce protocole en mesurant le module de Young des substrats souples en silicone de différents coefficients d’élasticité.
Introduction
Les cellules dans les tissus mous se trouvent dans un micro-environnement dont la raideur est dans le kilopascal rang1, à la différence de culture de tissus plats dont la raideur est de plusieurs ordres de grandeur plus élevés. Premières expérimentations avec des cellules sur des substrats mous enduit de protéine de matrice extracellulaire ont montré que la rigidité du substrat influence comment les cellules se déplacent ainsi qu’adhèrent à la matrice extracellulaire sous2,3. En effet, la rigidité du substrat influence fondamentalement la cellule fonction4 d’une manière similaire aux signaux biochimiques omniprésentes. Les gels de polyacrylamide (recouverts de protéines de la matrice extracellulaire) sont (eau-imprégnant) hydrogels qui ont été largement utilisés comme substrats de culture de cellules pour mécanobiologie études5. Polydiméthylsiloxane (PDMS), la plus courante silicone (polysiloxane), a été employé couramment comme un silicone rigide avec raideur megapascal-gamme pour micron-échelle fabrication6. Plus récemment, silicone souple substrats avec raideur dans la gamme kilopascal plus physiologiquement pertinents ont été employées comme substrats de culture cellulaire pour la mécanobiologie études7,8.
Plusieurs méthodes ont été utilisées pour mesurer la rigidité des substrats flexibles, y compris la microscopie à force atomique, déformation macroscopique des échantillons tout étirement, rhéologie et de mise en retrait à l’aide de sphères et sphérique à pointe microindentors9 . Alors que chaque technique a ses propres avantages et inconvénients, entaille à l’aide d’une sphère est une méthode particulièrement simple mais assez précise qui ne nécessite que l’accès à un microscope à fluorescence widefield. Entaille à l’aide d’une sphère métallique a été utilisée pour mesurer la rigidité des hydrogels dans un travail préalable3,9,10. Les premiers travaux qui ont démontré l’importance de la rigidité du substrat à mouvement cellulaire utilisé cette méthode pour déterminer l’hydrogel substrat raideur3. Plus récemment, microscopie confocale a également été utilisée pour une caractérisation élégant10.
Nous présentons ici un protocole étape par étape pour la préparation d’un substrat de silicone souple, couplage perles fluorescentes (et une protéine de la matrice extracellulaire comme le collagène je) juste à la surface supérieure, une sphère d’indentation et la surface supérieure en utilisant l’imagerie phase et fluorescence imaging, respectivement et enfin analyser les images pour calculer le module de Young du substrat silicone. Le substrat de silicone souple préparé de cette manière peut être facilement utilisé pour expériences de microscopie de force de traction. L’utilisation du silicone rigide (au lieu d’une boîte de Pétri) comme la base pour le silicone souple permet également aux études mécanobiologie utilisant un étirement externe. Lorsque cela est justifié, des considérations pratiques nécessaires pour éviter les complications possibles sont également indiquées.
Protocole
1. fabrication de substrats souples en Silicone
- Peser avec 1,75 g de la composante A et 1,75 g de la composante B (a : b = 1:1) de la trousse d’élastomère de silicone souple utilisant (polystyrène) pesant plateaux.
- Ajouter le composant A pour la composante B dans le plateau de pesage et mélangez-les ensemble pendant 5 min à l’aide d’un bâtonnet applicateur approprié.
- Ajouter le mélange ci-dessus à un 35 mm boîte de Pétri. Laissez le mélange de se répandre uniformément dans l’ensemble de la boîte de Pétri pour quelques minutes.
Remarque : Le choix du diamètre de la boîte de Pétri et la quantité de silicone souple permettra de déterminer l’épaisseur de silicone souple. Ici, l’épaisseur sera autour de 3,5 mm ; plus sur le choix de l’épaisseur d’élastomère dans la section « Discussion ». - Placer la boîte de Pétri avec le mélange de silicone, avec le couvercle, dans une chambre à vide pendant 15 min enlever les bulles d’air. Pendant ce temps, préchauffer un plat chaud à 70 ° C.
- Une fois la plaque chauffante atteint 70 ° C, placer une lame de verre sur elle et puis placez la boîte de Pétri avec le mélange de silicone sur la plaque en verre. Laissez le silicone cure à 70 ° C pendant 30 min. Ne placez pas le plat de polystyrène directement sur la plaque de cuisson, comme la boîte de Pétri peuvent fondre.
2. couplage des microbilles Fluorescent à la Silicone souple
- Placez le silicone doux durci (dans la boîte de Pétri non couvert) dans une chambre de UV profonde (une enceinte avec une lampe UV profonde des longueurs d’onde situées de 185 et 254 nm). Exposer l’échantillon de silicone souple (~ 5 à 10 cm de la lampe UV) aux UV profonde pendant 5 min.
- Alors que le silicone est exposé aux rayons ultraviolets profonde, procédez comme 2,2-2,6 ci-dessous. Après l’exposition aux UV profonde, dégazer la chambre UV profonde pendant au moins 5 min avant de les récupérer l’échantillon.
- En attendant, peser 19 mg de 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC) dans un tube de microtubes de 1,5 mL et ajouter 500 μl d’eau désionisée (DI). Dissoudre l’EDC en agitant doucement le tube.
- Dans un tube de microcentrifuge distinct de 1,5 mL, peser 11 mg de N- hydroxysulfosuccinimide (sulfo-NHS), ajouter 500 μl de l’eau distillée et dissoudre le sulfo-NHS en agitant doucement le tube. Ensuite, combinez les solutions EDC et sulfo-NHS dans un tube de microcentrifuge unique.
- Cette solution d’EDC/sulfo-NHS, ajouter 30 μL de 0,44 μm rouge de diamètre (ou toute autre couleur de fluorescence basé sur les cubes de filtre disponibles dans le microscope de fluorescence) carboxylate modifié fluorescent microbilles (avec une concentration stock de 1 % p/v).
- Ajouter le mélange d’EDC/sulfo-NHS/perle, 0,02 mg de collagène I (par une queue de rat, stock concentration de 4 mg/mL dans l’acide acétique 0,02 M) pour obtenir une concentration d’environ 0,02 mg/mL.
- Vortex EDC/NHS/perle/collagène je mélange brièvement pour s’assurer que les perles sont réparties dans l’ensemble, avant l’accouplement.
- Pipette 1 mL de l’EDC/NHS/perle/collagène je mélange sur un morceau de parafilm placé au dessus d’un autre couvercle plat peu profond (de petit diamètre). Inverser la boîte de Pétri avec du silicone mou sur ce mélange afin que la surface du silicone souple entre en contact avec le mélange, mais ne touche pas directement la surface du plus petit couvercle boîte de Pétri ci-dessous. Pour déclencher le Pétri inversé, utilisez une ou deux lames de verre en vertu de part et d’autre des entretoises Pétri inversé.
Remarque : Veuillez vous référer à la Figure 1 pour voir comment étape 2.7 est effectuée. - Couvrir l’échantillon de papier d’aluminium et il incuber à température ambiante pendant 30 min.
- Enlever la boîte de Pétri avec du silicone mou et la mettre debout (silicone-vers le haut).
- Laver la surface en silicone souple avec une solution saline tamponnée au phosphate (PBS) en ajoutant 2 mL de PBS (pH 7,4) dans le plat. Laisser reposer pendant quelques minutes. Aspirer au large de la PBS et laver le silicone avec 2 mL de PBS. Laissez la cure de silicone supplémentaires pour environ une journée. Pour cela, placer l’échantillon de silicone souple dans du PBS à 37 ° C pendant la nuit.
3. mesure de la rigidité de la Silicone avec échancrure de sphère à l’aide d’un Microscope à Fluorescence Widefield
- Récupérer la boîte de Pétri avec du silicone mou et s’assurer qu’il contient au moins 1 mL de PBS d’avoir la surface de silicone plusieurs mm au-dessous de la surface du liquide.
- Utilisez des pinces pointues, déposer cinq acheteurs de sphère de zirconium 1 mm sur le silicone souple. Plonger les sphères dans le milieu liquide et déposez-les, des bords de la couche de silicone et d’au moins 5 diamètres d’indenteur loin de l’emplacement de l’autres pénétrateurs.
Remarque : Lorsque larguée au-dessus de la surface du liquide, les sphères peuvent échouer entrer dans le milieu liquide (float) en raison de la tension superficielle du médium liquide. - Placez la boîte de Pétri avec du silicone mou sur la platine du microscope afin qu’il est possible de l’image par le biais de la base de Pétri.
- En imagerie en phase avec un objectif 10 X (par exemple un 10 sec X objective de NA 0,30), recherchez et apporter un pénétrateur de sphère dans le foyer.
- Prendre une image de phase d’une partie ou la totalité de l’indenteur et enregistrez cette image. Utiliser un balayage de tuiles si elles sont disponibles. Si l’indenteur présente des défauts visibles, jeter et remplacer par un autre indenteur.
- Sous imagerie direct phase, pan à gauche du bord de l’indenteur afin que le bord gauche de l’image est au moins une distance de ~1.5 R du centre indenteur. Veiller à ce que le centre de l’indenteur reste visible sur le côté droit, près du bord droit de la trame d’image. Prendre une image de phase et l’enregistrer.
- Placez-vous dans la source de lumière microscope l’illumination pour le canal rouge fluorescent. Avec le x- et y-mise au point de coordonnées inchangées (le x- positiony de la médiane d’indenteur dans et près du bord droit du cadre), vers le bas (diminution Z) jusqu'à ce que les microbilles rouge fluorescent sous le centre de l’indenteur sphère Il suffit d’aller hors de discussion.
- Prendre une z-pile avec une image pour chaque z-incrément de 0,5 µm jusqu'à ce que les microbilles dans la couche supérieure de la silicone loin l’indenteur (près du bord gauche du cadre d’imagerie) aller hors de discussion.
- Répétez les étapes 3,4-3,8 avec les autres acheteurs sur l’échantillon.
4. calculer la rigidité de la Silicone (module de Young)
- Ouvrez l’image de phase de l’indenteur utilisant ImageJ, cliquez sur l’outil en ligne et mesurez le diamètre de l’indenteur en pixels. Cliquez et maintenez sur un point situé sur le bord de l’indenteur, déplacez le curseur à un point diamétralement opposé au bord et noter la longueur en pixels affichés sur la barre d’état de la fenêtre principale de ImageJ avant de relâcher le curseur.
- Assurez-vous que l’unité de longueur est définie en pixels en cliquant Analyze | Définissez l’échelle et vérification de l' unité de longueur.
- Rayon de l’indenteur en pixels convertir μm en prenant en compte le grossissement de l’objectif et la taille du pixel caméra CCD (R en μm = R en pixels x la taille en pixels caméra CCD en μm / le grossissement de l’objectif).
- Ouvrez la couche rouge z-pile d’images faisant (si les microbilles sont rouge fluorescent) à ImageJ en cliquant sur fichier | Importation | Séquence d’images et sélectionnez n’importe quelle image dans la pile, puis cliquez sur OK pour ouvrir la pile.
Remarque : La F1 est le numéro du cadre au cours de laquelle les microbilles sous le centre d’indenteur sont dans le meilleur foyer possible et F2 est le numéro du cadre au cours de laquelle les microbilles (à une région de ~1.5 R loin du centre de la perle) près du bord gauche de l’image sont dans le meilleur foyer possible. Le z-différence entre les deux cadres est l’indentation profondeur δ.- À l’aide de l’outil en ligne dans ImageJ, tracez une ligne à travers un faisant bien défini dans l’image. Analyser, cliquez sur | Tracer le profil et cliquez sur le bouton Live pour obtenir l’intensité de balayage ligne mise à jour à travers le talon tout en sélectionnant les différents cadres. L’image que donne la valeur la plus élevée de l’intensité maximale peut être choisie comme l’armature en bref.
- Le z-incrément entre les cadres dans la z-pile étant 0,5 μm, calculer la profondeur d’indentation dans μm comme δ = (F2-F1) x 0,5.
- Calculer la force exercée sur le gel par le pénétrateur en raison de son poids (moins la force de flottabilité adverse), autrement dit, la mise en retrait la force F, comme le volume de l’indenteur x (la densité de l’indenteur - la densité du milieu liquide) x l’accélération gravitationnelle. Il faut utiliser l’équation F = (4/3) x 3,142 x (R3) x (ρindenteur - ρmoyen) x g , où R est le rayon de l’indenteur, ρindenteur est la densité de l’indenteur, ρmoyen est la masse volumique du milieu liquide et g est l’accélération due à la pesanteur (9,81 m/s2). Exprimer toutes les quantités du côté droit en unités SI pour obtenir F (en N).
- Calculer le module de Young (E) de la silicone à l’aide d’une mis à jour le11 équation de12 Hertz modèle :
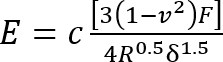
Où :
c = coefficient de correction qui modifie l’expression modèle Hertz qui le suit ;
v = coefficient de Poisson du gel silicone (pris comme 0,5 en ce qui concerne les matériaux incompressibles7) ;
F = la force de mise en retrait ;
R = le rayon de l’indenteur ; et
Δ = la profondeur de pénétration.
Exprimer toutes les quantités du côté droit en unités SI pour obtenir E en PA.- Calculer la correction facteur c comme suit3:
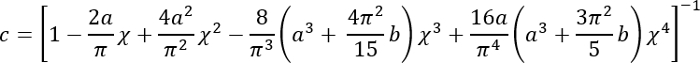
Où :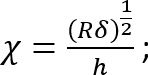
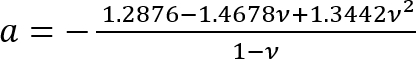 ; et
; et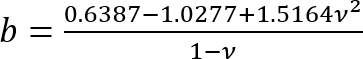 .
.
Il est à noter que ce facteur de correction est spécialement conçu pour être utilisé uniquement lorsque le silicone souple adhère bien à la boîte de Pétri (ou silicone rigide) dessous (ce qui est le cas ici). - Calculer la hauteur h de la couche de silicone souple basée sur la quantité de silicone ajouté et le diamètre de la boîte de Pétri. Vous pouvez également obtenir h directement en déterminant la coordonnée z de la surface supérieure et inférieure de la couche de silicone par imagerie de phase (impuretés mineures entrent en discussion à chaque surface). Notez que pour un grand h (h2 > Rδ), le facteur de correction c est proche de 1.
- Calculer la correction facteur c comme suit3:
- Répétez les étapes 4.1 à 4.4 pour chaque indenteur. Moyenne de l’Young obtenu de chaque indenteur pour obtenir la moyenne d’Young pour l’échantillon de silicone.
Résultats
En utilisant le protocole détaillé ci-dessus, nous préparé silicone souple dans une boîte de Pétri de 35 mm, il guéri à 70 ° C pendant 30 min et couplé microsphères fluorescentes (collagène et j’ai) sur l’extrados comme schématiquement représenté dans la Figure 1. UV profond a été utilisé précédemment pour la protéine éventuelle couplage aux substrats13. Notez que (I) les conditions de polymérisation uti...
Discussion
Alors que la méthode de mise en retrait de sphère est facile à mettre en œuvre, une attention particulière est versée pour le choix du pénétrateur et l’épaisseur de l’échantillon de silicone souple. L’équation utilisée pour calculer le module de Young est valide en vertu d’un ensemble de conditions11et ceux-ci sont généralement remplies lorsque l’épaisseur de l’échantillon de silicone est > 10 % du rayon indenteur et < ~ 13 x le rayon indenteur. Nous avons constaté qu?...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Margaret Gardel généreusement permettant l’utilisation du rhéomètre. Nous reconnaissons l’appui du NIH (1R15GM116082) qui ont permis ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| CY 52-276 A/B silicone elastomer kit | Dow Corning | CY 52-276 | Store at room temperature |
| Thermo Scientific Pierce EDC | Fisher Scientific | PI22980 | Store at -20°C |
| Thermo Scientific Pierce Sulfo-NHS crosslinker | Fisher Scientific | PI-24510 | Store at 4°C |
| Carboxyl fluorescent pink particles, 0.4-0.6 µm, 2 mL | Spherotech, Inc. | CFP-0558-2 | Store at 4°C, do not freeze |
| 1.0 mm Acid washed Zirconium beads | OPS Diagnostics LLC | BAWZ 1000-250-33 | |
| Deep UV chamber with ozone evacuator | Novascan Technologies, Inc. | PSD-UV4, OES-1000D | |
| Wide field fluorescence microscope | Leica Microsystems | DMi8 | |
| Collagen I, from rat tail | Corning | 354236 | Stock concentration = 4 mg/ml; store at 4°C |
| ImageJ-NIH | N/A | N/A | public-domain software |
Références
- Handorf, A. M., Zhou, Y., Halanski, M. A., Li, W. J. Tissue stiffness dictates development, homeostasis, and disease progression. Organogenesis. 11 (1), 1-15 (2015).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proceedings of the National Academy of Sciences. 94 (25), 13661-13665 (1997).
- Lo, C. M., Wang, H. B., Dembo, M., Wang, Y. L. Cell movement is guided by the rigidity of the substrate. Biophysical Journal. 79, 144-152 (2000).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their Substrate. Science. 310, 1139-1143 (2005).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps toward optimization and alternative uses. Methods in Cell Biology. 83, 29-46 (2007).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. Journal of Micromechanics and Microengineering. 24 (3), 035017 (2014).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Lee, E., et al. Deletion of the cytoplasmic domain of N-cadherin reduces, but does not eliminate, traction force-transmission. Biochemical and Biophysical Research Communications. 478 (4), 1640-1646 (2016).
- Frey, M. T., Engler, A., Discher, D. E., Lee, J., Wang, Y. L. Microscopic methods for measuring the elasticity of gel substrates for cell culture: microspheres, microindenters, and atomic force microscopy. Methods Cell Biol. 83, 47-65 (2007).
- Lee, D., Rahman, M. M., Zhou, Y., Ryu, S. Three-dimensional confocal microscopy indentation method for hydrogel elasticity measurement. Langmuir. 31 (35), 9684-9693 (2015).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (5), 2798-2810 (2002).
- Hertz, H. Über die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 92, 156-171 (1882).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M., Cassimeris, L., Tran, P. Protein micropatterns: a direct printing protocol using deep UVs. Microtubules: In Vivo. , 133-146 (2010).
- Bashirzadeh, Y., Qian, S., Maruthamuthu, V. Non-intrusive measurement of wall shear stress in flow channels. Sensors and Actuators A: Physical. 271, 118-123 (2018).
- Muhamed, I., Chowdhury, F., Maruthamuthu, V. Biophysical tools to study cellular mechanotransduction. Bioengineering (Basel). 4 (1), 12 (2017).
- Dumbali, S. P., Mei, L., Qian, S., Maruthamuthu, V. Endogenous sheet-averaged tension within a large epithelial cell colony. Journal of Biomechanical Engineering. 139 (10), 101008 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon