É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição da rigidez de substratos de Silicone macio para estudos de Mechanobiology, usando um microscópio de fluorescência Widefield
Neste Artigo
Resumo
Substratos com rigidez na faixa de superfície são úteis para estudar a resposta das células à rigidez de microambiente fisiologicamente relevante. Usando apenas um microscópio de fluorescência widefield, o módulo de Young de gel de silicone suave pode ser determinado usando um recuo com uma esfera apropriada.
Resumo
Tecidos moles do corpo humano, normalmente, tem rigidez na faixa quilopascal (kPa). Nesse sentido, substratos flexíveis de silicone e hidrogel tem provados para ser útil substratos para cultivo de células em um microambiente física que imita parcialmente na vivo condições. Aqui, apresentamos um protocolo simples para caracterizar o módulo de Young de substratos de elásticos lineares isotrópicos normalmente utilizados para estudos de mechanobiology. O protocolo consiste em preparar um substrato de silicone macio em uma placa de Petri ou silicone duro, revestindo a superfície superior do substrato do silicone com grânulos fluorescentes, usando uma esfera de milímetro-escala para recuar a superfície superior (por gravidade), imagem latente da fluorescente grânulos na superfície do silicone recuado usando um microscópio de fluorescência e analisando as imagens resultantes para calcular o módulo de Young do substrato do silicone. A superfície superior do substrato de acoplamento com uma proteína de matriz extracelular moduli (além do que os grânulos fluorescentes) permite que o substrato do silicone a ser facilmente usado para chapeamento da célula e estudos posteriores usando experimentos de microscopia de força de tração. O uso de silicone duro, em vez de uma placa de Petri, como a base do silicone macio, permite o uso de mechanobiology estudos envolvendo trecho externo. Uma vantagem específica do presente protocolo é um microscópio de fluorescência widefield, que é comumente disponível em muitos laboratórios, os principais equipamentos necessários para este procedimento. Vamos demonstrar este protocolo medindo-se o módulo de Young de substratos de silicone suave de diferentes módulos elásticos.
Introdução
Células em tecidos moles residem em um microambiente cuja rigidez é o hectopascal gama1, em contraste com pratos de cultura de tecidos cuja rigidez é várias ordens de magnitude maior. Primeiras experiências com células em substratos de macio revestido de proteínas da matriz extracelular mostraram que a rigidez de substrato influencia como células seguir em frente, bem como aderirem à matriz extracelular abaixo de2,3. Na verdade, a rigidez de substrato influencia fundamentalmente a função celular4 de maneira semelhante aos sinais bioquímicos penetrante. Gel de poliacrilamida (revestido com proteínas da matriz extracelular) são (água-permeando) hidrogel que têm sido amplamente utilizados como substratos de cultura de células para estudos de mechanobiology5. Polydimethylsiloxane (PDMS), o mais comum do silicone (silicone), foi amplamente utilizado como um silicone duro com rigidez megapascal-gama para mícron-escala de fabricação6. Mais recentemente, silicone macio substratos com rigidez na faixa hectopascal mais fisiologicamente relevantes têm sido empregados como substratos de cultura celular para mechanobiology estudos7,8.
Vários métodos têm sido utilizados para medir a dureza de substratos flexíveis, incluindo microscopia de força atômica, a deformação macroscópica das amostras toda sobre o alongamento, reologia e recuo usando esferas e Ponta esférica microindentors9 . Enquanto cada técnica tem suas próprias vantagens e desvantagens, recuo com uma esfera é um método especialmente simples, mas bastante preciso que requer apenas o acesso a um microscópio de fluorescência widefield. Recuo com uma esfera metálica tem sido usado para medir a rigidez de hidrogel em trabalhos anteriores3,9,10. Primeiros trabalhos que demonstrou a importância da rigidez de substrato para o movimento de células utilizaram este método para determinar o hidrogel substrato rigidez3. Mais recentemente, microscopia confocal também tem sido usada para uma caracterização elegante10.
Aqui, apresentamos um protocolo passo a passo para preparar um substrato de silicone suave, acoplamento grânulos fluorescentes (e uma proteína da matriz extracelular como colágeno eu) só para a superfície superior, uma esfera de recuo e o topo usando superfície de imagem de fase e fluorescência de imagem, respectivamente e, finalmente, analisando as imagens para calcular o módulo de Young do substrato do silicone. O substrato de silicone suave preparado dessa maneira pode ser facilmente usado para experimentos de microscopia de força de tração. O uso de silicone duro (em vez de uma placa de Petri) como a base para o silicone macio também permite estudos de mechanobiology usando um trecho externo. Que tal se justifique, as considerações práticas necessárias para evitar possíveis complicações também são indicadas.
Protocolo
1. fabricação de substrato de Silicone suave
- Pesar 1,75 g de componente e 1,75 g do componente B (A:B = 1:1) do kit de elastômero de silicone suave usando (poliestireno) pesando bandejas.
- Adicionar o componente para o componente B na bandeja de pesagem e misturá-los juntos por 5 min utilizando uma ansa apropriado.
- Adicione a mistura acima para uma placa de Petri de 35mm. Deixe a mistura espalhar uniformemente em toda a placa de Petri por alguns minutos.
Nota: A escolha do diâmetro do tubo de ensaio e a quantidade de silicone suave irá determinar a espessura do silicone macio. Aqui, a espessura será em torno de 3,5 mm; mais sobre como escolher a espessura de elastômero na seção de discussão . - Coloque a placa de Petri com a mistura do silicone, com a tampa fora, em uma câmara de vácuo para 15 min remover quaisquer bolhas de ar. Durante este tempo, pré-aqueça uma chapa quente a 70 ° C.
- Uma vez que a chapa quente chega a 70 ° C, coloque uma lâmina de vidro sobre ele e em seguida coloque a placa de Petri com a mistura do silicone sobre a lâmina de vidro. Deixe o silicone cura a 70 ° C por 30 min. Não coloque o prato de poliestireno diretamente na chapa quente, como o prato de Petri pode derreter.
2. acoplamento de Microbeads fluorescente para o Silicone macio
- Coloque o silicone macio curado (na prato de Petri descobertos) em uma câmara de UV profunda (um recinto com uma lâmpada UV profunda de comprimentos de onda de luz de 185 e 254 nm). Expor a amostra de silicone suave (~ 5 a 10 cm da lâmpada UV) à profunda UV luz por 5 min.
- Enquanto o silicone está sendo exposto à luz de UV profunda, prosseguir com passos 2.2-2.6 abaixo. Após a exposição UV profunda, desgaseifica a câmara UV profunda pelo menos 5 min antes de recuperar a amostra.
- Entretanto, pesar 19 mg de 1-ethyl-3-(3-dimethylaminopropyl) carbodiimida (EDC) em um tubo de microcentrifugadora de 1,5 mL e adicionar 500 μL de água deionizada (DI) para ele. Dissolva a EDC agitando suavemente o tubo.
- Em um tubo de microcentrifuga separadas 1,5 mL, pesar 11 mg de N- hydroxysulfosuccinimide (sulfo-NHS), adicionar-lhe 500 μL de água DI e dissolver o sulfo-NHS agitando suavemente o tubo. Então, combine as soluções de EDC e sulfo-NHS em um tubo de microcentrifugadora único.
- Para esta solução EDC/sulfo-NHS, adicione 30 μL de 0,44 μm vermelho de diâmetro (ou qualquer outra cor de fluorescência baseada os cubos filtro disponíveis no microscópio de fluorescência) carboxilato modificado microbeads fluorescente (com concentração estoque 1% p/v).
- Para a mistura EDC/sulfo-NHS/pérola, adicionar 0,02 mg de colágeno (a partir de um rabo de rato, estoque concentração de 4 mg/mL em 0,02 M de ácido acético) para obter uma concentração de cerca de 0,02 mg/mL.
- Vórtice do EDC/NHS/talão/colágeno mistura brevemente para assegurar que os grânulos são uniformemente dispersos por toda parte, antes de acoplamento.
- Pipete 1 mL da EDC/NHS/talão/colagénio eu mistura em um pedaço de parafilm colocada em cima de outra tampa rasa, plana (de menor diâmetro). Inverta a placa de Petri com silicone macio sobre esta mistura para que a superfície de silicone suave entra em contato com a mistura, mas não toca diretamente a superfície da placa de Petri tampa menor abaixo. Para levantar o prato de Petri invertido, use uma ou duas lâminas de vidro em ambos os lados dos espaçadores de Petri invertido.
Nota: Consulte a Figura 1 para ver como é realizada a etapa 2.7. - Cobrir a amostra com papel alumínio e incube-lo em temperatura ambiente por 30 min.
- Remova a placa de Petri com silicone macio e configurá-lo na posição vertical (do silicone para cima).
- Lave a superfície de silicone suave com tampão fosfato salino (PBS), adicionando 2 mL de PBS (pH 7,4) ao prato. Deixe descansar por alguns minutos. Aspire fora a PBS e lavar o silicone novamente com 2 mL de PBS. Deixe-a cura de silicone ainda mais para cerca de um dia. Por esse motivo, coloca a amostra de silicone macio em PBS a 37 ° C durante a noite.
3. medição da rigidez de Silicone com recuo de esfera usando um microscópio de fluorescência Widefield
- Recuperar a placa de Petri com silicone macio e certifique-se de que ele contém pelo menos 1 mL de PBS para ter a superfície do silicone vários mm abaixo da superfície líquida.
- Usando uma pinça pontiaguda, solte cinco indentors de esfera de zircónio de 1 mm em silicone macio. Mergulhe as esferas para o meio líquido e soltá-los, longe das bordas pelo menos 5 diâmetros de indentor longe o local das outros indentors e a camada de silicone.
Nota: Quando cair acima da superfície do líquido, as esferas podem falhar ao inserir o meio líquido (flutuar) devido a tensão de superfície do meio líquido. - Coloque a placa de Petri com silicone macio no palco microscópio para que seja possível a imagem através da base do prato de Petri.
- Utilizando imagens de fase com um objetivo X 10 (tais como um seco 10 X objetiva do at 0,30), localizar e trazer um indentor esfera em foco.
- Pegue uma imagem da fase de uma parte ou a totalidade da indentor e salvar essa imagem. Use um scan de telha, se disponível. Se o indentor tem qualquer defeitos visíveis, descartar e substituí-lo por outro indentor.
- Sob a imagem de fase ao vivo, pan à esquerda da borda do indentor modo que a borda esquerda do quadro é, pelo menos, uma distância de ~1.5 R do centro indentor. Certifique-se de que o centro do indentor permanece visível no lado direito, perto da borda direita do quadro da imagem. Pegue uma imagem de fase e salvá-lo.
- Mude a fonte de luz do microscópio para a iluminação para o canal vermelho fluorescente. Com o x- e y-coordenadas inalterados (o x-y posição do centro indentor dentro mas próximo à borda direita do quadro), foco em baixo (redução Z) até o vermelho microbeads fluorescente sob o centro do indentor a esfera Vá fora de foco.
- Pegue uma pilha com uma imagem para cada incremento de 0.5 µm z z até as microbeads na camada superior do silicone longe o indentor (perto da borda esquerda do quadro de imagem) percam o foco.
- Repita as etapas de 3.4-3.8 com os outros indentors na amostra.
4. cálculo rigidez do Silicone (módulo de Young)
- Abra a imagem da fase do indentor usando o ImageJ, clique na ferramenta linha e medir o diâmetro da indentor em pixels. Clique e segure em um ponto na borda indentor, mova o cursor para um ponto diametralmente oposto na borda e observe o comprimento em pixels exibidos na barra de status da janela principal do ImageJ antes de liberar o cursor.
- Certifique-se de que a unidade de comprimento é definida para pixels clicando Analyze | Definir escala e verificando a unidade de comprimento.
- Converter o raio do indentor em pixels para μm tendo em conta a ampliação objetiva e o tamanho do pixel câmera CCD (R em μm = R em pixels x o tamanho do pixel câmera CCD em μm / a ampliação objetiva).
- Abra o canal vermelho z-pilha de imagens Microconta (se o microbeads são vermelho fluorescente) no ImageJ clicando no arquivo | Importação | Sequência de imagem e selecione qualquer imagem na pilha e clique Okey para abrir a pilha.
Nota: F1 é o número do quadro em que o microbeads sob o centro indentor são no melhor possível foco e F2 é o número do quadro em que o microbeads (em uma região de ~1.5 R longe do centro do grânulo) perto da borda esquerda do quadro são no melhor possível foco. O z-diferença entre os dois quadros é o recuo δ de profundidade.- Usando a ferramenta de linha no ImageJ, desenhe uma linha através de uma Microconta bem definida na imagem. Clique em analisar | Traçar o perfil e clique no botão Live para obter a intensidade de varredura de linha atualizada através do grânulo enquanto faz a seleção de quadros diferentes. O quadro que dá o valor máximo da intensidade máxima pode ser escolhido como o quadro em foco.
- Desde que o z-incremento entre os quadros na pilha de z é 0.5 μm, calcular a profundidade do recuo em μm como δ = (F2-F1) x 0,5.
- Calcular a força exercida sobre o gel pelo indentor devido a seu peso (menos força de oposição flutuante), ou seja, o recuo da força F, como o volume da indentor x (a densidade da indentor - a densidade do meio líquido) x a aceleração da gravidade. Usar a equação F = (4/3) x 3.142 x (R.3) x (ρindentor - ρmédio) x g , onde R é o raio da indentor, ρindentor é a densidade da indentor, ρmédio é a densidade do meio líquido e g é a aceleração da gravidade (9.81 m/s2). Expressa todas as quantidades do lado direito em unidades SI para obter F (em N).
- Calcule o módulo de Young (E) do silicone usando um modificado11 Hertz equação de12 modelo:
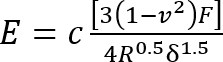
Onde:
c = fator de correção que modifica a expressão do modelo de Hertz que segue;
v = relação de Poisson do gel do silicone (tomado como 0.5 quanto materiais incompressível7);
F = força o recuo;
R = raio indentor; e
Δ = a profundidade do recuo.
Expressar todas as quantidades do lado direito em unidades SI para obter E em PA.- Calcule o fator de correção c como segue3:
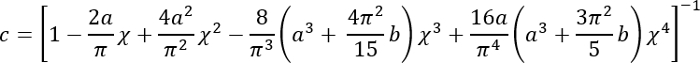
Onde: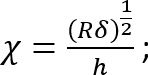
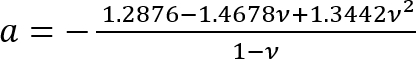 ; e
; e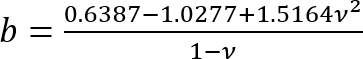 .
.
Deve notar-se que este fator de correção é especificamente para ser usado somente quando o silicone macio adere bem para o prato de Petri (ou silicone duro) por baixo (que é o caso aqui). - Calcule a altura h da camada de silicone suave com base na quantidade de silicone adicionado e o diâmetro do prato de Petri. Como alternativa, obter h diretamente determinando a coordenada z das superfícies superior e inferior da camada de silicone por imagens de fase (impurezas menores enfocadas em qualquer superfície). Note que para um grande h (h2 > Rδ), o fator de correção c está perto de 1.
- Calcule o fator de correção c como segue3:
- Repita as etapas 4.1-4.4 para cada indentor. Média do módulo de Young obtido de cada indentor para obter a média módulo de Young para a amostra do silicone.
Resultados
Usando o protocolo detalhado acima, temos preparado silicone macio em uma placa de Petri de 35mm, curou-a 70 ° C por 30 min e acoplado microbeads fluorescente (e colágeno eu) para a superfície superior como esquematicamente representada na Figura 1. UV profundo tenha sido usado anteriormente para a proteína eventual acoplamento para substratos13. Note que (I) as condições de cura usadas aqui são específicas para este silic...
Discussão
Enquanto o método de indentação de esfera é fácil de implementar, cuidado deve prestar atenção para a escolha de indentor e a espessura da amostra silicone macio. A equação utilizada para calcular o módulo de Young é válida sob um conjunto de condições11e estas normalmente são satisfeitas quando a espessura da amostra do silicone é > 10% do raio indentor e < ~ 13 x o raio indentor. Descobrimos que uma espessura do silicone de 5-10 x o raio indentor foi uma boa escolha, no qual a es...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos Margaret Gardel generosamente, permitindo o uso da rheometer. Reconhecemos o apoio do NIH (1R15GM116082) que permitiu a este trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| CY 52-276 A/B silicone elastomer kit | Dow Corning | CY 52-276 | Store at room temperature |
| Thermo Scientific Pierce EDC | Fisher Scientific | PI22980 | Store at -20°C |
| Thermo Scientific Pierce Sulfo-NHS crosslinker | Fisher Scientific | PI-24510 | Store at 4°C |
| Carboxyl fluorescent pink particles, 0.4-0.6 µm, 2 mL | Spherotech, Inc. | CFP-0558-2 | Store at 4°C, do not freeze |
| 1.0 mm Acid washed Zirconium beads | OPS Diagnostics LLC | BAWZ 1000-250-33 | |
| Deep UV chamber with ozone evacuator | Novascan Technologies, Inc. | PSD-UV4, OES-1000D | |
| Wide field fluorescence microscope | Leica Microsystems | DMi8 | |
| Collagen I, from rat tail | Corning | 354236 | Stock concentration = 4 mg/ml; store at 4°C |
| ImageJ-NIH | N/A | N/A | public-domain software |
Referências
- Handorf, A. M., Zhou, Y., Halanski, M. A., Li, W. J. Tissue stiffness dictates development, homeostasis, and disease progression. Organogenesis. 11 (1), 1-15 (2015).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proceedings of the National Academy of Sciences. 94 (25), 13661-13665 (1997).
- Lo, C. M., Wang, H. B., Dembo, M., Wang, Y. L. Cell movement is guided by the rigidity of the substrate. Biophysical Journal. 79, 144-152 (2000).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their Substrate. Science. 310, 1139-1143 (2005).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps toward optimization and alternative uses. Methods in Cell Biology. 83, 29-46 (2007).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. Journal of Micromechanics and Microengineering. 24 (3), 035017 (2014).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Lee, E., et al. Deletion of the cytoplasmic domain of N-cadherin reduces, but does not eliminate, traction force-transmission. Biochemical and Biophysical Research Communications. 478 (4), 1640-1646 (2016).
- Frey, M. T., Engler, A., Discher, D. E., Lee, J., Wang, Y. L. Microscopic methods for measuring the elasticity of gel substrates for cell culture: microspheres, microindenters, and atomic force microscopy. Methods Cell Biol. 83, 47-65 (2007).
- Lee, D., Rahman, M. M., Zhou, Y., Ryu, S. Three-dimensional confocal microscopy indentation method for hydrogel elasticity measurement. Langmuir. 31 (35), 9684-9693 (2015).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (5), 2798-2810 (2002).
- Hertz, H. Über die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 92, 156-171 (1882).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M., Cassimeris, L., Tran, P. Protein micropatterns: a direct printing protocol using deep UVs. Microtubules: In Vivo. , 133-146 (2010).
- Bashirzadeh, Y., Qian, S., Maruthamuthu, V. Non-intrusive measurement of wall shear stress in flow channels. Sensors and Actuators A: Physical. 271, 118-123 (2018).
- Muhamed, I., Chowdhury, F., Maruthamuthu, V. Biophysical tools to study cellular mechanotransduction. Bioengineering (Basel). 4 (1), 12 (2017).
- Dumbali, S. P., Mei, L., Qian, S., Maruthamuthu, V. Endogenous sheet-averaged tension within a large epithelial cell colony. Journal of Biomechanical Engineering. 139 (10), 101008 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados