Method Article
ARN du Virus Dengue dans le surnageant de Culture de cellules infectées par PCR Quantitative en temps réel de la mesure
Dans cet article
Résumé
Analyse de réaction en chaîne de polymérase quantitative en temps réel combinée avec la transcription inverse (RT-qPCR) a été largement utilisée pour mesurer le niveau des infections à virus à ARN. Nous présentons ici un dosage direct de la RT-qPCR, ne nécessitant pas une étape de purification du RNA, mis au point pour la quantification de plusieurs virus à ARN, y compris le virus de la dengue.
Résumé
À l’heure actuelle, la technologie de Real-Time polymerase chain reaction (PCR) est un outil indispensable pour la détection et la quantification des génomes viraux dans les laboratoires de recherche, ainsi que pour le diagnostic moléculaire, en raison de sa sensibilité, spécificité, et plus de commodité. Toutefois, dans la plupart des cas, la PCR quantitative (qPCR) généralement utilisé pour détecter l’infection par le virus s’est appuyé sur la purification de l’acide nucléique viral avant l’étape de l’ACP. Dans cette étude, l’essai de qPCR (RT-qPCR) basés sur la fluorescence de la transcription inverse est développé grâce à la combinaison d’un tampon de traitement et un réactif de RT-PCR en une étape pour que l’ensemble du processus, à la récolte du surnageant de culture d’infectées par le virus les cellules jusqu'à la détection en temps réel, peuvent être effectuées sans purification de RNA virale. Le protocole établi permet la quantification d’un large éventail de l’ARN des concentrations de virus de la dengue (DENV) dans les 90 min. En outre, la capacité d’adaptation du RT-qPCR test direct à l’évaluation d’un agent antiviral est démontrée par une expérience in vitro à l’aide d’un inhibiteur de la DENV a déjà été indiqué, l’acide mycophénolique (MPA). En outre, les autres virus à ARN, y compris le virus de la fièvre jaune (SVA), le virus Chikungunya (CHIKV) et le virus de la rougeole (MeV), peuvent être quantifiés en direct RT-qPCR suivant le même protocole. Par conséquent, le dosage direct de RT-qPCR décrit dans le présent rapport est utile pour surveiller la réplication des virus à ARN d’une manière simple et rapide, qui sera développée en une plate-forme prometteuse pour une étude de criblage à haut débit et le diagnostic clinique.
Introduction
Le genre Flavivirus , de la famille des Flaviviridae comprend plus de 70 enveloppé, virus à ARN positif brin qui sont transmis par les moustiques et les tiques. Ce qui est important, les flavivirus infection chez l’homme souvent conduit à cliniques sévères, telles que la fièvre et l’encéphalite hémorragique1. En effet, une récente épidémie du virus Zika (ZIKV), un flavivirus, s’est propagé de façon explosive dans toute l’Amérique et s’est avérée être associée à des complications neurologiques, y compris une microcéphalie2,3. Flavivirus, par conséquent, ont des répercussions cliniques et économiques importantes sur la société moderne.
Un flavivirus important est le virus de la dengue (DENV), un virus transmises par les moustiques, largement répandu dans les régions tropicales et subtropicales du monde. DENV est transmise par les moustiques Aedes , y compris les Aedes albopictus , Aedes aegypti, ce qui entraîne la propagation mondiale des flambées de dengue4. Actuellement, l’Organisation mondiale de la santé (OMS) classe la maladie de la dengue dans trois catégories : la dengue sans signes avant-coureurs, la dengue avec signes avant-coureurs et sévère de la dengue4. Bien que la primo-infection avec l’un des quatre sérotypes du ministère de l’environnement (DENV-1-4) est souvent asymptomatique ou spontanément vers la guérison, les études épidémiologiques ont montré que l’infection secondaire des sérotypes différents augmente le risque de formes plus graves de la dengue. Il est à noter que l’amélioration de l’infection à DENV causée par le non dépendante des anticorps ou subneutralizing les anticorps produits au cours de l’infection primaire a été proposée comme un mécanisme potentiel de la dengue sévère qui a eu lieu comme l’infection secondaire. Toutefois, aucun médicament antiviral spécifique n’est disponible pour DENV infection5.
Pour le développement d’agents antiviraux contre le ministère de l’environnement, routine et dosages robustes, qui soient prêtent bien à un cadre de haut débit, sont indispensables pour détecter la réplication du virus quantitativement. Classiquement, des dosages biologiques (p. ex., plaque assay) pour quantifier les virus infectieux et des tests immunologiques (p. ex., immuno enzymatique [ELISA]) pour la détection des antigènes viraux ont été utilisés pour surveiller la DENV réplication in vitro et in vivo6,7. Toutefois, ces tests sont souvent laborieux et nécessitent plusieurs jours à accomplir, qui empêche le traitement d’un grand nombre d’échantillons. À cet égard, RT-qPCR est un test fiable pour détecter une infection DENV : c’est relativement rapide, sensible et spécifique7. En outre, la technique de RT-qPCR a plus d’avantages dans un format haut débit. Néanmoins, la procédure typique de RT-PCR pour les virus à ARN exige la récupération des acides nucléiques viraux dans des échantillons recueillis. Bien que les différentes méthodes d’extraction peuvent être utilisés pour la RT-qPCR, plusieurs étapes sont encore nécessaires pour obtenir l’ARN viral purifiée. En outre, RT-qPCR tests exigent habituellement colonnes à centrifuger coûteux ou des solvants organiques dangereux, rendant ainsi le processus de préparation plus lourd. Puisqu’en évitant d’abus et/ou de la contamination croisée entre les échantillons est un facteur critique de succès quantification des génomes viraux, une méthode moins laborieuse et fastidieux est préférable, surtout si la RT-qPCR doit être appliquée à format de haut débit.
Nous rapportons ici une simple procédure de RT-qPCR pour mesurer DENV ARN dans un surnageant de culture de cellules infectées qui n’implique pas de purification de RNA virale. Ce protocole optimisé de la RT-qPCR est composée de deux étapes : i) l’incubation d’un surnageant de culture de cellules infectées par le ministère de l’environnement avec un tampon de traitement et en une seule étape ii) RT-qPCR sur un appareil de PCR en temps réel. En conséquence, DENV RNA dans un surnageant de culture peuvent être détecté dans les 90 min (Figure 1). Nous décrivons également l’application de la RT-qPCR direct aux autres infections à virus à ARN.
Protocole
1. préparation de la matrice d’ADN de la norme de l’ARN
- Préparer un mélange PCR (volume total de 50 μL, tableau 1) en utilisant un ADN de plasmide vecteur contenant DENV-2 C de la Nouvelle-Guinée (NGC, numéro d’acquisition : AF038403.1) 3' non traduite de région (3' UTR)8 et amorces (T7-DENV-3 'UTR Fwd et DENV 3' UTR Rvs) dans un tube de 0,2 mL, comme décrit dans le tableau 2.
Remarque : Cette étape doit être effectuée sous une hotte propre (ou dans une salle blanche) pour éviter la contamination des produits axés sur l’amplicon. - PCR-amplifier le cDNA de T7 séquence-fusionnée DENV 3' UTR dans un thermocycleur, en utilisant les conditions suivantes : 30 cycles (98 ° c pendant 10 s, 55 ° C pendant 5 s et 72 ° C pendant 5 s).
- Mélanger la réaction de PCR avec 10 μL de 6 x chargement gel colorant et charge sur un gel d’agarose de 1 % gel avec une échelle moléculaire ADN allant de 0,1 à 10 paires de kilobases (kbp).
- Visualiser le produit PCR (479 paires de bases [Pb]) sous la lumière UV de longueur d’onde à l’aide d’une méthode de visualisation de l’ADN et un gel de système d’imagerie. Découper la bande d’ADN à l’aide d’un scalpel propre.
- Extraire l’ADN à l’aide d’un kit de purification de l’ADN (Table des matières).
Remarque : Cette étape de purification peut être effectuée à l’extérieur de la hotte propre, mais il est essentiel de garder un environnement propre au cours du processus pour éviter la contamination de RNase, qui est un problème majeur dans les étapes suivantes de synthèse standard DENV RNA.- Peser la tranche de gel et ajouter 100 μL de tampon de capture par 100 mg de gel tranche dans un tube de microtubes de 1,5 mL.
- Dissoudre le gel par incubation à 60 ° C pendant 5 à 15 min.
- Monter une colonne de purification de l’ADN avec un tube de prélèvement et transférer 600 μl de l’échantillon dissous dans la colonne de purification.
- Centrifuger à 16 000 x g pendant 30 s et jeter le cheminement. Si le volume de l’échantillon est supérieur à 600 μL, appliquer le reste de l’échantillon à la colonne de purification d’ADN après le premier tour et répétez cette étape.
- Appliquer 500 μL de tampon de la colonne de purification de l’ADN de lavage.
- Centrifuger à 16 000 x g pendant 30 s.
- Placer la colonne dans un nouveau tube de microtubes de 1,5 mL.
- Ajouter 50 μL de tampon d’élution et incuber la colonne à température ambiante pendant 1 min.
- Centrifuger à la vitesse maximale pendant 1 minute éluer ADN.
- Mesurer la densité optique de l’ADN à 260 nm sur un spectrophotomètre à l’aide de 3 μl de l’échantillon éluée. Utilisez le même volume de tampon d’élution comme blanc.
Remarque : La matrice d’ADN peut être conservée à-20 ° C jusqu'à l’utilisation.
2. synthèse de la norme RNA DENV 3' UTR
Remarque : Maintenir la ribonucléase (RNase)-environnement libre autant que possible d’effectuer les étapes suivantes. La mise en place du réactif doit être effectuée à l’intérieur d’une hotte propre, à l’aide de tubes, des conseils et exempte de nucléase pipettes.
- Mélanger l’in vitro (IVT) réaction de transcription (d’un volume total de 20 μL) avec 100 ng d’ARN T7 promoteur séquence fusionnée DENV 3' UTR matrice d’ADN (de l’étape 1.6) dans un tube PCR de 0,2 mL comme indiqué dans le tableau 3.
- Incuber le mélange à 37 ° C dans le thermocycleur pendant 2 h.
- Ajouter 1 μL de DNase à la réaction d’IVT et poursuivre l’incubation à 37 ° C pendant 15 min.
- Purifier in vitro transcrit l’ARN utilisant un kit de purification d’ARN (Table des matières).
- Ajouter 80 ml d’exempte de RNase H2O et 350 μL de tampon de capture, dont 1 % de β-mercaptoéthanol.
- Ajouter 250 μL d’éthanol à 100 % à la réaction d’IVT et mélangez-le bien de pipetage.
- Monter une colonne de RNA purification avec un tube de prélèvement et transférer l’échantillon de RNA dans la colonne de purification.
- Il centrifuger à 8 000 x g pendant 15 s et jeter le cheminement.
- Appliquez 500 μL de tampon de lavage à la colonne de purification RNA et il centrifuger à 8 000 x g pendant 2 min.
- Placer la colonne dans un tube de microtubes de 1,5 mL.
- Ajouter 50 μL d’exempte de RNase H2O et incuber la colonne à température ambiante pendant 1 min.
- Centrifuger l’il à la vitesse maximale pendant 1 minute Éluer la RNA.
- Mesurer la densité optique de l’ARN à 260 nm sur un spectrophotomètre, à l’aide de 3 μl de l’échantillon éluée. Utilisez le même volume de H2O comme blanc.
- Déterminer le nombre de copies de la DENV 3' UTR ARN synthétisé. 1 ng d’ARN de DENV 3' UTR (462 bases, Figure 2) est comparable à 4,05 x 109 exemplaires.
- Conserver la norme RNA à-80 ° C jusqu'à l’utilisation.
3. traitement des échantillons de Virus pour la RT-qPCR
Remarque : Les étapes 3.1 – 3.3 sont à effectuer à l’intérieur d’une armoire de sécurité biologique. En particulier, manipulation du surnageant de culture contenant un virus infectieux doit être effectuée au titre de l’environnement de niveau 2 (ou supérieur) sur la biosécurité.
- Mix 199 μL d’un tampon de traitement et 1 μL d’exempte de nucléase protéinase K.
- En série de diluer la DENV 3' UTR ARN synthétisé (de l’étape 2.6) 01:10 pour obtenir 5 x 109 à 5 x 103 copies/μL de RNA standard à l’aide de cellules milieu de culture (p. ex., DMEM additionné de sérum de veau fœtal 10 % et des antibiotiques [FBS DMEM/10%]) contenant un inhibiteur de RNase 40 unités/mL.
- Mix 5 μL du surnageant de culture de cellules infectées par le ministère de l’environnement et la norme DENV 3' UTR ARN avec 5 μL de solution tampon/protéinase K (à l’étape 3.1) de traitement à l’aide de bandes de 8 tubes PCR ou une plaque à 96 puits PCR. Comme une commande sans modèle (NTC), mélanger 5 μl de milieu de culture cellulaire (c.-à-d., aucun virus n’est inclus) avec 5 μL de la solution tampon/protéinase K de traitement.
- Après une brève centrifugation, incuber les échantillons dans un thermocycleur en utilisant les conditions suivantes : 1 cycle (de 25 ° C pendant 10 min et 75 ° C pendant 5 min).
Remarque : Les échantillons traités peuvent être conservés à 4 ° C si l’analyse PCR en temps réel se fait le jour même. Pour le stockage à long terme, les échantillons doivent être conservés à-80 ° C.
4. Real-time PCR analyses
Remarque : Il est fortement recommandé d’effectuer étapes 4.1-4.4 à l’intérieur d’une hotte propre pour minimiser la contamination des produits liés à l’amplicon ou RNase.
- Préparer un mélange maître RT-qPCR avec un réactif de RT-PCR en une étape (Table des matières) dans un tube de microtubes de 1,5 mL (RNase-libre) à l’aide de DENV 3' UTR propres amorces et une sonde fluorogène (tableaux 1). La quantité de chaque composant (tableau 4) selon les 11 % de plus du nombre total d’échantillons, y compris les réactions de l’ARN et NTC standards suffisante.
- Aliquoter 8 μL de master mix dans le puits pour servir dans une assiette PCR en temps réel de 96 puits (Table des matières).
- En bref, centrifuger les échantillons traités, y compris la DENV 3' UTR RNA standard et NTC (de l’étape 3.4) et ajouter 2 μL des échantillons dans chaque puits de la plaque PCR en temps réel de 96 puits.
- Sceller la plaque PCR avec film optiquement transparent adhésif.
- Brièvement, centrifuger la plaque à 200 x g pour enlever les bulles d’air.
- Placer la plaque dans un appareil de PCR en temps réel et le cycle de la plaque à l’aide des conditions suivantes : 1 cycle de la RT en scène (25 ° C pendant 10 min), 1 cycle de l’étape d’activation polymérase (95 ° C pendant 2 min), 40 cycles de l’étape d’amplification (95 ° C pour 10 s et 60 ° C pendant 30 s [unique d’acquisition de données à cette étape]).
- Déterminer le nombre de copies de l’ARN DENV dans les échantillons à l’aide d’un logiciel associées à la PCR en temps réel.
- Dans la fenêtre paramètres , attribuer le bien d’une réaction qui doit être analysé comme échantillon inconnu .
- Assignez le puits de le dilués en série DENV 3' UTR ARN en tant que norme et tapez le numéro de copie attendue de RNA norme dans chaque puits (p. ex., si 5 x 103 copies/μL de solution étalon de RNA sont utilisée, tapez 5 000). Assignez le puits comme Contrôle négatif pour NTC.
- Dans la fenêtre d’analyse , cliquez sur Analyze et s’assurer que le coefficient de corrélation (R2) de la courbe standard générée est équivalente ou supérieure à 0,98.
- En règle générale, utilisez les paramètres de Ct par défaut (seuil : auto, cycle de début planifié : auto, cycle de fin de référence : auto) pour analyse.
Remarque : Le nombre de copies d’échantillons inconnus est automatiquement calculé sur les seuils de cycle (Ct) des réactions individuelles. Le nombre de copies calculé de chaque échantillon est considéré comme copies RNA par 10 réaction de RT-qPCR μL (par exemple, si 12 345 est indiquée dans un échantillon inconnu , ce qui signifie que 12 345 copies d’ARN DENV sont présents dans la réaction).
Résultats
Pour la quantification de l’ARN DENV par analyse de la RT-qPCR, une norme sur le nombre de copie connue, qui peut être détectée par la même amorce, est une condition sine qua non. Dans ce protocole, l’ARN de nucléotides de long 462 contenant les 3'UTR séquence de la souche de NGC DENV-2 était en vitro transcrit à partir de l’ARN T7 promoteur-fusionnées DENV-2 3' matrice d’ADN de l’UTR, qui avait été amplifié par PCR et purifié (Figure 2 a et 2 b). quand une dilution en série 10 fois la norme DENV ARN (de 5 x 109 à 5 x 102 exemplaires dans une réaction de RT-qPCR 10 μL) a été soumis à une analyse directe de la RT-qPCR en utilisant 3' amorces spécifiques UTR un fluorogène sonde et9, un linéaire courbe avec un bon coefficient de corrélation (R2 = 0.98726) a été obtenue (Figure 2).
Ensuite, ce dosage direct de la RT-qPCR a été utilisée pour quantifier la DENV dans le surnageant de culture de cellules infectées par le virus. DENV-2 (Singapour isolat EDEN2 329510), qui avait été propagée dans des cellules C6/36 moustique et titré par essai de plaque à l’aide de cellules BHK-2111, a été dilués en série (à partir de 8 x 106 à 80 plaque formation unités [PFU] / ml). DENV échantillons étaient alors traitement avec un égal volume de tampon de traitement contenant de la protéinase K pour deproteinize des virions et soumis à un test de RT-qPCR direct ciblant la DENV 3' séquence d’ARN UTR. Encore une fois, une bonne corrélation (R2 = 0.99981) entre le titre infectieux DENV et le Ct, un nombre de cycles qui est considéré comme le point où le signal fluorescent augmente avec la croissance exponentielle au-dessus de l’arrière-plan, a été obtenu (Figure 3 a). Lorsque les valeurs Ct générés à partir d’une dilution en série du stock DENV avec titres infectieux connus ont été tracées sur la courbe d’étalonnage faite avec in vitro transcrit 3' UTR RNA, toutes les parcelles obtenues à partir de 8 x 106 80 UFP/mL (égal à 8 x 103 à 8 x 10-2 PFU dans une réaction de RT-qPCR 10 μL) étaient dans les limites des personnes torturées à l’ARN standard (5 x 10,9 , 5 x 103 exemplaires dans une réaction de la RT-qPCR 10 μL, Figure 3 b), ce qui indique que les échantillons de DENV avec un large éventail d’infectieuses les titres peuvent être analysés en même temps, cette RT-qPCR direct. Dans des expériences parallèles, a examiné l’effet de traitement de la mémoire tampon ou le traitement de la protéinase K sur la détection de l’ARN viral par RT-qPCR analyse. Bien que le traitement d’une dilution du journal de l’échantillon DENV (8 x 106 à 8 x 102 UFP/mL) avec saline tamponnée au phosphate (PBS) seule avant la RT-qPCR (1:1 dilution de l’échantillon de virus avec du PBS) et une incubation de 25 ° C pendant 10 min et 75 ° C pendant 5 min a suscité un courbe de régression (Figure 3, ligne noire) et les valeurs de Ct moyennes obtenues par traitement PBS ont été retardés de 2,6 à 3,2 cycles par rapport à la Ct obtenue par traitement de tampon/protéinase K (Figure 3, ligne pointillée). En outre, la dilution la plus élevée du virus (8 x 102 UFP/mL [8 x 10-1 PFU par réaction de RT-qPCR 10 μL]) pas pu être détectée avec ce traitement de PBS (Figure 3). En l’absence de protéinase K pendant le traitement de tampon de traitement (ligne de laFigure 3, gris), une régression semblable a été générée ; Toutefois, le retard dans l’amplification (cycles de 0,1 à 0,8) a été encore observée par rapport à la réaction de transformation contenant la protéinase K (Figure 3, ligne pointillée). Ces données indiquent que, parmi les conditions testées, traitement de l’échantillon DENV avec tampon de traitement ainsi que de la protéinase K améliore la sensibilité de l’essai de la RT-qPCR.
Le dosage direct de la RT-qPCR a évalué plus de son applicabilité à la validation des agents antiviraux contre DENV. L’acide mycophénolique (MPA), un inhibiteur non nucléosidiques de l’inosine monophosphate déshydrogénase qui est utilisé comme immunosuppresseur en transplantation, a été signalé à inhiber DENV in vitro12,,13. Bien que les études précédentes utilisés un essai de plaque conventionnelle ou un dosage de cytométrie de flux pour détecter les antigènes viraux pour démontrer l’effet inhibiteur du MPA le DENV infection12,13, dans la présente étude, RT-qPCR directe a été appliquée pour évaluer l’activité antivirale de l’APM. Les cellules HeLa, qui avaient été injectées à une densité de 5 x 104 cellules/puits dans une plaque 24 puits 1 jour avant l’infection, ont été exposés à DENV-2 à un MOI de 1 pour 1 h et, après le lavage, cultivées avec FBS DMEM/10% en présence de 50 – 0,016 μg/mL () MPA (ou 0,1 % diméthylsulfoxyde [DMSO]). Le surnageant de culture rassemblé 3 jours après l’infection et soumis à l’essai de RT-qPCR direct DENV 3' UTR des amorces spécifiques et une sonde fluorescente. La figure 4 illustre les copies d’ARN DENV (par réaction) dans les surnageants de culture de cellules infectées traitées avec des concentrations croissantes de MPA, qui ont été déterminées par un in vitro transcrit 3' norme UTR RNA. Avec un traitement de 50 μg/mL (156 μM) MPA, a observé une réduction à 99,87 ± 0,02 % de la culture témoin DMSO (Figure 4). Ce qui est important, l’IC50 (concentration inhibitrice à 50 %) pour MPA déterminée par les données indiquées dans la Figure 4 se chiffrait à 0,79 μM, qui est similaire aux valeurs déclarées précédemment12,13. Ce résultat, indique donc que ce test de RT-qPCR direct est une méthode fiable et utile pour l’évaluation de l’effet inhibiteur d’agents antiviraux sur infection DENV.
Enfin, les demandes du dosage direct de la RT-qPCR d’autres virus à ARN ont été testés. Lorsqu’un stock de fièvre jaune virus (Vfj) 17D souche vaccinale (flavivirus), qui avait été amplifié sur cellules Vero et titré sur cellules BHK-21, a été soumis pour diriger à l’aide de la RT-qPCR amorces VFJ-17D-spécifiques et un fluorogène sonde14, comme décrit dans le tableau 1, la courbe d’étalonnage avec bonne corrélation directe entre les valeurs de Ct et de titres de virus pourrait être générée avec une dilution en série 10 fois le stock de virus (3,2 x 105 à 3,2 UFP/mL, Figure 5 a). Direct même, RT-qPCR analyse des virus du Chikungunya (CHIKV, Togaviridae) stock de souche Ross, qui avait été amplifié sur cellules Vero et titré sur cellules BHK-21, à l’aide d’amorces spécifiques CHIKV et un fluorogène sonde15 (tableau 1), a donné une bonne régression entre titres infectieux (4,4 x 108 à 4,4 x 103 UFP/mL) et les valeurs de Ct (Figure 5 b). Ce fut également le cas pour la détection d’une dilution en série (8 x 102 à 8 x 10-2 UFP/mL, Figure 5) du virus de la rougeole (MeV, Paramyxoviridae) qui ont été propagé et titré avec cellules Vero, à l’aide précédemment amorces signalés et un fluorogène sonde16 (tableau 1). Ces résultats démontrent l’adaptabilité du RT-qPCR test direct pour la détection quantitative de plusieurs virus à ARN.
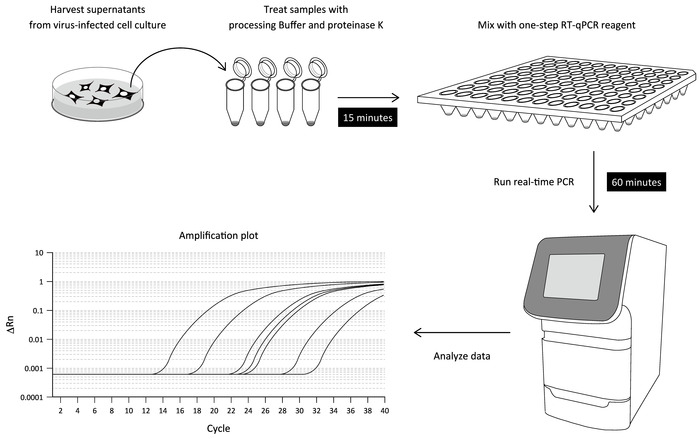
Figure 1 : flux de travail de l’essai direct de la RT-qPCR. Le surnageant de culture de cellules infectées par le ministère de l’environnement est traité avec un tampon de traitement contenant la protéinase K pour libérer de l’ARN viral (étape-traitement de l’échantillon). L’échantillon traité est ensuite mélangé avec un réactif de RT-PCR en une étape et soumis à la PCR en temps réel à l’aide de DENV 3' UTR propres amorces et une sonde fluorogène. Les niveaux d’ARN viral décelé dans les échantillons respectifs peuvent être déterminés par une norme diluée en série utilisant in vitro transcrit l’ARN DENV. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
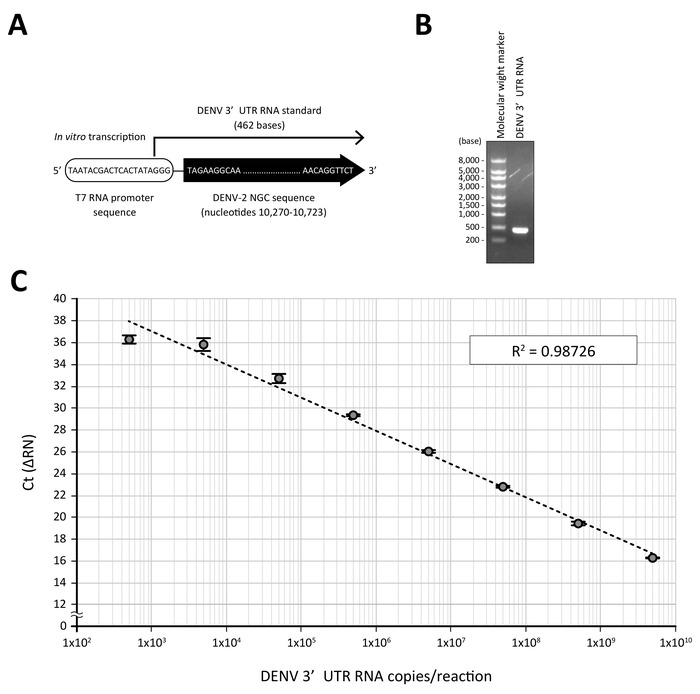
Figure 2 : courbe d’étalonnage générée par DENV 3' UTR ARN. (A) l’ARN Standard contenant 3' UTR de NGC DENV-2 a été transcrit in vitro d’un fragment PCR fusionnés avec séquence d’ARN T7 promoteur. (B) purifiée DENV 3' UTR RNA (250 ng) a été visualisée sur un gel d’agarose à 1 % (voie de droite). La voie de gauche montre le marqueur de poids moléculaire pour l’électrophorèse de RNA. (C), une dilution de journal des amorces DENV 3 'norme RNA UTR a été traitée avec le tampon de traitement contenant la protéinase K et soumis à une analyse PCR en temps réel en utilisant un réactif de RT-qPCR en une seule étape et DENV 3' UTR-spécifiques et un jeu de sondes fluorogéniques. Les valeurs moyennes de la Ct (n = 3) obtenu en dilutions respectives ont comploté contre la quantité estimée de 3' UTR ARN (5 x 10,9 , 5 x 102 ARN copie dans une réaction de RT-qPCR 10 μL). R2 est le coefficient de corrélation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
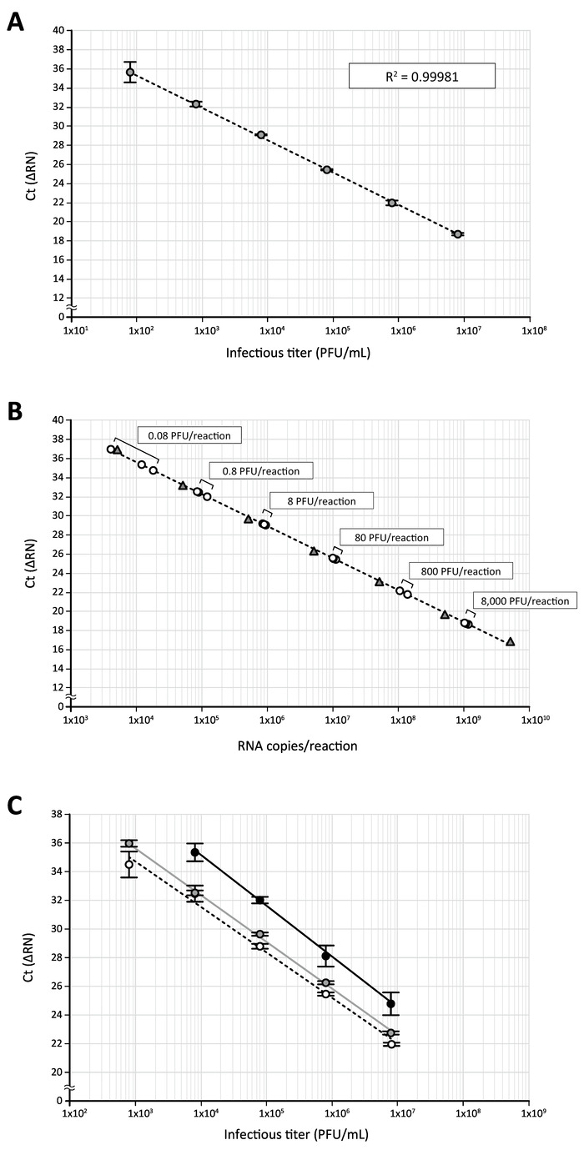
Figure 3 : la quantification de l’ARN DENV en stock de virus par direct RT-qPCR. (A), le haut-titre DENV-2 stock produit en cellules C6/36 a été dilué en série 10 fois (8 x 10,6 , 8 x 101 UFP/mL) avec FBS DMEM/10% contenant un inhibiteur de RNase et soumis à l’essai de RT-qPCR direct avec DENV 3' UTR propres amorces /Probe. (B) Ct valeurs obtenues par RT-qPCR de stock DENV journal dilué (cercles) ont été tracées sur une courbe d’étalonnage du 3' UTR RNA (triangles) transcrite in vitro. L’utilisation de 8 x 106 stock UFP/mL dans un dosage direct de la RT-qPCR correspond à 8 x 103 PFU du virus dans un 10 μL de réaction RT-qPCR. (C), ce panneau affiche l’effet tampon et traitements de la protéinase K sur la détection de l’ARN viral de transformation. Stock DENV dilué (8 x 106 à 8 x 102 UFP/mL) est incubée avec un volume égal de tampon de traitement contenant de la protéinase K (cercles blancs), traitement seul (cercles gris) tampon ou PBS (cercles noirs) et ensuite soumis à la direct Dosage de la RT-qPCR. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
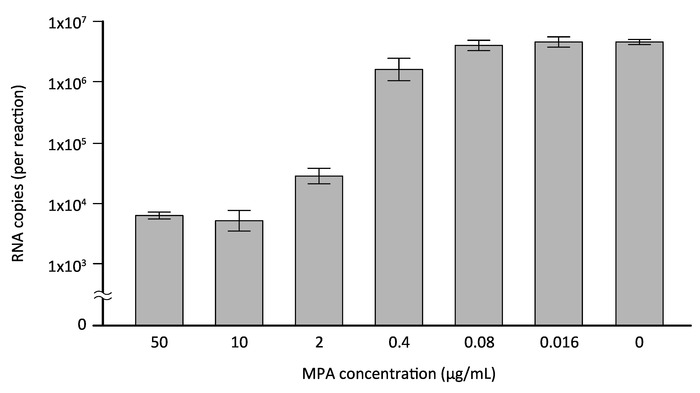
Figure 4 : évaluation de l’effet inhibiteur du MPA par direct RT-qPCR. Les cellules HeLa ont été infectés par DENV-2 à un MOI de 1 et cultivées en présence de concentrations croissantes de MPA, un inhibiteur rapporté précédemment du ministère de l’environnement (ou 0,1 % DMSO). Trois jours après l’infection, les surnageants de culture de cellules infectées ont été recueillis et soumis à l’essai de RT-qPCR directe à l’aide de la sonde 3' UTR propres amorces/DENV. Le nombre de copies d’ARN viral a été déterminé par le ministère de l’environnement 3' UTR ARN transcrit standard in vitro. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
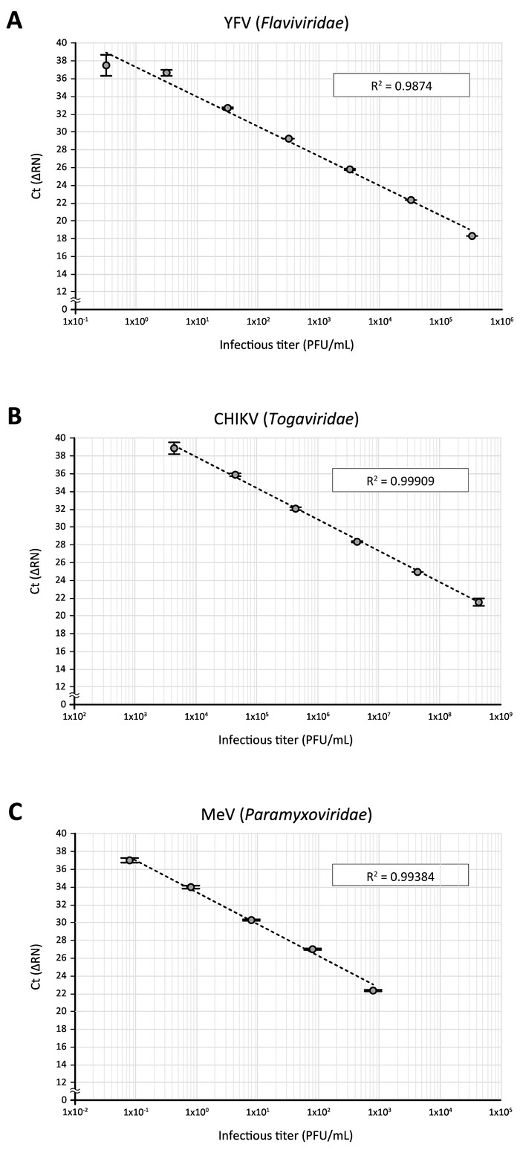
Figure 5 : l’application de la RT-qPCR direct pour la détection d’autres virus à ARN. Les stocks de virus en série dilué de VFJ (A), CHIKV (B) et (C) MeV ont été soumis à l’essai RT-qPCR directe à l’aide d’amorces PCR et fluorogène sondes spécifiques à leurs séquences d’ARN virales respectifs. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Objectif | Nom | Séquence (5' - 3') | Remarque |
| T7 promoteur fusionnés avec le DENV-2 3' amplification de cDNA UTR | T7-DENV 3' UTR Fwd | TAA TAC GAC TCA LTC TAG GGgaa c tTA GAA GGC AAA ACT AAC ATG AAA | Italique, T7 promoteur ; minuscule, entretoise ; "BOLD", NGC DENV-2 nucléotides 10 270-10 292 |
| DENV 3' UTR Rvs | AGA ACC TGT TGA TTC AAC AGC | Nucléotides NGC DENV-2 10 723-10 703 | |
| RT-qPCR analyse du ministère de l’environnement | DENV-2 3' UTR F | AAG GAC AGG TAG TTA GAG GAG ACC C | Référence 9 |
| DENV-2 3' UTR R | GGC GTT CTG TGC CTG GAA TGA TG | ||
| Sonde 2 Den-2-4 | 6FAM-AAC AGC ATA TTG ACG CTG GGA AAG ACC-TAMRA | ||
| Analyse de la RT-qPCR de VFJ | VFJ NS5 F | GAA CAG TGA TCA GGA ACC CCT TCT | Référence 14 |
| VFJ NS5 R | GGA TGT TTG GTT CAC AGT AAA TGT G | ||
| VFJ NS5 sonde | 6FAM-CTA CGT GTC TGG AGC GCC CAG CAA T-TAMRA | ||
| Analyse de la RT-qPCR de CHIKV | CHIK E1 F | TCG ACG CCG CCT CTT TAA | Référence 15 |
| CHIK E1 R | ATC GAA TGC ACC GCA CAC T | ||
| CHIK E1 P | 6FAM-ACC AGC CTG PCA CCA TTC CCT AGA C-TAMRA | ||
| Analyse de la RT-qPCR de MeV | MeV N F | TGG CAT CTG AAC TCG GTA TCA C | Référence 16 |
| MeV N R | TGT TDC CAG TAG TAT GCA TTG CAA | ||
| MeV N P | 6FAM-GCC AGG ATG CAA GGC TTG TTT CAG A-TAMRA |
Tableau 1 : Amorce d’oligonucléotide fluorogène sonde séquences utilisées dans cette étude.
| Composants | Concentration de stock | Volume (μL) | Concentration finale |
| PrimeSTAR Max Premix | x 2 | 25 | 1 x |
| T7-DENV 3' UTR Fwd | 1 ΜM | 10 | 200 nM |
| DENV 3' UTR Rvs | 1 ΜM | 10 | 200 nM |
| pEU/DENV 3' UTR | 1 ng/μL | 1 | 20 pg/μL |
| Exempte de nucléase H2O | 4 | ||
| Total | 50 |
Tableau 2 : Composants d’une PCR mix pour la préparation du modèle de DENV 3' UTR ADN.
| Composants | Concentration de stock | Volume (μL) | Concentration finale |
| T7-séquence fusionnée DENV 3' UTR matrice d’ADN | (variable) | x | 100 ng par réaction |
| Solution de l’ATP | 75 mM | 2 | 7,5 mM |
| Solution CTP | 75 mM | 2 | 7,5 mM |
| Solution de GTP | 75 mM | 2 | 7,5 mM |
| Solution de l’UTP | 75 mM | 2 | 7,5 mM |
| Tampon de réaction | x 10 | 2 | 1 x |
| T7 Enzyme Mix | 2 | ||
| Inhibiteur de RNase recombinant | 40 unités/μL | 1 | 2 unités/μL |
| Exempte de nucléase H2O | 7 - x | ||
| Total | 20 |
Tableau 3 : Composantes d’un IVT mélangent pour la synthèse de la norme DENV 3' UTR RNA.
| Composants | Concentration de stock | Volume (μL) | Concentration finale dans une réaction de la RT-qPCR |
| iTaq universal sonde mélange réactionnel | x 2 | 5,00 | 1 x |
| iScript de la transcriptase inverse de pointe | 40 x | 0.25 | 100 ng par réaction |
| Mélange de primer/sondes | DENV-2 3' UTR F: 3 ΜM | 1,00 | 300 nM |
| DENV-2 3' UTR R: 3 ΜM | 300 nM | ||
| Sonde 2 Den-2-4 : 2 μM | 200 nM | ||
| Exempte de nucléase H2O | 1,75 | ||
| Total partiel | 8,00 |
Tableau 4 : composants d’un mélange maître pour l’analyse en temps réel RT-qPCR d’ARN DENV. Notez que 2 μl de l’échantillon DENV traité (ou d’ARN standard) doit être ajouté au mélange maître 8 μL (un total de 10 μL / réaction).
Discussion
Aujourd'hui, détection d’acide nucléique viral par PCR en temps réel basé sur fluorescentes devient un étalon-or pour le diagnostic moléculaire de pathogènes virus humains, en raison de sa sensibilité et rapidité,7. Cela est particulièrement important pour confirmer l’infection par le virus dans la phase précoce de maladies infectieuses aiguës telles que la fièvre dengue,17. En outre, dans le domaine de la recherche fondamentale de DNEV, RT-qPCR test est un outil indispensable pour la surveillance de la réplication virale in vitro culture qui mènera à la compréhension de la biologie de la réplication du ministère de l’environnement et la découverte d’antiviraux inhibiteurs. Dans cette étude, la fluorescent basée sur la PCR en temps réel a été développée par une combinaison d’un tampon de traitement et un réactif de RT-PCR en une étape pour que DENV ARN dans le surnageant de culture de cellules infectées a pu être quantifiée par la RT-qPCR sans purification le génome d’ARN viral. Par rapport aux tests de routine pour détecter la réplication du virus, tels que l’essai de plaque, ELISA ou conventionnelle RT-qPCR employant RNA purification6,7, un protocole simplifié de l’essai de la RT-qPCR a donné lieu à une grande réduction du temps et étapes nécessaires pour quantifier l’ARN DENV. C’est aussi une caractéristique importante qui a des avantages à réduire au minimum la contamination et la perte du matériel génétique. Néanmoins, il est à noter que l’utilisation d’un capot propre est indispensable à l’installation de l’IVT (étape 2.1) et les réactions de la RT-qPCR (mesures 4.1 – 4,4) pour éviter la contamination croisée des produits liés à l’amplicon ou RNase. Il est également crucial gérer le surnageant, y compris des virus infectieux, à l’intérieur d’une armoire de biosécurité (étape 3.3) afin de réduire un risque d’infection de laboratoire de culture.
Une autre signification du test RT-qPCR direct, c’est qu’une vaste gamme de copies de RNA virales peut être analysée en même temps sans dilution ni de la concentration de l’échantillon. Lorsqu’on utilise un dilués en série DENV 3' UTR RNA standard, le protocole RT-qPCR direct produit une courbe d’étalonnage linéaire sept ordres de grandeur, et la limite inférieure de quantification était 500 copies RNA (Figure 2). Pour la détection du ministère de l’environnement dans le surnageant de culture de cellules infectées, 8 x 10,3 , 8 x 10-2 virus de PFU dans un 10 μL RT-qPCR étaient dans la norme gamme de DENV 3' UTR ARN, et la limite inférieure de détection (8 x 10-2 PFU) a été calculée pour contenir 11 , 400 exemplaires de RNA ± 7 077 (Figure 3 b). À noter, comme l’indiquent plusieurs flavivirus études18,19,20, le rapport le plus élevé de copies de RNA virales à titre infectieux virus (p. ex., PFU) dans des échantillons de DENV a été également observé dans cette étude. Cette surestimation est supposée pour être en grande partie en raison de la présence de défectueux (c'est-à-direnon infectieuse) virus ou l’ARN viral gratuit libérés par les cellules infectées et morts. Bien que le ratio de RNA copies : PFU obtenus dans cette étude (1,1 × 105 à 1,3 x 105 RNA copies/PFU) était incompatible avec les données présentées précédemment (rapports vont de 1 à 3 log)21,20, cela peut être attribuée à la différence de souches de virus, des cellules ou des conditions de culture utilisées. Une autre explication plausible pour la différence est que, puisque aucun processus de purification de RNA a été impliqué dans le dosage direct de RT-qPCR décrit ci-après, plus DENV ARN dans le surnageant de culture pouvaient être détecté par analyse PCR en temps réel sans aucune perte de viral matériel génétique.
La simplicité de la RT-qPCR direct améliore la capacité à gérer un grand nombre d’échantillons dans les puits multiples formats, comme une plaque à 96 puits. Par conséquent, cette propriété aidera l’application future de la dosage direct de la RT-qPCR à une étude de criblage à haut débit pour la découverte de médicaments anti-DENV. En effet, dans ce rapport, application du test pour la validation d’un inhibiteur de l’anti-DENV, MPA, RT-qPCR directe a été examinée, et le résultat a montré qu’une valeur de50 IC MPa obtenus par le dosage direct de la RT-qPCR (Figure 4) a été comparable à celle rapportés dans les études précédentes à l’aide de plaque test12,13. Cela démontre que RT-qPCR direct est un test utile pour évaluer correctement l’effet inhibiteur d’agents antiviraux et peut être adopté dans un médicament à l’étude de dépistage à l’avenir.
Cette étude, on a essayé d’appliquer la RT-qPCR directe à la détection d’autres virus à ARN. Comme illustré à la Figure 5, quand 10 fois les dilutions de trois autres virus à ARN (VFJ, CHIKV et MeV) classés en différents genres (Flaviviridae, Togaviridaeet Paramyxoviridae, respectivement) ont été examinés à l’aide précédemment signalées amorces et fluorogène sondes spécifiques les séquences d’ARN virales respectifs. Bonnes corrélations entre titres infectieux et des valeurs de Ct ont été obtenues par des essais directs de RT-qPCR et les corrélations ont été linéaires de 4 à 6 ordres de grandeur. Cela suggère que le protocole de la RT-qPCR direct est adaptable aux différents types de virus à ARN en changeant simplement les amorces spécifiques du virus et sondes fluorogéniques.
Néanmoins, la sensibilité de détection variait entre les virus analysés dans cette étude (Figure 5). Une modification du protocole permettant d’améliorer la détection de l’ARN du virus cible devrait être d’utiliser un nouvel ensemble de séquences d’apprêt/sonde. En outre, une étape clé pour l’analyse de la RT-qPCR direct le succès semble être la libération efficace du génome viral au cours de l’échantillon de traitement pas (pas 3.1 à 3.4). Ce serait d’une importance particulière pour la détection quantitative des virus stables comme un virus non enveloppé. Bien que comme une expérience préliminaire, virus Coxsackie B3 (CVB3), un virus non enveloppés à ARN appartenant à Picornaviridae, a été soumis à l’essai de RT-qPCR directe en utilisant des amorces spécifiques aux CVB3 décrites précédemment et sonde fluorescente22, un signal de l’amplicon positive n’a pas pu être détecté même avec un stock de virus haut-titre (1 x 105 UFP/mL). Cela paraît en grande partie imputables à l’intégrité physique élevée du virus non enveloppé. Jusqu'à présent, certains tests de RT-PCR qui ne nécessitent pas la purification des acides nucléiques ont été développés pour détecter plusieurs virus à ARN, qui emploient différents protocoles dans la version de RNA étape23,24,25, 26. ainsi, l’utilisation des traitements alternatifs (ou autres), par exemple une incubation d’un échantillon de virus à une température élevée, potentiellement augmente la sensibilité de détection.
En résumé, le protocole de RT-qPCR direct développé dans cette étude était une méthode simple et rapide mais fiable de quantification de l’ARN viral dans un surnageant de culture de cellules infectées. À cause de cette simplicité, le dosage direct de la RT-qPCR pourrait traiter un nombre d’échantillons en peu de temps, qui semble prometteuse pour l’analyse de haut-débit de réplication du virus. En outre, l’application du protocole RT-qPCR direct aux autres virus à ARN a aussi été démontrée. Cette approche devrait, par conséquent, être un outil utile pour surveiller efficacement les infections de virus à ARN dans un environnement de laboratoire de recherche et, éventuellement, dans les diagnostics cliniques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Subhash G. VIARD (Duke-NUS Graduate Medical School, Singapour) pour le DENV-2 isoler EDEN2 3295 et Shunro Imura (Station de quarantaine Kobe, Japon) pour le VFJ souche utilisée comme vaccin 17D. Les auteurs sont également reconnaissants aux membres du département de microbiologie et contrôle des infections pour leur aide. Ce travail est soutenu par le MEXT KAKENHI Grant nombre JP16737900.
matériels
| Name | Company | Catalog Number | Comments |
| PrimeSTAR Max DNA Polymerase | Takara Bio. Inc | R045A | Comparable PCR reagent kit can be used. |
| SimpliAmp Thermal Cycler | Thermo Fisher Scientific | A24811 | Comparable thermal cycler instrument, but PCR cycle condition needs to be optimized. |
| 6x Gel Loading Dye | New England BioLabs | B7024S | Comparable gel loading dye can be used. |
| 2-Log DNA Ladder | New England BioLabs | N3200 | 0.1-10.0 kilobase pairs. Comparable DNA molecular ladder can be used. |
| Gel Scene Tablet | Astec | GST-33 | Comparable gel imaging system can be used. |
| illustra GFX PCR Purification Kit | GE Healthcare Life Sciences | 28-9034-70 | Comparable gel extraction kit can be used. |
| BioSpectrometer | Eppendorf | 6135000905 | Comparable spectrophotometer can be used. |
| MEGAscrip T7 Transcription Kit | Thermo Fisher Scientific | AM1334 | |
| TURBO DNase | Thermo Fisher Scientific | AM2238 | Included in MEGAscrip T7 Transcription Kit. |
| Recombinant RNase Inhibitor | Takara Bio. Inc | 2313A | 40 units/μL |
| RNeasy Mini Kit | Qiagen | 74104 | Comparable RNA purification kit can be used. |
| CellAmp Direct RNA Prep Kit | Takara Bio. Inc | 3733Q | |
| Proteinase K | Nacalai Tesque | 15679-06 | >600 units/mL. Comparable reagent can be used. |
| iTaq Universal Probes One-Step Kit | Bio-Rad | 1725141 | |
| MicroAmp Fast Optical 96-Well Reaction Plate, 0.1 mL | Thermo Fisher Scientific | 4346907 | Comparable plate or tube can be used dependent on the real-time PCR instrument, but PCR cycle condition needs to be optimized. |
| MicroAmp Optical Adhesive Film | Thermo Fisher Scientific | 4311971 | Comparable film or optical cap can be used dependent on the real-time PCR plate or tube. |
| StepOnePlus Real-Time PCR System | Thermo Fisher Scientific | StepOnePlus-01 | Comparable real-time PCR instrument, but PCR cycle condition needs to be optimized. |
Références
- Pastorino, B., Nougairede, A., Wurtz, N., Gould, E., de Lamballerie, X. Role of host cell factors in flavivirus infection: Implications for pathogenesis and development of antiviral drugs. Antiviral Research. 87 (3), 281-294 (2010).
- Fauci, A. S., Morens, D. M. Zika Virus in the Americas--Yet Another Arbovirus Threat. New England Journal of Medicine. 374 (7), 601-604 (2016).
- Wen, Z., Song, H., Ming, G. L. How does Zika virus cause microcephaly?. Genes and Development. 31 (9), 849-861 (2017).
- Guzman, M. G., Harris, E. Dengue. Lancet. 385 (9966), 453-465 (2015).
- Low, J. G., Ooi, E. E., Vasudevan, S. G. Current Status of Dengue Therapeutics Research and Development. Journal of Infectious Diseases. 215 (suppl_2), S96-S102 (2017).
- Sukhavachana, P., Nisalak, A., Halstead, S. B. Tissue culture techniques for the study of dengue viruses. Bulletin of the World Health Organization. 35 (1), 65-66 (1966).
- Tang, K. F., Ooi, E. E. Diagnosis of dengue: an update. Expert Review of Anti-Infective Therapy. 10 (8), 895-907 (2012).
- Suzuki, Y., et al. Characterization of RyDEN (C19orf66) as an Interferon-Stimulated Cellular Inhibitor against Dengue Virus Replication. PLoS Pathogens. 12 (1), e1005357 (2016).
- Callahan, J. D., et al. Development and evaluation of serotype- and group-specific fluorogenic reverse transcriptase PCR (TaqMan) assays for dengue virus. Journal of Clinical Microbiology. 39 (11), 4119-4124 (2001).
- Low, J. G., et al. Early Dengue infection and outcome study (EDEN) - study design and preliminary findings. Annals of the Academy of Medicine, Singapore. 35 (11), 783-789 (2006).
- Hishiki, T., et al. Interferon-mediated ISG15 conjugation restricts dengue virus 2 replication. Biochemical and Biophysical Research Communications. 448 (1), 95-100 (2014).
- Diamond, M. S., Zachariah, M., Harris, E. Mycophenolic acid inhibits dengue virus infection by preventing replication of viral RNA. Virology. 304 (2), 211-221 (2002).
- Takhampunya, R., Ubol, S., Houng, H. S., Cameron, C. E., Padmanabhan, R. Inhibition of dengue virus replication by mycophenolic acid and ribavirin. Journal of General Virology. 87 (Pt 7), 1947-1952 (2006).
- Akondy, R. S., et al. Initial viral load determines the magnitude of the human CD8 T cell response to yellow fever vaccination. Proceedings of the National Academy of Sciences of the United States of America. 112 (10), 3050-3055 (2015).
- Edwards, C. J., et al. Molecular diagnosis and analysis of Chikungunya virus. Journal of Clinical Virology. 39 (4), 271-275 (2007).
- Hummel, K. B., Lowe, L., Bellini, W. J., Rota, P. A. Development of quantitative gene-specific real-time RT-PCR assays for the detection of measles virus in clinical specimens. Journal of Virological Methods. 132 (1-2), 166-173 (2006).
- Peeling, R. W., et al. Evaluation of diagnostic tests: dengue. Nature Reviews: Microbiology. 8 (12 Suppl), S30-S38 (2010).
- Bae, H. G., Nitsche, A., Teichmann, A., Biel, S. S., Niedrig, M. Detection of yellow fever virus: a comparison of quantitative real-time PCR and plaque assay. Journal of Virological Methods. 110 (2), 185-191 (2003).
- Colton, L., Biggerstaff, B. J., Johnson, A., Nasci, R. S. Quantification of West Nile virus in vector mosquito saliva. Journal of the American Mosquito Control Association. 21 (1), 49-53 (2005).
- Richardson, J., Molina-Cruz, A., Salazar, M. I., Black, W. Quantitative analysis of dengue-2 virus RNA during the extrinsic incubation period in individual Aedes aegypti. American Journal of Tropical Medicine and Hygiene. 74 (1), 132-141 (2006).
- Wang, W. K., et al. Detection of dengue virus replication in peripheral blood mononuclear cells from dengue virus type 2-infected patients by a reverse transcription-real-time PCR assay. Journal of Clinical Microbiology. 40 (12), 4472-4478 (2002).
- Gnadig, N. F., et al. Coxsackievirus B3 mutator strains are attenuated in vivo. Proceedings of the National Academy of Sciences of the United States of America. 109 (34), E2294-E2303 (2012).
- Rudenko, N., Golovchenko, M., Cihlarova, V., Grubhoffer, L. Tick-borne encephalitis virus-specific RT-PCR--a rapid test for detection of the pathogen without viral RNA purification. Acta Virologica. 48 (3), 167-171 (2004).
- Pastorino, B., et al. Development of a TaqMan RT-PCR assay without RNA extraction step for the detection and quantification of African Chikungunya viruses. Journal of Virological Methods. 124 (1-2), 65-71 (2005).
- Nishimura, N., et al. Detection of noroviruses in fecal specimens by direct RT-PCR without RNA purification. Journal of Virological Methods. 163 (2), 282-286 (2010).
- Kang, K., et al. A direct real-time polymerase chain reaction assay for rapid high-throughput detection of highly pathogenic North American porcine reproductive and respiratory syndrome virus in China without RNA purification. Journal of Animal Science and Biotechnology. 5 (1), 45 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon