Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthode de préparation d'échantillons de microscope électronique de balayage et de transmission pour les appendices du bec de bois
Dans cet article
Résumé
Afin d'observer l'ultrastructure de la sensibilité d'insecte, le protocole de préparation d'échantillon de balayage et de transmission d'électron (SEM et TEM, respectivement) ont été présentés dans l'étude. Tween 20 a été ajouté dans le fixatif pour éviter la déformation de l'échantillon dans LA microscopie de fluorescence DE SEM a été utile pour améliorer la précision de tranchage dans TEM.
Résumé
Ce rapport décrit les méthodes de préparation d'échantillon qui scannent et canalysent des observations de microscope électronique, démontrées en préparant des appendices du coléopter de bois, Chlorophorus caragana Xie et Wang (2012), pour les deux types de microscopie électronique. Le protocole de préparation de l'échantillon de microscopie électronique à balayage (SEM) était basé sur la fixation chimique de l'échantillon, la déshydratation dans une série de bains d'éthanol, le séchage et le revêtement par pulvérisation. En ajoutant Tween 20 (Polyoxyethylene sorbitan laurate) au fixatif et à la solution de lavage, la surface du corps d'insecte du scétis boisé a été lavée plus proprement dans SEM. La microscopie électronique de transmission de cette étude (TEM) comprenait une série d'étapes, y compris la fixation, la déshydratation de l'éthanol, l'intégration dans la résine, le positionnement à l'aide de la microscopie à fluorescence, la sectionnement et la coloration. Fixative avec Tween 20 permis pénétrer la paroi du corps d'insecte de colégon boisé plus facilement qu'il ne l'aurait été sans Tween 20, et par la suite de meilleurs tissus fixes et organes dans le corps, ainsi donné des observations électroniques de microscope de transmission claire des ultrastructures de sensilla d'insecte. L'étape suivante de cette préparation a été de déterminer les positions des insectes sensilla dans l'échantillon incorporé dans le bloc de résine en utilisant la microscopie de fluorescence pour augmenter la précision du positionnement sensilla cible. Cette précision de découpe améliorée.
Introduction
La microscopie électronique de balayage est un outil important dans beaucoup d'études de morphologie, que SEM montre des structures de surface1,2. L'attrait de la microscopie électronique de transmission est qu'elle peut être utilisée pour étudier un large éventail de structures biologiques à l'échelle nanométrique, de l'architecture des cellules et de l'ultrastructure des organites à la structure des complexes macromoléculaires et des protéines. TEM montre les structures intérieures3,4,5.
Le coleoptera est le plus grand groupe d'insectes, comprenant environ 182 familles et 350 000 espèces. La plupart des insectes coleopterans, en particulier le coléoptère du bois, se nourrissent de plantes, dont beaucoup sont d'importants ravageurs des forêts et des arbres fruitiers, causant des dommages dévastateurs aux arbres6. À l'heure actuelle, la population de prévention et de lutte des ravageurs basée sur la théorie de l'écologie chimique a reçu une attention croissante7. Des méthodes efficaces, peu toxiques et exemptes de pollution pour la phéromone sont devenues un moyen efficace8. L'étude de la morphologie sensilla et de l'ultrastructure des insectes est une partie importante de la recherche sur l'écologie chimique des insectes. La microscopie électronique de balayage et de transmission (SEM et TEM, respectivement) sont employées à grand effet pour étudier leur morphologie et anatomie interne. Cependant, pendant la préparation d'échantillons d'insectes pour la microscopie électronique (EM), l'objectivité et l'authenticité du site d'observation peuvent être affectées9. En général, la préparation de l'échantillon SEM des insectes nécessite le nettoyage, la fixation des tissus, la déshydratation, la métathèse, le séchage et le revêtement10. En raison de l'environnement complexe dans lequel vivent les bûcherons, la surface du corps a souvent divers polluants et leurs appendices ont souvent beaucoup de sensibilités fines ou de poils. En particulier, certains bûcherons ne sont pas disponibles dans l'élevage en laboratoire, qui a recueilli directement dans le champ, puis mis dans le liquide de fixation pour assurer la fraîcheur et ensuite lavé dans le laboratoire. Si l'échantillon est d'abord fixé puis lavé, il est évidemment beaucoup plus difficile d'enlever les débris parce que le glutaraldéhyde le fixe fortement à l'échantillon. Tween 20 est un surfactant11,12,13,14, qui joue un rôle important dans le processus de lavage, y compris la réduction de la tension de surface de l'eau et l'amélioration de la mouillabilité de l'eau à la surface de la lessive. Dans cette étude, Tween 20 a été ajouté à la solution de fixation et pbS solution de nettoyage pour réduire la tension de surface du liquide, et d'empêcher la saleté de déposer sur la surface du corps du scétole boisant, ce qui a rendu la surface du corps plus propre dans SEM.
À l'aide de TEM, la sensilla sur différents organes d'insectes peut être tranchée pour révéler les structures claires à l'intérieur d'eux, fournissant ainsi une base pour analyser les fonctions sensilla. Lorsque l'insecte sujet, comme le scétis boisé, est grand, et sa paroi corporelle a un degré substantiel de sclérotisation, de sorte que le fixatif peut ne pas saturer entièrement les tissus des organes à l'intérieur du corps des insectes. Tween 20 peut améliorer la dispersion et la capacité de suspension de la saleté. Dans cette étude, Tween 20 a été ajouté au fixatif pour améliorer la pénétration du liquide fixatif dans la paroi du corps des insectes du scendis boisé, évitant la déformation et l'effondrement de l'épidermi11,12,13. En outre, en utilisant la technologie de tranchage général, il est difficile de localiser avec précision différents types de sensilla, en particulier pour certains petits sensilla15. Basée sur la préparation traditionnelle de l'échantillon TEM, cette étude a combiné la microscopie à fluorescence et le SEM pour déterminer la position de l'insecte sensilla dans le bloc intégré, améliorant ainsi la précision des tranches.
Access restricted. Please log in or start a trial to view this content.
Protocole
CAUTION : Consultez les fiches de données sur la sécurité des matériaux des réactifs avant de les utiliser. Plusieurs des produits chimiques utilisés lors de la préparation de l'échantillon sont toxiques, mutagènes, cancérigènes et/ou reprotoxiques. Utilisez de l'équipement de protection individuelle (gants, blouse de laboratoire, pantalon sépuldage et chaussures à boutfermé) et travaillez sous une hotte de fumée tout en manipulant l'échantillon.
1. Préparation et imagerie de l'échantillon SEM
- Fixation et nettoyage d'échantillon
- Travailler dans une zone où C. caragana se produisent, attirer les adultes dans les pièges de champ appâtés avec des attractants de plantes, tels que l'isophorone16. Préserver les corps propres de C. caragana adulte en 0,1 mol L-1 saline tamponnée par phosphate (PBS, pH 7,2), 2,5 % (wt/vol) glutaraldéhyde (Anhydrous EM Grad) et 0,06 % (vol/vol) Tween 20. Fixer l'échantillon à 4 oC au cours du week-end.
- Retirer les corps du liquide de conservation et rincer dans un tampon de phosphate. À l'aide d'un stéréomicroscope, retirez les appendices et nettoyez-les par ultrason (40 kHz) dans un salin à phosphate de 0,1 mol-1 (pH 7,2) avec 0,06 % (vol/vol) Tween 20 (PBST). Après le nettoyage pendant 100 s, transférer l'échantillon au microscope pour vérifier s'il était propre. Dans des circonstances normales, nettoyer pendant 400 s pour s'assurer que l'échantillon était assez propre pour observer et non endommagé.
- Exemple de déshydratation, de montage et de séchage
- Déshydratez les échantillons en utilisant des traitements successifs de 20 min dans 50 %, 60 %, 70 %, 80 %, 85 %, 90 %, 95 %, 100 % et 100 % (tous vol/vol). Sous un stéréomicroscope, utiliser du ruban adhésif à double face de carbone pour fixer séparément 3 surfaces d'observation (ventrales et latérales dorsales) sur les talons. Notez que toutes les surfaces d'observation doivent être propres et exemptes de contamination. Placer l'étape de l'échantillon dans un plat de pétri contenant un dessiccant gel de silice pendant 48 h.
- Sputter-coat et Sample Insertion
- À l'aide de l'instrument de pulvérisation d'ion Hitachi Koki (E-1010), tournez MAIN VALVE pour ouvrir la position, retirez le couvercle de la chambre d'échantillon et mettez l'échantillon dans la chambre. Mettez l'interrupteur POWER allumé, et la lumière READY était allumée. Définir le temps de pulvérisation en 45 secondes, et l'épaisseur du revêtement à 70,875 euros. Une fois que l'index mécanique de cadran de pompe est tombé au-dessous de 7, appuyez sur DISCHARGE et commencez à pulvériser du platine. À la fin de l'expérience, éteignez l'alimentation et prenez l'échantillon hors de la chambre. Épaisseur du film de pulvérisation: d KIVt ("d" est l'épaisseur du film dans l'unité de " ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' K" est une constante, selon le métal et le gaz pulés. Par exemple, K de l'air est de 0,07; "I" est l'unité mA de flux plasmatique; "V" est la tension appliquée dans l'unité de "KV". "t" est le temps en quelques secondes.
- Insérer le talon contenant l'échantillon sur le stade de SEM. Assurez-vous que l'étape de l'échantillon avec le talon de l'échantillon avait une hauteur suffisante pour permettre une bonne image. Ouvrez le logiciel SEM et sélectionnez une tension de fonctionnement souhaitée, à partir de 20 kV.
2. Préparation et imagerie d'échantillons TEM
- Obtenir et fixer l'échantillon comme dans les étapes 1.1.1 et 1.1.2.
- Nettoyage, fixation secondaire et déshydratation
- Retirer le C. caragana adulte du liquide de conservation. À l'aide d'un stéréomicroscope, retirer les appendices, laver les échantillons en PBST pendant 3 h, puis les corriger en tétroxide d'osmium de 1 % (wt/vol) dans le PBS pendant 1h à 25 oC. Déshydratez les échantillons en utilisant des traitements successifs de 20 min dans 50 %, 60 %, 70 %, 80 %, 85 %, 90 %, 95 %, 100 % et 100 % (tout vol/vol) de l'éthanol à température ambiante.
- Intégration et polymérisation de résine
- Intégrer les échantillons dans de la résine dans un moule plat en incorporation. L'échantillon se trouvait au bas de la plaque et a été placé le plus près possible du bord de la rainure encastrée. Placer l'étiquette dans le blanc puis couver la plaque contenant l'échantillon à 60 oC pendant 72 h. Retirez la capsule de l'incubateur et vérifiez que la résine s'était polymérisée.
- Section de l'échantillon et coloration
- Une fois que l'échantillon s'est solidifié, placez chaque bloc de résine sous un microscope à fluorescence et photographiez-les sous la lumière bleue. Déplacez la source de lumière fluorescente du microscope pour qu'il irradie l'échantillon d'en haut. Activer la sensibilité dans le bloc de résine pour être clairement observée. Photographié et mesurer les distances pour cibler la sensilla (Figure 1).
- Se référer à l'image SEM des palpes (Figure 2A), et couper grossièrement le bloc de résine avec une lame de rasoir pour fermer le récepteur cible (Figure 2B).
- Ensuite, à l'aide de la microscopie à fluorescence à la lumière bleue, photographiez le bloc de résine grossièrement coupé, en ajustant la source de lumière d'en haut afin que la sensibilité soit observée clairement. La lumière verte excitée par la lumière bleue a créé une observation favorable. Lors de l'imagerie, le micromètre objectif (DIV 0.01mm) a été ajouté au stade du microscope à fluorescence, puis la distance de la cible a été mesurée par le logiciel ImageJ (U.S. National Institute of Health) (Figure 2C). La règle d'image a été faite par Adobe Photoshop CS5 (Adobe Systems, Inc., San Jose, CA, USA). Ensuite, pour le découpage de l'ultramicrotome, définir la distance de coupe, en utilisant des épaisseurs de tranches de 50-60 nm, jusqu'à ce que la position cible a été atteinte. Utilisez la microscopie à fluorescence pour identifier le récepteur cible.
- Montez les sections sur des grilles de cuivre enduites de Formvar, enduites de 100 mailles, doublement tachées d'acétate uranyl et de citrate de plomb.
- Tout d'abord, ajouter 3,75 g d'acétate uranyl à 50 ml de 50 % de méthanol. Grilles de taches avec une seringue filtrée (0,45 m) d'une solution saturée d'acétate uranyl à température ambiante pendant 10 min. Couvrir les sections pendant la coloration pour bloquer les précipités induits par la lumière. Rincer 2x à 50 % de méthanol; 2x eau dégazée filtrée.
- Deuxièmement, ajouter 0,02 g de citrate de plomb à 10 ml d'eau distillée dégazée dans le tube de centrifugeuse. Ajouter 0,1 ml d'hydroxyde de sodium de 10 N, sceller et secouer pour dissoudre. Grilles de tache avec une solution de citrate de plomb pendant 8 min. Centrifugeuse avant utilisation. La coloration doit être faite dans un environnement exempt de dioxyde de carbone pour empêcher la formation de précipitations de carbonate de plomb. Déposer des gouttes de tache sur des carrés de boîtes en plastique. Rincer à l'eau filtrée dégazée et sécher17. Observez-les via TEM fonctionnant à 80 kV.
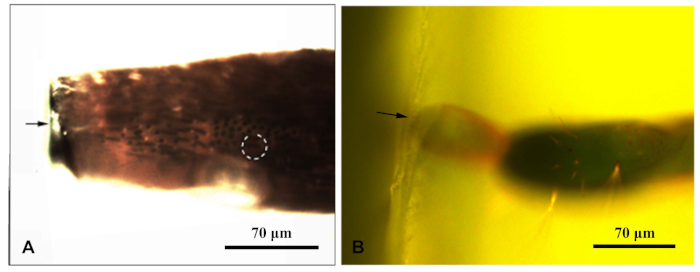
Figure 1 : Un microscope fluorescent a photographié un bloc de résine enveloppant l'appendice du Chlorophorus caragana. (A) Bloc de résine d'Antenna; (B) Bloc de résine à la fin de l'ovipositeur. La flèche indiquait le bord du bloc de résine; le cercle pointillé indique la sensilla cible. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
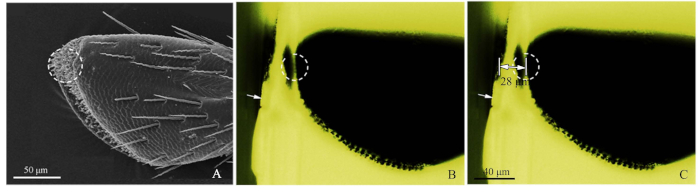
Figure 2 : Procédures de la méthode précise de localisation sensilla. (A) Le 4ème sous-segment d'un palp maxillaire de Chlorophorus caragana, le cercle pointillé a montré la sensilla ciblée par SEM. (B) Le 4ème sous-segment d'un palp maxillaire de C. caragana vu par la microscopie de fluorescence. La flèche blanche a montré le bord grossièrement coupé du bloc de résine et le cercle pointillé a montré l'emplacement précis. (C) La distance marquée entre le bord du bloc de résine et l'emplacement de la cible maxillaire (28 m dans cet échantillon). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Access restricted. Please log in or start a trial to view this content.
Résultats
En utilisant le nettoyage et la solution fixative avec Tween 20, une image SEM plus propre a été observée que celle sans Tween 20 (Figure 3). La solution de fixation de tween 20 a pénétré la solution de fixation de glutaraldéhyde dans le tissu. La structure de microtubule a été clairement vue. L'image TEM de la structure interne de l'échantillon a été floue sans Tween 20 (Figure 4).
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans cet article, nous avons présenté un schéma de préparation d'échantillon pour la microscopie électronique de balayage et de transmission pour le colégon laborieux. En utilisant l'appendice d'insecte comme sujet représentatif d'étude, nous avons démontré plusieurs améliorations au-dessus des méthodes traditionnelles de préparation d'échantillon.
L'huile liquide détachée de la surface solide est émulsionnée en petites gouttelettes, qui peuvent être bien dispersées et sus...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons aucun conflit d'intérêts à divulguer.
Remerciements
Nous apprécions l'aide généreuse du Beijing Vocational College of Agriculture, de l'Institute for the Application of Atomic Energy (Chinese Academy of Agricultural Science), du Bioresearch Center de l'Université forestière de Beijing et du professeur Shan-gan Zhang de l'Institut de Zoologie, Académie chinoise des sciences. Cette recherche a été soutenue par le National Key R-D Program of China (2017YFD06000103), la National Natural Science Foundation of China (Grant No. 31570643, 81774015), Forest Scientific Research in the Public Welfare of China (201504304), Inner Mongolia Agriculture University High-level Talent Research Startup Plan (203206038), and Inner Mongolia Autonomous Region Higher Education Research Project (NJZZ18047), Inner Mongolia Autonomous Region Linxue "Double First-class" Construction Project (170001).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
Références
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215(2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , Springer. 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, Pergamon Press. Oxford. 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. Introduction to Conventional Transmission Electron Microscopy. , Cambridge University Press. Cambridge. 1(2003).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon