このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
木管化カブトムシの付属物の走査型および透過型電子顕微鏡の試料調製方法
要約
昆虫センシラの超構造を観察するために、走査電子顕微鏡と透過電子顕微鏡(それぞれSEMおよびTEM)のサンプル調製プロトコルを研究で提示した。TEMでサンプル変形を避けるためにTween 20を固定に添加した。蛍光顕微鏡法はTEMにおけるスライス精度を向上させるのに役立った。
要約
このレポートでは、両方のタイプの電子顕微鏡に対して、木管粉カブトムシ、クロロフォラス・カラガナ・シー&ワン(2012)の付属物を調製して実証したサンプル調製法および透過型電子顕微鏡観察方法について説明した。走査型電子顕微鏡(SEM)サンプル調製プロトコルは、一連のエタノール浴におけるサンプル化学固定、脱水、乾燥、スパッタコーティングに基づいていました。Tween20(ポリオキシエチレンソルビタンラウレート)を固定液と洗浄液に添加することにより、木除けカブトムシの昆虫体表面をよりきれいに洗浄した。本研究では、透過電子顕微鏡(TEM)の試料調製には、固定、エタノール脱水、樹脂への埋め込み、蛍光顕微鏡を用いた位置決め、切除、染色を含む一連のステップが含まれる。Tween 20を用いた固定剤は、木田の虫体壁をTween 20なしでより簡単に貫通し、その後体内の組織や臓器をより良く固定し、昆虫感覚超構造の透明な透過電子顕微鏡観察を生み出した。この調製の次のステップは、蛍光顕微鏡法を用いて標的感覚位置の精度を高めることによって、樹脂ブロックに埋め込まれた試料中の昆虫感覚の位置を決定することでした。これにより、スライス精度が向上しました。
概要
走査型電子顕微鏡は、多くの形態研究において重要なツールであり、SEMは表面構造1、2を示している。透過型電子顕微鏡法の魅力は、細胞のアーキテクチャや小器官の超構造から、高分子複合体やタンパク質の構造まで、ナノメートルスケールで幅広い生体構造を研究できるということです。TEM は内部構造3、4、5を示しています。
Coleopteraは、約182の家族と350,000種を含む昆虫の最大のグループです。コレオプテランの昆虫、特に木を退屈するカブトムシのほとんどは植物を食べ、その多くは森林や果樹の重要な害虫であり、木に壊滅的な被害を与える6.現在、化学生態学説に基づく害虫の予防・防除集団は、7.1.1の注目を集めている。効率的で低毒性、無公害のフェロモン制御法が有効な方法8となっている。昆虫の形態と超構造を研究することは、昆虫化学生態学研究の重要な部分です。走査電子顕微鏡と透過電子顕微鏡(SEMとTEM)は、それらの形態と内部解剖学を研究するために大きな効果を発揮します。しかし、電子顕微鏡(EM)用の昆虫試料の調製中に、観察部位の客観性および真正性が9に影響を受ける可能性がある。一般に、昆虫のSEM試料調製には、洗浄、組織固定、脱水、メタセシス、乾燥、およびスパッタコーティング10が必要である。木をつなぐカブトムシが生きる複雑な環境のために、体表面はしばしば様々な汚染物質を有し、その付属物はしばしば多くの細長い長いセンシラまたは毛先を有する。特に、一部の木ボラーは、現場で直接収集し、その後、新鮮さを確保するために液体を固定するために入れて、その後、実験室で洗浄実験室で利用できない。サンプルが最初に固定され、次に洗浄された場合、グルタルアルデヒドがサンプルに強く固定するため、明らかに破片を除去することははるかに困難です。トゥイーン20は、水の表面張力を低下させ、洗濯物表面の水の濡れ性を向上させるなど、洗浄工程において重要な役割を果たす界面活性剤11、12、13、14である。本研究では、液体の表面張力を低減する固定液とPBS洗浄液にTween20を添加し、SEMで体表面をクリーナーさせた木張りカブトムシの体表面に汚れが付着するのを防止した。
TEMを使用して、昆虫の異なる器官上のセンシラをスライスして、その中の明確な構造を明らかにし、感覚機能を分析するための基礎を提供することができる。木除けカブトムシのような被検昆虫が大きく、体壁がかなりの程度の硬化を有する場合、固定剤は昆虫体内の臓器組織を十分に飽和させることができない。トゥイーン20は、汚れの分散および懸濁能力を高めることができる。本研究では、Tween 20を固定液に加えて、木張りカブトムシの昆虫体壁への固定液の浸透を促進し、表皮11、12、13の変形および崩壊を回避した。さらに、一般的なスライス技術を使用して、特にいくつかの小さなセンシラ15のために、センシラの異なるタイプを正確に見つけることが困難である。従来のTEMサンプル調製に基づいて、本研究は蛍光顕微鏡とSEMを組み合わせて埋め込みブロック内の昆虫感覚の位置を決定し、スライス精度を向上させた。
プロトコル
注意: 試薬を使用する前に、材料安全データシートを参照してください。サンプル調製中に使用される化学物質のいくつかは、毒性、突然変異原性、発癌性、および/または再増殖性である。個人用保護具(手袋、ラボコート、フルレングスパンツ、クローズドトゥシューズ)を使用し、サンプルを扱いながらヒュームフードの下で作業します。
1. SEM サンプル調製とイメージング
- サンプル固定とクリーニング
- C.カラガナが発生する地域で働き、イソフォロン16のような植物誘引剤で餌を与えたフィールドトラップに大人を引き付ける。成体C.カラガナのきれいな体を0.1モルL-1リン酸緩衝生理食塩水(PBS、pH 7.2)、2.5%(wt/vol)グルタルアルデヒド(無水EMグラード)、0.06%(vol/vol)トゥイーン20に保存する。週末に4°Cでサンプルを固定します。
- 保存液から体を取り出し、リン酸バッファーですすいでください。ステレオ顕微鏡を使用して、付属物を取り除き、0.1 molL-1リン酸緩衝生理食塩基(pH 7.2)で超音波洗浄(40 kHz)、Tween 20(PBST)で洗浄します。100sの洗浄後、試料を顕微鏡に移し、清潔かどうかを確認します。通常の状況では、サンプルが観察するのに十分な清潔で損傷していないことを確認するために、400年代に清掃してください。
- 脱水、取り付け、乾燥のサンプル
- 50%、60%、70%、80%、85%、90%、100%、および100%(全vol/vol)エタノールで20分連続処理を使用してサンプルを脱水する。ステレオ顕微鏡では、カーボン両面粘着テープを使用して、3つの観察面(後側腹側および側面)をスタブに別々に固定します。すべての表示面は、汚れのない清潔な状態に保たれなければならないことに注意してください。48時間シリカゲル乾燥剤を含むシャーレにサンプルステージを置きます。
- スパッタコートとサンプル挿入
- 日立工機(E-1010)イオンスパッタリング装置を使用し、MAIN VALVEをOPEN位置に回転させ、試料室カバーを外し、試料をチャンバーに入れます。電源スイッチをオンにし、READYライトが点灯しました。スパッタリング時間を45秒、コーティングの厚さを70.875 Åに設定します。機械式ポンプ真空ダイヤルインデックスが7を下回ったら、放電を押して白金の噴霧を開始します。実験の最後に、電源をオフにし、チャンバーからサンプルを取り出します。スプレーフィルムの厚さ: d = KIVt ("d"は、"Å"の単位でのフィルムの厚さです。K"は、スパッタ金属とガスに依存して一定である。たとえば、空気の K は 0.07 です。「I」はプラズマ流の単位mAです。「V」は「KV」の単位で印加される電圧です。"t" は秒単位の時間です。
- サンプルを含むスタブを SEM のステージに挿入します。SEMソフトウェアを開き、20kVから始まる、目的の動作電圧を選択します。
2. TEM サンプル調製とイメージング
- 手順 1.1.1 および 1.1.2 のようにサンプルを取得して修正します。
- クリーニング、二次固定、脱水
- 保存液から成人C.カラガナを取り除きます。形素顕微鏡を使用して、付属物を取り出し、PBSTで3時間洗浄し、PBS中の1%(wt/vol)の四酸化オスメウムで25°Cで1hで後定着させます。50%、60%、70%、80%、85%、90%、100%、100%(全vol/vol)エタノールを室温で20分連続処理して脱水した。
- 樹脂埋め込みと重合
- 平らな埋め込み型の樹脂にサンプルを埋め込む。試料はプレートの底部にあり、凹溝の縁にできるだけ近くに置いた。ラベルをブランクに入れ、サンプルを含むプレートを60°Cで72時間インキュベートし、インキュベーターからカプセルを取り出し、樹脂が重合していることを確認します。
- サンプルの断面と染色
- サンプルが固まったことを確認したら、各樹脂ブロックを蛍光顕微鏡の下に置き、青色光の下で撮影します。顕微鏡の蛍光光源を上から照射するように移動します。樹脂ブロックのセンシラを明確に観察できるようにします。センサをターゲットとする距離を撮影し、測定します(図1)。
- PalpsのSEM画像(図2A)を参照し、カミソリの刃で樹脂ブロックを大まかに切り、標的受容体を閉じます(図2B)。
- 次に、青色光蛍光顕微鏡を用いて、大まかに切られた樹脂ブロックを撮影し、上から光源を調整して、センサが明確に観察されるようにする。青い光によって励起された緑色の光が、良好な観測を生み出した。イメージングの際、蛍光顕微鏡ステージに対する目的マイクロメータ(DIV 0.01mm)を加え、次いでImageJソフトウェア(米国国立衛生研究所)で目標の距離を測定した(図2C)。イメージルーラーはアドビフォトショップCS5(アドビシステムズ社、サンノゼ、カリフォルニア州、米国)によって作られました。次いで、超ミクロトームスライスのために、切断距離を設定し、50〜60nmのスライス厚みを用いて、目標位置に達するまで。蛍光顕微鏡法を使用して、標的受容体を特定します。
- Formvarコーティングされた100メッシュの銅グリッドにセクションを取り付け、酢酸ウラニルとクエン酸鉛で二重染色します。
- まず、50%メタノールの50mLに3.75gの酢酸ウラニルを加える。室温で酢酸ウラニルの飽和溶液の濾過(0.45 μm)シリンジを10分間染色する際の染色時の染色部で、0.45 μmのシリンジを濾過したスタイングリッドが、光の析出を遮断します。50%メタノールで2倍をリンス;2xろ過した脱気水。
- 第二に、遠心管内の脱気蒸留水の10 mLに0.02 gの鉛クエン酸を加える。10Nの水酸化ナトリウムの0.1mLを加え、シールして振って溶解させます。使用前に8分間のクエン酸鉛の溶液を使用してグリッドを染色します。炭酸鉛沈殿の形成を防ぐために、二酸化炭素フリー環境で染色を行う必要があります。プラスチック製のシャーレ皿の正方形に汚れの滴を置きます。脱ガス濾過水および乾燥17でリンス。80 kVで動作するTEMを介してそれらを観察してください。
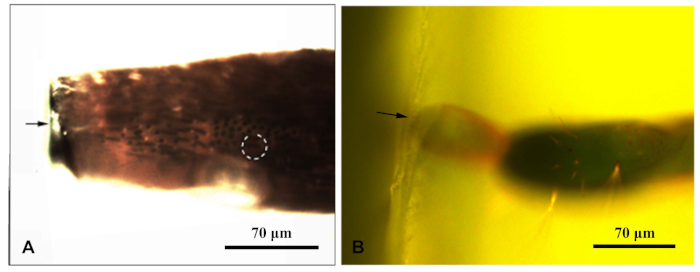
図1:蛍光顕微鏡は、クロロフォラスカラガナの付属部を囲む樹脂ブロックを撮影した。(A) アンテナ樹脂ブロック;(B) 卵子の端部に樹脂ブロックを付けたもの。矢印は樹脂ブロックの縁を示した。点線の円は、ターゲットセンシラを示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
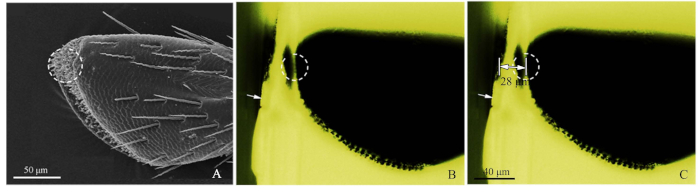
図2:精密な感覚的位置法の手順。(A)葉ロフォラスカラガナの上顎手のひらの第4サブセグメントは、点線円がSEMによって標的としたセンシラを示した(B)蛍光顕微鏡で見たC.カラガナの上顎手パルプの4番目のサブセグメント。白矢印は樹脂ブロックの大まかに切り取られた縁を示し、点線の円は正確な位置を示した。(C) 樹脂ブロックの縁から上顎のパルプターゲット位置までの目印の距離(このサンプルでは28 μm)。この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
Tween 20での洗浄および固定液を用いて、Tween 20を使用しないものよりもクリーンなSEM画像が観察された(図3)。Tween 20固定液は、グルタルアルデヒド固定溶液を組織に浸透させた。微小管構造がはっきりと見られた。サンプルの内部構造のTEM画像は、Tween 20なしでぼやけました(図4)。
ディスカッション
本稿では、木材用カブトムシの走査および透過電子顕微鏡のサンプル調製スキームを紹介した。代表的な研究対象として虫の付属物を用いて、従来のサンプル調製方法に対していくつかの改良点を実証した。
固体表面から切り離された液体油は、小さな液滴に乳化され、被用物の表面への再沈着を低減するために洗浄媒体中に十分に分散および懸濁することができる。?...
開示事項
私たちは開示する利益相反はありません。
謝辞
北京農学部、原子力応用研究所(中国農学院)、北京林業大学生物研究センター、山金教授の多大な支援に感謝します。中国科学院動物学研究所の張。この研究は、中国国家主要研究開発プログラム(2017YFD0600103)、中国自然科学財団(グラントNo.31570643、81774015)、中国の公共福祉における森林科学研究(201504304)、内モンゴルによって支援されました。農業大学ハイレベル人材研究立ち上げ計画(203206038)、内モンゴル自治区高等教育研究プロジェクト(NJZZ18047)、内モンゴル自治区臨行「ダブルファーストクラス」建設プロジェクト(170001)
資料
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
参考文献
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215 (2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. . Introduction to Conventional Transmission Electron Microscopy. , 1 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved