JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
목공 딱정벌레의 부속물을 위한 주사 및 투과 전자 현미경의 시료 제조 방법
요약
곤충 센실라의 초구조를 관찰하기 위해, 스캐닝 및 투과 전자 현미경(SEM 및 TEM) 시료 준비 프로토콜을 각각 연구에서 발표되었다. Tween 20은 SEM에서 샘플 변형을 피하기 위해 고정식에 첨가되었습니다.
초록
이 보고서는 주사 및 투과 전자 현미경 관찰, 목공 딱정벌레, 클로로 포러스 카라가나 Xie & 왕 (2012)의 부속물을 제조하여 입증 된 샘플 준비 방법을 설명, 전자 현미경의 두 가지 유형. 스캐닝 전자 현미경(SEM) 샘플 전처리 프로토콜은 일련의 에탄올 목욕, 건조 및 스퍼터 코팅에서 샘플 화학적 고정, 탈수에 기초하였다. Tween 20(폴리옥시에틸렌 소르비탄 라우레이트)을 고정액 및 세척 용액에 첨가함으로써, 목공 딱정벌레의 곤충 체표면을 SEM에서 보다 깨끗하게 세척하였다. 이 연구의 전송 전자 현미경 검사법 (TEM) 견본 준비는 고착, 에탄올 탈수, 수지에 있는 포함, 형광 현미경 검사법을 사용하여 위치, 단면도 및 염색을 포함하여 일련의 단계를 관련시켰습니다. Tween 20을 이용한 고정제는 트웬(20)이 없었을 때보다 더 쉽게 목공 딱정벌레의 곤충 몸벽을 관통하고, 이어서 체내에 더 나은 고정 조직과 장기를 침투시켜 곤충 센실라 울트라구조의 명확한 투과 전자 현미경 관측을 산출하였다. 이 제제의 다음 단계는 형광 현미경을 사용하여 수지 블록에 내장된 샘플에서 곤충 센실라의 위치를 결정하여 표적 센실라 포지셔닝의 정밀도를 높이는 것이었다. 이렇게 하면 슬라이스 정확도가 향상되었습니다.
서문
주사 전자 현미경 검사법은 SEM이 표면 구조를 보여줍니다 많은 형태학 연구에서 중요한 도구입니다1,2. 전송 전자 현미경 검사법의 매력은 세포의 구조와 세포기관의 초구조에서, 거대 분자 복합체 및 단백질의 구조에, 나노 미터 규모에 있는 생물학 구조물의 넓은 범위를 공부하는 것을 이용될 수 있다는 것입니다. TEM은 내부 구조를 보여줍니다3,4,5.
콜레옵테라는 약 182가구와 350,000여 종의 곤충을 포함한 가장 큰 곤충 군이다. 콜레옵테란 곤충의 대부분, 특히 목공 딱정벌레는 식물을 먹고, 그 중 많은 식물은 숲과 과일 나무의 중요한 해충이며, 나무에 치명적인 손상을초래6. 현재, 화학생태이론에 근거한 해충의 예방 및 방제 인구는7. 효율적이고 독성이 낮고 무공해 페로몬 제어 방법이 효과적인방법이되었습니다 8. 곤충의 센실라 형태와 초구조를 연구하는 것은 곤충 화학 생태 연구의 중요한 부분입니다. 스캐닝 및 투과 전자 현미경 검사법 (SEM 및 TEM, 각각)은 그들의 형태및 내부 해부학을 공부하는 큰 효력을 위해 이용됩니다. 그러나, 전자 현미경 검사법(EM)을 위한 곤충 샘플의 제조 도중, 관측 부위의 객관성 및진위도9에영향을 받을 수 있다. 일반적으로 곤충의 SEM 샘플 제제는 세정, 조직 고정, 탈수, 대사, 건조 및 스퍼터코팅(10)을필요로 한다. 나무 보링 딱정벌레가 살고있는 복잡한 환경으로 인해 신체 표면에는 종종 다양한 오염 물질이 있으며 부속물은 종종 많은 미세한 긴 센실라 또는 강모가 있습니다. 특히, 일부 목공은 현장에서 직접 수집 한 실험실 제기에서 사용할 수 없으며 신선도를 보장하기 위해 유체를 고정시키고 실험실에서 세척합니다. 시료가 먼저 고정된 다음 세척되면 글루타랄데히드가 시료에 강하게 고정되기 때문에 이물질을 제거하는 것이 훨씬 더 어렵습니다. 트웬(20)은 계면활성제11,12,13,14,이는 세탁물의 표면 장력을 감소시키고 세탁물의 수면의 습류성을 향상시키는 등 세척 과정에서 중요한 역할을 한다. 본 연구에서, Tween 20은 액체의 표면 장력을 감소시키고, SEM에서 바디 표면을 더 깨끗하게 만든 나무 보링 딱정벌레의 체체 표면에 침전되는 먼지를 방지하기 위해 고정 용액 및 PBS 세정 액에 첨가되었다.
TEM을 사용하여, 곤충의 다른 기관에 센실라는 그 안에 명확한 구조를 밝히기 위하여 슬라이스될 수 있습니다, 따라서 감각증 기능을 분석하기 위한 기초를 제공하. 목공 딱정벌레와 같은 대상 곤충이 크고, 그 몸벽이 경화의 상당 정도를 가지면, 고정제는 곤충 체 내의 장기 조직을 완전히 포화시키지 못할 수 있다. 트위넨(20)은 먼지의 분산 및 현탁용량을 향상시킬 수 있다. 본 연구에서, 트웬(20)은 목초지 딱정벌레의 곤충 체벽내로의 고정유체 침투를 향상시키기 위해 고정식에 첨가하였으며,표피11,12,13의변형 및 붕괴를 피하하였다. 또한, 일반 슬라이스 기술을 사용하면, 특히 일부 작은센실라(15)에대해 다른 유형의 센실라를 정확하게 찾기가 어렵다. 전통적인 TEM 견본 준비에 근거를 두어, 이 연구 결과는 임베디드 블록에 있는 곤충 감각실라의 위치를 결정하기 위하여 형광 현미경 검사법과 SEM을 결합하여, 따라서 슬라이스 정확도를 향상합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
주의: 시약의 재료 안전 데이터 시트를 사용하기 전에 참조하십시오. 샘플 준비 중에 사용되는 여러 화학 물질은 독성, 돌연변이, 발암 성 및 / 또는 재현독성입니다. 개인 보호 장비(장갑, 실험실 코트, 전신 바지 및 닫힌 발가락 신발)를 사용하고 샘플을 처리하는 동안 연기 후드 아래에서 작업하십시오.
1. SEM 견본 준비 및 화상 진찰
- 샘플 고정 및 세척
- C. 카라가나 발생 지역에서 작업, 이소포론16등의 식물 매력으로 미끼 필드 트랩에 성인을 유치. 0.1 molL-1 인산 완충 식염수(PBS, pH 7.2), 글루타랄데히드(Anhydrous EM Grad) 및 0.06%(vol/vol) 트웬트 20에 성인 C. 카라가나의 깨끗한 몸을 보존합니다. 주말에 4 °C에서 샘플을 고정합니다.
- 보존 액에서 시체를 제거하고 인산염 완충액으로 헹시다. 입체 현미경을 사용하여 부속물을 제거하고 0.1 mol L-1 인산완식염수(pH 7.2)에서 0.06%(vol/vol) 트웬 20(PBST)로 초음파(40kHz)로 세척합니다. 100초 동안 세척한 후 샘플을 현미경으로 옮겨 깨끗한지 확인합니다. 정상적인 상황에서는 400년대를 깨끗하게 청소하여 시료가 관찰할 수 있을 만큼 깨끗하고 손상되지 않도록 하십시오.
- 샘플 탈수, 장착 및 건조
- 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100%, 100% (모든 vol/vol) 에탄올에서 20분 연속 처리를 사용하여 샘플을 탈수한다. 입체 현미경으로 탄소 양면 접착 테이프를 사용하여 3개의 관찰 표면(등쪽 복부 및 측면)을 스텁에 별도로 고정합니다. 모든 시야 표면은 깨끗하고 오염이 없어야 합니다. 시료를 실리카 겔 데시칸트를 함유한 페트리 접시에 48시간 동안 놓는다.
- 스퍼터 코트 및 샘플 삽입
- 히타치 코키 (E-1010) 이온 스퍼터링 악기를 사용하여, 오픈 위치에 메인 밸브를 회전, 샘플 챔버 커버를 제거하고 챔버에 샘플을 넣어. 전원 스위치를 켜면 READY 표시등이 켜져 있습니다. 스퍼터링 시간을 45초로 설정하고 코팅 두께를 70.875 Å로 설정합니다. 기계식 펌프 진공 다이얼 지수가 7 이하로 떨어지면 DISCHARGE를 누르고 백금 분무를 시작합니다. 실험이 끝나면 전원 공급 장치를 끄고 샘플을 챔버에서 꺼내십시오. 스프레이 필름 두께: d = KIVt("d"는 "Å"; "; "의 단위에서 막의 두께이다; " K"는 스퍼터드 금속 및 가스에 따라 상수입니다. 예를 들어, 공기의 K는 0.07; "I"는 플라즈마 흐름의 단위 mA; "V"는 "KV"의 장치에 적용되는 전압입니다. "t"는 초 단위로 시간입니다.
- 샘플을 포함하는 스텁을 SEM 의 단계에 삽입합니다. SEM 소프트웨어를 열고 20kV부터 원하는 작동 전압을 선택합니다.
2. TEM 견본 준비 및 화상 진찰
- 1.1.1 단계 및 1.1.2 단계에서와 같이 샘플을 획득하고 수정합니다.
- 청소, 이차 고정 및 탈수
- 보존 액에서 성인 C. 카라가나는 제거합니다. 입체 현미경을 사용하여 부속물을 제거하고 PBST에서 샘플을 3 시간 동안 씻은 다음 25 °C에서 1 시간 동안 PBS에서 1 % (wt / vol) 오스뮴 테트 록사이드로 사후 수정하십시오. 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100%, 100% 및 100%(모든 vol/vol) 에탄올로 20분 연속 처리를 사용하여 시료를 탈수합니다.
- 수지 임베딩 및 중합
- 평평한 임베딩 금형에 수지에 샘플을 포함시면 됩니다. 샘플을 플레이트의 바닥에 놓고 오목홈의 가장자리에 가능한 한 가깝게 배치하였다. 라벨을 블랭크에 넣고 샘플을 함유한 플레이트를 60°C에서 72시간 동안 인큐베이터에서 제거하고 수지가 중합되었는지 확인합니다.
- 샘플 단면 및 염색
- 일단 견본이 응고되었다는 것을 확인한 후에, 형광 현미경의 밑에 각 수지 블록을 놓고 청색광 의 밑에 그(것)들을 사진하십시오. 현미경의 형광광원을 이동하여 샘플을 위에서 조사합니다. 수지 블록의 센실라를 명확하게 관찰할 수 있습니다. 센실라를 타겟팅하기 위한 거리를 촬영하고측정합니다(그림 1).
- Palps의 SEM 이미지를참조(도 2A),대상 수용체를 닫기 위해 면도날로 수지 블록을 대략 잘라냅니다(도2B).
- 다음으로, 청색광형광현미경을 사용하여, 대략 절단된 수지 블록을 촬영하고, 상기에서 광원을 조정하여 센실라를 선명하게 관찰했다. 푸른 빛에 흥분 한 녹색 빛은 유리한 관찰을 만들었습니다. 이미징 시, 객관적인 마이크로미터(DIV 0.01mm)를 형광 현미경 스테이지에 첨가한 다음, 대상의 거리를 ImageJ 소프트웨어(미국 국립보건원)에 의해 측정하였다(그림2C). 이미지 통치자는 어도비 포토샵 CS5에 의해 만들어졌다 (어도비 시스템즈, 주식 회사, 산호세, 캘리포니아, 미국). 그런 다음, 울트라 마이크로토메 슬라이싱의 경우, 목표 위치에 도달할 때까지 50-60 nm 슬라이스 두께를 사용하여 절삭 거리를 설정합니다. 형광 현미경 검사법을 사용하여 표적 수용체를 정확히 찾아내보도록 하십시오.
- 우라날 아세테이트와 납 구연산염으로 이중 으로 염색된 Formvar 코팅 된 100 메쉬 구리 그리드에 섹션을 장착하십시오.
- 첫째, 50 % 메탄올의 50 mL에 3.75 g의 우라날 아세테이트를 추가하십시오. 실온에서 우라일 아세테이트의 포화 용액의 여과된(0.45 μm) 주사기로 스테인 그리드를 10분 동안. 염색 시 점면 빛이 유도된 침전물들을 차단한다. 50 % 메탄올에서 2 x 헹구십시오; 2x 여과 된 탈기 수.
- 둘째, 0.02 g의 납 구연산염을 원심 분리 튜브에 10 mL의 탈기 증류수를 추가합니다. 0.1 mL의 수산화 나트륨 10 개를 넣고 밀봉하고 흔들어 용해시도록 하십시오. 8 분 동안 납 구연산염용액으로 그리드를 얼룩지게하십시오. 염색은 납 탄산염 침전물의 형성을 방지하기 위해 이산화탄소가없는 환경에서 수행되어야합니다. 플라스틱 페트리 접시의 사각형에 얼룩 방울을 놓습니다. 탈기 여과수로 헹구고17. 80 kV에서 작동하는 TEM을 통해 관찰하십시오.
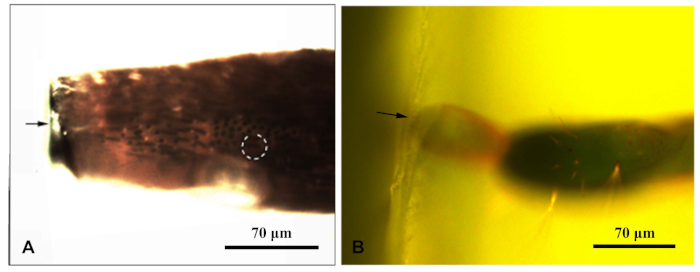
그림 1: 형광 현미경은 클로로포러스 카라가나부속을둘러싸는 수지 블록을 촬영했다. (a)안테나 수지 블록; (B)수지 블록의 끝에 있는 오비포시터의 끝. 화살은 수지 블록의 가장자리를 나타냈다; 점선 원은 대상 센실라를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
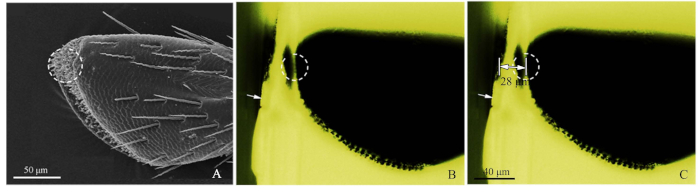
그림 2: 정확한 센실라 위치 방법의 절차. (A) 클로로포러스 카라가나상악점의 4번째 서브세그먼트는, 점선원은 SEM에 의해 표적화된 센실라를 나타냈다. 흰색 화살표는 수지 블록의 대략 절단 가장자리를 보여주고 점선 원은 정확한 위치를 보여 주었다. (C)수지 블록의 가장자리에서 상악점 점액 대상 위치까지의 현저한 거리(이 샘플에서 28 μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
Tween 20을 사용한 세척 및 고정 용액을 사용하여, 더 깨끗한 SEM 이미지는 트웬 20(그림3)이없는 것보다 더 깨끗한 SEM 영상을 관찰하였다. 트웬 20 고정용액은 글루타랄데히드 고정액을 조직 내로 침투하였다. 미세소관 구조가 명확하게 보였다. 샘플의 내부 구조의 TEM 이미지는 Tween 20(도4)없이흐려졌다.
Access restricted. Please log in or start a trial to view this content.
토론
이 기사에서는 목공 딱정벌레에 대한 주사 및 투과 전자 현미경 검사법을 위한 샘플 준비 계획을 발표했습니다. 곤충 부속을 대표적인 연구 대상자로 사용하여 기존의 시료 전처리 방법에 비해 몇 가지 개선된 방법을 입증했습니다.
고체 표면에서 분리된 액체 오일은 작은 액적으로 유화되어, 이는 물체의 표면에 재증착을 감소시키기 위해 세척 매체에 잘 분산되고 부유될 수...
Access restricted. Please log in or start a trial to view this content.
공개
우리는 공개할 이해 상충이 없습니다.
감사의 말
우리는 베이징 전문 대학, 원자력 응용 연구소 (중국 농업 과학 아카데미), 베이징 임업 대학의 바이오 연구 센터 및 산간 교수의 관대 한 지원에 감사드립니다. 동물학 연구소의 장, 중국 과학 아카데미. 이 연구는 중국의 국가 핵심 R&D 프로그램(2017YFD0600103), 중국 국립자연과학재단(보조금 제31570643, 81774015), 중국 공공복지 산림과학연구(201504304), 내몽골의 지원을 받았습니다. 농업대학 고위인재연구창업계획(203206038) 및 내몽골 자치구 고등교육연구사업(NJZZ18047), 내몽골 자치구 린수 "더블 퍼스트 클래스" 건설사업(170001)
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
참고문헌
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215(2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , Springer. 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, Pergamon Press. Oxford. 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. Introduction to Conventional Transmission Electron Microscopy. , Cambridge University Press. Cambridge. 1(2003).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유