Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification de trois lésions de l’ADN par spectrométrie de masse et évaluation de leurs niveaux dans les tissus de souris exposés à des particules fines ambiantes
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons ici les méthodes de quantification sensible et précise des lésions 8-oxo-7,8-dihydro-2 '-désoxyguanosine (8-oxodGuo), 1,n6-étheno-2 '-désoxyadénosine (1,n6-Dado) et 1,n2- étheno-2 '-désoxyguanosine (1,N-2dguo) dans l’ADN. Les méthodes ont été appliquées à l’évaluation des effets des particules fines ambiantes (PM2,5) dans les tissus (poumons, foie et rein) des souris A/J exposées.
Résumé
Les adduits d’ADN et les bases d’ADN oxydées sont des exemples de lésions de l’ADN qui sont des biomarqueurs utiles pour l’évaluation de la toxicité des substances qui sont électrophiliques, génèrent des électrophiles réactifs lors de la biotransformation, ou induisent un stress oxydatif. Parmi les nucléobases oxydées, la plus étudiée est la 8-oxo-7, 8-dihydroguanine (8-oxoGua) ou la 8-oxo-7,8-dihydro-2 '-désoxyguanosine (8-oxodGuo), un biomarqueur des lésions de base induites oxydativement dans l’ADN. Les aldéhydes et les époxyaldéhydes résultant du processus de peroxydation lipidique sont des molécules électrophiles capables de former des adduits d’ADN exocyclique mutagènes, tels que les adduits d’étheno 1,n2-étheno-2'-désoxyguanosine (1,n2- εdGuo) et 1,n6-étheno-2 '-désoxyadénosine (1,n6-εdado), qui ont été suggérés comme biomarqueurs potentiels dans la pathophysiologie de l’inflammation. Des méthodes sélectives et sensibles pour leur quantification dans l’ADN sont nécessaires à l’élaboration de stratégies préventives pour ralentir les taux de mutation cellulaire et le développement des maladies chroniques (p. ex. cancer, maladies neurodégénératives). Parmi les méthodes sensibles disponibles pour leur détection (chromatographie liquide à haute performance couplée à des détecteurs de spectrométrie de masse électrochimique ou tandem, essai de comète, immunodosages, 32P-post-étiquetage), les plus sélectifs sont ceux basés sur chromatographie liquide haute performance couplée à la spectrométrie de masse en tandem (HPLC-ESI-MS/MS). La sélectivité est un avantage essentiel lors de l’analyse d’échantillons biologiques complexes et de HPLC-ESI-MS/MS évolué comme étalon-or pour la quantification des nucléosides modifiés dans les matrices biologiques, comme l’ADN, l’urine, le plasma et la salive. L’utilisation de normes internes étiquetées isotopiquement ajoute l’avantage de corrections pour les pertes de molécules au cours de l’hydrolyse de l’ADN et des étapes d’enrichissement de l’analyte, ainsi que pour les différences de l’ionisation de l’analyte entre les échantillons. Il aide également à identifier le pic chromatographique correct lorsque plus d’un pic est présent.
Nous présentons ici des méthodes de HPLC-ESI-MS/MS validées, précises et précises, qui ont été appliquées avec succès pour la quantification du 8-oxodGuo, 1,n6-Dado et 1,n2-dguo dans le poumon, le foie et l’ADN des reins des souris A/J pour l’évaluation des effets de l’exposition aux PM2,5 ambiantes.
Introduction
Certaines espèces d’oxygène réactif (ROS) sont capables d’oxyder des liaisons doubles de carbone de bases d’ADN et de certains carbones dans la portion désoxyribose, générant des bases oxydées et des ruptures de brin d’ADN1. En tant que molécule chargée négativement riche en atomes d’azote et d’oxygène, l’ADN est aussi une cible pour les groupes électrophiles qui réagissent de façon covalente avec les sites nucléophiles (azote et oxygène), donnant des produits qui sont appelés adduits d’ADN2. Ainsi, les adduits d’ADN et les bases d’ADN oxydées sont des exemples de lésions de l’ADN qui sont des biomarqueurs utiles pour l’évaluation de la toxicité des substances qui sont électrophiliques, génèrent des électrophiles réactifs lors de la biotransformation, ou induisent un stress oxydatif1, 2. les deux. Bien que les bases modifiées de l’ADN puissent être retirées de l’ADN par réparation d’excision de base ou de nucléotide (BER ou NER), l’induction d’un déséquilibre entre la génération et l’élimination des lésions de l’ADN en faveur de l’ancien conduit à une augmentation nette de leurs niveaux dans les heures supplémentaires de l’ADN3 < /C5 >. Les résultats sont l’augmentation des taux de mutation de l’ADN, l’expression génique réduite et l’activité protéique diminuée2,4,5,6,7, effets qui sont étroitement liés à la développement des maladies. Les mutations de l’ADN peuvent affecter diverses fonctions cellulaires, telles que la signalisation cellulaire, le cycle cellulaire, l’intégrité du génome, la stabilité du télomère, l’épigénome, la structure de la chromatine, l’épissage d’ARN, l’homéostasie protéique, le métabolisme, l’apoptose et la différenciation cellulaire8 ,9. Les stratégies visant à ralentir les taux de mutation cellulaire et le développement des maladies chroniques (p. ex. cancer, maladies neurodégénératives) traversent la connaissance des sources de mutation, parmi lesquelles les lésions de l’ADN et leurs causes.
Les ROS générés de façon endogène en excès, en raison de l’exposition aux polluants, de l’inflammation persistante, de la pathophysiologie des maladies (p. ex. le diabète), etc., sont des causes importantes de dommages causés par la biomolécule, y compris l’ADN et les lésions lipidiques1. À titre d’exemple, le radical hydroxyle hautement réactif (OH) formé à partir de H2O2 réduction par des ions métalliques de transition (Fe2 +, Cu+) oxyde les bases de l’ADN, la portion de sucre d’ADN et les acides gras polyinsaturés à la diffusion contrôlée taux de change10. Parmi les 80 déjà caractérisés nucléobases oxydées3, la plus étudiée est la 8-oxo-7, 8-dihydroguanine (8-oxoGua) ou 8-oxo-7, 8-dihydro-2 '-désoxyguanosine (8-oxodGuo, figure 1), une lésion qui est capable d’induire gt transversions dans cellules de mammifères10,11. Il est formé par l’oxydation mono-électronique de la guanine, ou par le radical hydroxyle ou l’attaque de l’oxygène sinéne de la guanine dans l’ADN1. Les acides gras polyinsaturés sont d’autres cibles importantes d’oxydants hautement réactifs, tels que •Oh, qui initie le processus de peroxydation lipidique1,12. Il donne lieu à des hydroperoxydes d’acides gras qui peuvent se décomposer en aldéhydes électrophiliques et en époxyaldéhydes, comme le malondialdéhyde, le 4-hydroxy-2-nonenal, le 2,4-décadienal, le 4,5-époxy-(2E)-décénal, l’Hexénal, l’acroléine, le crotonaldéhyde, qui sont capables de former des adduits d’ADN exocyclique mutagènes, tels que les adduits de malondialdéhyde-, Propano-ou étheno1,12,13. Les adduits d’étheno 1,n2-étheno-2'-désoxyguanosine (1,n2-εdguo, figure 1) et 1,n6-étheno-2 '-désoxyadénosine (1,n6-εdado, figure 1 ) ont été suggérés comme biomarqueurs potentiels dans la pathophysiologie de l’inflammation14,15.
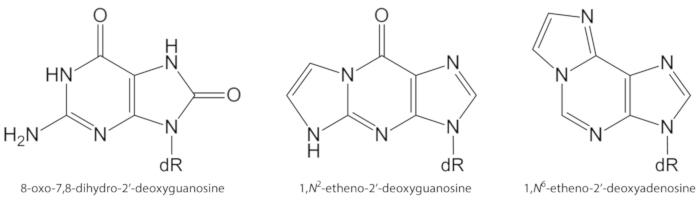
La figure 1. Les structures chimiques des lésions de l’ADN quantifiées dans la présente étude. dR = 2 ́-désoxyribose. Ce chiffre a été modifié à partir de Oliveira et al.34. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Des études réalisées au début des années 1980 ont permis la détection sensible du 8-oxodGuo par chromatographie liquide à haute performance couplée à la détection électrochimique (HPLC-ECD). La quantification du 8-oxodguo par HPLC-ECD dans plusieurs systèmes biologiques soumis à des conditions oxydantes a conduit à la reconnaissance du 8-oxodguo comme biomarqueur des lésions de base induites oxydativement dans l’ADN1,16. Bien que robustes et permettant la quantification du 8-oxodGuo dans la gamme faible de fmol17, les mesures HPLC-ECD reposent sur la précision du temps de rétention de l’analyte pour l’identification de l’analyte et sur la résolution de la chromatographie afin d’éviter les interférences de autres constituants de l’échantillon. Comme la détection électrochimique nécessite l’utilisation de sel (p. ex., phosphate de potassium, acétate de sodium) dans la phase mobile, le maintien de conditions analytiques adéquates nécessite un temps de nettoyage de la colonne et du matériel de routine.
Alternativement, l’utilisation de l’enzyme de réparation de l’ADN bactérien formamidopyrimidine DNA glycosylase (FPG) et, par la suite, de l’humain 8-oxoguanine glycosylase 1 (hOGG1), pour la détection et l’enlèvement de 8-oxoGua de l’ADN, est apparu comme un moyen pour l’induction de l’ADN labiles Sites. Les sites labiles alcalins sont convertis en ruptures de brin d’ADN et permettent la quantification indirecte très élevée sensible de la 8-oxoGua par électrophorèse alcaline de gel de cellule simple («dosage de comète»). La haute sensibilité et l’accomplissement des analyses sans besoin d’extraction d’ADN cellulaire sont les principaux avantages de ce type de dosage. Il donne les plus faibles niveaux stables de 8-oxoGua dans l’ADN, typiquement 7-10 fois plus bas que les niveaux obtenus par des méthodes bioanalytiques basées sur HPLC. Cependant, il s’agit d’une mesure indirecte de la 8-oxogua et certains inconvénients sont le manque de spécificité ou l’efficacité inconnue des enzymes de réparation utilisés1,16,18.
Les immunodosages sont d’autres méthodes utilisées pour la détection des adduits de l’ADN 8-oxoGua1 et exocyclique, tels que 1,n6-Dado et 1,n2-dguo12. Malgré la sensibilité, une lacune de l’utilisation des anticorps pour la détection des lésions de l’ADN est le manque de spécificité en raison de la réactivité croisée à d’autres composants d’échantillons biologiques, y compris les bases normales d’ADN1,12. Les adduits d’ADN exocycliques, y compris 1,n6-Dado et 1,n2-dguo, peuvent également être détectés et quantifiés par des essais de P-post-étiquetage 32hautement sensibles12. La sensibilité élevée de 32P-le post-étiquetage permet l’utilisation de très petites quantités d’ADN (par exemple, 10 μg) pour la détection d’environ 1 adduit par 1010 bases normales19. Cependant, l’utilisation de la radio-chimie, le manque de spécificité chimique et la faible précision sont quelques inconvénients19,20.
Une limitation partagée des méthodes citées ci-dessus est la faible sélectivité ou spécificité pour la détection des molécules souhaitées. Dans ce scénario, la HPLC couplée à la spectrométrie de masse en tandem par ionisation par ÉLECTROPULVÉRISATION (HPLC-ESI-MS/MS et HPLC-MS3) a évolué comme étalon-or pour la quantification des nucléosides modifiés dans les matrices biologiques, comme l’ADN, l’urine, le plasma et la salive le premier , le 19 , 20. les avantages des méthodes HPLC-ESI-MS/MS sont la sensibilité (typiquement dans la plage de fmol faible) et la haute spécificité fournie par i) la séparation chromatographique, II) le schéma caractéristique et connu de la fragmentation des molécules à l’intérieur de la masse chambre de collision du spectromètre, et III) la mesure exacte du rapport masse/charge sélectionné (m/z) en mode de surveillance de réaction multiple1,19. L’utilisation de normes internes étiquetées isotopiquement ajoute l’avantage de corrections pour les pertes de molécules au cours de l’hydrolyse de l’ADN et des étapes d’enrichissement de l’analyte, ainsi que pour les différences de l’ionisation de l’analyte entre les échantillons. Il aide également à identifier le pic chromatographique correct lorsque plus d’un pic est présent1,12,19,20.
Plusieurs méthodes basées sur HPLC-ESI-MS/MS ont été utilisées pour la quantification de 8-oxodguo, 1, n6-Dado et 1,n2-dguo dans l’ADN extrait de différents échantillons biologiques12,15,20 ,21,22,23,24,25,26,27,28,29 . Particules fines (PM2,5) portent des produits chimiques organiques et inorganiques, tels que les hydrocarbures aromatiques polycycliques (HAP), les nitro-HAP, les aldéhydes, les cétones, les acides carboxyliques, les quinolines, les métaux et les ions solubles dans l’eau, qui peuvent induire une inflammation et stress oxydatif, conditions qui favorisent l’apparition de dommages de biomolécule et de la maladie30,31,32,33. Nous présentons ici les méthodes validées HPLC-ESI-MS/MS qui ont été appliquées avec succès pour la quantification de 8-oxodGuo, 1,n6-Dado et 1,n2-dguo dans l’ADN pulmonaire, hépatique et rénale de souris A/J pour l’évaluation de la effets de l’exposition ambiante2,5 de PM34.
Access restricted. Please log in or start a trial to view this content.
Protocole
Des souris A/J mâles de quatre semaines, exemptes de pathogènes spécifiques, ont été obtenues du centre d’élevage des animaux de laboratoire de Fundação Oswaldo Cruz (FIOCRUZ), Rio de Janeiro, Brésil, et ont été traitées en conséquence au Comité d’éthique de la faculté de médecine, Université de São Paulo (protocole no 1310/09).
1. ramassage des tissus de souris
- Anesthésier l’animal avec la xylazine et la kétamine. Pour une souris de 30 g de poids corporel, injecter une solution (pas plus de 2 mL) contenant 2,63 mg de kétamine et 0,38 mg de xylazine, intrapéritonéale.
- Prélever du sang (0,5-1,5 mL) pour des analyses complémentaires (p. ex., activité enzymatique antioxydante, taux de malondialdéhyde).
- Rasez les poils abdominaux du bassin jusqu’au processus xiphoïde. Faire une incision dans une ligne médiane verticale dans la zone sans poils. Faire des incisions dans les lignes latérales horizontales afin d’exposer les organes abdominaux.
- Coupez l’aorte abdominale pour favoriser l’exsanguination et pour euthanasier l’animal.
- Enlevez les tissus d’intérêt (dans ce cas, le foie, les reins et les poumons).
- Pour éliminer le foie, coupez la veine de Cava inférieure et la veine hépatique du portail.
- Pour enlever les reins, section les veines rénales et les artères.
- Pour enlever les poumons, faire une incision dans les extrémités du diaphragme et la circonférence à proximité de la paroi thoracique. Briser les clavicules en ouvrant un ciseaux à l’intérieur de la cavité thoracique. Coupez l’OS extern du processus xiphoïde vers la trachée, afin d’exposer les poumons et le cœur.
- Tenez le poumon avec une pince, section la trachée et les ligaments autour des poumons. Enlevez soigneusement les poumons de bloc plus le coeur. Pour retirer les poumons du bloc, tenez le cœur avec une pince et coupez tous les vaisseaux dans sa base.
- Lavez immédiatement les tissus isolés dans une solution saline froide (0,9% NaCl), transférez-les dans des tubes cryogéniques et trempez immédiatement les tubes dans de l’azote liquide. Après avoir terminé le travail, rangez les tubes à-80 ° c.
ATTENTION: l’azote liquide en contact direct avec la peau, la muqueuse ou les yeux provoque des brûlures. Utiliser une protection individuelle adéquate pour éviter tout contact. Travailler dans un laboratoire ventilé pour éviter l’asphyxie due à la vapeur d’azote liquide.
2. extraction de l’ADN
Note: la méthode d’extraction de l’ADN a été modifiée de Loureiro et coll. (2009)35 pour permettre l’analyse des lésions étudiées ici.
- Transférer les tubes contenant les tissus pour sécher la glace.
- Utilisez une plaque de culture placée sur la glace comme base pour couper un morceau de tissu avec un scalpel. Poids 1 g pour une utilisation immédiate. Le reste du tissu doit être maintenu sur de la glace carbonique jusqu’à ce qu’il revienne au stockage à-80 ° c.
NOTE: il est important d’éviter la décongélation du tissu restant pour empêcher la formation d’artefacts si des répétitions des analyses sont nécessaires. - Pour chaque 1 g de tissu dans 50 mL de tubes plafonnés, ajouter 10 mL de la solution de lyse cellulaire commerciale contenant 0,5 mM de déféroxamine et conserver sur la glace.
Remarque: ajouter la déféroxamine au volume de la solution pour une utilisation immédiate. Pour chaque 100 ml de solution, ajouter 0,0328 g de sel de mésylate de déféroxamine. - Homogénéiser les tissus à l’aide d’un homogénéisateur tissulaire jusqu’à obtention d’une solution homogène sans fragments tissulaires. Maintenez le tube froid (sur la glace) pendant l’homogénéisation. Utilisez une vitesse basse pour éviter le chauffage.
- Ajouter 150 μL de solution de protéinase K (20 mg/mL) à chaque échantillon homogénéisé. Secouez les tubes par inversion et conservez-les à température ambiante pendant la nuit.
- Ajouter 40 μL de solution de ribonucléase A (15 mg/mL), agiter par inversion et maintenir les tubes à température ambiante pendant 2 h.
NOTE: préparer la solution de ribonucléase A dans le tampon d’acétate de sodium 10 mM, pH 5,2 pour éviter les précipitations. Chauffer la solution à 100 ° c pendant 15 min avant utilisation pour obtenir une solution exempte de désoxyribonucléase. - Ajouter 5 mL de la solution commerciale de précipitation de protéine, tourbillonner vigoureusement, et centrifuger à 2 000 x g, 4 ° c, pendant 10 minutes.
- Transférer les surnageants à 50 mL de tubes plafonnés contenant 10 mL d’isopropanol froid. Inversez les tubes doucement plusieurs fois jusqu’à l’observation de l’ADN précipité.
Remarque: le protocole peut être suspendu ici, en gardant les tubes à-20 ° c. - Prélever l’ADN précipité à l’aide d’une pipette Pasteur fermée à la fin. Le transférer dans des tubes contenant 4 mL de tampon Tris 10 mM, 1 mM de déféroxamine, pH 7,0.
- Une fois que l’ADN est complètement dissous dans la solution ci-dessus (ne pas tourbillonner), ajouter 4 mL d’une solution de chloroforme contenant 4% d’alcool isoamyle.
- Inverser les tubes 10 fois pour l’homogénéisation, centrifuger à 2 000 x g, 4 ° c, pendant 10 minutes pour séparer les deux phases, et transférer la phase supérieure vers un nouveau tube.
- Répétez les étapes 2,10 et 2,11 deux fois de plus.
- Ajouter 8 mL d’éthanol absolu et 0,4 mL d’une solution de 5 M de NaCl pour précipiter l’ADN.
- Recueillir à nouveau l’ADN précipité et le transférer à 3 mL de 70% d’éthanol. Répétez cette étape une fois de plus.
- Jetez la solution d’éthanol avec précaution et inversez les tubes contenant l’ADN précipité sur du papier absorbant pour éliminer l’excès de la solution.
- Ajouter 200 μL de solution de déféroxamine de 0,1 mM pour dissoudre l’ADN. Maintenir les tubes à 4 ° c jusqu’à ce que l’ADN soit complètement réhydraté (pendant la nuit).
- Déterminer la concentration d’ADN en mesurant l’absorbance à 260 nm et sa pureté par le rapport d’absorbance de 260/280 nm.
NOTE: pour déterminer la concentration d’ADN, transférer une aliquote de 10 μL de la solution d’ADN à 990 μL d’eau ultrapure (dilution 100X). Multiplier l’absorbance à 260 nm (il devrait être inférieur à 1) par 50 (50 μg/mL est la concentration d’ADN double brin lorsque l’absorbance d’une solution de longueur de 1 cm à 260 nm est 1) et par la dilution utilisée (100X) pour obtenir la concentration d’ADN en μg/mL. Si l’absorbance à 260 nm est supérieure à 1, des dilutions supplémentaires sont nécessaires. Le ratio d’absorbance de 260/280 nm doit être égal ou supérieur à 1,8 pour la pureté d’ADN désirée, mais les ratios autour de 1,6 sont acceptables.
3. hydrolyse enzymatique de l’ADN
- Recette d’analyse
- 1,n6-εdado et 1,n2-εdguo analyses: à une aliquote contenant 150 μg d’ADN, ajouter 7,5 μl de tampon Tris/mgcl2 de 200 mm (pH 7,4), 1,4 μl de la solution étalon interne contenant 250 fmol/μl de [15N5 ] 1,n6-εdado et [15N5] 1,n2-εdguo et 15 unités de désoxyribonucléase I. Ajustez le volume final à 200 μl avec de l’eau ultrapure, en soustrayant les volumes d’enzymes à utiliser à l’étape 3.2.1.
- 8-oxodGuo analyses: pour une aliquote contenant 80 μg d’ADN, ajouter 3,8 μL de tampon Tris/MgCl2 de 200 mm (pH 7,4), 2 μl de la solution étalon interne contenant 1 000 fmol/μl de [15N5] 8-oxodguo, et 8 unités de désoxyribonucléase I. Ajuster le volume final à 100 μL avec de l’eau ultrapure, en soustrayant les volumes d’enzymes à utiliser à l’étape 3.2.2.
NOTE: les normes internes [15n5] 1,n6-εdado, [15n5] 1,n2-εdguo et [15n5] 8-oxodguo peuvent être synthétisées et caractérisées comme décrit35,36,37. Les quantités des étalons internes dans les volumes d’échantillonnage injectés doivent être les mêmes que celles des volumes des courbes d’étalonnage injectées.
- Incuber les échantillons à 37 ° c pendant 1 heure.
- Échantillons de l’étape 3,1: ajouter 0,006 unités de phosphodiestérase I de Crotalus atrox et 15 unités de phosphatase alcaline de la muqueuse intestinale bovine.
- Échantillons de l’étape 3,2: ajouter 0,0032 unités de phosphodiestérase I de Crotalus atrox et 8 unités de phosphatase alcaline de la muqueuse intestinale bovine.
- Incuber les échantillons à 37 ° c pendant 1 heure.
- Centrifuger les échantillons à 14 000 x g pendant 10 minutes.
- Échantillons de l’étape 3.2.1: séparer 10 μL de chaque échantillon pour la quantification des désoxynucléosides (dAdo, dGuo) par HPLC/DAD (étape 9). Soumettre le volume résiduel à l’extraction en phase solide (étape 4).
- Échantillons de l’étape 3.2.2: transférer 80 μL du surnageant dans des flacons pour préparations injectables de 50 μL (1 000 fmol de [15N5] 8-oxodguo) dans le système HPLC-ESI-MS/MS. Réserver les 20 μL restants pour la quantification de dGuo par HPLC/DAD (étape 9).
4. extraction en phase solide pour les analyses de 1, n6-εdado et 1, n2-εdguo
- Chargez les cartouches (SPE-C18, 30 mg/mL, 33 μM, 1 mL) avec 1 mL de la séquence de solutions suivante: 100% de méthanol, eau désionisée, échantillon d’ADN hydrolysé, eau désionisée, 10% de méthanol, 15% de méthanol et 100% de méthanol (à collecter).
Remarque: ne laissez pas les cartouches sécher entre les applications des différentes solutions. Ajoutez la solution suivante immédiatement après que la solution précédente pénètre complètement la cartouche. - Sécher sous vide la dernière fraction d’élution (100% méthanol) contenant les adduits.
- Resuspendre les échantillons séchés dans 83,1 μL d’eau ultrapure immédiatement avant l’analyse HPLC-ESI-MS/MS, pour obtenir 200 fmol de chaque étalon interne dans 50 μL de chaque échantillon.
5. préparation des courbes d’étalonnage
- Préparer au moins cinq points dans l’intervalle de 300 à 6 000 fmol de la norme 8-oxodGuo, avec la quantité fixe de 1 000 fmol de [15N5] 8-oxodguo dans chaque point. Considérez ces montants dans le volume injecté.
- Préparer au moins cinq points dans l’intervalle de 1 à 40 fmol de 1,n6-εdado et 1,n2-εdguo, avec des quantités fixes de 200 fmol de[15n5] 1, n6-εdado et [15n5] 1, N 2-εdguo dans chaque point. Considérez ces montants dans le volume injecté.
- Préparez au moins cinq points dans l’intervalle de 0,05-1 nmol de dGuo et d’Dado. Considérez ces montants dans le volume injecté.
6. préparation d’échantillons d’ADN pour la validation de la méthode
- 1,n6-εdado et 1,n2-εdguo analyses: ajouter des quantités variables de 1, n6-εdado et 1, n2-εdguo (p. ex., 1,75, 8,75, 17,5 et 35 fmol) et des quantités fixes de [15N5] 1, N6-εdado et [15N5] 1,n2-ΕDGUO (350 fmol) à 100 μg d’ADN de thymus de veau et effectuer l’hydrolyse enzymatique comme décrit à l’étape 3. Traitez les échantillons en quatre exemplaires en deux jours différents. Utilisez les échantillons pour l’exactitude des méthodes et l’évaluation de la précision.
NOTE: le volume final des hydrolysats d’ADN sera de 200 μL (étape 3), dont 10 μL seront séparés pour la quantification des désoxynucléosides par HPLC/DAD (étape 9). La solution restante (190 μL) sera soumise à une extraction en phase solide (étape 4), la fraction séchée sera resuspendue en 83,1 μL (étape 4,3), à partir de laquelle 50 μL sera injecté dans le système HPLC-ESI-MS/MS. Les quantités de 1,n6-εdado et de 1, n2-εdguo injectées seront de 1, 5, 10 et 20 fmol, avec 200 fmol de[15n5] 1, n6-εdado et [15n5] 1,n 2-εdguo dans chaque échantillon. - 8-oxodGuo analyses: ajouter des quantités variables de 8-oxodGuo (p. ex., 734, 1 468, 2 938 et 4 408 fmol) et une quantité fixe de [15N5] 8-oxodguo (2 000 fmol) à 100 μg d’ADN de thymus de veau et effectuer l’hydrolyse enzymatique comme décrit à l’étape 3. Traitez les échantillons en quatre exemplaires en deux jours différents. Utilisez les échantillons pour l’exactitude des méthodes et l’évaluation de la précision.
NOTE: le volume final des hydrolysats d’ADN sera de 100 μL (étape 3), dont 50 μL seront injectés dans le système HPLC-ESI-MS/MS. Les quantités de 8-oxodGuo injectées seront 367, 734, 1469 et 2204 fmol, avec 1 000 fmol de [15N5] 8-oxodguo dans chaque échantillon. - Ajouter 13,125 fmol de 1,n6-εdado (pour obtenir 7,5 fmol dans le volume d’injection) et 35 fmol de 1,n2-εdguo (pour obtenir 20 fmol dans le volume d’injection) à huit échantillons de 100 μg d’ADN de thymus de veau.
- Ajouter les normes internes [15n5] 1,n6-εdado et [15n5] 1,n2-εdguo (200 fmol) à quatre des échantillons. Procéder à l’hydrolyse de l’ADN et à l’extraction en phase solide de tous les échantillons.
- Ajouter les normes internes [15n5] 1,n6-εdado et [15n5] 1,n2-εdguo (200 fmol) aux quatre autres échantillons.
- Utilisez les échantillons pour calculer la récupération des adduits à partir de l’extraction en phase solide.
7. HPLC-ESI-MS/MS analyse de 8-oxodGuo
- En infutilisant la norme 8-oxodGuo dans l’équipement, réglez les paramètres ESI-MS/MS pour la meilleure détection de son modèle de fragmentation par la surveillance de réaction multiple (MRM): m/z 284 [m + h] + → m/z 168 [m-2 '-deoxyribose + H]+.
- Utiliser les mêmes paramètres pour la détection de[15N5] 8-oxodguo : m/z 289 [m + H]+m/z → 173 [m-2 '-deoxyribose + H]+.
Remarque: utilisez un équipement équivalent ou supérieur à l’équipement utilisé dans ce travail (voir le tableau des matériaux). Les paramètres ESI-MS/MS ont été définis comme décrit dans le tableau 1.
- Utiliser les mêmes paramètres pour la détection de[15N5] 8-oxodguo : m/z 289 [m + H]+m/z → 173 [m-2 '-deoxyribose + H]+.
- Filtrer (en utilisant des membranes poreuses de 0,22 μM) et degasify (à l’aide d’un sonicateur) tous les solvants à base d’eau HPLC.
- Utilisez les conditions de chromatographie suivantes pour les analyses et montez le système comme illustré à la figure 2.
Remarque: la colonne A est connectée à la pompe binaire. Son éluent est dirigé vers la détection UV et les déchets dans les 16 premières min et de 32 à 46 min de la chromatographie, comme illustré à la figure 2a. Il s’agit de la colonne à travers laquelle l’échantillon est élué immédiatement après l’injection. La colonne B est reliée à la pompe isocratique et au spectromètre de masse. Il reçoit l’éluent de la colonne A seulement dans l’intervalle de 16-32 min, lorsque la vanne est commutée à la position illustrée à la figure 2b. La commutation de vanne permet la connexion entre les deux colonnes, qui sont éluées par le gradient de la pompe binaire. La configuration illustrée à la figure 2b permet une séparation et un rétrécissement supplémentaires des pics. En outre, seule la fraction chromatographique de l’intérêt atteint le spectromètre de masse, améliorant la sensibilité et la sélectivité.- Éluer une 50 x 2,0 mm d.i., 2,5 μm, colonne C18 (colonne A de la figure 2) couplée à une cartouche de protection de sécurité c18 (4,0 x 3,0 mm d.i.) avec un gradient de 0,1% d’acide formique (solvant a) et de méthanol contenant 0,1% d’acide formique (solvant B) à un débit de 150 μL/min et à 25 ° c.
- Utilisez le programme de gradient suivant pour la pompe binaire: de 0 à 25 min, 0-15% du solvant B; 25 à 28 min, 15-80% du solvant B; 28 à 31 min, 80% du solvant B; 31 à 33 min, 80-0% du solvant B; 33 à 46 min, 0% du solvant B.
- Utiliser la vanne de commutation pour diriger les 16 premières minutes d’éluant vers les déchets et la fraction de 16-32 min à une deuxième colonne (150 x 2,0 mm d.i., 3,0 μm, C18, colonne B de la figure 2) relié à la source ESI et conditionné par la pompe isocratique avec une solution de 15% moi éthanol dans l’eau contenant 0,1% d’acide formique (150 μL/min).
Remarque: avant d’utiliser le programme de vanne de commutation de l’étape 7.3.1.2, vérifier si la norme 8-oxodGuo élute de la première colonne après 16 min. Il est important de fermer la vanne à 32 min pour utiliser le gradient de la pompe binaire pour éluer 8-oxodGuo de la deuxième colonne et obtenir un pic chromatographique pointu. La lésion 8-oxodGuo élute de la deuxième colonne à environ 36 min. des variations du temps de rétention de l’analyte peuvent survenir en fonction de la colonne et de l’équipement utilisé. Des adaptations du programme de gradient de solvant HPLC peuvent être nécessaires.
- Éluer une 50 x 2,0 mm d.i., 2,5 μm, colonne C18 (colonne A de la figure 2) couplée à une cartouche de protection de sécurité c18 (4,0 x 3,0 mm d.i.) avec un gradient de 0,1% d’acide formique (solvant a) et de méthanol contenant 0,1% d’acide formique (solvant B) à un débit de 150 μL/min et à 25 ° c.
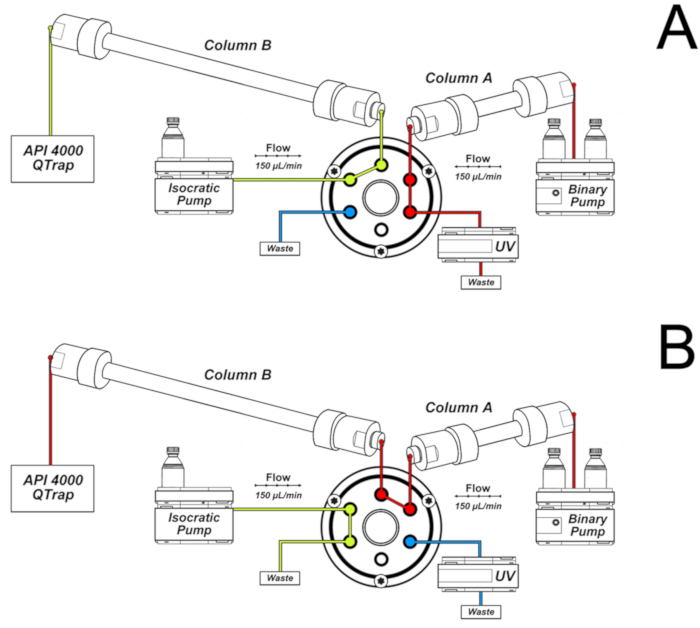
La figure 2. Système de deux colonnes utilisées pour les analyses de 8-oxo-7,8-dihydro-2 '-désoxyguanosine (8-oxodGuo). A) configuration utilisée dans les 16 premières minutes et de 32 à 46 min de la chromatographie; B) configuration utilisée dans l’intervalle 16-32 min, permettant une séparation plus poussée et un rétrécissement maximal dans la colonne B avant l’élution vers la source ESI du spectromètre de masse. Ce chiffre a été réédité par Oliveira et al.34. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
8. analyse HPLC-ESI-MS/MS de 1, n 6 -εdado et 1, n 2 -εdguo
- En infutilisant les normes 1,n6-Εdado et 1,n2-εdguo dans l’équipement, réglez les paramètres ESI-MS/MS pour la meilleure détection de leurs schémas de fragmentation par la surveillance des réactions multiples (MRM): m/z 276 [m + h]+ → m/z 160 [m 2 '-deoxyribose + h]+ pour la détection de 1,N6-εdado et m/z 292 [m + h]+ → m/z 176 [m-2 '-deoxyribose + h ]+ pour la détection de 1,N2-εdguo.
- Utiliser les mêmes paramètres pour la détection de [15n5] 1, n6-εdado (m/z 281 [m + h]+m/z → 165 [m-2 '-deoxyribose + h]+) et [15n 5] 1,N2-εdguo (m/z 297 [m + h]+ → m/z 181 [m-2 '-deoxyribose + H]+). Réglez les paramètres ESI-MS/MS comme décrit dans le tableau 1.
| Paramètres ESI-MS/MS | 8-oxodGuo | Adduits d’etheno |
| Rideau gaz | 20 psi | 20 psi |
| Gaz de nébulisation | 55 | 50 |
| Source d’ions gaz | 50 psi | 40 psi |
| Gaz de dissociation induit par collision | taille moyenne | taille moyenne |
| Tension de pulvérisation ionique | 5000 | 4500 |
| Température de la sonde ESI | 450 | 450 |
| Potentiel de déglutionnage | 31 V, 8-oxodGuo | 41 V, 1, N6-εdado |
| 31 V, [15N5] 8-oxodguo | 41 V, [15n5] 1, n6-εdado | |
| 45 V, 1, N2-εdguo | ||
| 45V, [15n5] 1, n2-εdguo | ||
| Énergie de collision | 23 eV, 8-oxodGuo | 25 eV, 1, N6-εdado |
| 23 eV, [15N5] 8-oxodguo | 25 eV, [15n5] 1, n6-εdado | |
| 27 eV, 1, N2-εdguo | ||
| 27 eV, [15n5] 1, n2-εdguo | ||
| Potentiel de sortie de cellule de collision | 16 V, 8-oxodGuo, | 8 V, 1, N6-εdado |
| 16 V, [15N5] 8-oxodguo | 8 V, [15n5] 1, n6-εdado | |
| 16 V, 1, N2-εdguo | ||
| 16 V, [15N5] 1, n2-εdguo | ||
| Potentiel d’entrée | de 10 V | de 10 V |
Tableau 1. Paramètres utilisés dans l’équipement ESI-MS/MS pour la détection des lésions de l’ADN. Ce tableau a été modifié à partir de Oliveira et al.34.
- Filtrer (en utilisant des membranes poreuses de 0,22 μM) et degasify (à l’aide d’un sonicateur) tous les solvants à base d’eau HPLC.
- Utilisez les conditions de chromatographie suivantes pour les analyses.
- Éluer une 150 x 2,0 mm d.i., 3,0 μm, colonne C18 couplée à une cartouche de sécurité C18 (4,0 x 3,0 mm d.i.) avec un gradient d’acétate d’ammonium de 5 mM, pH 6,6 (solvant A) et acétonitrile (solvant B) à un débit de 130 μL/min et 25 ° c.
- Utilisez le programme de gradient suivant pour la pompe binaire: de 0 à 10 min, 0% de solvant B; 10 à 39 min, 0-20% du solvant B; 39 à 41 min, 20-75% du solvant B; 41 à 46 min, 75% du solvant B; 46 à 47 min, 75-0% du solvant B; 47 à 60 min, 0% du solvant B.
- Utilisez la vanne de commutation pour diriger le premier 35 min d’éluent vers les déchets et la fraction 35-42 min de la source ESI. Assurez-vous que les normes d’adduit éluute de la colonne dans l’intervalle défini (35-42 min). Apportez des ajustements si nécessaire.
- Éluer une 150 x 2,0 mm d.i., 3,0 μm, colonne C18 couplée à une cartouche de sécurité C18 (4,0 x 3,0 mm d.i.) avec un gradient d’acétate d’ammonium de 5 mM, pH 6,6 (solvant A) et acétonitrile (solvant B) à un débit de 130 μL/min et 25 ° c.
9. quantification de la normale 2 '-désoxyribonucleosides par HPLC-UV
- Utiliser un équipement similaire à l’équipement utilisé dans ce travail (voir le tableau des matériaux).
- Éluer un 250 mm x 4,6 mm d.i., 5 μm, colonne C18 attaché à une cartouche de sécurité C18 (4,0 x 3,0 mm d.i.) avec une pente de 0,1% d’acide formique et de méthanol.
- Utilisez le programme de gradient suivant: de 0 à 25 min, 0 à 18% de méthanol; de 25 à 27 min, 18 à 0% méthanol; de 27 à 37 min, 0% méthanol) à un débit de 1 mL/min et 30 ° c.
- Injecter 5 μL de chaque échantillon réservé pour la quantification de 2 '-désoxynucléosides.
- Réglez le détecteur DAD à 260 nm pour l’intégration des pics dGuo et dAdo.
10. quantification des lésions de l’ADN
- Intégrer les pics de 8-oxodGuo, [15n5] 8-Oxodguo, 1,n6-εdado, [15n5] 1,n6-εdado, 1,n2-εdguo, et [15n5] 1,n2 -εdguo des analyses HPLC-ESI-MS/MS.
- Calculer les ratios de surface de 8-oxodGuo/[15n5] 8-Oxodguo, 1, n6-εdado/[15n5] 1,n6-εdado, et 1,n2-εdguo/[15n5 ] 1,N2-εdguo pour les courbes d’étalonnage et les échantillons.
- Tracer les courbes d’étalonnage à l’aide des ratios de surface obtenus à l’étape 10.1.1 de l’axe y et des quantités d’analytes présentes dans chaque point de l’axe x.
- Calculer les quantités (fmol) de lésions dans chaque échantillon injecté en utilisant les ratios calculés à l’étape 10.1.1 et les courbes d’étalonnage de l’étape.
- Intégrez les pics de dGuo et d’Dado des analyses HPLC-UV.
- Tracer les courbes d’étalonnage à l’aide des zones obtenues à l’étape 10,2 dans l’axe y et des quantités d’analytes présentes dans chaque point de l’axe x.
- Calculer les quantités (nmol) de dGuo et d’dAdo dans chaque échantillon injecté en utilisant les zones obtenues à l’étape 10,2 et les courbes d’étalonnage de l’étape 10.2.1.
- Calculer les quantités (nmol) de dGuo et d’Dado présentes dans chaque échantillon injecté dans le système HPLC-ESI-MS/MS, étant donné que les quantités calculées à l’étape 10.2.2 sont présentes dans le volume de l’échantillon de 5 μL, tandis que 50 μL ont été injectés dans le système HPLC-ESI-MS/MS.
NOTE: pour calculer la quantité de dGuo dans les échantillons utilisés pour l’analyse de 8-oxodGuo, il suffit de multiplier la quantité (nmol/μL) obtenue à l’étape 10.2.2 par 50. Pour calculer les quantités de dAdo et de dGuo dans les échantillons utilisés pour les analyses de 1,n6-Εdado et 1,n2-εdguo, considérez l’étape de concentration après l’extraction en phase solide. Le volume de 50 μL injecté dans le système HPLC-ESI-MS/MS correspond à 114,32 μL de l’échantillon original. Les quantités (nmol/μL) obtenues à l’étape 10.2.2 doivent être multipliées par 114,32 pour obtenir les valeurs correctes. - Calculez les fractions molaires 8-oxodGuo/dGuo, 1,n6-εdado/Dado, 1,n2-εdguo/dguo. Les ratios (lésion fmol/DÉSOXYNUCLÉOSIDE normal de nmol) donnent le nombre de lésions par 106 dguo normal ou Dado.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les concentrations moyennes d’ADN (± SD) obtenues à partir du foie de souris (~ 1 g de tissu), du poumon (~ 0,2 g de tissu) et du rein (~ 0,4 g de tissu) ont été respectivement 5 068 ± 2 615, 4 369 ± 1 021 et 3 223 ± 723 μg/mL dans le volume final de 200 μL. Un chromatogramme représentatif obtenu par HPLC-DAD de l’ADN purifié est illustré à la figure 3. La présence des quatre 2 '-désoxynucléosides, exempts des ribonucléosides d’ARN, qui...
Access restricted. Please log in or start a trial to view this content.
Discussion
Un problème majeur trouvé dans les analyses de 8-oxodguo par HPLC méthodes est l’induction possible de sa formation au cours des procédures de travail de l’extraction de l’ADN, l’hydrolyse de l’ADN, et la concentration des hydrolysats d’ADN22,38. Afin de minimiser le problème de la formation artifactuelle 8-oxodGuo, il est recommandé l’addition de la déféroxamine à toutes les solutions d’extraction, de stockage et d’hydrolyse de l’ADN...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo, proc. 2012/22190-3 et 2012/08616-8), CNPq (proc. 454214/2014-6 et 429184/2016-6), CAPES, PRPUSP (Pró-Reitoria de Pesquisa da Universidade de São Paulo), INCT INAIRA (MCT/CNPq/FNDCT/CAPES/ FAPEMIG/FAPERJ/FAPESP; Proc. 573813/2008-6), INCT Redoxoma (FAPESP/CNPq/CAPES; Proc. 573530/2008-4), NAP Redoxoma (PRPUSP; Proc. 2011.1.9352.1.8) et CEPID Redoxoma (FAPESP; Proc. 2013/07937-8). T. F. Oliveira et A. A. F. Oliveira ont reçu des bourses de FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) et CAPES (Coordenação de Aperfeiçoamento de Pessoal de nível Superior). M. H. G. Medeiros, P. di mascio, P. H. N. Saldiva, et A. P. M. Loureiro ont reçu des bourses de CNPq.
Quelques figures et tableaux présents dans ce travail ont été publiés à l’origine dans Oliveira A.A.F. et coll. effets génotoxiques et épigenotoxiques chez des souris exposées à des particules fines ambiantes concentrées (PM2,5) de la ville de São Paulo, au Brésil. Toxicologie des particules et des fibres. 15, 40 (2018).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
Références
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2'-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2'-deoxyguanosine in human cells. Biochemistry. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , John Wiley & Sons. UK. (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2'-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2'-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure? Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2'-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2'-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson's disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, Á, Escobar, J. 7,8-Hydroxy-2'-deoxyguanosine/2'-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, IARC. Lyon, France. (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40(2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2'-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2'-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2'-deoxyguanosine and 1,N2-propano-2'-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon