Method Article
Infection des larves de poisson zèbre par des spores d’Aspergillus pour l’analyse des interactions hôte-pathogène
Dans cet article
Résumé
Ce protocole décrit un modèle d’infection d’Aspergillus dans les larves de poisson zèbre. Les spores d’Aspergillus sont microinjectées dans le cerveau postérieur des larves, et un traitement chimique est utilisé pour induire une immunosuppression. La progression de l’infection est surveillée via une configuration d’imagerie quotidienne pour surveiller la croissance fongique et les réponses immunitaires ainsi que l’énumération des spores vivantes par placage d’unités formant des colonies.
Résumé
L’aspergillose invasive (IA) est l’une des infections fongiques les plus courantes chez les personnes immunodéprimées. Malgré la disponibilité des médicaments antifongiques, l’IA peut entraîner une mortalité de >50% chez les patients immunodéprimés infectés. Il est crucial de déterminer les facteurs de l’hôte et de l’agent pathogène qui contribuent à la susceptibilité à l’infection et aux faibles taux de survie chez les patients infectés afin de développer de nouveaux traitements. Les réponses immunitaires innées jouent un rôle pivot dans la reconnaissance et la clairance des spores d’Aspergillus, bien que l’on en sache peu sur les mécanismes cellulaires et moléculaires exacts. Des modèles fiables sont nécessaires pour étudier les interactions mécanistes détaillées entre l’hôte et l’agent pathogène. La clarté optique et la tractabilité génétique des larves de poissons zèbres en font un modèle intrigant pour étudier les interactions hôte-pathogène de multiples infections bactériennes et fongiques humaines chez un hôte vivant et intact. Ce protocole décrit un modèle larvaire d’infection d’Aspergillus de poisson zèbre. Tout d’abord, les spores d’Aspergillus sont isolées et injectées dans le ventricule du cerveau postérieur du poisson zèbre par microinjection. Ensuite, des inhibiteurs chimiques tels que des médicaments immunosuppresseurs sont ajoutés directement à l’eau larvaire. Deux méthodes pour surveiller l’infection dans les larves injectées sont décrites, y compris le 1) homogénéisation des larves pour le dénombrement de l’unité formant colonie (UFC) et 2) une configuration répétée et quotidienne d’imagerie en direct. Dans l’ensemble, ces techniques peuvent être utilisées pour analyser mécaniquement la progression de l’infection à Aspergillus in vivo et peuvent être appliquées à différents milieux de l’hôte et souches d’Aspergillus pour interroger les interactions hôte-pathogène.
Introduction
Aspergillus fumigatus est un champignon saprophyte omniprésent, et ses spores en suspension dans l’air peuvent être trouvées à l’intérieur et à l’extérieur1. Ces spores sont inhalées par tout le monde mais se dégagent efficacement des poumons des individus immunocompétents1,2. Cependant, les personnes atteintes d’affections pulmonaires altérées telles que la mucoviscidose peuvent développer une aspergillose bronchopulmonaire due à la germination fongique dans les poumons3. La forme la plus grave de cette infection, l’aspergillose invasive (IA), affecte les personnes immunodéprimées et implique la croissance du champignon dans d’autres organes2,3. L’IA entraîne >50% de décès de patients infectés malgré la disponibilité de thérapies antifongiques4. Chez les personnes immunocompétentes, les réponses immunitaires innées jouent un rôle majeur dans l’élimination des spores inhalées1. Cependant, les mécanismes spécifiques qui contribuent à cette clairance immunitaire innée ne sont pas bien compris. Il est important de comprendre les mécanismes cellulaires et moléculaires des principales cellules immunitaires innées (c.-à-d. macrophages et neutrophiles) dans la clairance d’Aspergillus afin de trouver de nouvelles stratégies thérapeutiques pour l’IA.
Bien que les modèles mammifères aient joué un rôle déterminant dans l’identification des facteurs de virulence fongique et des réponses immunitaires de l’hôte5,6, l’accessibilité visuelle est limitée pour les interactions hôte-pathogène au niveau cellulaire. Les expériences de culture tissulaire ne peuvent pas récapituler complètement l’environnement multicellulaire complexe et les interactions qui existent chez des animaux entiers7. Par conséquent, le poisson zèbre a gagné en popularité en tant qu’organisme modèle alternatif pour combler cette lacune et faciliter l’étude des interactions hôte-pathogène chez un hôte vivant et intact au cours d’une infection de plusieurs jours8,9. Le système immunitaire inné du poisson zèbre se développe dès 24 h après la fécondation (hpf)10, et le système adaptatif prend 4 à 6 semaines pour en développer11, offrant une fenêtre de temps dans laquelle les réponses immunitaires innées peuvent être évaluées isolément. Les réponses immunitaires innées sont bien conservées entre l’homme et le poissonzèbre 11. Le poisson zèbre a de nombreuses qualités qui facilitent l’étude de ces réponses, y compris la clarté optique (qui permet l’imagerie vivante à haute résolution d’hôtes intacts) et la tractabilité génétique (qui facilite les études mécanistes moléculaires).
Le modèle d’infection à Aspergillus du poisson zèbre larvaire décrit ici a été développé à l’origine par Knox et al.12. Il a récemment été élargi par notre groupe et d’autres pour étudier les mécanismes immunitaires de l’hôte12,13,les interactions hôte-pathogène13,14,15,les mécanismes d’immunosuppression13,16,17,la virulence fongique18et l’efficacité des médicaments antifongiques19,20. Ce modèle récapitule de multiples aspects de l’aspergillose humaine. Alors que les larves immunocompétentes sont résistantes, les larves immunodéprimées peuvent succomber à l’infection12,13,16,17.
Dans ce modèle, une infection localisée est établie en injectant des spores dans le ventricule du cerveau postérieur de la larve, une zone moins peuplée de phagocytes, et le recrutement et le comportement des phagocytes peuvent être évalués12,13. On pense que les macrophages agissent comme la première ligne de défense contre les spores d’Aspergillus chez l’homme1 et les modèles mammifères6,21. De même, dans le modèle du poisson zèbre, les macrophages sont recrutés pour les spores d’Aspergillus injectées, tandis que les neutrophiles sont recrutés secondairement en réponse à la croissance hyphale12,13,22. De ce modèle, on a également appris qu’Aspergillus peut persister dans les larves immunocompétentes de type sauvage après plus de 7 jours d’infection. En outre, l’évolution complète de l’infection peut être suivie chez les mêmes animaux vivants par imagerie confocale quotidienne.
Ce protocole décrit la technique de microinjection pour injecter des spores dans le ventricule du cerveau postérieur des larves de 2 jours de poteau-fécondation (2 dpf). L’infection est ensuite surveillée jusqu’à 7 jours, car les larves de poissons zèbres peuvent vivre jusqu’à 10 dpf sans se nourrir. L’immunosuppression peut être induite par le traitement de drogue, et l’application des drogues aux larves est également décrite. En conclusion, deux méthodes pour suivre la progression d’infection sont décrites, y compris la quantification des CFUs des larves individuelles et une configuration quotidienne d’imagerie en direct.
Protocole
Les chercheurs devraient obtenir l’approbation de toutes les expériences sur les animaux auprès des comités appropriés de soins et d’utilisation des animaux. Les données représentatives présentées dans cet article proviennent d’expériences réalisées dans le cadre de protocoles approuvés par le Comité institutionnel de soins et d’utilisation des animaux de l’Université Clemson (PUA2018-070, AUP2019-012).
1. Préparation des spores d’Aspergillus pour injection
- À partir d’une suspension de spores d’Aspergillus, calculer le volume nécessaire pour obtenir 1 x 106 spores. Le volume doit être de 20 à 100 μL; si ce n’est pas le cas, produire une dilution 10x dans 0,01 % (v/v) de Tween-20 stérile (Tween-water; Table des matériaux). Par exemple, si le volume calculé est de 5 μL, produire une dilution 10x et utiliser 50 μL de la solution diluée.
NOTA : Deux plaques/souches peuvent être préparées pour recueillir plus de spores ou comme pièce de rechange en cas de contamination. - Étaler 1 x 106sporesd’Aspergillus sur une plaque de glucose à milieu minimal (GMM)(table des matériaux)avec un épandeur stérile jetable en forme de L dans une armoire de biosécurité. Évitez de vous étendre sur la marge de la plaque. Incuber à 37 °C pendant 3 à 4 jours, la plaque tournée vers l’envers.
- Le jour de la collecte, apportez du miracloth stérile et des tubes coniques de 50 mL (deux par souche), des bouteilles fraîches d’eau Tween stérile (une par souche) et des épandeurs stériles jetables en forme de L à l’armoire de biosécurité.
REMARQUE: Miracloth peut être coupé en ~ 8 en x 6 en morceaux, enveloppé dans du papier d’aluminium et autoclavé pour stériliser. - Placez un morceau de miracloth dans chaque tube conique étiqueté de 50 mL et re-capuchon. Sortez le paquet de miracloth restant du capot.
- Apportez les assiettes dans l’armoire de biosécurité. Ouvrez une plaque, puis versez de l’eau Tween sur le dessus pour couvrir environ les trois quarts de la plaque.
- À l’aide d’un épandeur jetable en forme de L, grattez doucement la surface de la culture fongique dans un mouvement de va-et-vient, tout en utilisant l’autre main pour faire pivoter la plaque. Gratter jusqu’à ce que presque toutes les spores soient homogénéisées dans le Tween-water.
REMARQUE: En raison de l’hydrophobicité élevée, les spores peuvent créer des « bouffées » lorsque de l’eau Tween est ajoutée ou pendant le grattage. Il faut prendre grand soin d’éviter la contamination des tubes ou des plaques à proximité. Il est conseillé de changer les gants et d’essuyer la surface avec 70% d’éthanol entre l’extraction des différentes souches. - Prenez un tube conique de 50 mL et retirez le morceau de miracloth. Pliez-le en deux et transformez-le en un filtre inséré dans le haut du tube conique de 50 mL.
- Versez l’homogénat fongique de la plaque sur le miracloth dans le tube.
REMARQUE: Si deux plaques d’une même souche sont préparées, grattez les deux plaques et versez-les dans le même tube conique. - Verser de l’eau tween pour porter le volume total dans le tube conique à 50 mL.
- Tourner à 900 x g pendant 10 min. Assurez-vous d’utiliser des bouchons anti-aérosolisation dans la centrifugeuse.
- Versez le surnageant dans une solution d’eau de Javel à environ 10% pour décontaminer. Versez 50 mL de PBS 1x stérile dans le tube conique, puis vortex ou secouer pour remettre la pastille.
- Tourner à nouveau à 900 x g pendant 10 min. Versez le surnageant et ressuscitez le culot dans 5 mL de PBS 1x stérile. Filtrer à travers un morceau frais de miracloth dans un tube conique frais de 50 mL.
- Faire des dilutions sériel 10 fois (10x, 100x, 1000x) de l’homogénat fongique dans des tubes à centrifuger de 1,7 mL (p. ex., pour la solution 10x, mélanger 100 μL de l’homogénat fongique avec 900 μL de Tween-water).
- Choisissez la première dilution dans laquelle les spores ne sont pas visibles lorsqu’elles sont rejetées dans l’eau tween et utilisez cette dilution pour compter le nombre de spores à l’aide d’un hémocytomètre.
- Calculer la concentration de spores dans l’homogénat fongique préparé (suspension d’eau) à l’aide de la formule suivante:
Concentration (spores/mL) = Nombre de spores dans les 25 boîtes du milieu x facteur de dilution x 104 - Préparer un stock de 1 mL de 1,5 x 108 spores/mL dans un tube de microcentrifugation stérile 1x dans un tube de microcentrifugation de 1,7 mL. Cette préparation de spores peut être conservée à 4 °C pendant environ 4 semaines.
- Avant utilisation dans les injections, mélanger 20 μL de la préparation de spores avec 10 μL de rouge de phénol stérile à 1 % dans un tube à centrifuger de 1,7 mL pour obtenir une concentration finale de spores de 1 x 108 spores/mL. Vortex soigneusement avant l’injection.
REMARQUE: La solution rouge de phénol à 1% doit être stérilisée par filtre et stockée dans des aliquotes. - Pour une injection simulée, mélanger 20 μL de 1x PBS avec 10 μL de rouge de phénol stérile à 1 %.
2. Préparation des plaques de gélose pour injection
- Préparer 2% d’agarose dans un milieu E3 et fondre au micro-ondes.
- Verser dans une boîte de Pétri de 100 mm x 15 mm (~ 25 mL par plaque), faire tourbillonner pour couvrir la plaque uniformément et laisser refroidir.
- Envelopper la plaque avec un film de paraffine et la conserver inversée à 4 °C.
- Avant l’injection, porter la plaque à température ambiante (RT).
- Verser ~1 mL de filtre stérilisé à 2% d’albumine sérique bovine (BSA) sur la plaque, incliner la plaque pour étaler et couvrir tout le fond, et rincer avec E3.
REMARQUE: La solution de BSA à 2% peut être stérilisée par filtre et stockée sous forme de aliquotes de 1 mL à -20 °C. Le prétraitement BSA à 2% empêche les larves de coller à la surface de l’agarose. - Versez E3 avec de la tricaine tamponnée sur la plaque et laissez-la reposer jusqu’à l’injection.
3. Microinjection du ventricule de larve de larve de mésencéphale de poisson zèbre
- Déchorionate manuellement les larves avec pince à 2 dpf dans une boîte de Petri.
REMARQUE: La déchorionation peut être effectuée à tout moment à partir de 1,5 dpf jusqu’au moment de l’injection. - Retirer autant d’E3 que possible de la boîte de Petri et ajouter de la tricaine tamponnée de 300 μg/mL dans E3 pour anesthésier les larves.
REMARQUE : Une solution mère de tricaine tamponnée à 4 mg/mL dans E3 peut être préparée et conservée à 4 °C. La solution de travail peut être réalisée en diluant 4 mL de la solution mère jusqu’à 50 mL avec E3. - Utilisez une configuration de microinjection fournie avec l’injecteur de pression, l’unité de contre-pression, le footswitch, le porte-micropipette, le micromanipulateur et un support et une plaque magnétiques, le tout connecté à une source d’air comprimé(Table des matériaux).
- Ouvrez la vanne d’air comprimé et allumez le micro-injecteur. Réglez la pression sur ~ 25 PSI, la durée de l’impulsion à 60 ms et l’unité de contre-pression à 1 PSI.
- Chargez une aiguille de microinjection à l’aide d’une pointe de pipette de microchargeur(Table des matériaux)avec environ 3 à 5 μL de PBS préparé ou de suspension de spores avec du rouge de phénol. Montez l’aiguille sur le micromanipulateur.
REMARQUE: Les aiguilles de microinjection peuvent être préparées comme décrit précédemment23. Le stéréomicroscope utilisé pour les microinjections devrait avoir un réticule oculaire pour étalonner l’aiguille de microinjection. Le réticule doit être étalonné à l’est d’un micromètre d’étage et la longueur de l’échelle du réticule (μm) doit être déterminée. Le diamètre de la goutte de suspension de spores qui s’éjecte de l’aiguille est mesuré en fonction du nombre de hachages (du réticule) qui chevauchent la goutte. - Positionnez le micromanipulateur de manière à ce que l’extrémité de l’aiguille soit visible au grossissement le plus bas sous le stéréomicroscope. Zoom sur un grossissement 4x, en gardant l’aiguille à la vue.
- À l’aide d’une pince tranchante, coupez l’extrémité de l’aiguille. Appuyez sur la pédale d’injection pour visualiser la taille de la gouttelette qui sort. Continuez à couper jusqu’à ce que ~ 3 nL de suspension de spores soit injecté (ici, il s’agit de cinq hachages).
- Déplacez le micromanipulateur et l’aiguille hors de la voie pour éviter de frapper accidentellement l’aiguille pendant que les larves sont disposées sur la plaque d’injection.
- Versez E3-Tricaine de la plaque d’injection, puis transférez ~ 24 larves anesthésiées sur la plaque d’injection avec le moins d’E3 possible à l’aide d’un pipet de transfert.
- À l’aide d’un petit outil pour manipuler les larves de poissons zèbres (c.-à-d. outil de boucle capillaire ou outil de cils), disposez les larves en fonction de la direction dans laquelle elles sont orientées. Plus précisément, placez tous face à droite dans une rangée, et tous tournés vers la gauche dans une rangée ci-dessous.
REMARQUE: Cet arrangement est difficile s’il y a trop de liquide sur la plaque, car les larves vont « flotter » hors de leur place. Cependant, trop peu de liquide est également problématique si les injections prennent beaucoup de temps, car les larves peuvent se dessécher ou l’anesthésie s’estomper. Ainsi, une attention particulière doit être accordée à la quantité de liquide sur la plaque tout au long du processus de microinjection. - Réglez le zoom du microscope sur le grossissement le plus bas. Ramenez le micromanipulateur et disposez de sorte que l’aiguille soit proche des larves, à un angle d’environ 30°-60°, au milieu du champ de vision.
- Effectuez un zoom avant sur le grossissement le plus élevé et utilisez des boutons de réglage fins pour ajuster davantage la position de l’aiguille. Vérifiez qu’environ 30 à 70 spores sortent de l’aiguille en injectant la suspension de spores dans le liquide sur la plaque à côté des larves. Ajustez le temps et la pression sur la configuration de l’injection, si nécessaire.
REMARQUE : Cet essai doit être répété après toutes les cinq à six larves, car le nombre de spores sortant de l’aiguille peut augmenter ou diminuer au fil du temps. - En commençant par la rangée dans laquelle les larves sont orientées vers l’aiguille, déplacez la plaque de sorte que l’aiguille soit directement au-dessus et positionnée près des premières larves.
- En déplaçant l’aiguille avec le micromanipulateur, insérez l’aiguille à travers le tissu autour de la vésicule otique pour percer dans le ventricule du cerveau postérieur. Déplacez la plaque avec l’autre main si nécessaire pour obtenir la bonne orientation de la larve avec l’angle de l’aiguille.
- Vérifiez visuellement que l’extrémité de l’aiguille est au centre du ventricule du cerveau postérieur, appuyez sur la pédale pour injecter des spores et rétractez doucement l’aiguille.
REMARQUE: Le colorant rouge de phénol doit principalement rester dans le ventricule du cerveau postérieur. Une petite quantité peut aller dans le mécène, mais elle ne doit pas atteindre le cerveau avant ou à l’extérieur du cerveau. Si c’est le cas, le volume injecté est trop grand et la pression et le temps doivent être réduits en conséquence, ou une nouvelle aiguille doit être étalonnée. - En descendant la plaque, injectez toutes les larves de cette rangée. Ensuite, tournez la plaque et injectez toutes les larves de l’autre rangée.
REMARQUE: Les larves injectées ou accidentellement endommagées par inadvertance peuvent être marquées par 1) injecter dans le jaune plusieurs fois pour créer une marque rouge ou 2) faire glisser la larve hors de la rangée avec l’aiguille. - Déplacez l’aiguille vers le haut et hors du chemin à nouveau. Effectuez un zoom arrière sur un grossissement inférieur sur le microscope. Le colorant rouge de phénol doit toujours être visible dans le cerveau postérieur de chaque larve.
- Tout d’abord, retirez-vous avec un outil de boucle de cheveux et une pipette pour éliminer toutes les larves avec des injections infructueuses. Transférer les larves restantes dans une nouvelle boîte de Pétri en les lavant de l’assiette avec de l’E3 stérile frais et un pipet de transfert.
- Répétez l’opération au besoin pour le numéro d’échantillon expérimental final souhaité.
- Rincer les larves au moins 2x avec E3 et assurer la récupération de l’anesthésie.
- Pour quantifier la survie sans autre traitement, à l’aide d’une pipette de transfert, transférer les larves dans une plaque de 96 puits (1 larve par puits) en E3.
4. Établissement d’un nombre de spores injectées et viables
- Immédiatement après l’injection, à l’aide d’une pipette de transfert, choisissez au hasard environ huit des larves injectées et transférez-les dans des tubes à centrifuger de 1,7 mL (une larve par tube).
- Euthanasier les larves avec de la tricaine ou en les plaçant à 4 °C pendant 0,5–2,0 h.
- Préparer 1 mL d’ampicilline à 1 mg/mL et des solutions antibiotiques à 0,5 mg/mL de kanamycine dans du PBS 1x stérile. La solution restante peut être conservée à 4 °C et utilisée ultérieurement.
NOTA : Les solutions d’origine d’ampicilline à 100 mg/mL et de kanamycine à 50 mg/mL peuvent être préfabriqués, stérilisés par filtre et entreposés dans des aliquotes à -20 °C. Diluer ces 100x dans 1x PBS pour obtenir la solution de travail. - À l’aide d’une pipette, retirez autant de liquide que possible du tube de centrifugation, en laissant la larve derrière vous et ajoutez 90 μL du PBS 1x avec des antibiotiques.
REMARQUE: Les antibiotiques sont utilisés pour prévenir la croissance bactérienne dans les plaques de MGM qui peuvent interférer avec le comptage des colonies d’Aspergillus. - Homogénéiser les larves dans un lyseur tissulaire à 1 800 oscillations/min (30 Hz) pendant 6 min. Tourner à 17 000 x g pendant 30 s.
- Étiqueter les plaques de MGM (une plaque par larve homogénéisée). À l’aide d’un brûleur Bunsen pour créer un environnement stérile, pipettez la suspension homogénéisée d’un tube au milieu de la plaque GMM, puis étalez-la à l’aide d’un épandeur jetable en forme de L. Évitez d’étaler l’homogénéat contre la jante.
- Incuber les plaques à l’envers à 37 °C pendant 2–3 jours et compter le nombre de colonies formées (UFC).
- Pour mesurer le nombre de spores vivantes pendant la période d’infection, cueillez les larves de la plaque de 96 puits 1 à 7 jours après l’injection (dpi) et transférez-les dans des tubes à centrifuger. Euthanasier et homogénéiser les larves pour qu’ils se propagent sur les plaques de MGM, comme décrit aux étapes 4.1 à 4.5.
5. Traitement médicamenteux des larves injectées
- Après la section 4, divisez les larves injectées restantes en deux plats de 3,5 mm: un pour le traitement médicamenteux et un pour le contrôle. Utilisez environ 24 larves infectées par condition.
REMARQUE: Les plats de 3,5 mm peuvent être traités avec du lait en poudre non gras à 2% dans de l’eau, rincés, séchés à l’air et stockés à RT au préalable. Le revêtement avec du lait empêchera les larves de coller au plastique. - Préparer la solution médicamenteuse souhaitée et le véhicule en E3 sans bleu de méthylène dans des tubes coniques en fonction de la concentration finale requise, puis bien mélanger. Par exemple, pour surveiller la survie des larves exposées à la dexaméthasone, utilisez 24 larves (répétitions) pour la dexaméthasone et 24 pour le contrôle du véhicule, comme le DMSO. Préparer 5 mL de la solution médicamenteuse à la concentration requise. Ici, 5 mL de DMSO à 0,1 % et 10 μM de dexaméthasone ont été utilisés, et 24 larves/condition ont été transférées à environ 200 μL du véhicule/solution médicamenteuse/larves.
- Retirer autant de liquide que possible d’une parabole à l’munie d’une pipette de transfert et ajouter la commande du véhicule contenant de l’E3 prémélangée. Répéter avec E3 prémélangé contenant le traitement d’intérêt pour l’autre plat.
- À l’aide d’une pipette, transférer les larves dans une plaque de 96 puits (une larve par puits). Surveiller la survie des larves injectées exposées au véhicule ou au médicament pendant 7 jours.
REMARQUE: Le médicament peut être appliqué uniquement le jour de l’infection et conservé sur les larves pendant toute l’expérience ou peut être rafraîchi quotidiennement.
6. Imagerie quotidienne des larves infectées à l’aide du dispositif de blessure et de piégeage du poisson zèbre pour la croissance et l’imagerie (zWEDGI)
- S’assurer que les larves sont traitées avec 100 μM de N-phénylthiourée (PTU) à 24 hpf pour prévenir la pigmentation et que le PTU est conservé sur les larves pendant toute l’expérience.
NOTA : L’UMP à une valeur de 75 à 100 μM empêche la pigmentation des larves sans défauts de développement flagrants24. Cependant, le PTU peut interférer avec certains processus biologiques25, et les chercheurs doivent déterminer au préalable si le médicament peut affecter les processus à l’étude. - Infecter les larves transgéniques avec des populations cellulaires d’intérêt marqués à 2 dpf avec des spores d’Aspergillus conçues pour exprimer une protéine fluorescente, comme décrit à la section 3. Ensuite, transférer les larves infectées dans des puits d’une plaque de 48 puits dans environ 500 μL/puits d’E3 sans bleu de méthylène.
REMARQUE: Une plaque de 48 puits est utilisée ici, car il est plus facile de transférer les larves dans et hors de lors de l’imagerie quotidienne répétée. - Le jour de l’imagerie, préparez deux boîtes de Petri de 3,5 mm : une avec 100 μM de PTU et une avec de la ztricaine E3.
- Ajouter E3-tricaine dans les chambres d’un dispositif zWEDGI26,27. Sous le stéréomicroscope, retirez les bulles d’air des chambres et du canal de retenue à l’aide d’une micropipette P100. Enlevez tout excès d’E3-tricaine, de sorte que c’est seulement dans les chambres.
- Pipettez une larve de la plaque à l’aide d’une pipette de transfert. Si beaucoup de liquide est utilisé pour l’enlever, pipetter dans une parabole de 3,5 mm contenant de l’E3-PTU. Ensuite, pipette vers le haut à nouveau, en utilisant le moins de liquide possible, et transférer dans E3-tricaine.
- Attendez environ 30 s pour l’anesthésie, puis transférez-la dans la chambre de chargement du dispositif de blessure et de piégeage (p. ex. zWEDGI).
- Sous le stéréomicroscope, positionnez la larve. Utilisez la micropipette P100 pour retirer la tricaine E3 de la chambre de blessure et relâchez-la dans la chambre de chargement pour déplacer la queue de la larve dans le canal de restriction. Assurez-vous que la larve est positionnée sur son côté latéral, dorsal ou dorso-latéral, de sorte que le cerveau postérieur puisse être enténé avec une lentille objective inversée.
- Larve d’image avec un microscope confocal.
- Après imagerie, avec la pipette P100, relâchez la tricaine E3 dans la chambre de blessure pour pousser la larve du canal de retenue dans la chambre de chargement.
- À l’aide d’une pipette de transfert, ramassez la larve et transférez-la dans la boîte de Pétri avec E3-Tricaine. En utilisant le moins de liquide possible, transférez-le dans la boîte de Petri avec E3-PTU. Rincer dans PTU et transférer dans la plaque de 48 puits.
Résultats
Après microinjection des spores d’Aspergillus dans le cerveau postérieur des larves de poisson zèbre, les résultats de l’infection peuvent être suivis de multiples essais, y compris la survie, les UFC et l’imagerie vivante. Dans un essai de survie, le nombre de larves infectées survivant de 1 à 7 dpi a été surveillé. Lorsque les larves de type sauvage n’ont pas été traitées, très peu de décès ont été observés, et environ 80 à 100 % des larves ont survécu à l’ensemble de l’expérience (figure 1). Si les larves étaient immunodéprimées, par exemple par exposition au corticostéroïde dexaméthasone (10 μM), on a observé une diminution significative de la survie (figure 1).
Lorsque les UFC ont été quantifiées tout au long de l’expérience de 7 jours à partir de larves de type sauvage infectées par des spores d’A. fumigatus, on a observé une persistance des spores, avec une clairance lente au fil du temps (figure 2A). Le nombre de spores survivantes à 1, 2, 3, 5 et 7 dpi a été normalisé au nombre de spores injectées à 0 ppp pour comparer la persistance et la clairance entre les répétitions(Figure 2B).
Les lignées de poissons transgéniques exprimant des protéines fluorescentes dans les leucocytes ainsi que des spores d’Aspergillus exprimant des protéines fluorescentes peuvent être utilisées pour visualiser à la fois le recrutement et le comportement des leucocytes ainsi que la germination et la croissance fongiques13. Lorsque les macrophages ont été marqués (p. ex. Tg(mpeg1:H2B-GFP)),on a généralement observé un regroupement de macrophages dans environ 50 % des larves, à partir de 2 à 3 dpi(figure 3A). Le recrutement des neutrophiles (Tg(lyz:BFP)) a été généralement retardé, se produisant principalement après la germination fongique(figure 3A). Bien que la charge fongique ait persisté pendant toute l’expérience chez la majorité des larves(figure 3A),une clairance a été observée(figure 3B). Chez certaines larves, une charge fongique en dehors du cerveau postérieur a également été observée plus tard dans l’infection, en raison de la dissémination fongique, probablement dans les macrophages.
La zone autour de la vésicule otique est un endroit possible où cette dissémination peut être trouvée (Figure 3C). Ces observations ont été quantifiées chez plusieurs larves individuelles au cours de l’expérience entière (Figure 4). Typiquement, la germination a été observée chez environ 60 % des larves de 5 dpi(figure 4A). La zone de l’amas de phagocytes, le recrutement des macrophages et le recrutement des neutrophiles varient à la fois au fil du temps et entre les larves, certaines tendances à la hausse tout au long de l’expérience et d’autres se résolvant au fil du temps (Figure 4B, C, D).
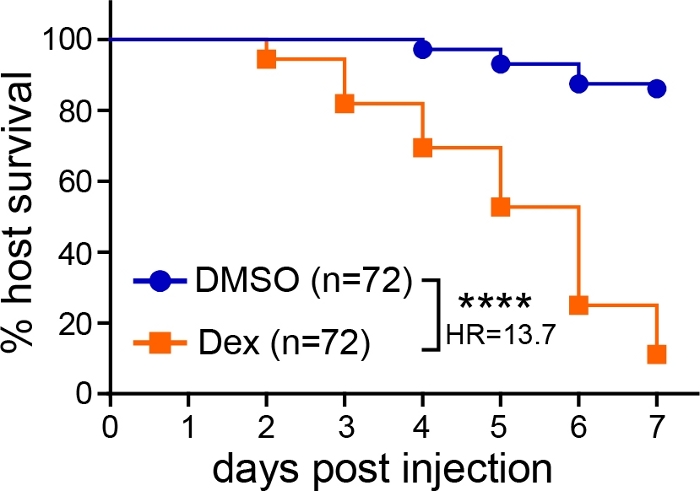
Figure 1 : Analyse représentative de la survie des larves infectées. Des larves infectées par l’aspergilleont été exposées à un véhicule témoin (DMSO) ou à la dexaméthasone (Dex), et la survie a été surveillée. Les données représentent trois répliques regroupées. CDU d’injection moyenne : DMSO = 30, Dex = 29 (la valeur de p et le rapport de risque ont été calculés par analyse de régression proportionnelle de risque de Cox, ****p < 0,0001). Veuillez cliquer ici pour voir une version plus grande de cette figure.
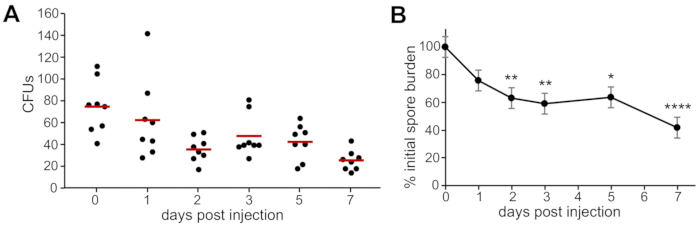
Figure 2 : Dénombrement représentatif de l’UFC chez les larves infectées immédiatement après l’injection (0 ppp) et pendant le cours de l’infection (2, 3, 5 et 7 dpi). Huit larves infectées ont été homogénéisées et plaquées pour compter l’UFC pour chaque point de temps et se répliquer. (A) Exemple de données d’une réplique. Chaque point représente une larve, les barres représentent des moyennes pour chaque point de temps. (B) Les comptes de CFU ont été normalisés au compte de CFU à 0 dpi pour chaque répétition, et trois répétitions ont été regroupées. Les données ont été comparées entre les conditions expérimentales à l’aide d’une analyse de la variance et résumées en termes de moyennes marginales estimées et d’erreurs-types. Astérix représente une signification statistique par rapport à l’UFC à 0 dpi (*p < 0,05, **p < 0,01, ****p < 0,0001). Veuillez cliquer ici pour voir une version plus grande de cette figure.
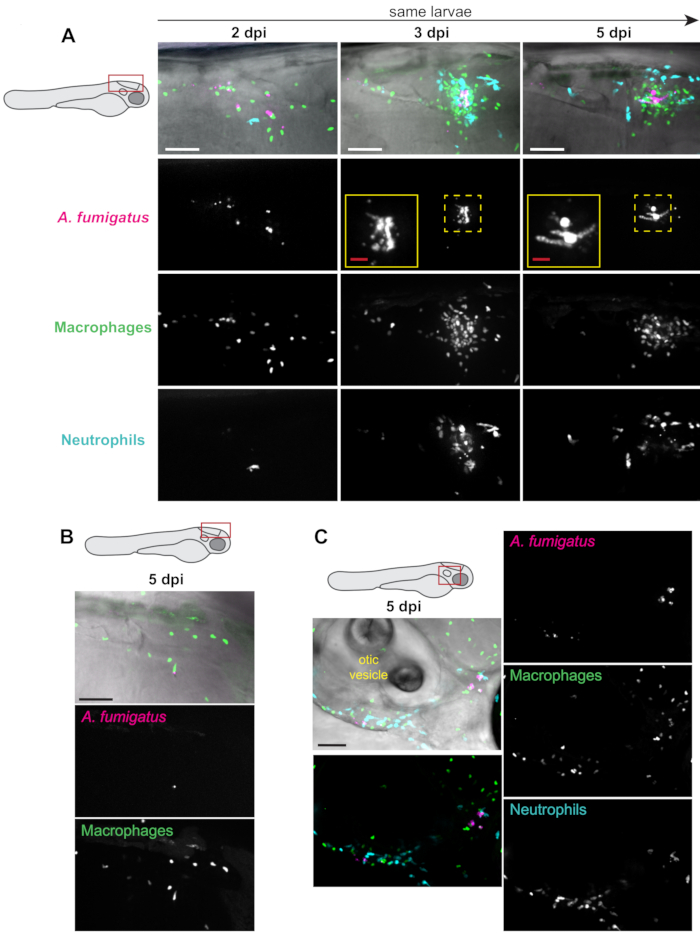
Figure 3 : Images représentatives d’expériences d’infection. des larves PTU-traitées avec les macrophages fluorescents (mpeg1: H2B-GFP) et les neutrophiles (lyz: BFP) ont été injectées avec RFP-exprimant A. fumigatus. Des larves vivantes et infectées ont été iimages à plusieurs reprises à 2, 3, et 5 dpi sur un microscope confocal. Les images de projection Z d’intensité maximale sont affichées. Les schémas des larves indiquent l’emplacement de l’imagerie pour chaque panneau. Toutes les barres d’échelle représentent 100 μm, à l’exception des barres d’échelle en médaillon, qui sont de 25 μm. (A) Les images montrées proviennent d’une seule larve prise à 2, 3 et 5 dpi, ce qui représente une progression typique de l’infection. Les médaillons montrent une germination fongique aux jours 3 et 5. (B) Image représentative d’un sous-ensemble de larves qui peuvent éliminer l’infection, avec une faible charge fongique et peu d’inflammation à 5 dpi. (C) Image représentative d’un sous-ensemble de larves dans lequel l’infection se propage hors du cerveau postérieur à des points de temps ultérieurs. Dans cette image, des champignons, des macrophages et des neutrophiles peuvent être trouvés autour et au-dessous de la vésicule otique. Veuillez cliquer ici pour voir une version plus grande de cette figure.
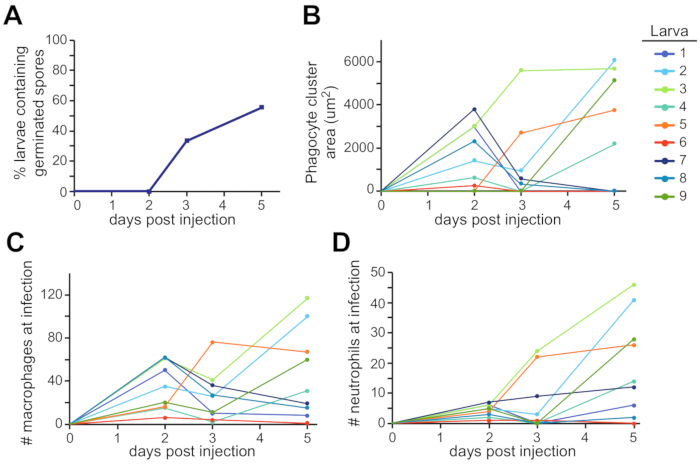
Figure 4 : Quantification représentative des expériences d’imagerie. Les images de la configuration expérimentale de la figure 3 ont été analysées pour la germination fongique et le recrutement des leucocytes. (A) Les larves ont été notées pour la présence de spores germées chaque jour, et le pourcentage de larves ayant une germination a été calculé. (B,C,D) Chaque larve individuelle est représentée sous la forme d’une ligne de couleur différente. L’aspect et la taille de faisceau de phagocyte (B), le recrutement de macrophage (C), et le recrutement de neutrophile (D) ont été suivis au cours de l’expérience de 5 jours pour chaque larve. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le modèle d’infection décrit ici est bénéfique pour analyser les réponses immunitaires de l’hôte, les interactions hôte-pathogène et la pathogenèse fongique12,13,14,15. Cette information peut être tirée de l’imagerie à haute résolution d’agents pathogènes marqués par fluorescence et de cellules hôtes13,de la survie larvaire et de la persistance de l’UFC au fil du temps.
La technique de microinjection est essentielle au succès de ce protocole et peut devoir être ajustée lors de l’utilisation de différents équipements et configurations de microinjection. En particulier, la pression et le temps d’injection sont deux variables majeures et peuvent être ajustés pour s’assurer que le volume éjecté par l’aiguille est d’environ 3 nL. La taille de l’aiguille déterminée en la coupant avec une pince régule également le nombre de spores injectées; cependant, une ouverture plus grande peut causer des dommages tissulaires à la larve. D’autre part, une ouverture trop petite ne laissera pas sortir les spores relativement grosses (>2 μm) et peut entraîner un colmatage des aiguilles. Si cela se produit, l’aiguille peut être reclipped pour avoir une ouverture légèrement plus grande.
D’autres protocoles pour la microinjection de bactéries utilisent PVP-40 pour aider à maintenir un mélange d’injection homogène, mais nous n’avons trouvé aucun avantage à utiliser ce support avec des spores d’Aspergillus. Le colmatage de l’aiguille peut être atténué en faisant vortex la préparation fongique à fond pour briser les touffes avant de charger l’aiguille. Parfois, un sabot dans l’aiguille peut également être délogé en augmentant temporairement la pression ou le temps d’injection et en déclenchant le microinjecteur pendant que l’aiguille est dans le liquide entourant les larves. La pression et le temps d’injection doivent ensuite être réduits à nouveau aux niveaux précédents. Dans d’autres cas, un sabot ne peut pas être retiré et une nouvelle aiguille doit être chargée et réétalonnée.
Ce protocole est conçu pour injecter environ 30 à 70 spores par larve. On sait que sur la base de la concentration de la préparation de spores et du volume injecté, ce nombre est assez faible. Cependant, il a été empiriquement constaté que c’est le nombre de spores injectées dans ces conditions. On ne sait pas pourquoi cette différence se produit, mais elle peut être due à l’agglutination des spores dans l’aiguille. Nos propres tentatives d’injecter un plus grand nombre de spores ont été largement infructueuses.
Pour s’assurer qu’environ 30 à 70 spores sont injectées et maintenir la consistance des injections dans toutes les larves, vérifiez le nombre de spores en les injectant sur l’E3 entourant les larves. Répétez cela toutes les cinq à six larves tout au long de toutes les injections. Si le nombre de spores semble changer, la pression et/ou le temps d’injection peuvent être ajustés pour injecter un nombre constant de spores sur plusieurs larves. Cependant, il faut veiller à ce que la dose injectable reste principalement dans le cerveau postérieur et ne remplisse pas le mécène et le cerveau avant.
Pour assurer une infection localisée, la suspension de spores doit être contenue dans le ventricule du cerveau postérieur. Cela peut être visualisé par la coloration rouge phénol juste après l’injection, bien que la couleur rouge diffuse avec le temps. Pour les injections, la région autour de la vésicule otique est utilisée pour percer et atteindre le ventricule à un angle de 45° à 65°. Cette zone n’a pas de vaisseaux sanguins principaux, provoque moins de dommages aux tissus et guérit instantanément. Si la peau au-dessus du ventricule est percée, la suspension de spores peut être fuie, car l’aiguille qui doit être utilisée pour les injections de spores d’Aspergillus est plus grande que celle utilisée pour les suspensions bactériennes. Les larves injectées sans succès ou accidentellement endommagées peuvent être marquées en injectant dans le jaune plusieurs fois pour créer une marque rouge ou en faisant glisser la larve hors de la rangée avec l’aiguille. Une fois qu’une série d’injections est terminée, ces larves doivent être enlevées et éliminées avant que le reste ne soit lavé de la plaque. E3 sans bleu de méthylène est utilisé pour anesthésier les larves avant l’injection et aussi garder la larve après les injections, parce que le bleu de méthylène est antifongique.
Au moment de l’injection, le nombre d’UFC représente le nombre de spores viables dans l’hôte infecté. Cependant, si les spores germent en hyphes, ceux-ci peuvent être divisés en « unités fongiques » viables distinctes lors de l’homogénéisation et peuvent donner lieu à de multiples colonies. Ou, un hyphe multicellulaire ininterrompu peut donner naissance à une seule colonie, ce qui entraîne une représentation moyenne, mais imprécise, de la charge fongique. Cela peut être atténué en combinant le nombre d’UFC avec la microscopie longitudinale des larves individuelles, ce qui fournit des données visuelles sur le devenir des spores injectées.
Par rapport au système des mammifères, le modèle d’infection à larve de poisson zèbre est particulièrement important en raison de son accessibilité optique. Le recrutement et la réponse des cellules immunitaires innées peuvent être visualisés au sein d’un hôte vivant intact. Cela peut être incorporé avec l’inhibition génétique ou chimique des cibles moléculaires pour analyser comment chaque cible affecte la réaction des macrophages ou des neutrophiles contre les spores d’Aspergillus chez un animal vivant.
Bien que le modèle d’infection à Aspergillus, la larve de poisson zèbre continue de jouer un rôle déterminant dans la description de différents aspects de l’IA12,13,14,15,16,17,18,19,20,22,il existe d’autres domaines d’expansion. Du côté de l’hôte, il est utilisé pour décrire les réponses immunitaires au niveau cellulaire, mais cela peut être étendu pour analyser les mécanismes immunitaires au niveau moléculaire en le combinant avec le morpholino ciblé, CRISPR, les lignées mutantes stables ou l’exposition chimique. Une mise en garde est que les homologues de tous les composants connus de la voie immunitaire innée des mammifères n’ont pas été identifiés chez le poisson zèbre.
Du côté de l’agent pathogène, la virulence de différentes espèces et souches a été décrite. Une piste prometteuse de recherche future est l’utilisation de souches mutantes d’Aspergillus pour tester comment des gènes ou des protéines spécifiques contribuent en tant que facteurs de virulence. Ainsi, de nouveaux médicaments antifongiques peuvent être développés pour cibler ces protéines. Les médicaments antifongiques actuels ont une faible efficacité chez les patients humains et il y a une résistance croissante à ces médicaments dans les champignons28. Ce modèle in vivo peut être utilisé pour étudier pourquoi ces médicaments échouent et comme modèle intermédiaire pour tester l’efficacité de nouveaux médicaments antifongiques. Dans l’ensemble, les résultats découverts à l’aide de ce modèle peuvent faciliter le développement futur de traitements efficaces pour les patients infectés par Aspergillus.
Déclarations de divulgation
Aucun conflit ou intérêt financier à divulguer.
Remerciements
Ce travail a été soutenu par le National Institute of Allergy And Infectious Diseases des National Institutes of Health sous le numéro de prix K22AI134677. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Dumont forceps #5 | Roboz Surgical Instrument Co. | RS-5045 | |
| Eyepiece reticle | Microscope World | RETR10 | For calibrating needles, used in Stereomicroscope |
| Microinjector setup: Back pressure unit | Applied Scientific Instrumentation | BPU | |
| Footswitch | Applied Scientific Instrumentation | FTSW | |
| Micro pipet holder kit | Applied Scientific Instrumentation | M-Pip | |
| Pressure injector | Applied Scientific Instrumentation | MPPI-3 | |
| Micromanipulator setup: Micromanipulator | Narashige (Tritech) | M-152 | |
| Magnetic stand and plate | Tritech | MINJ-HBMB | |
| Needle puller | Sutter Instrument | P-97 | |
| Stereomicroscope | Nikon | SMZ-745 | |
| Tissuelyser II | Qiagen | 85300 | To homogenize larvae |
| Material | Company | Catalog Number | Comments/Description |
| Agarose | Fisher | BP160-500 | |
| Ampicillin sodium salt | Fisher | AAJ6380706 | |
| BSA, fraction V | VWR | AAJ65855-22 | |
| Kanamycin sulfate | Fisher | AAJ1792406 | |
| L spreaders | Fisher | 14 665 230 | |
| Microcapillary needles (no filament) | World Precision Instruments (WPI) | TW100-3 | |
| Microloader pipet tips | VWR | 89009-310 | To load the needle with Aspergillus suspension |
| Miracloth | VWR | EM475855-1R | To filter Aspergillus suspension |
| N-phenylthiourea | Fisher | AAL0669009 | To prevent pigmentation |
| Phenol red, 1% solution | Fisher | 57254 | |
| Tricaine (Ethyl 3-aminobenzoate, methanesulfonic acid salt) | Fisher | AC118000500 | To anesthetize larvae |
| Tween-20 | Fisher | BP337-500 | |
| Media and Solutions | Components/Recipe | ||
| E3 media: 60x E3 | 17.2 g NaCl, 0.76 g KCl, 2.9 g CaCl2, 4.9 g MgSO4 · 7H2O, to 1 L with H2O | ||
| 1x E3 | 16.7 ml 60x stock, 430 ul 0.05 M NaOH, to 1 L with H2O (optional: + 3 ml 0.01% methylene blue) | ||
| Tricaine stock solution | 2 g Tricaine, 5 g Na2HPO4 · 7H2O, 4.2 ml 60X E3, to 500 ml with H2O, pH to 7.0-7.5 with NaOH | ||
| Glucose minimal media (GMM) agar: GMM agar | 10 g Glucose (Dextrose), 50 ml 20x Nitrate salts, 1 ml TE, to 1 L with H2O, pH to 6.5 with NaOH, + 16 g Agar, autoclave | ||
| 20x Nitrate salts | 120 g NaNO3, 10.4 g KCl, 10.4 g, MgSO4 · 7H2O, 30.4 g, KH2PO4, to 1 L with H2O, autoclave | ||
| Trace elements (TE) | 2.20 g ZnSO4 · 7H2O, 1.10 g H3BO3, 0.50 g MnCl2 · 4H2O, 0.16 g FeSO4 · 7H2O, 0.16 g CoCl2 · 6H2O, 0.16 g CuSO4 · 5H2O, 0.11 g (NH4)6Mo7O24 · 4H2O, 5.00 g Na2EDTA, to 100 ml with H2O, dissolve stirring overnight, autoclave |
Références
- Latge, J. P. Aspergillus fumigatus and aspergillosis. Clinical Microbiology Reviews. 12 (2), 310-350 (1999).
- Denning, D. W. Invasive aspergillosis. Clinical Infectious Diseases. 26 (4), 781-803 (1998).
- Dagenais, T. R., Keller, N. P. Pathogenesis of Aspergillus fumigatus in Invasive Aspergillosis. Clinical Microbiology Reviews. 22 (3), 447-465 (2009).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: systematic review of the literature. Clinical Infectious Diseases. 32 (3), 358-366 (2001).
- Mirkov, I., Popov, A., Lazovic, B., Glamoclija, J., Kataranovski, M. Usefulness of animal models of aspergillosis in studying immunity against Aspergillus infections. Journal de Mycologie Médicale. 29 (1), 84-96 (2019).
- Schaffner, A., Douglas, H., Braude, A. Selective protection against conidia by mononuclear and against mycelia by polymorphonuclear phagocytes in resistance to Aspergillus. Observations on these two lines of defense in vivo and in vitro with human and mouse phagocytes. Journal of Clinical Investigation. 69 (3), 617-631 (1982).
- Behnsen, J., et al. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathogens. 3 (2), 13 (2007).
- Torraca, V., Mostowy, S. Zebrafish Infection: From Pathogenesis to Cell Biology. Trends in Cell Biology. 28 (2), 143-156 (2018).
- Rosowski, E. E., et al. The Zebrafish as a Model Host for Invasive Fungal Infections. Journal of Fungi. 4 (4), (2018).
- Herbomel, P., Thisse, B., Thisse, C. Ontogeny and behaviour of early macrophages in the zebrafish embryo. Development. 126 (17), 3735-3745 (1999).
- Traver, D., et al. The Zebrafish as a Model Organism to Study Development of the Immune System. Advances in Immunology. 81, 254-330 (2003).
- Knox, B. P., et al. Distinct innate immune phagocyte responses to Aspergillus fumigatus conidia and hyphae in zebrafish larvae. Eukaryotic Cell. 13 (10), 1266-1277 (2014).
- Rosowski, E. E., et al. Macrophages inhibit Aspergillus fumigatus germination and neutrophil-mediated fungal killing. PLoS Pathogens. 14 (8), 1007229 (2018).
- Koch, B. E. V., Hajdamowicz, N. H., Lagendijk, E., Ram, A. F. J., Meijer, A. H. Aspergillus fumigatus establishes infection in zebrafish by germination of phagocytized conidia, while Aspergillus niger relies on extracellular germination. Scientific Reports. 9 (1), 12791 (2019).
- Pazhakh, V., Ellett, F., Croker, B. A. beta-glucan-dependent shuttling of conidia from neutrophils to macrophages occurs during fungal infection establishment. PLoS Biology. 17 (9), 3000113 (2019).
- Herbst, S., et al. Phagocytosis-dependent activation of a TLR9-BTK-calcineurin-NFAT pathway co-ordinates innate immunity to Aspergillus fumigatus. EMBO Molecular Medicine. 7 (3), 240-258 (2015).
- Shah, A., et al. Calcineurin Orchestrates Lateral Transfer of Aspergillus fumigatus during Macrophage Cell Death. American Journal of Respiratory and Critical Care Medicine. 194 (9), 1127-1139 (2016).
- Jain, S., et al. Selenate sensitivity of a laeA mutant is restored by overexpression of the bZIP protein MetR in Aspergillus fumigatus. Fungal Genetics and Biology. 117, 1-10 (2018).
- Jones, C. N., et al. Bifunctional Small Molecules Enhance Neutrophil Activities Against Aspergillus fumigatus in vivo and in vitro. Frontiers in Immunology. 10, 644 (2019).
- Rosowski, E. E., He, J., Huisken, J., Keller, N. P., Huttenlocher, A. Efficacy of voriconazole against A. fumigatus infection depends on host immune function. Antimicrobial Agents and Chemotherapy. , 00917-00919 (2019).
- Herbst, S., et al. A new and clinically relevant murine model of solid-organ transplant aspergillosis. Disease Models and Mechanisms. 6 (3), 643-651 (2013).
- Knox, B. P., Huttenlocher, A., Keller, N. P. Real-time visualization of immune cell clearance of Aspergillus fumigatus spores and hyphae. Fungal Genetics and Biology. 105, 52-54 (2017).
- Harvie, E. A., Huttenlocher, A. Non-invasive Imaging of the Innate Immune Response in a Zebrafish Larval Model of Streptococcus iniae Infection. Journal of Visualized Experiments. (98), e52788 (2015).
- Karlsson, J., von Hofsten, J., Olsson, P. E. Generating transparent zebrafish: a refined method to improve detection of gene expression during embryonic development. Marine Biotechnology. 3 (6), 522-527 (2001).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Huemer, K., et al. zWEDGI: Wounding and Entrapment Device for Imaging Live Zebrafish Larvae. Zebrafish. 14 (1), 42-50 (2017).
- Huemer, K., et al. Long-term Live Imaging Device for Improved Experimental Manipulation of Zebrafish Larvae. Journal of Visualized Experiments. (128), e56340 (2017).
- Perlin, D. S., Shor, E., Zhao, Y. Update on Antifungal Drug Resistance. Current Clinical Microbiology Reports. 2 (2), 84-95 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon