Method Article
호스트 병원체 상호 작용의 분석을 위한 아스퍼질러스 포자를 가진 얼룩말 물고기 애벌레의 감염
요약
이 프로토콜은 제브라피시 애벌레에 있는 Aspergillus 감염 모형을 기술합니다. 아스퍼질러스 포자는 유충의 뒷뇌에 마이크로인주사를 주입하고, 화학적 치료는 면역억제를 유도하는 데 사용된다. 감염 진행은 곰팡이 성장과 면역 반응을 모니터링하기 위해 매일 이미징 설정을 통해 모니터링될 뿐만 아니라 식민지 형성 단위 도금에 의한 살아있는 포자의 열거를 모니터링합니다.
초록
침략적인 aspergillosis (IA)는 면역 손상개별 중 일반적인 곰팡이 감염의 한개입니다. 항진균제의 가용성에도 불구하고, IA는 감염된 면역 손상 환자에서 >50% 사망률을 유발할 수 있습니다. 새로운 치료법을 개발하기 위해 감염된 환자의 감염 감수성과 낮은 생존율에 기여하는 숙주 및 병원균 요인을 결정하는 것이 중요합니다. 타고난 면역 반응은 아스퍼질러스 포자의 인식과 통관에 중추적인 역할을 하지만 정확한 세포 및 분자 메커니즘에 대해서는 거의 알려져 없습니다. 신뢰할 수 있는 모델은 호스트와 병원체 사이 상세한 기계론상호를 조사하기 위하여 요구됩니다. 제브라피시 애벌레의 광학 선명도와 유전적 관성은 살아있는 호스트에서 여러 인간 세균 및 곰팡이 감염의 숙주 병원체 상호 작용을 연구하는 흥미로운 모델입니다. 이 프로토콜은 애벌레 제브라 피시 아스퍼질러스 감염 모델을 설명합니다. 첫째, 아스퍼길러스 포자는 마이크로 주입을 통해 제브라피시 뒷뇌 심실에 고립되고 주입됩니다. 이어서, 면역억제제와 같은 화학억제제는 애벌레물에 직접 첨가된다. 주입된 애벌레에서 감염을 모니터링하는 두 가지 방법이 설명되며, 콜로니 형성 유닛(CFU) 열거 및 2)를 위한 애벌레의 균질화(1)를 포함하였으며, 2) 반복적이고 매일 살아있는 이미징 설정을 한다. 전반적으로, 이러한 기술은 생체 내에서 아스퍼길러스 감염의 진행을 기계적으로 분석하는 데 사용될 수 있으며 호스트 병원체 상호 작용을 심문하기 위해 다른 숙주 배경 및 아스퍼길러스 균주에 적용 될 수 있습니다.
서문
아스퍼질러스 훈증은 유비쿼터스 사프로피틱 곰팡이이며, 공중 포자는 실내와 야외1모두에서 찾을 수 있습니다. 이 포자는 모든 사람에 의해 흡입되지만 면역 능력이있는 개인의 폐에서 효과적으로 지워집니다1,2. 그러나 낭포성 섬유증과 같은 변경된 폐 질환을 가진 사람들은 폐3의곰팡이 발아로 인한 기관지 폐 아스퍼질로증을 개발할 수 있다. 이 감염의 가장 가혹한 양식, 침략적인 aspergillosis (IA), 면역 손상한 개별에 영향을 미치고 그밖기관으로곰팡이의 성장을 관련시킵니다2,3. IA는 항곰팡이 치료의 가용성에도 불구하고 감염된 환자의 >50% 죽음으로 이어진다4. 면역 능력이 있는 개인에서, 타고난 면역 반응은 흡입한 포자를 지우는 데 중요한 역할을한다 1. 그러나, 이 타고난 면역 정리에 기여하는 특정 기계장치는 잘 이해되지 않습니다. IA에 대한 새로운 치료 전략을 찾기 위해 아스퍼길러스의 클리어런스에서 주요 선천성 면역 세포 (즉, 대식세포 및 호중구)의 세포 및 분자 메커니즘을 이해하는 것이 중요합니다.
포유류 모델은 곰팡이 독성 인자 및 숙주 면역 반응을 식별하는 데 중요한 역할을해 왔지만5,6,세포 수준에서 숙주 병원체 상호 작용에 대한 시각적 접근성이 제한됩니다. 조직 배양 실험은 전체 동물7에존재하는 복잡한 다세포 환경 및 상호 작용을 완전히 재구성할 수 없다. 따라서, 제브라피쉬는 이러한 격차를 메우고 다일 감염8,9에걸쳐 숙주-병원체 상호작용연구를 용이하게 하는 대체 모델 유기체로서 인기를 얻고 있다. 제브라피시 인제면역계는 24시간 후수정(hpf)10으로일찍 발전하며 적응계통은11을개발하는 데 4~6주가 걸리며, 선천적인 면역 반응을 격리하여 평가할 수 있는 시간의 창을 제공한다. 타고난 면역 반응은 인간과제브라피시(11)사이에서 잘 보존된다. Zebrafish는 광학 선명도(온전한 숙주의 고해상도 라이브 이미징허용) 및 유전적 학력(분자 기계학 연구를 용이하게 하는)을 포함하여 이러한 반응의 조사를 용이하게 하는 많은 자질을 가지고 있습니다.
여기에 설명된 애벌레 제브라피시 아스퍼질러스 감염 모델은 원래 녹스 외12에의해 개발되었다. 최근 우리 그룹 등에 의해 확장되어 호스트 면역기전(12,13,숙주-병원체 상호작용 13,14,15,면역억제13,16,17,곰팡이독성18,및 항곰팡이약 효능19,20)의메커니즘을조사하고 있다. 이 모델은 인간의 아스퍼질로증의 여러 측면을 재구성합니다. 면역능력유충은 저항력이 있지만 면역절충유충은감염 12,13,16,17에굴복할 수 있다.
본 모델에서, 국소화된 감염은 유충의 뒤폐신뇌 심실로 포자를 주입하여 확립되고, 식신구로 덜 채워진 부위, 그리고 식세포 모집 및 행동을 평가할 수 있다12,13. 대식세포는 인간1과 포유류 모델6,21에서 아스퍼길러스 포자에 대한 방어의 첫 번째 선 역할을 하는 것으로 여겨진다. 유사하게, 제브라피시 모델에서, 대식세포는 주입된 아스퍼질러스 포자로 모집되고, 호중구는 최면성장(12,13,22)에응하여 2차적으로 모집된다. 이 모델에서, 그것은 또한 아스퍼 질루스는 감염의 7 일 이상 후에 야생형 면역 무능한 애벌레에서 지속될 수 있다는 것을 배웠습니다. 더욱이, 감염의 전체 과정은 매일 공초점 화상 진찰에 의해 동일 살아있는 동물에서 따를 수 있습니다.
이 프로토콜은 2일 후 수정(2dpf) 애벌레의 뒤뇌 심실에 포자를 주입하는 미세주입 기법을 설명한다. 감염은 다음 최대 7 일 동안 모니터링, 제브라 피시 애벌레먹이 없이 최대 살 수 있습니다. 면역 억제는 약물 치료에 의해 유도될 수 있고, 유충에 약물의 적용도 설명된다. 마지막으로, 개별 애벌레로부터 의 CFU의 정량화와 매일 라이브 이미징 설정을 포함하여 감염 진행을 따르는 두 가지 방법이 설명된다.
프로토콜
연구원은 적절한 동물 관리 및 사용 위원회에서 모든 동물 실험에 대한 승인을 받아야합니다. 이 문서에 표시된 대표적인 데이터는 클렘슨 대학 기관 동물 관리 및 사용위원회 (AUP2018-070, AUP2019-012)에 의해 승인 된 프로토콜에 따라 수행 된 실험에서 입니다.
1. 주사를 위한 아스퍼길러스 포자의 준비
- 아스퍼길러스 포자 서스펜션에서 1 x 106 포자를 얻는 데 필요한 볼륨을 계산합니다. 부피는 20-100 μL이어야 합니다. 그렇지 않은 경우, 0.01 %(v /v) 멸균 Tween-20 (트위엔 워터)에서 10 배 희석을 생성; 재료의 표). 예를 들어 계산된 부피가 5μL인 경우 10배 희석을 생성하고 희석된 용액의 50 μL을 사용합니다.
참고: 두 개의 플레이트/스트레인은 오염시 더 많은 포자를 수집하거나 여분의 것으로 준비할 수 있습니다. - 1 x 106아스퍼질러스 포자를 하나의 포도당 최소 미디어(GMM) 플레이트(재료표)에확산하여 멸균 일회용 L자형 스프레더를 생물안전 캐비닛에 장착합니다. 접시의 여백으로 확산하지 마십시오. 3-4일 동안 37°C에서 배양하고 플레이트가 거꾸로 향합니다.
- 수집 당일에는 멸균 미라클로와 50mL 원뿔관(균주당 2개), 멸균 트위엔워터(균주당 1개), 멸균 일회용 L자 형 스프레더를 생물안전 캐비닛에 넣습니다.
참고 : 미라 클로스는 호일로 싸서 소독하기 위해 자동 적으로 - × 6으로 절단 할 수 있습니다. - 50mL 원뿔튜브에 미라클로 한 조각을 놓고 다시 한장. 나머지 미라클로스 패킷을 후드에서 꺼내라.
- 접시를 생물 안전 캐비닛에 넣습니다. 접시 한 개를 열고 상단에 트위엔 물을 부어 접시의 약 3 분기를 덮습니다.
- 일회용 L자형 스프레더를 사용하여 곰팡이 배양의 표면을 앞뒤로 긁어내고 다른 손으로 플레이트를 회전시합니다. 거의 모든 포자가 트위엔 워터로 균질화 될 때까지 긁어 냅니다.
참고: 높은 소수성으로 인해, 포자는 트위엔 물을 첨가하거나 긁는 동안 "퍼프"를 만들 수 있습니다. 인근 튜브 나 접시의 오염을 피하기 위해 세심한주의를 기울여야합니다. 장갑을 교체하고 다른 균주의 추출 사이에 70 %의 에탄올로 표면을 닦아하는 것이 좋습니다. - 50mL 원뿔튜브 를 하나 가지고 미라 천 조각을 제거합니다. 반으로 접어서 50mL 원물 튜브 의 상단에 삽입 된 필터로 만듭니다.
- 접시에서 곰팡이 균동호를 튜브에 붓습니다.
참고: 한 변형의 두 플레이트가 준비되면 두 판을 긁어 동일한 원뿔 튜브에 붓습니다. - 원물 튜브의 총 부피를 50mL로 가져오기 위해 트위엔 워터를 붓습니다.
- 900 x g에서 10 분 동안 회전하십시오. 원심분리기에서 에어로졸화 방지 캡을 사용해야 합니다.
- 오염제거를 위해 상체를 ~10% 표백액에 붓습니다. 멸균 1x PBS 50mL를 원내 튜브에 붓고, 소용돌이 또는 흔들어 펠릿을 다시 보냅니다.
- 900 x g에서 10분 동안 다시 회전합니다. 상체를 붓고 멸균 1x PBS의 5mL에서 펠릿을 다시 분리합니다. 신선한 미라클로를 걸러내고 신선한 50mL 원피스 튜브에 넣습니다.
- 1.7mL 원심분리관(예: 10x 용액의 경우, 곰팡이 균질 100 μL의 100 μL을 900 μL의 Tween-water로 혼합)에서 곰팡이 균성 균성(10배, 100x, 1000x)을 10배 연속 희석(10배, 1000x, 1000x)으로 만듭니다.
- 포자가 트위엔물로 배출될 때 포자가 보이지 않는 첫 번째 희석을 선택하고 이 희석을 사용하여 혈류계를 사용하여 포자의 수를 계산합니다.
- 다음 공식을 사용하여 준비된 곰팡이 균질(water suspension)에서 포자 농도를 계산합니다.
농도(포자/mL) = 중간 25박스 x 희석계수 x104의 포자 수 - 1.7 mL 마이크로 센심 분리기 튜브에 멸균 1x PBS로 1mL 스톡1.5 x 108 포자/mL을 준비합니다. 이 포자 제제는 ~4주 동안 4°C로 저장할 수 있다.
- 주사에 사용하기 전에, 1.7 mL 원심분리기 튜브에 10 μL의 10 μL과 포자 제제의 20 μL을 혼합하여 1 x 108 포자 /mL의 최종 포자 농도를 달성하십시오. 주입 하기 전에 소용돌이철에 철저 하 게.
참고: 1% 페놀 레드 솔루션은 필터 멸균 및 알리쿼트에 저장되어야 합니다. - 모의 주입의 경우 1x PBS의 20 μL과 1% 멸균 페놀 레드의 10 μL을 혼합합니다.
2. 주사를 위한 한천 판 준비
- E3 배지에 2% 아가로즈를 준비하고 전자레인지에 녹입니다.
- 100mm x 15mm 페트리 접시(접시당 ~25mL)에 붓고, 소용돌이치며 접시를 고르게 덮고 식힙니다.
- 접시를 파라핀 필름으로 감싸고 4°C에서 반전된 저장합니다.
- 주입 하기 전에, 실온 (RT)에 접시를 가지고.
- 필터 ~1mL를 소소 살부 알부민(BSA)을 접시에 붓고, 접시를 기울여 전체 바닥을 퍼뜨리고 덮고, E3로 헹구는다.
참고: 2% BSA 용액은 -20°C에서 1mL 알리쿼트로 필터 멸균 및 저장될 수 있으며, 2% BSA 전처리는 애벌레가 아가로즈 표면에 달라붙는 것을 방지한다. - 완충된 트리카인을 접시에 넣고 주입할 때까지 앉게 하십시오.
3. 제브라피시 애벌레 힌드뇌 심실 미세 주입
- 페트리 접시에 2dpf에서 집게와 함께 수동으로 경멸 유충.
참고: 점곡은 주사 시점까지 언제든지 1.5dpf까지 수행될 수 있다. - 페트리 접시에서 가능한 한 많은 E3를 제거하고 버퍼링된 300 μg/mL 트리카인을 E3에 추가하여 애벌레를 마취합니다.
참고: E3의 완충 된 4 mg / mL 트리카인의 재고 용액을 4 ° C에서 제조 및 저장할 수 있습니다. 작업 용액은 E3로 최대 50mL의 스톡 용액 4mL을 희석하여 만들 수 있습니다. - 압력 인젝터, 배압 장치, 풋 스위치, 마이크로 피펫 홀더, 마이크로 조작기 및 자기 스탠드 및 플레이트와 함께 제공되는 마이크로 주입 설정을 사용하여 압축 공기의 공급원(재료표)에연결됩니다.
- 압축 공기 밸브를 열고 마이크로 인젝터를 켭니다. 압력을 ~25 PSI로 설정하고 펄스 지속 시간을 60 ms로, 역압 유닛을 PSI로 설정합니다.
- 마이크로 로더 파이펫 팁(재료의 표)을사용하여 마이크로 주입 바늘을 적재하여 약 3-5 μL의 준비 된 PBS 또는 포자 현탁액을 페놀 레드로 로드합니다. 바늘을 미세 조작기 위에 장착합니다.
참고: 미세 주입 바늘은 이전에 설명된 대로 제조될 수 있다23. 미세 주입에 사용되는 스테레오 현미경은 미세 주입 바늘을 보정하는 눈 조각 망상이 있어야합니다. 망상은 단계 마이크로미터로 보정되어야하며, 망상 스케일 (μm)의 길이를 결정해야합니다. 바늘에서 배출되는 포자 현탁액 의 직경은 낙하와 겹치는 해시 (망막)의 수에 따라 측정됩니다. - 미세 조작기를 배치하여 바늘의 끝이 스테레오 현미경하에서 가장 낮은 배율로 볼 수 있도록 합니다. 4배 배율로 확대하여 바늘을 볼 수 있습니다.
- 날카로운 집게를 사용하여 바늘의 끝을 잘라냅니다. 주입 페달을 눌러 나오는 액적의 크기를 시각화합니다. 포자 서스펜션의 ~3 nL이 주입 될 때까지 다시 클리핑 유지 (여기, 이것은 다섯 해시입니다).
- 유충이 주사 판에 배열되는 동안 실수로 바늘에 부딪히는 것을 피하기 위해 마이크로 조작기와 바늘을 이동합니다.
- 주입 플레이트에서 E3-트리카인을 붓고, 전이 파이프를 사용하여 가능한 E3로 주사 판으로 ~24 마취 유충을 전달합니다.
- 제브라피시 애벌레(예: 헤어 루프 도구 또는 속눈썹 도구)를 조작하기 위한 작은 도구를 사용하여 애벌레가 직면하고 있는 방향에 따라 애벌레를 정렬합니다. 특히, 모든 한 줄로 오른쪽에 배치하고, 모든 아래 행에 왼쪽을 향하고있다.
참고 : 애벌레가 장소에서 "떠"로 접시에 너무 많은 액체가있는 경우이 배열은 어렵습니다. 그러나, 너무 작은 액체는 또한 주사가 오래 걸리는 경우에 문제가 있습니다, 애벌레가 건조하거나 마취가 떨어져 마모할 수 있기 때문에. 따라서, 주의 깊게주의전체 미세 주입 과정을 통해 접시에 액체의 양에 지불해야한다. - 현미경 줌을 가장 낮은 배율로 조정합니다. 마이크로 조작기를 다시 가져와서 바늘이 관의 중간에 ~ 30°-60° 각도로 애벌레에 가까울 수 있도록 정렬합니다.
- 가장 높은 배율로 확대하고 미세 조정 노브를 사용하여 바늘의 위치를 더욱 조정하십시오. 포자 현탁액을 애벌레 옆의 접시에 액체에 주입하여 바늘에서 ~30-70 포자가 나오는지 확인하십시오. 필요한 경우 주입 설정에 시간과 압력을 조정합니다.
참고: 바늘에서 나오는 포자의 수가 시간이 지남에 따라 증가하거나 감소 할 수 있기 때문에이 테스트는 매 5 ~ 6 개의 애벌레 후에 반복되어야합니다. - 애벌레가 바늘을 향해 향하는 행으로 시작하여, 바늘이 바로 위에 있고 첫 번째 애벌레 근처에 위치되도록 접시를 이동합니다.
- 마이크로 조작기로 바늘을 이동, 뒤늦은 뇌 심실로 관통하는 오정 소포 주위의 조직을 통해 바늘을 삽입. 바늘의 각도로 애벌레의 올바른 방향을 얻기 위해 필요에 따라 다른 손으로 접시를 이동합니다.
- 육안으로 바늘의 끝이 뒷뇌 심실의 중심에 있는지 확인하고 발 페달을 눌러 포자를 주입하고 바늘을 부드럽게 철회하십시오.
참고: 페놀 레드 염료는 주로 뇌심실 내에 있어야 합니다. 소량은 중뇌로 들어갈 수 있지만 뇌나 뇌 바깥쪽에 도달해서는 안됩니다. 이 경우 주입되는 부피가 너무 크고 압력에 따라 압력과 시간을 줄이거나 새로운 바늘을 보정해야합니다. - 접시 아래로 이동, 그 행에 모든 애벌레를 주입. 그런 다음 접시를 돌리고 다른 행에 모든 애벌레를 주입합니다.
참고: 성공적으로 주입되거나 실수로 손상된 애벌레는 1) 노른자에 두 번 주입하여 빨간색 마크를 만들거나 2) 바늘로 행에서 애벌레를 끌어낼 수 있습니다. - 바늘을 다시 위아래로 움직입니다. 현미경의 낮은 배율로 축소합니다. 페놀 붉은 염료는 여전히 각 애벌레의 뒷뇌에서 볼 수 있어야합니다.
- 첫째, 헤어 루프 도구와 파이펫으로 당겨 서 실패 한 주사와 애벌레를 처분하십시오. 신선한 멸균 E3와 전송 파이프와 접시에서 씻어 새로운 페트리 접시에 나머지 애벌레를 전송합니다.
- 원하는 최종 실험 샘플 번호에 필요에 따라 반복합니다.
- E3로 적어도 2배의 애벌레를 헹구고 마취로부터 의회복을 보장합니다.
- 더 이상의 치료 없이 생존을 정량화하기 위해, 전송 파이펫을 사용하여, E3에서 96 웰 플레이트 (우물 당 1 애벌레)로 유충을 전송한다.
4. 주입 및 실행 가능한 포자 번호의 설립
- 주입 직후, 이송 파이펫을 사용하여, 무작위로 주입 된 애벌레의 약 8을 선택하고 1.7 mL 원심 분리 튜브 (튜브 당 하나의 애벌레)로 전송합니다.
- 트리카인으로 유충을 안락사하거나 0.5-2.0 h에 대한 4 °C에 배치하여 유충을 억제합니다.
- 멸균 1x PBS에서 1 mg/mL 암피실린 및 0.5 mg/mL 카나마이신 항생제 용액의 1mL을 준비하십시오. 남은 용액은 4°C에 저장되고 나중에 사용할 수 있습니다.
참고: 100 mg/mL 및 카나마이신 50 mg/mL에서 암피실린의 스톡 용액은 -20°C에서 미리 제조, 필터 멸균 및 알리쿼트에 저장될 수 있다. 작동 솔루션을 얻기 위해 1x PBS에서 이러한 100배를 희석합니다. - 파이펫을 사용하여 원심분리기 튜브에서 가능한 한 많은 액체를 제거하고 애벌레를 뒤로 하고 항생제로 1x PBS의 90 μL을 추가합니다.
참고: 항생제는 아스퍼 질러스 식민지의 계산을 방해할 수 있는 GMM 플레이트에 있는 세균성 성장을 방지하기 위하여 이용됩니다. - 1,800 μm/분(30Hz)에서 6분 동안 조직 용액으로 유충을 균질화합니다. 30 s에 대한 17,000 x g에서 아래로 회전.
- 라벨 GMM 플레이트 (균질화 유충 당 하나의 플레이트). 분젠 버너를 사용하여 멸균 환경을 조성한 후, 한 튜브에서 GMM 플레이트 의 중간까지 균질화 된 서스펜션을 피펫한 다음 일회용 L 자형 스프레더를 사용하여 확산시다. 테두리에 동종모를 퍼뜨리지 마십시오.
- 플레이트를 37°C에서 2-3일 동안 거꾸로 배양하고 형성된 콜로니(CFU)의 수를 계산한다.
- 감염 기간 동안 살아있는 포자의 수를 측정하려면, 1-7 일 사후 주입 (dpi)에서 96 우물 플레이트에서 애벌레를 선택하고 원심 분리 튜브로 전송합니다. 4.1-4.5 단계에 설명된 바와 같이 유충을 GMM 플레이트에 퍼지도록 안락사및 균질화한다.
5. 주입 된 애벌레의 약물 치료
- 섹션 4 후, 나머지 주입 유충을 두 개의 3.5 mm 접시로 분할: 약물 치료를 위한 하나 및 대조군을 위한 하나. 조건 당 약 24 감염된 애벌레를 사용하십시오.
참고: 3.5mm 의 요리는 물에 2 % 무지방 건조 우유로 처리 할 수 있습니다, 헹구고, 공기 건조, 사전에 RT에 저장. 우유코팅은 유충이 플라스틱에 달라붙는 것을 방지합니다. - 필요한 최종 농도에 따라 원문 튜브에 메틸렌 블루없이 원하는 약물 용액과 차량을 E3에서 준비한 다음 잘 섞는다. 예를 들어, 덱사메타손에 노출된 애벌레의 생존을 모니터링하려면 덱사메타손에 대해 24개의 애벌레(복제)와 DMSO와 같은 차량 제어를 위해 24개의 애벌레(복제)를 사용한다. 필요한 농도로 약물 용액의 5mL를 준비합니다. 여기서, 0.1% DMSO 및 10 μM 덱사메타손의 5mL가 사용되었고, 24개의 애벌레/조건이 차량/약물 용액/유충의 ~200 μL로 옮겨졌다.
- 이송 파이펫으로 한 접시에서 가능한 한 많은 액체를 제거하고 차량 제어가 포함된 미리 혼합된 E3를 추가합니다. 다른 요리에 대한 관심의 치료를 포함하는 미리 혼합 된 E3로 반복하십시오.
- 파이펫을 사용하여 애벌레를 96 개의 우물 플레이트 (우물 당 1 개의 애벌레)로 옮습니다. 7 일 동안 차량 이나 약물에 노출 된 주입 된 애벌레의 생존을 모니터링 합니다.
참고: 약물은 감염 당일에만 적용될 수 있으며 전체 실험을 위해 애벌레에 보관하거나 매일 새로 고칠 수 있습니다.
6. 제브라피시 상처 및 혈관 제거 장치를 사용하여 감염된 애벌레의 매일 이미징 (zWEDGI)
- 애벌레가 색소 침착을 방지하기 위해 24hpf에서 100 μM N-페닐티오레아 (PTU)로 처리되고 PTU가 전체 실험을 위해 애벌레에 보관되도록하십시오.
참고: 75-100 μM에서 PTU는 심각한 발달결함(24)없이유충의 색소 침착을 방지한다. 그러나, PTU는 몇몇 생물학 프로세스를 방해할 수 있습니다25,연구원은 약이 조사중인 어떤 프로세스든지에 영향을 미칠 수 있는지 여부를 미리 결정해야 합니다. - 섹션 3에 설명된 바와 같이 형광 성 단백질을 발현하도록 설계된 Aspergillus 포자를 사용하여 2 dpf에서 관심있는 표시 된 세포 인구로 형질성 유충을 감염하십시오. 그런 다음 감염된 유충을 메틸렌 블루없이 약 500 μL /웰의 E3에서 48 개의 우물로 옮기합니다.
참고: 48 웰 플레이트는 반복된 매일 이미징 중에 애벌레를 안팎으로 옮기는 것이 더 쉽기 때문에 여기에서 사용됩니다. - 이미징 당일에는 3.5mm 페트리 요리 2개를 준비합니다: 100 μM PTU와 E3-트리카인이 있는 요리.
- zWEDGI장치(26,27)의챔버에 E3-트리카인을 추가한다. 스테레오 현미경의 밑에, P100 마이크로피펫을 사용하여 챔버 및 억제 채널에서 기포를 제거합니다. 모든 초과 E3-트리카인을 제거, 그래서 그것은 챔버에서만.
- 피펫은 전송 파이펫을 사용하여 접시에서 하나의 애벌레를 피펫. 액체를 많이 제거하는 데 사용되는 경우, 파이펫은 E3-PTU를 포함하는 3.5mm 접시에 넣습니다. 그런 다음 가능한 한 적은 액체를 사용하여 다시 파이펫을 하고 E3-트리카인으로 옮습니다.
- ~30초의 마취를 기다린 다음 상처 및 함정 장치의 적재챔버로 옮긴다(예: zWEDGI).
- 스테레오 현미경의 밑에, 애벌레를 놓습니다. P100 마이크로피펫을 사용하여 상처있는 챔버에서 E3-트리베인을 제거하고 로딩 챔버로 방출하여 애벌레의 꼬리를 제한 채널로 이동시다. 후뇌가 반전된 객관적렌즈로 이미지화될 수 있도록 유충이 측면, 등쪽 또는 등쪽 측면에 배치되어 있는지 확인합니다.
- 공초점 현미경을 가진 심상 애벌레.
- 이미징 후, P100 파이펫으로, 감속 챔버에 E3-트리베인을 방출하여 제지 채널에서 애벌레를 로딩 챔버로 밀어 넣습니다.
- 이송 파이펫을 사용하여 애벌레를 집어 들고 E3-트리케인으로 페트리 접시로 다시 옮킨다. 가능한 한 적은 액체를 사용하여 E3-PTU로 페트리 접시에 옮깁니다. PTU에서 헹구고 48 웰 플레이트로 다시 옮깁니다.
결과
제브라피시 유충의 뒷뇌로 아스퍼질러스 포자를 미세 주입한 후, 감염 결과는 생존, CFU 및 라이브 이미징을 포함한 여러 가지 해석을 따를 수 있습니다. 생존 분석에서, 1-7 dpi생존하는 감염된 애벌레의 수를 감시했다. 야생형 애벌레가 치료되지 않은 상태로 방치되었을 때, 극히 작은 사망이 관찰되었고, -80%-100%의 애벌레가 실험 전체를살아남았다(도 1). 유충이 코르티코스테로이드 약물 덱사메타손(10 μM)에 노출되는 등 면역억제된 경우, 생존율이 현저히 감소하였다(도1).
CfU가 A. fumigatus 포자에 감염된 야생형 애벌레로부터 7일 간의 실험을 통해 정량화되었을 때, 포자의 지속성이 관찰되었고, 시간이 지남에 따라 느린 간격으로 관찰하였다(그림2A). 1, 2, 3, 5 및 7 dpi에서 생존하는 포자의 수는 복제에 걸쳐 지속성과 클리어런스를 비교하여 0 dpi에 주입된 포자의 수로 정규화되었다(그림2B).
형광 단백질을 표현하는 아스퍼길러스 포자와 함께 백혈구에서 형광 단백질을 발현하는 트랜스제닉 어항은 백혈구 모집 및 행동뿐만 아니라 곰팡이 발아 및 성장13을시각화하는 데 사용될 수 있다. 대식세포가 표지되었을 때(예를 들어,Tg(mpeg1:H2B-GFP)),유충의 ~50%에서 대식파지 클러스터링은 전형적으로 관찰되었고, 2-3 dpi(그림3A)에서시작했다. 호중구(Tg(lyz:BFP))모집은 전형적으로 지연되었고, 곰팡이 발아가 발생한 후 주로 발생하였다(그림3A). 곰팡이 부담은 애벌레의 대부분(도 3A)에서전체 실험에 대한 지속되었지만, 클리어런스가 관찰되었다(도 3B). 일부 유충에서는, 뒤늦은 두뇌의 외부 곰팡이 부담은 또한 대식세포에서 확률이 높은 곰팡이 보급 때문에 감염에서 나중에 관찰되었습니다.
오틱 소포 주변 지역은 이 보급이 발견될 수 있는 한 가지 가능한위치(도 3C)이다. 이러한 관찰은 전체실험(도 4)의과정을 통해 다중 개별 애벌레에서 정량화되었다. 전형적으로, 발아는 애벌레의 ~60%에서 5dpi(도4A)로보였다. 식구 체 클러스터 영역, 대식세포 모집 및 호중구 모집은 시간이 지남에 따라 유충에 따라 다양하며, 실험 전반에 걸쳐 일부 추세가 증가하고 시간이 지남에 따라 일부 해결(그림 4B, C, D).
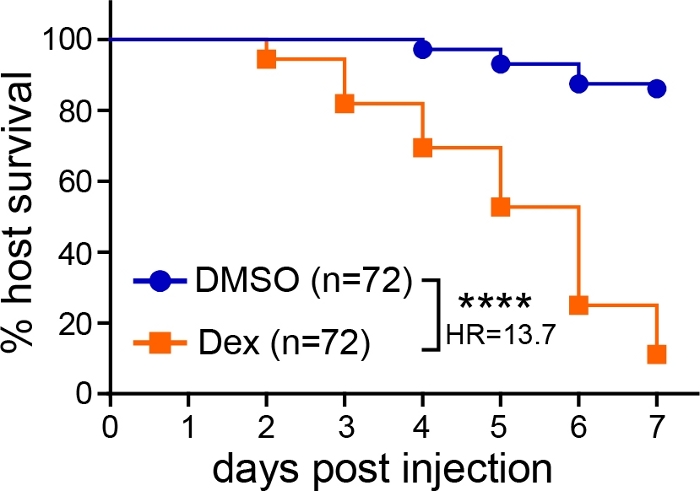
그림 1: 감염된 애벌레의 대표적인 생존 분석. 아스퍼길러스-감염된애벌레는 차량 제어(DMSO) 또는 덱사메타손(Dex)에 노출되었고, 생존을 모니터링하였다. 데이터는 풀로 된 세 복제를 나타냅니다. 평균 주입 CFU: DMSO = 30, 덱스 = 29 (p 값 및 위험 비율은 콕스 비례 위험 회귀 분석에 의해 계산되었다, ****p < 0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
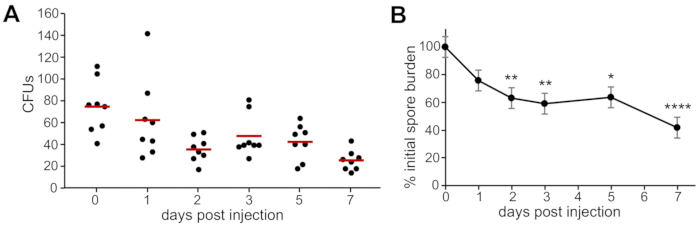
그림 2: 대표적인 CFU는 주입 직후와 감염 과정(2, 3, 5 및 7 dpi) 중 개별 감염된 애벌레에서 계산됩니다. 감염된 8개의 애벌레는 각 정시에 대해 CFU를 계산하고 복제하기 위해 균질화되고 도금되었다. (A)하나의 복제본의 예제 데이터. 각 점은 하나의 애벌레를 나타내며 막대는 각 시간점에 대한 수단을 나타냅니다. (B)CFU 카운트는 각 복제에 대해 0 dpi로 CFU 카운트로 정규화되었고, 세 개의 복제가 풀로 처리되었다. 데이터는 분산 분석을 사용하여 실험 조건 간에 비교되었으며 예상 한계 수단 및 표준 오류 측면에서 요약되었습니다. Asterix는 0 dpi에서 CFU에 비해 통계적 유의를 나타냅니다 (*p < 0.05, **p < 0.01, ****p < 0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
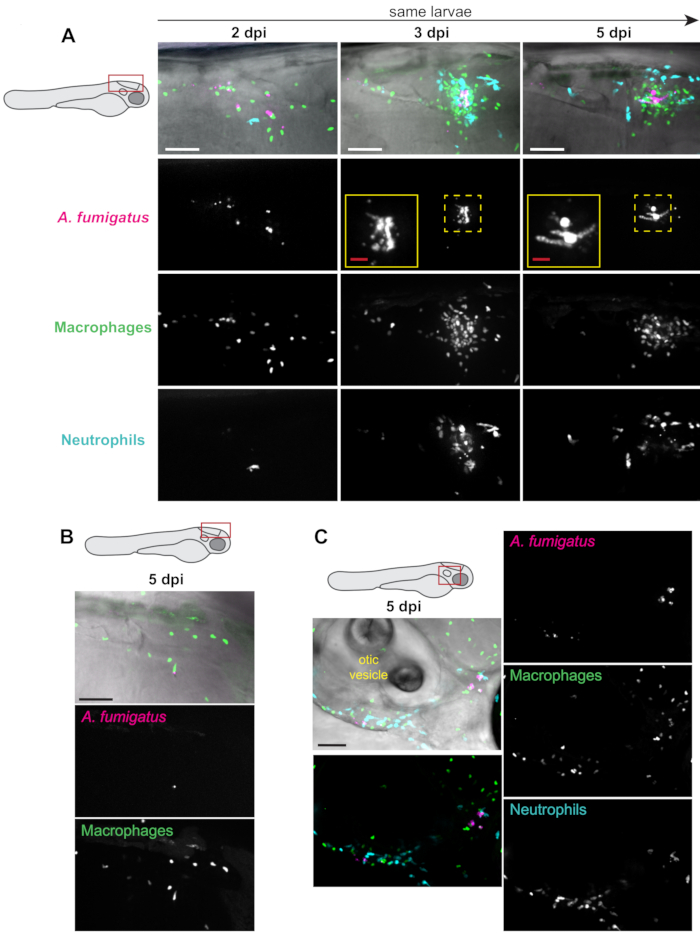
그림 3: 감염 실험의 대표적인 이미지입니다. 형광 대식세포(mpeg1:H2B-GFP) 및 호중구(lyz:BFP)를 가진 PTU 처리 애벌레는 RFP 발현 A. fumigatus로주입되었다. 살아있는, 감염된 애벌레는 공초점 현미경에 2, 3 및 5 dpi에서 반복적으로 심화되었다. 최대 강도 Z 프로젝션 이미지가 표시됩니다. 애벌레의 회로도는 각 패널에 대한 이미징의 위치를 나타냅니다. 모든 스케일 바는 25 μm인 인셋 스케일 바를 제외하고 100 μm을 나타내며(A)표시된 이미지는 일반적인 감염 진행을 나타내는 2, 3 및 5 dpi에서 찍은 단일 애벌레로부터 이다. Inset은 3일과 5일에 곰팡이 발아를 보여줍니다. (B)5 dpi에서 낮은 곰팡이 부담과 많은 염증으로 감염을 지울 수있는 애벌레의 부분 집합의 대표적인 이미지. (C)감염이 후기 시점에서 뒤늦게 뇌에서 전파되는 애벌레의 부분 집합의 대표적인 이미지. 이 이미지에서는 곰팡이, 대식세포 및 호중구가 오틱 소포 의 전후에 발견 될 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
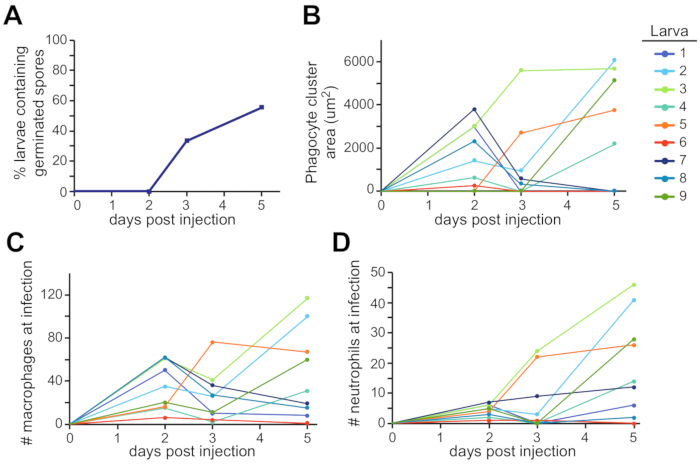
그림 4: 이미징 실험의 대표적인 정량화. 그림 3의 실험 용 설정에서 이미지는 곰팡이 발아 및 백혈구 모집을 위해 분석되었습니다. (A)애벌레는 매일 발아 포자의 존재에 대해 득점되었고, 발아를 가진 애벌레의 백분율을 계산하였다. (B, C, D) 각 개별 애벌레는 다른 색상 선으로 표현됩니다. 식구체 클러스터 외관 및 크기(B), 대식세포 모집(C), 호중구 모집(D)은 각 애벌레에 대한 5일 간의 실험을 통해 뒤따랐다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기서 설명된 감염 모델은 숙주 면역 반응, 숙주 병원체 상호 작용 및곰팡이 병원성(12,13,14,15)을분석하는 데 유익하다. 이 정보는 시간이 지남에 따라 형광 표지 병원체 및 숙주 세포13,애벌레 생존 및 CFU 지속성의 고해상도 이미징에서 파생될 수 있다.
미세 주입 기술은 이 프로토콜의 성공에 매우 중요하며 다른 미세 주입 장비 및 설정을 사용할 때 조정해야 할 수도 있습니다. 특히, 주사의 압력과 시간은 2개의 주요 변수이며 바늘에 의해 배출되는 부피가 ~3nL인지 확인하기 위해 조절될 수 있다. 포셉으로 클리핑하여 결정된 바늘의 크기는 또한 주입되는 포자의 수를 조절합니다; 비록, 더 큰 개구부 애벌레에 조직 손상을 일으킬 수 있습니다. 한편, 개구부의 너무 작은 것은 상대적으로 큰 포자 (>2 μm)를 허용하지 않으며 바늘 막힘으로 이어질 수 있습니다. 이 경우, 바늘은 약간 더 큰 개구부를 가지고 리클링 될 수있다.
박테리아의 미세 주입을 위한 그밖 프로토콜은 균질한 주입 혼합물을 유지하는 것을 돕기 위하여 PVP-40를 이용합니다, 그러나 우리는 Aspergillus 포자를 가진 이 담체를 사용하는 어떤 이점을 찾아낸지 않았습니다. 바늘의 막히는 바늘을 적재하기 전에 덩어리를 부러뜨리기 위해 곰팡이 제제를 철저히 피류하여 완화 될 수 있습니다. 때때로, 바늘의 막신은 또한 일시적으로 압력 또는 주입 시간을 증가시키고 바늘이 애벌레를 둘러싼 액체에있는 동안 마이크로 인젝터를 트리거하여 빠질 수 있습니다. 압력 및 주입 시간은 다음 이전 수준으로 다시 감소 한다. 다른 경우에는 나막신을 제거할 수 없으며 새 바늘을 적재하고 재보정해야 합니다.
이 프로토콜은 애벌레 당 ~ 30-70 포자를 주입하도록 설계되었습니다. 포자 제제의 농도와 주입된 부피의 농도에 기초하여, 이 숫자는 매우 낮은 것으로 알려져 있다. 그러나, 그것은 경험적으로 이 조건의 밑에 주입된 포자의 수이다는 것을 것을을 발견되었습니다. 왜 이 다름이 생기는지는 알려지지 않았지만, 바늘에 포자 덩어리 때문일 수 있다. 포자의 더 많은 수를 주입하는 우리 자신의 시도는 크게 성공하지 못했습니다.
약 30-70 포자가 주입되고 모든 애벌레 에 걸쳐 주사의 일관성을 유지하기 위해 애벌레를 둘러싼 E3에 주입하여 포자의 수를 확인하십시오. 모든 주사를 통해 5 ~ 6 개의 애벌레마다이 반복. 포자 수가 변화하는 것처럼 보이면 압력 및/또는 주입 시간을 조정하여 여러 애벌레에 걸쳐 일관된 수의 포자를 주입할 수 있습니다. 그러나, 주사 복용량은 주로 뒤뇌에 남아 하 고 중 뇌와 전뇌를 채우지 않는 주의 해야 한다.
국소화된 감염을 보장하기 위하여는, 포자 현탁액은 뒤늦은 두뇌 심실 안에 포함되어야 합니다. 이것은 주사 직후 페놀 레드 염색에 의해 시각화 될 수 있지만 빨간색색상은 시간이 지남에 따라 확산됩니다. 주사의 경우, 오틱 소포 주변의 영역은 45°-65° 각도로 심실을 관통하고 도달하는 데 사용됩니다. 이 지역에는 주요 혈관이 없고, 조직 손상이 적으며, 즉시 치유됩니다. 심실 위에 피부가 관통되는 경우, 아스퍼질러스 포자 주사에 사용해야 하는 바늘이 세균 현탁액에 사용되는 것보다 크기 때문에 포자 현탁액이 유출될 수 있다. 성공적으로 주입하거나 실수로 손상된 애벌레는 노른자에 빨간색 마크를 만들거나 바늘로 행에서 애벌레를 드래그하여 몇 번 주입하여 표시 할 수 있습니다. 주사 세트가 완료되면, 이 애벌레는 제거하고 나머지는 접시에서 세척되기 전에 폐기해야합니다. 메틸렌 블루가 없는 E3는 주사 전에 애벌레를 마취시키고 주사 후 유충을 유지하는 데 사용되며, 메틸렌 블루는 항곰팡이이기 때문이다.
주사 시 CFU 카운트는 감염된 호스트 내에서 실행 가능한 포자의 수를 나타냅니다. 그러나, 포자가 최해에 발아하는 경우에, 이들은 균질화 도중 별개의 실행 가능한 "곰팡이 단위"로 분해될 수 있고 다중 식민지를 초래할 수 있습니다. 또는, 끊어지지 않는 다세포 하이파는 단일 식민지를 초래할 수 있으며, 그 결과 평균적, 그러나 부정확한 곰팡이 부담을 표현합니다. 이것은 주입된 포자의 운명의 시각적 데이터를 제공하는 개별 애벌레의 세로 현미경 검사법과 CFU 수를 결합하여 완화될 수 있습니다.
포유류 시스템에 비해, 제브라피시 유충 감염 모델은 광학 접근성 때문에 특히 중요합니다. 타고난 면역 세포의 모집 및 반응은 살아있는 그대로 호스트 내에서 시각화 될 수있다. 이것은 각 표적이 살아있는 동물에 있는 Aspergillus 포자에 대하여 대식세포 또는 호중구 반응에 어떻게 영향을 미치는지 분석하기 위하여 분자 표적의 유전 또는 화학적인 억제와 통합될 수 있습니다.
제브라피쉬애벌레 아스퍼질러스 감염 모델은 IA12,13,14, 15,16,17,18,19,20,22의상이한 측면을 설명하는 데 중요한 역할을 하고 있지만, 다른 확장 영역이 있다. 숙주 측에서, 세포 수준 면역 반응을 설명하는 데 사용되지만, 이것은 표적 모르폴리노, CRISPR, 안정적인 돌연변이 라인, 또는 화학 적 노출과 결합하여 분자 수준에서 면역 메커니즘을 분석하기 위해 확장 될 수있다. 한 가지 주의해야 할 점은 알려진 모든 포유류 선천적 면역 경로 구성 요소에 대한 동형구가 제브라피시에서 확인되지 않았다는 것입니다.
병원체 측에서, 다른 종및 긴장의 독성이 기술되었습니다. 미래 연구의 유망한 방법은 특정 유전자 또는 단백질이 독성 요인으로 기여하는 방법을 테스트하기 위해 돌연변이 아스퍼질러스 균주의 사용입니다. 따라서, 새로운 항곰팡이 약은 이 단백질을 표적으로 하기 위하여 개발될 수 있습니다. 현재 항진균제는 인체 환자에서 효능이 낮으며곰팡이(28)에서이러한 약물에 대한 내성이 증가하고 있다. 이 생체 내 모델은 이러한 약물이 실패하는 이유를 조사하고 새로운 항 곰팡이 약물의 효능을 테스트하는 중간 모델로 사용될 수 있습니다. 전반적으로,이 모델을 사용하여 발견 된 사실 인정은 Aspergillus-감염된 환자를 위한 효과적인 처리의 미래 발달을 촉진할 수 있습니다.
공개
공개할 충돌이나 재정적 이해관계가 없습니다.
감사의 말
이 작품은 수상 번호 K22AI134677에 따라 건강의 국립 연구소의 알레르기 및 전염병의 국립 연구소에 의해 지원되었다. 이 내용은 전적으로 저자의 책임이며 반드시 국립 보건원의 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| Dumont forceps #5 | Roboz Surgical Instrument Co. | RS-5045 | |
| Eyepiece reticle | Microscope World | RETR10 | For calibrating needles, used in Stereomicroscope |
| Microinjector setup: Back pressure unit | Applied Scientific Instrumentation | BPU | |
| Footswitch | Applied Scientific Instrumentation | FTSW | |
| Micro pipet holder kit | Applied Scientific Instrumentation | M-Pip | |
| Pressure injector | Applied Scientific Instrumentation | MPPI-3 | |
| Micromanipulator setup: Micromanipulator | Narashige (Tritech) | M-152 | |
| Magnetic stand and plate | Tritech | MINJ-HBMB | |
| Needle puller | Sutter Instrument | P-97 | |
| Stereomicroscope | Nikon | SMZ-745 | |
| Tissuelyser II | Qiagen | 85300 | To homogenize larvae |
| Material | Company | Catalog Number | Comments/Description |
| Agarose | Fisher | BP160-500 | |
| Ampicillin sodium salt | Fisher | AAJ6380706 | |
| BSA, fraction V | VWR | AAJ65855-22 | |
| Kanamycin sulfate | Fisher | AAJ1792406 | |
| L spreaders | Fisher | 14 665 230 | |
| Microcapillary needles (no filament) | World Precision Instruments (WPI) | TW100-3 | |
| Microloader pipet tips | VWR | 89009-310 | To load the needle with Aspergillus suspension |
| Miracloth | VWR | EM475855-1R | To filter Aspergillus suspension |
| N-phenylthiourea | Fisher | AAL0669009 | To prevent pigmentation |
| Phenol red, 1% solution | Fisher | 57254 | |
| Tricaine (Ethyl 3-aminobenzoate, methanesulfonic acid salt) | Fisher | AC118000500 | To anesthetize larvae |
| Tween-20 | Fisher | BP337-500 | |
| Media and Solutions | Components/Recipe | ||
| E3 media: 60x E3 | 17.2 g NaCl, 0.76 g KCl, 2.9 g CaCl2, 4.9 g MgSO4 · 7H2O, to 1 L with H2O | ||
| 1x E3 | 16.7 ml 60x stock, 430 ul 0.05 M NaOH, to 1 L with H2O (optional: + 3 ml 0.01% methylene blue) | ||
| Tricaine stock solution | 2 g Tricaine, 5 g Na2HPO4 · 7H2O, 4.2 ml 60X E3, to 500 ml with H2O, pH to 7.0-7.5 with NaOH | ||
| Glucose minimal media (GMM) agar: GMM agar | 10 g Glucose (Dextrose), 50 ml 20x Nitrate salts, 1 ml TE, to 1 L with H2O, pH to 6.5 with NaOH, + 16 g Agar, autoclave | ||
| 20x Nitrate salts | 120 g NaNO3, 10.4 g KCl, 10.4 g, MgSO4 · 7H2O, 30.4 g, KH2PO4, to 1 L with H2O, autoclave | ||
| Trace elements (TE) | 2.20 g ZnSO4 · 7H2O, 1.10 g H3BO3, 0.50 g MnCl2 · 4H2O, 0.16 g FeSO4 · 7H2O, 0.16 g CoCl2 · 6H2O, 0.16 g CuSO4 · 5H2O, 0.11 g (NH4)6Mo7O24 · 4H2O, 5.00 g Na2EDTA, to 100 ml with H2O, dissolve stirring overnight, autoclave |
참고문헌
- Latge, J. P. Aspergillus fumigatus and aspergillosis. Clinical Microbiology Reviews. 12 (2), 310-350 (1999).
- Denning, D. W. Invasive aspergillosis. Clinical Infectious Diseases. 26 (4), 781-803 (1998).
- Dagenais, T. R., Keller, N. P. Pathogenesis of Aspergillus fumigatus in Invasive Aspergillosis. Clinical Microbiology Reviews. 22 (3), 447-465 (2009).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: systematic review of the literature. Clinical Infectious Diseases. 32 (3), 358-366 (2001).
- Mirkov, I., Popov, A., Lazovic, B., Glamoclija, J., Kataranovski, M. Usefulness of animal models of aspergillosis in studying immunity against Aspergillus infections. Journal de Mycologie Médicale. 29 (1), 84-96 (2019).
- Schaffner, A., Douglas, H., Braude, A. Selective protection against conidia by mononuclear and against mycelia by polymorphonuclear phagocytes in resistance to Aspergillus. Observations on these two lines of defense in vivo and in vitro with human and mouse phagocytes. Journal of Clinical Investigation. 69 (3), 617-631 (1982).
- Behnsen, J., et al. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathogens. 3 (2), 13 (2007).
- Torraca, V., Mostowy, S. Zebrafish Infection: From Pathogenesis to Cell Biology. Trends in Cell Biology. 28 (2), 143-156 (2018).
- Rosowski, E. E., et al. The Zebrafish as a Model Host for Invasive Fungal Infections. Journal of Fungi. 4 (4), (2018).
- Herbomel, P., Thisse, B., Thisse, C. Ontogeny and behaviour of early macrophages in the zebrafish embryo. Development. 126 (17), 3735-3745 (1999).
- Traver, D., et al. The Zebrafish as a Model Organism to Study Development of the Immune System. Advances in Immunology. 81, 254-330 (2003).
- Knox, B. P., et al. Distinct innate immune phagocyte responses to Aspergillus fumigatus conidia and hyphae in zebrafish larvae. Eukaryotic Cell. 13 (10), 1266-1277 (2014).
- Rosowski, E. E., et al. Macrophages inhibit Aspergillus fumigatus germination and neutrophil-mediated fungal killing. PLoS Pathogens. 14 (8), 1007229 (2018).
- Koch, B. E. V., Hajdamowicz, N. H., Lagendijk, E., Ram, A. F. J., Meijer, A. H. Aspergillus fumigatus establishes infection in zebrafish by germination of phagocytized conidia, while Aspergillus niger relies on extracellular germination. Scientific Reports. 9 (1), 12791 (2019).
- Pazhakh, V., Ellett, F., Croker, B. A. beta-glucan-dependent shuttling of conidia from neutrophils to macrophages occurs during fungal infection establishment. PLoS Biology. 17 (9), 3000113 (2019).
- Herbst, S., et al. Phagocytosis-dependent activation of a TLR9-BTK-calcineurin-NFAT pathway co-ordinates innate immunity to Aspergillus fumigatus. EMBO Molecular Medicine. 7 (3), 240-258 (2015).
- Shah, A., et al. Calcineurin Orchestrates Lateral Transfer of Aspergillus fumigatus during Macrophage Cell Death. American Journal of Respiratory and Critical Care Medicine. 194 (9), 1127-1139 (2016).
- Jain, S., et al. Selenate sensitivity of a laeA mutant is restored by overexpression of the bZIP protein MetR in Aspergillus fumigatus. Fungal Genetics and Biology. 117, 1-10 (2018).
- Jones, C. N., et al. Bifunctional Small Molecules Enhance Neutrophil Activities Against Aspergillus fumigatus in vivo and in vitro. Frontiers in Immunology. 10, 644 (2019).
- Rosowski, E. E., He, J., Huisken, J., Keller, N. P., Huttenlocher, A. Efficacy of voriconazole against A. fumigatus infection depends on host immune function. Antimicrobial Agents and Chemotherapy. , 00917-00919 (2019).
- Herbst, S., et al. A new and clinically relevant murine model of solid-organ transplant aspergillosis. Disease Models and Mechanisms. 6 (3), 643-651 (2013).
- Knox, B. P., Huttenlocher, A., Keller, N. P. Real-time visualization of immune cell clearance of Aspergillus fumigatus spores and hyphae. Fungal Genetics and Biology. 105, 52-54 (2017).
- Harvie, E. A., Huttenlocher, A. Non-invasive Imaging of the Innate Immune Response in a Zebrafish Larval Model of Streptococcus iniae Infection. Journal of Visualized Experiments. (98), e52788 (2015).
- Karlsson, J., von Hofsten, J., Olsson, P. E. Generating transparent zebrafish: a refined method to improve detection of gene expression during embryonic development. Marine Biotechnology. 3 (6), 522-527 (2001).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Huemer, K., et al. zWEDGI: Wounding and Entrapment Device for Imaging Live Zebrafish Larvae. Zebrafish. 14 (1), 42-50 (2017).
- Huemer, K., et al. Long-term Live Imaging Device for Improved Experimental Manipulation of Zebrafish Larvae. Journal of Visualized Experiments. (128), e56340 (2017).
- Perlin, D. S., Shor, E., Zhao, Y. Update on Antifungal Drug Resistance. Current Clinical Microbiology Reports. 2 (2), 84-95 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유