Method Article
Infecção de larvas de zebrafish com esporos de Aspergillus para análise de interações hospedeiro-patógeno
Neste Artigo
Resumo
Este protocolo descreve um modelo de infecção de Aspergillus em larvas de zebrafish. Os esporos de aspergillus são microinjetados na cérebro traseira das larvas, e o tratamento químico é usado para induzir a imunossupressão. A progressão da infecção é monitorada através de uma configuração diária de imagens para monitorar o crescimento fúngico e as respostas imunológicas, bem como a enumeração de esporos vivos por placa de unidade formadora de colônias.
Resumo
A aspergillose invasiva (IA) é uma das infecções fúngicas mais comuns entre indivíduos imunocomprometidos. Apesar da disponibilidade de medicamentos antifúngicos, a IA pode causar >50% de mortalidade em pacientes imunocomprometidos infectados. É fundamental determinar fatores hospedeiros e patógenos que contribuem para a suscetibilidade da infecção e baixas taxas de sobrevivência em pacientes infectados, a fim de desenvolver novas terapêuticas. As respostas imunológicas inatas desempenham um papel fundamental no reconhecimento e liberação dos esporos de Aspergillus, embora pouco se saiba sobre os mecanismos celulares e moleculares exatos. Modelos confiáveis são necessários para investigar interações mecanicistas detalhadas entre o hospedeiro e o patógeno. A clareza óptica e a trato genética das larvas de zebrafish fazem deles um modelo intrigante para estudar interações hospedeira-patógeno de múltiplas infecções bacterianas e fúngicas humanas em um hospedeiro vivo e intacto. Este protocolo descreve um modelo de infecção por zebrafish larval Aspergillus. Primeiro, os esporos de Aspergillus são isolados e injetados no ventrículo de cérebro traseiro de zebrafish via microinjeção. Em seguida, inibidores químicos como drogas imunossupressores são adicionados diretamente à água larval. Dois métodos para monitorar a infecção em larvas injetadas são descritos, incluindo a homogeneização 1) de larvas para enumeração da unidade formadora de colônias (UFC) e 2) uma configuração de imagem ao vivo repetida e diária. No geral, essas técnicas podem ser usadas para analisar mecanicamente a progressão da infecção por Aspergillus in vivo e podem ser aplicadas a diferentes origens hospedeiras e cepas de Aspergillus para interrogar interações hospedeiro-patógeno.
Introdução
Aspergillus fumigatus é um fungo saprofítico onipresente, e seus esporos aéreos podem ser encontrados tanto dentro quanto fora de casa1. Estes esporos são inalados por todos, mas são efetivamente liberados dos pulmões de indivíduos imunocompetuntes1,2. No entanto, pessoas com condições pulmonares alteradas, como a fibrose cística, podem desenvolver aspergillose broncopulmonar devido à germinação fúngica nos pulmões3. A forma mais grave dessa infecção, aspergillose invasiva (IA), afeta indivíduos imunocomprometidos e envolve o crescimento do fungo em outros órgãos2,3. A IA leva a >50% de morte de pacientes infectados, apesar da disponibilidade de terapias antifúngicas4. Em indivíduos imunocompetuntes, as respostas imunes inatas desempenham um papel importante na limpeza dos esporos inalados1. No entanto, os mecanismos específicos que contribuem para essa liberação imunológica inata não são bem compreendidos. É importante compreender os mecanismos celulares e moleculares das principais células imunes inatas (ou seja, macrófagos e neutrófilos) no desembaraço da Aspergillus, a fim de encontrar novas estratégias terapêuticas para a IA.
Embora os modelos de mamíferos tenham sido fundamentais na identificação de fatores de virulência fúngica e respostas imunes hospedeiras5,6, a acessibilidade visual é limitada para interações hospedeiro-patógeno no nível celular. Experimentos de cultura tecidual não podem recapitular totalmente o complexo ambiente multicelular e as interações que existem em animais inteiros7. Portanto, o zebrafish ganhou popularidade como um organismo modelo alternativo para preencher essa lacuna e facilitar o estudo das interações hospedeiro-patógeno em um hospedeiro vivo e intacto em uma infecção de vários dias8,9. O sistema imunológico inato de zebrafish desenvolve-se até 24 horas após a fertilização (hpf)10, e o sistema adaptativo leva de 4 a 6 semanas para desenvolver11, proporcionando uma janela de tempo em que as respostas imunes inatas podem ser avaliadas isoladamente. As respostas imunológicas inatas são bem conservadas entre humanos e zebrafish11. Os zebrafish têm muitas qualidades que facilitam a investigação dessas respostas, incluindo a clareza óptica (que permite a imagem ao vivo de alta resolução de hospedeiros intactos) e a tratobilidade genética (o que facilita estudos mecanicistas moleculares).
O modelo de infecção por zebrafish larval Aspergillus descrito aqui foi originalmente desenvolvido por Knox et al.12. Foi recentemente expandido pelo nosso grupo e outros para investigar mecanismos imunológicos hospedeiros12,13, interações hospedeira-patógeno13,14,15, mecanismos de imunossupressão13,16,17, virulência fúngica18, e eficácia de drogas antifúngis19,20. Este modelo recapitula múltiplos aspectos da aspergillose humana. Enquanto as larvas imunocompetente são resistentes, larvas imunocomprometidas podem sucumbir à infecção12,13,16,17.
Nesse modelo, uma infecção localizada é estabelecida injetando esporos no ventrículo de cérebro traseiro da larva, uma área menos povoada com fagocitos, e o recrutamento e comportamento de fagocitos podem ser avaliados12,13. Acredita-se que os macrófagos agem como a primeira linha de defesa contra esporos de Aspergillus em humanos1 e modelos mamíferos6,21. Da mesma forma, no modelo de zebrafish, os macrófagos são recrutados para os esporos aspergillus injetados, enquanto os neutrófilos são recrutados em segundo lugar em resposta ao crescimento hifál12,13,22. A partir desse modelo, também foi aprendido que a Aspergillus pode persistir em larvas imunocompetntes do tipo selvagem após mais de 7 dias de infecção. Além disso, todo o curso da infecção pode ser acompanhado nos mesmos animais vivos por imagens confocal diárias.
Este protocolo descreve a técnica de microinjeção para injetar esporos no ventrículo de cérebro traseiro de 2 dias após a fertilização (2 dpf) larvas. A infecção é então monitorada por até 7 dias, já que as larvas de zebrafish podem viver até 10 dpf sem se alimentar. A imunossupressão pode ser induzida pelo tratamento medicamentoso, e a aplicação de drogas nas larvas também é descrita. Finalmente, são descritos dois métodos para seguir a progressão da infecção, incluindo a quantificação de UFC de larvas individuais e uma configuração diária de imagens ao vivo.
Protocolo
Os pesquisadores devem obter aprovação para todos os experimentos com animais dos comitês de cuidados e uso adequados dos animais. Os dados representativos mostrados neste artigo são de experimentos realizados em protocolos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Clemson (AUP2018-070, AUP2019-012).
1. Preparação de esporos de Aspergillus para injeção
- A partir de uma suspensão de esporos Aspergillus, calcule o volume necessário para obter 1 x 106 esporos. O volume deve ser de 20 a 100 μL; se não, produza uma diluição de 10x em Tween-20 estéril de 0,01% (v/v) (Tween-water; Tabela de Materiais). Por exemplo, se o volume calculado for de 5 μL, produza uma diluição de 10x e utilize 50 μL da solução diluída.
NOTA: Duas placas/cepa podem ser preparadas para coletar mais esporos ou como um sobressalente em caso de contaminação. - Espalhe 1 x 106Esporos de Aspergillus em uma placa de mídia mínima de glicose (GMM)(Tabela de Materiais)com um espalhador descartável em forma de L estéril em um armário de biossegurança. Evite se espalhar até a margem da placa. Incubar a 37 °C durante 3-4 dias, com a placa virada de cabeça para baixo.
- No dia da coleta, traga miracloth estéril e tubos cônicos de 50 mL (dois por cepa), garrafas frescas de tween-água estéril (uma por cepa) e espalhadores descartáveis em forma de L para o armário de biossegurança.
NOTA: O pano de mira pode ser cortado em ~8 em x 6 em pedaços, enrolado em papel alumínio e autoclavado para esterilizar. - Coloque um pedaço de pano de mira em cada tubo cônico de 50 mL e recape. Tire o pacote de miraclo do capô.
- Traga placas para o armário de biossegurança. Abra uma placa, depois despeje tween-water na parte superior para cobrir cerca de três quartos da placa.
- Usando um espalhador descartável em forma de L, raspe suavemente a superfície da cultura fúngica em um movimento de ida e volta, enquanto usa a outra mão para girar a placa. Raspe até que quase todos os esporos sejam homogeneizados na água da interpolação.
NOTA: Devido à alta hidroofobidade, os esporos podem criar "puffs" quando a água da interpolação é adicionada ou durante a raspagem. Deve-se tomar muito cuidado para evitar a contaminação de tubos ou placas próximas. Aconselhável trocar luvas e limpar a superfície com 70% de etanol entre a extração de diferentes cepas. - Pegue um tubo cônico de 50 mL e remova o pedaço de pano de mira. Dobre-o ao meio e transforme-o em um filtro inserido na parte superior do tubo cônico de 50 mL.
- Despeje o homogeneizar fúngico da placa sobre o pano de miraclo no tubo.
NOTA: Se duas placas de uma cepa estiverem preparadas, raspe as duas placas e despeje-as no mesmo tubo cônico. - Despeje a tween-água para levar o volume total do tubo cônico para 50 mL.
- Gire a 900 x g por 10 min. Certifique-se de usar tampas que previnem a aerossolização na centrífuga.
- Despeje o supernaspeir em ~10% de solução de alvejante para descontaminar. Despeje 50 mL de PBS estéril no tubo cônico, depois vórtice ou shake para resuspensar a pelota.
- Gire novamente a 900 x g por 10 min. Despeje o supernasciente e resuspenque a pelota em 5 mL de PBS 1x estéril. Filtre através de um pedaço fresco de miracloth em um tubo cônico fresco de 50 mL.
- Faça diluições seriais de 10 vezes (10x, 100x, 1000x) do homogeneizar fúngico em tubos de centrífugas de 1,7 mL (por exemplo, para a solução de 10x, misture 100 μL do homogenate fúngico com 900 μL de Tween-water).
- Escolha a primeira diluição em que os esporos não são visíveis quando são descarregados em tween-água e use esta diluição para contar o número de esporos usando um hemócitometro.
- Calcule a concentração de esporos no homogeneado fúngico preparado (suspensão da água) utilizando a seguinte fórmula:
Concentração (esporos/mL) = Número de esporos no meio 25 caixas x fator de diluição x 104 - Prepare um estoque de 1 mL de 1,5 x 108 esporos/mL em 1x PBS estéril em um tubo de microcentrifuuge de 1,7 mL. Esta preparação de esporos pode ser armazenada a 4 °C por ~4 semanas.
- Antes de usar em injeções, misture 20 μL da preparação do esporo com 10 μL de 1% de fenol vermelho estéril em um tubo de centrífuga de 1,7 mL para alcançar uma concentração final de esporos de 1 x 108 esporos/mL. Vórtice completamente antes da injeção.
NOTA: A solução vermelha de fenol de 1% deve ser esterilizada por filtro e armazenada em alíquotas. - Para uma injeção simulada, misture 20 μL de 1x PBS com 10 μL de 1% vermelho fenol estéril.
2. Preparação de placas de ágar para injeção
- Prepare 2% de agarose em meio E3 e derreta em um micro-ondas.
- Despeje em uma placa de Petri de 100 mm x 15 mm (~25 mL por placa), gire para cobrir a placa uniformemente, e deixe esfriar.
- Enrole a placa com filme de parafina e armazene invertido a 4 °C.
- Antes da injeção, leve a placa à temperatura ambiente (RT).
- Despeje ~1 mL de filtro esterilizado 2% de albumina de soro bovino (BSA) na placa, incline a placa para espalhar e cubra todo o fundo e enxágue com E3.
NOTA: A solução BSA de 2% pode ser esterilizada por filtros e armazenada como alíquotas de 1 mL a -20 °C. 2% de pré-tratamento BSA impede que larvas grudem na superfície da agarose. - Despeje e3 com tricaine tampão na placa e deixe descansar até a injeção.
3. Microinjeção de ventrículo de larva de zebrafish
- Larvas descorionas manualmente com fórceps a 2 dpf em uma placa de Petri.
NOTA: A descorção pode ser realizada a qualquer momento, a partir de 1,5 dpf até o momento da injeção. - Remova o máximo de E3 possível da placa de Petri e adicione tricaine de 300 μg/mL em E3 para anestesiar larvas.
NOTA: Uma solução de estoque de tricaine de 4 mg/mL tampão no E3 pode ser preparada e armazenada a 4 °C. A solução de trabalho pode ser feita diluindo 4 mL da solução de estoque até 50 mL com E3. - Use uma configuração de microinjeção fornecida com o injetor de pressão, unidade de pressão traseira, footswitch, suporte de micropipette, micromanipulador, e um suporte magnético e placa, tudo conectado a uma fonte de ar comprimido(Tabela de Materiais).
- Abra a válvula de ar comprimido e ligue o microinjetor. Coloque a pressão em ~25 PSI, a duração do pulso para 60 ms e a unidade de pressão traseira para 1 PSI.
- Carregue uma agulha de microinjeção usando uma ponta de pipeta de microcarregador(Tabela de Materiais)com cerca de 3-5 μL de PBS preparado ou suspensão de esporos com vermelho fenol. Monte a agulha no micromanipulador.
NOTA: As agulhas de microinjeção podem ser preparadas como descrito anteriormente23. O microscópio estéreo usado para microinjeções deve ter um reticle de peça ocular para calibrar a agulha de microinjeção. A espasma deve ser calibrada com um micrômetro de estágio, e o comprimento da escala de tique-reticle (μm) deve ser determinado. O diâmetro da queda da suspensão do esporo que ejeta da agulha é medido dependendo do número de hashes (da reticição) que se sobrepõem à queda. - Posicione o micromanípulo para que a extremidade da agulha esteja à vista na menor ampliação sob o microscópio estéreo. Zoom para ampliação de 4x, mantendo a agulha à vista.
- Usando fórceps afiados, corte a ponta da agulha. Pressione o pedal de injeção para visualizar o tamanho da gota que sai. Mantenha o recorte de volta até que ~3 nL de suspensão de esporos seja injetado (aqui, são cinco hashes).
- Mova o micromanípulador e a agulha para fora do caminho para evitar acidentalmente bater na agulha enquanto as larvas estão dispostas na placa de injeção.
- Despeje E3-Tricaine da placa de injeção e transfira ~24 larvas anestesiadas para a placa de injeção com o mínimo de E3 possível usando uma tubulação de transferência.
- Usando uma pequena ferramenta para manipular larvas de zebrafish (ou seja, ferramenta de alça capilar ou ferramenta de cílios), organize as larvas de acordo com a direção em que estão voltadas. Especificamente, coloque todos voltados para a direita em uma linha, e todos voltados para a esquerda em uma fileira abaixo.
NOTA: Este arranjo é difícil se houver muito líquido na placa, pois as larvas "flutuarão" para fora do lugar. No entanto, muito pouco líquido também é problemático se as injeções demorarem muito tempo, pois as larvas podem secar ou a anestesia se desgastar. Assim, deve-se prestar atenção à quantidade de líquido na placa durante todo o processo de microinjeção. - Ajuste o zoom do microscópio para a menor ampliação. Traga o micromanipulador de volta e organize para que a agulha esteja perto das larvas, em um ângulo ~30°-60°, no meio do campo de visão.
- Amplie até a ampliação mais alta e use botões de ajuste finos para ajustar ainda mais a posição da agulha. Verifique se ~30-70 esporos estão saindo da agulha injetando a suspensão do esporo no líquido na placa ao lado das larvas. Ajuste o tempo e a pressão na configuração da injeção, se necessário.
NOTA: Este teste deve ser repetido após cada cinco a seis larvas, pois o número de esporos que saem da agulha pode aumentar ou diminuir ao longo do tempo. - Começando pela linha em que as larvas estão voltadas para a agulha, mova a placa para que a agulha esteja diretamente acima e posicionada perto das primeiras larvas.
- Movendo a agulha com o micromanipulador, insira a agulha através do tecido ao redor do vesículo ístico para perfurar através do ventrículo do cérebro traseiro. Mova a placa com a outra mão conforme necessário para obter a orientação certa da larva com o ângulo da agulha.
- Verifique visualmente se a extremidade da agulha está no centro do ventrículo do cérebro traseiro, pressione o pedal do pé para injetar esporos e retraia suavemente a agulha.
NOTA: O corante vermelho fenol deve permanecer principalmente dentro do ventrículo de cérebro traseiro. Uma pequena quantidade pode ir para o cérebro médio, mas não deve atingir o cérebro ou fora do cérebro. Se isso acontecer, o volume que está sendo injetado é muito grande, e a pressão e o tempo devem ser diminuídos em conformidade, ou uma nova agulha deve ser calibrada. - Movendo-se para baixo da placa, injetar todas as larvas nessa linha. Em seguida, vire a placa e injete todas as larvas na outra linha.
NOTA: Larvas injetadas ou acidentalmente danificadas podem ser marcadas por 1) injetando na gema algumas vezes para criar uma marca vermelha ou 2) arrastando a larva para fora da linha com a agulha. - Mova a agulha para cima e para fora do caminho novamente. Amplie para uma ampliação mais baixa no microscópio. O corante vermelho fenol ainda deve ser visível no cérebro traseiro de cada larva.
- Primeiro, afaste-se com a ferramenta de alça de cabelo e pipeta para descartar qualquer larva com injeções mal sucedidas. Transfira as larvas restantes para uma nova placa de Petri lavando-as da placa com E3 estéril fresco e uma tubulação de transferência.
- Repita conforme necessário para o número final da amostra experimental desejado.
- Enxágüe as larvas pelo menos 2x com o E3 e garanta a recuperação da anestesia.
- Para quantificar a sobrevida sem qualquer tratamento adicional, utilizando uma pipeta de transferência, transfira larvas para uma placa de poço 96 (1 larva por poço) em E3.
4. Estabelecimento de números de esporos injetados e viáveis
- Imediatamente após a injeção, usando uma pipeta de transferência, escolha aleatoriamente cerca de oito das larvas injetadas e transfira-as para tubos centrífugas de 1,7 mL (uma larva por tubo).
- Eutanize larvas com tricaine ou colocando-as a 4 °C por 0,5-2,0 h.
- Prepare 1 mL de ampicillina de 1 mg/mL e 0,5 mg/mL de soluções de antibióticos de kanammicina em 1x PBS estéril. A solução restante pode ser armazenada a 4 °C e usada posteriormente.
NOTA: As soluções de estoque de ampicillina a 100 mg/mL e kanamicina 50 mg/mL podem ser pré-feitas, esterilizadas por filtro e armazenadas em alíquotas a -20 °C. Diluir estes 100x em 1x PBS para obter a solução de trabalho. - Usando uma pipeta, remova o máximo de líquido possível do tubo centrífuga, deixando a larva para trás e adicione 90 μL do 1x PBS com antibióticos.
NOTA: Os antibióticos são usados para prevenir o crescimento bacteriano em placas gmm que podem interferir na contagem de colônias aspergillus. - Homogeneize larvas em um tecido lyser a 1.800 oscilações/min (30 Hz) por 6 min. Gire a 17.000 x g para 30 s.
- Etiquetar placas GMM (uma placa por larva homogeneizada). Usando um queimador Bunsen para criar um ambiente estéril, pipeta a suspensão homogeneizada de um tubo para o meio da placa GMM, em seguida, espalhe usando um espalhador descartável em forma de L. Evite espalhar o homogeneizar contra a borda.
- Incubar as placas de cabeça para baixo a 37 °C durante 2-3 dias e contar o número de colônias formadas (UFC).
- Para medir o número de esporos vivos durante o período de infecção, pegue larvas da placa de 96 poços em 1-7 dias após a injeção (dpi) e transfira-as para tubos de centrífuga. Eutanize e homogeneize larvas para se espalhar em placas GMM, conforme descrito nas etapas 4.1-4.5.
5. Tratamento medicamentoso de larvas injetadas
- Após a seção 4, divida as larvas injetadas restantes em dois pratos de 3,5 mm: um para o tratamento medicamentoso e outro para o controle. Use cerca de 24 larvas infectadas por condição.
NOTA: Os pratos de 3,5 mm podem ser tratados com 2% de leite seco sem gordura em água, enxaguado, seco a ar e armazenado em RT antecipadamente. O revestimento com leite evitará que as larvas grudem no plástico. - Prepare a solução de droga desejada e o veículo em E3 sem azul metileno em tubos cônicos de acordo com a concentração final necessária, em seguida, misture bem. Por exemplo, para monitorar a sobrevivência de larvas expostas à dexametasona, utilize 24 larvas (réplicas) para dexametasona e 24 para o controle do veículo, como o DMSO. Prepare 5 mL da solução de medicamentos na concentração necessária. Aqui, foram utilizadas 5 mL de DMSO e 10 μM dexametasona, e 24 larvas/condição foram transferidas para ~200 μL da solução/larvas do veículo/droga.
- Retire o máximo de líquido possível de um prato com uma pipeta de transferência e adicione o E3 pré-mediado contendo controle do veículo. Repita com o E3 pré-x contendo o tratamento de interesse para o outro prato.
- Usando uma pipeta, transfira larvas para 96 placas de poço (uma larva por poço). Monitore a sobrevivência de larvas injetadas expostas ao veículo ou à droga por 7 dias.
NOTA: A droga pode ser aplicada exclusivamente no dia da infecção e mantida nas larvas durante todo o experimento ou pode ser atualizada diariamente.
6. Imagens diárias de larvas infectadas usando o dispositivo de ferida e armadilha de zebrafish para crescimento e imagem (zWEDGI)
- Certifique-se de que as larvas sejam tratadas com 100 μM N-phenylthiourea (PTU) a 24 hpf para evitar pigmentação e que o PTU seja mantido nas larvas durante todo o experimento.
NOTA: PTU a 75-100 μM previne a pigmentação de larvas sem quaisquer defeitos de desenvolvimentobrutos 24. No entanto, a PTU pode interferir em alguns processos biológicos25, e os pesquisadores devem determinar de antemão se a droga pode afetar quaisquer processos sob investigação. - Infectar larvas transgênicas com populações de células rotuladas de interesse em 2 dpf com esporos aspergillus projetados para expressar uma proteína fluorescente, como descrito na seção 3. Em seguida, transfira larvas infectadas em poços de uma placa de 48 poços em cerca de 500 μL/poço de E3 sem azul de metileno.
NOTA: Uma placa de 48 poços é usada aqui, porque é mais fácil transferir larvas para dentro e para fora durante a repetida imagem diária. - No dia da imagem, prepare duas placas de Petri de 3,5 mm: uma com PTU de 100 μM e outra com E3-tricaine.
- Adicione E3-tricaine nas câmaras de um dispositivo zWEDGI26,27. Sob o microscópio estereo, remova bolhas de ar das câmaras e do canal de contenção usando uma micropipette P100. Remova todo o excesso de E3-tricaine, de modo que é apenas nas câmaras.
- Pipeta uma larva da placa usando uma pipeta de transferência. Se muito líquido for usado para removê-lo, pipeta em um prato de 3,5 mm contendo E3-PTU. Em seguida, pipeta novamente, usando o mínimo de líquido possível, e transferir para E3-tricaine.
- Aguarde ~30 s para anestesia e, em seguida, transfira para a câmara de carregamento do dispositivo de ferimento e armadilha (por exemplo, zWEDGI).
- Sob o microscópio estéreo, posicione a larva. Use a micropipette P100 para remover e3-tricaine da câmara de ferimentos e solte na câmara de carregamento para mover a cauda da larva para o canal de restrição. Certifique-se de que a larva esteja posicionada em seu lado lateral, dorsal ou dorso-lateral, para que o cérebro traseiro possa ser visualizado com uma lente objetiva invertida.
- Larva de imagem com um microscópio confocal.
- Após a imagem, com a pipeta P100, solte E3-tricaine na câmara de ferimentos para empurrar a larva do canal de contenção para a câmara de carregamento.
- Usando uma pipeta de transferência, pegue a larva e transfira de volta para a placa de Petri com E3-Tricaine. Usando o mínimo de líquido possível, transfira-o para a placa de Petri com E3-PTU. Enxágüe em PTU e transfira de volta para a placa 48.
Resultados
Após a microinjeção dos esporos de Aspergillus no cérebro traseiro das larvas de zebrafish, o resultado da infecção pode ser seguido por múltiplos ensaios, incluindo sobrevivência, CFUs e imagens vivas. Em um ensaio de sobrevivência, o número de larvas infectadas sobreviventes de 1 a 7 dpi foi monitorado. Quando as larvas do tipo selvagem foram deixadas sem tratamento, muito pouca morte foi observada, com ~80%-100% das larvas sobrevivendo a totalidade do experimento(Figura 1). Se as larvas foram imunossupressores, como a exposição à droga corticosteroide dexametasona (10 μM), observou-se diminuição significativa da sobrevida(Figura 1).
Quando as UFC foram quantificadas ao longo dos 7 dias de experimento de larvas selvagens infectadas com esporos de A. fumigatus, observou-se persistência dos esporos, com desobstrução lenta ao longo do tempo(Figura 2A). O número de esporos que sobreviveram a 1, 2, 3, 5 e 7 dpi foram normalizados ao número de esporos injetados em 0 dpi para comparar persistência e folga entre as réplicas(Figura 2B).
Linhas de peixes transgênicos que expressam proteínas fluorescentes em leucócitos, juntamente com esporos aspergillus fluorescentes que expressam proteínas podem ser usados para visualizar tanto o recrutamento e o comportamento de leucócitos quanto a germinação e crescimento fúngico13. Quando os macrófagos foram rotulados (por exemplo,Tg(mpeg1:H2B-GFP),oagrupamento de macrófagos em ~50% das larvas foi tipicamente observado, a partir de 2-3 dpi(Figura 3A). O recrutamento de neutrófilos (Tg:BFP)foi tipicamente atrasado, ocorrendo principalmente após a germinação fúngica(Figura 3A). Enquanto a carga fúngica persistiu durante todo o experimento na maioria das larvas(Figura 3A),observou-se a liberação(Figura 3B). Em algumas larvas, a carga fúngica fora do cérebro traseiro também foi observada mais tarde na infecção, devido à disseminação fúngica, provavelmente em macrófagos.
A área ao redor da vesícula otic é um local possível onde essa divulgação pode ser encontrada(Figura 3C). Essas observações foram quantificadas em múltiplas larvas individuais ao longo de todo o experimento(Figura 4). Normalmente, a germinação era observada em ~60% das larvas por 5 dpi(Figura 4A). A área de cluster phagocyte, o recrutamento de macrófagos e o recrutamento de neutrófilos variam tanto ao longo do tempo quanto em larvas, com algumas tendências ao longo do experimento e algumas resolvendo ao longo do tempo (Figura 4B,C,D).
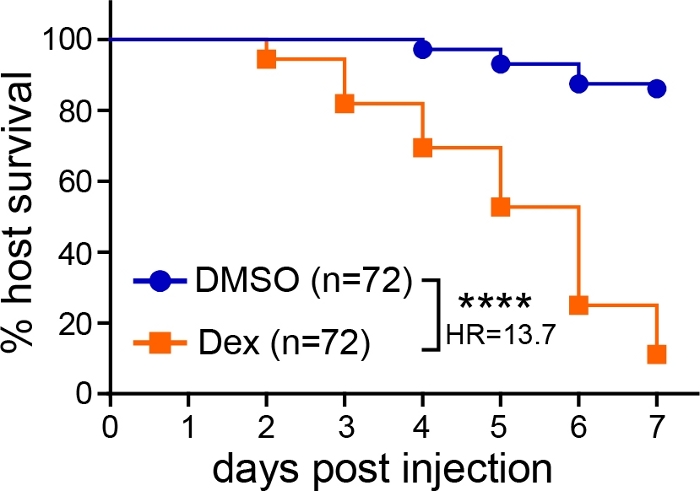
Figura 1: Análise representativa da sobrevivência das larvas infectadas. Aspergillus-infectadas larvas foram expostas ao controle do veículo (DMSO) ou dexmethasona (Dex), e a sobrevivência foi monitorada. Os dados representam três réplicas agrupadas. AS CFUs médias de injeção: DMSO = 30, Dex = 29 (p-valor e razão de risco foram calculadas pela análise de regressão de risco proporcional de Cox, ****p < 0,0001). Clique aqui para ver uma versão maior desta figura.
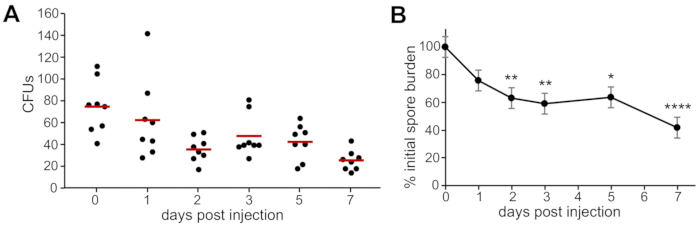
Figura 2: A CFU representativa conta com larvas infectadas individuais imediatamente após a injeção (0 dpi) e durante o curso de infecção (2, 3, 5 e 7 dpi). Oito larvas infectadas foram homogeneizadas e banhadas para contar a UFC para cada ponto de tempo e replicar. (A) Exemplos de dados de uma réplica. Cada ponto representa uma larva, as barras representam meios para cada ponto de tempo. (B) As contagens de UFC foram normalizadas para a contagem da UFC em 0 dpi para cada réplica, e três réplicas foram agrupadas. Os dados foram comparados entre condições experimentais utilizando análise de variância e resumidos em termos de meios marginais estimados e erros padrão. Astérix representam significância estatística em relação à UFC em 0 dpi (*p < 0,05, **p < 0,01, ****p < 0,0001). Clique aqui para ver uma versão maior desta figura.
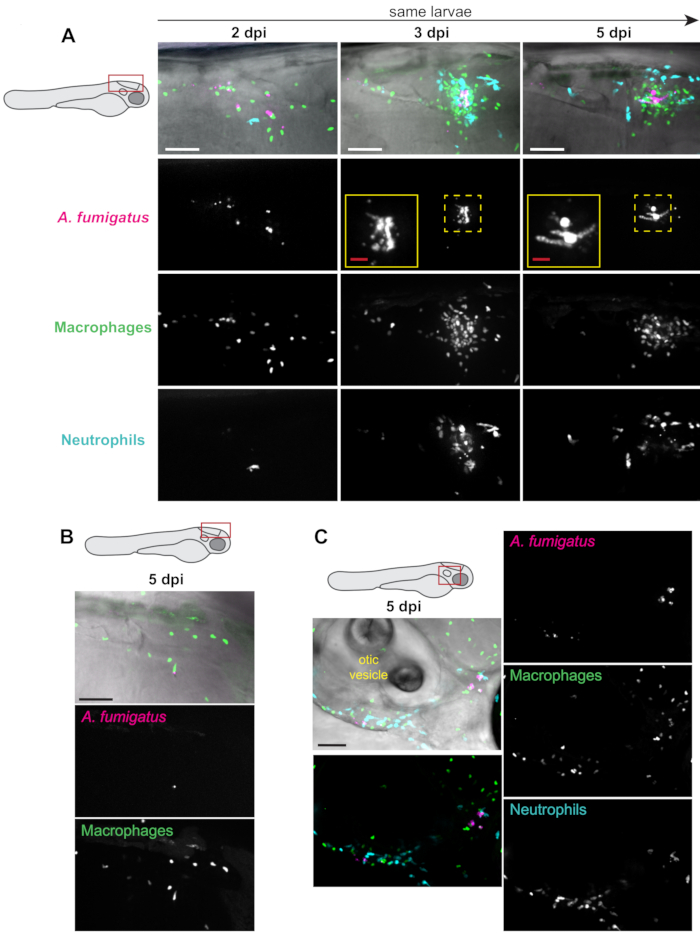
Figura 3: Imagens representativas de experimentos de infecção. Larvas tratadas com PTU com macrófagos fluorescentes (mpeg1:H2B-GFP) e neutrófilos (lyz:BFP) foram injetadas com A. fumigatusexpressando RFP . Larvas infectadas ao vivo foram imagens repetidamente aos 2, 3 e 5 dpi em um microscópio confocal. Intensidade máxima As imagens de projeção Z são exibidas. Esquemas de larvas indicam a localização da imagem para cada painel. Todas as barras de escala representam 100 μm, exceto para as barras de escala de entrada, que são de 25 μm. (A) As imagens mostradas são de uma única larva tirada a 2, 3 e 5 dpi, representando uma progressão típica da infecção. Os insets mostram germinação fúngica nos dias 3 e 5. (B) Imagem representativa do subconjunto de larvas que podem limpar a infecção, com baixa carga fúngica e pouca inflamação a 5 dpi. (C) Imagem representativa do subconjunto de larvas em que a infecção se dissemina para fora do cérebro traseiro em momentos posteriores. Nesta imagem, fungos, macrófagos e neutrófilos podem ser encontrados ao redor e abaixo da vesícula otica. Clique aqui para ver uma versão maior desta figura.
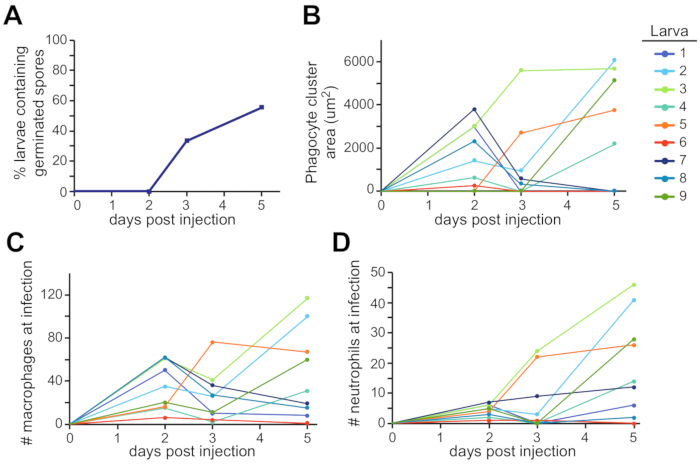
Figura 4: Quantificação representativa de experimentos de imagem. Imagens da configuração experimental na Figura 3 foram analisadas para germinação fúngica e recrutamento de leucócitos. (A) Larvas foram pontuadas para a presença de esporos germinados em cada dia, e a porcentagem de larvas com germinação foi calculada. (B,C,D) Cada larva individual é representada como uma linha de cores diferente. Aparência e tamanho do cluster faófilo (B), recrutamento de macrófagos (C) e recrutamento de neutrófilos (D) foram seguidos ao longo do experimento de 5 dias para cada larva. Clique aqui para ver uma versão maior desta figura.
Discussão
O modelo de infecção descrito aqui é benéfico para analisar as respostas imunes do hospedeiro, interações hospedeira-patógeno e patogênese fúngica12,13,14,15. Essas informações podem ser derivadas da imagem de alta resolução de patógenos fluorescentes e células hospedeiras13,sobrevivência larval e persistência da UFC ao longo do tempo.
A técnica de microinjeção é fundamental para o sucesso deste protocolo e pode precisar ser ajustada ao usar diferentes equipamentos e configurações de microinjeção. Em particular, a pressão e o tempo de injeção são duas variáveis principais e podem ser ajustados para garantir que o volume ejetado pela agulha seja ~3 nL. O tamanho da agulha conforme determinado pelo recorte com fórceps também regula o número de esporos injetados; embora, uma abertura maior pode causar danos teciduais à larva. Por outro lado, uma abertura muito pequena não permitirá que os esporos relativamente grandes (>2 μm) saiam e podem levar ao entupimento da agulha. Se isso ocorrer, a agulha pode ser relipped para ter uma abertura ligeiramente maior.
Outros protocolos para microinjeção de bactérias utilizam PVP-40 para ajudar a manter uma mistura de injeção homogênea, mas não encontramos nenhuma vantagem em usar este portador com esporos Aspergillus. O entupimento da agulha pode ser mitigado com o vórtice da preparação fúngica completamente para quebrar qualquer aglomerado antes de carregar a agulha. Às vezes, um entupimento na agulha também pode ser desalojado aumentando temporariamente o tempo de pressão ou injeção e acionando o microinjetor enquanto a agulha está no líquido ao redor das larvas. O tempo de pressão e injeção deve então ser reduzido novamente para níveis anteriores. Em outros casos, um entupimento não pode ser removido, e uma nova agulha precisa ser carregada e recalibrada.
Este protocolo foi projetado para injetar ~30-70 esporos por larva. Sabe-se que com base na concentração da preparação do esporo e no volume injetado, este número é bastante baixo. No entanto, foi empiricamente encontrado que este é o número de esporos injetados nessas condições. Por que essa diferença ocorre é desconhecida, mas pode ser devido ao esporos na agulha. Nossas próprias tentativas de injetar um número maior de esporos foram em grande parte mal sucedidas.
Para garantir que cerca de 30 a 70 esporos estejam sendo injetados e manter a consistência das injeções em todas as larvas, verifique o número de esporos injetando no E3 ao redor das larvas. Repita isso a cada cinco a seis larvas ao longo de todas as injeções. Se a contagem de esporos parece mudar, o tempo de pressão e/ou injeção pode ser ajustado para injetar um número consistente de esporos em várias larvas. No entanto, deve-se tomar cuidado para que a dose de injeção permaneça principalmente no cérebro traseiro e não preencha o cérebro médio e o cérebro.
Para garantir uma infecção localizada, a suspensão do esporo deve ser contida dentro do ventrículo de cérebro traseiro. Isso pode ser visualizado pela coloração vermelha fenol logo após a injeção, embora a cor vermelha difunde com o tempo. Para injeções, a região ao redor do vesículo ático é usada para perfurar e alcançar o ventrículo em um ângulo de 45°-65°. Esta área não tem vasos sanguíneos principais, causa menos danos teciduais e cicatriza instantaneamente. Se a pele sobre o ventrículo for perfurada, a suspensão do esporo pode ser vazada, pois a agulha que deve ser usada para injeções de esporos Aspergillus é maior do que a usada para suspensões bacterianas. Larvas injetadas ou acidentalmente danificadas podem ser marcadas injetando na gema algumas vezes para criar uma marca vermelha ou arrastando a larva para fora da linha com a agulha. Depois que um conjunto de injeções estiver completo, essas larvas devem ser removidas e descartadas antes que o resto seja lavado da placa. E3 sem azul de metileno é usado para anestesiar larvas antes da injeção e também manter larva após as injeções, porque o azul de metileno é antifúngico.
No momento da injeção, as contagens de UFC representam o número de esporos viáveis dentro do hospedeiro infectado. No entanto, se os esporos germinarem em hifas, estes podem ser divididos em "unidades fúngicas" separadas durante a homogeneização e podem dar origem a várias colônias. Ou, uma hifa multicelular ininterrupta pode dar origem a uma única colônia, resultando em uma representação média, mas imprecisa, do fardo fúngico. Isso pode ser mitigado combinando a contagem da UFC com microscopia longitudinal de larvas individuais, que fornece dados visuais do destino dos esporos injetados.
Em comparação com o sistema de mamíferos, o modelo de infecção por larvas de zebrafish é particularmente significativo devido à sua acessibilidade óptica. O recrutamento e a resposta de células imunes inatas podem ser visualizados dentro de um hospedeiro intacto ao vivo. Isso pode ser incorporado com inibição genética ou química de alvos moleculares para analisar como cada alvo afeta a reação macrófago ou neutrófilo contra esporos de Aspergillus em um animal vivo.
Enquanto o modelo de infecção por zebrafish Aspergillus continua sendo fundamental na descrição de diferentes aspectos da IA12,13,14,15,16,17,18,19,20,22, há outras áreas de expansão. Do lado hospedeiro, é usado para descrever respostas imunes de nível celular, mas isso pode ser expandido para analisar mecanismos imunológicos no nível molecular, combinando-o com morfolino direcionado, CRISPR, linhas mutantes estáveis ou exposição química. Uma ressalva é que os homólogos de todos os mamíferos conhecidos inatas componentes da via imunológica não foram identificados em zebrafish.
Do lado do patógeno, a virulência de diferentes espécies e cepas foram descritas. Uma avenida promissora de pesquisas futuras é o uso de cepas mutantes de Aspergillus para testar como genes ou proteínas específicas contribuem como fatores de virulência. Assim, novas drogas antifúngicas podem ser desenvolvidas para atingir essas proteínas. Os medicamentos antifúngicos atuais têm baixa eficácia em pacientes humanos e há crescente resistência a essas drogas em fungos28. Este modelo in vivo pode ser usado para investigar por que essas drogas falham e como um modelo intermediário para testar a eficácia de novas drogas antifúngicas. No geral, os achados descobertos usando esse modelo podem facilitar o desenvolvimento futuro de tratamentos eficazes para pacientes infectados pela Aspergillus.
Divulgações
Não há conflitos ou interesses financeiros para divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional de Alergia e Doenças Infecciosas dos Institutos Nacionais de Saúde sob o Prêmio Número K22AI134677. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| Dumont forceps #5 | Roboz Surgical Instrument Co. | RS-5045 | |
| Eyepiece reticle | Microscope World | RETR10 | For calibrating needles, used in Stereomicroscope |
| Microinjector setup: Back pressure unit | Applied Scientific Instrumentation | BPU | |
| Footswitch | Applied Scientific Instrumentation | FTSW | |
| Micro pipet holder kit | Applied Scientific Instrumentation | M-Pip | |
| Pressure injector | Applied Scientific Instrumentation | MPPI-3 | |
| Micromanipulator setup: Micromanipulator | Narashige (Tritech) | M-152 | |
| Magnetic stand and plate | Tritech | MINJ-HBMB | |
| Needle puller | Sutter Instrument | P-97 | |
| Stereomicroscope | Nikon | SMZ-745 | |
| Tissuelyser II | Qiagen | 85300 | To homogenize larvae |
| Material | Company | Catalog Number | Comments/Description |
| Agarose | Fisher | BP160-500 | |
| Ampicillin sodium salt | Fisher | AAJ6380706 | |
| BSA, fraction V | VWR | AAJ65855-22 | |
| Kanamycin sulfate | Fisher | AAJ1792406 | |
| L spreaders | Fisher | 14 665 230 | |
| Microcapillary needles (no filament) | World Precision Instruments (WPI) | TW100-3 | |
| Microloader pipet tips | VWR | 89009-310 | To load the needle with Aspergillus suspension |
| Miracloth | VWR | EM475855-1R | To filter Aspergillus suspension |
| N-phenylthiourea | Fisher | AAL0669009 | To prevent pigmentation |
| Phenol red, 1% solution | Fisher | 57254 | |
| Tricaine (Ethyl 3-aminobenzoate, methanesulfonic acid salt) | Fisher | AC118000500 | To anesthetize larvae |
| Tween-20 | Fisher | BP337-500 | |
| Media and Solutions | Components/Recipe | ||
| E3 media: 60x E3 | 17.2 g NaCl, 0.76 g KCl, 2.9 g CaCl2, 4.9 g MgSO4 · 7H2O, to 1 L with H2O | ||
| 1x E3 | 16.7 ml 60x stock, 430 ul 0.05 M NaOH, to 1 L with H2O (optional: + 3 ml 0.01% methylene blue) | ||
| Tricaine stock solution | 2 g Tricaine, 5 g Na2HPO4 · 7H2O, 4.2 ml 60X E3, to 500 ml with H2O, pH to 7.0-7.5 with NaOH | ||
| Glucose minimal media (GMM) agar: GMM agar | 10 g Glucose (Dextrose), 50 ml 20x Nitrate salts, 1 ml TE, to 1 L with H2O, pH to 6.5 with NaOH, + 16 g Agar, autoclave | ||
| 20x Nitrate salts | 120 g NaNO3, 10.4 g KCl, 10.4 g, MgSO4 · 7H2O, 30.4 g, KH2PO4, to 1 L with H2O, autoclave | ||
| Trace elements (TE) | 2.20 g ZnSO4 · 7H2O, 1.10 g H3BO3, 0.50 g MnCl2 · 4H2O, 0.16 g FeSO4 · 7H2O, 0.16 g CoCl2 · 6H2O, 0.16 g CuSO4 · 5H2O, 0.11 g (NH4)6Mo7O24 · 4H2O, 5.00 g Na2EDTA, to 100 ml with H2O, dissolve stirring overnight, autoclave |
Referências
- Latge, J. P. Aspergillus fumigatus and aspergillosis. Clinical Microbiology Reviews. 12 (2), 310-350 (1999).
- Denning, D. W. Invasive aspergillosis. Clinical Infectious Diseases. 26 (4), 781-803 (1998).
- Dagenais, T. R., Keller, N. P. Pathogenesis of Aspergillus fumigatus in Invasive Aspergillosis. Clinical Microbiology Reviews. 22 (3), 447-465 (2009).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: systematic review of the literature. Clinical Infectious Diseases. 32 (3), 358-366 (2001).
- Mirkov, I., Popov, A., Lazovic, B., Glamoclija, J., Kataranovski, M. Usefulness of animal models of aspergillosis in studying immunity against Aspergillus infections. Journal de Mycologie Médicale. 29 (1), 84-96 (2019).
- Schaffner, A., Douglas, H., Braude, A. Selective protection against conidia by mononuclear and against mycelia by polymorphonuclear phagocytes in resistance to Aspergillus. Observations on these two lines of defense in vivo and in vitro with human and mouse phagocytes. Journal of Clinical Investigation. 69 (3), 617-631 (1982).
- Behnsen, J., et al. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathogens. 3 (2), 13 (2007).
- Torraca, V., Mostowy, S. Zebrafish Infection: From Pathogenesis to Cell Biology. Trends in Cell Biology. 28 (2), 143-156 (2018).
- Rosowski, E. E., et al. The Zebrafish as a Model Host for Invasive Fungal Infections. Journal of Fungi. 4 (4), (2018).
- Herbomel, P., Thisse, B., Thisse, C. Ontogeny and behaviour of early macrophages in the zebrafish embryo. Development. 126 (17), 3735-3745 (1999).
- Traver, D., et al. The Zebrafish as a Model Organism to Study Development of the Immune System. Advances in Immunology. 81, 254-330 (2003).
- Knox, B. P., et al. Distinct innate immune phagocyte responses to Aspergillus fumigatus conidia and hyphae in zebrafish larvae. Eukaryotic Cell. 13 (10), 1266-1277 (2014).
- Rosowski, E. E., et al. Macrophages inhibit Aspergillus fumigatus germination and neutrophil-mediated fungal killing. PLoS Pathogens. 14 (8), 1007229 (2018).
- Koch, B. E. V., Hajdamowicz, N. H., Lagendijk, E., Ram, A. F. J., Meijer, A. H. Aspergillus fumigatus establishes infection in zebrafish by germination of phagocytized conidia, while Aspergillus niger relies on extracellular germination. Scientific Reports. 9 (1), 12791 (2019).
- Pazhakh, V., Ellett, F., Croker, B. A. beta-glucan-dependent shuttling of conidia from neutrophils to macrophages occurs during fungal infection establishment. PLoS Biology. 17 (9), 3000113 (2019).
- Herbst, S., et al. Phagocytosis-dependent activation of a TLR9-BTK-calcineurin-NFAT pathway co-ordinates innate immunity to Aspergillus fumigatus. EMBO Molecular Medicine. 7 (3), 240-258 (2015).
- Shah, A., et al. Calcineurin Orchestrates Lateral Transfer of Aspergillus fumigatus during Macrophage Cell Death. American Journal of Respiratory and Critical Care Medicine. 194 (9), 1127-1139 (2016).
- Jain, S., et al. Selenate sensitivity of a laeA mutant is restored by overexpression of the bZIP protein MetR in Aspergillus fumigatus. Fungal Genetics and Biology. 117, 1-10 (2018).
- Jones, C. N., et al. Bifunctional Small Molecules Enhance Neutrophil Activities Against Aspergillus fumigatus in vivo and in vitro. Frontiers in Immunology. 10, 644 (2019).
- Rosowski, E. E., He, J., Huisken, J., Keller, N. P., Huttenlocher, A. Efficacy of voriconazole against A. fumigatus infection depends on host immune function. Antimicrobial Agents and Chemotherapy. , 00917-00919 (2019).
- Herbst, S., et al. A new and clinically relevant murine model of solid-organ transplant aspergillosis. Disease Models and Mechanisms. 6 (3), 643-651 (2013).
- Knox, B. P., Huttenlocher, A., Keller, N. P. Real-time visualization of immune cell clearance of Aspergillus fumigatus spores and hyphae. Fungal Genetics and Biology. 105, 52-54 (2017).
- Harvie, E. A., Huttenlocher, A. Non-invasive Imaging of the Innate Immune Response in a Zebrafish Larval Model of Streptococcus iniae Infection. Journal of Visualized Experiments. (98), e52788 (2015).
- Karlsson, J., von Hofsten, J., Olsson, P. E. Generating transparent zebrafish: a refined method to improve detection of gene expression during embryonic development. Marine Biotechnology. 3 (6), 522-527 (2001).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Huemer, K., et al. zWEDGI: Wounding and Entrapment Device for Imaging Live Zebrafish Larvae. Zebrafish. 14 (1), 42-50 (2017).
- Huemer, K., et al. Long-term Live Imaging Device for Improved Experimental Manipulation of Zebrafish Larvae. Journal of Visualized Experiments. (128), e56340 (2017).
- Perlin, D. S., Shor, E., Zhao, Y. Update on Antifungal Drug Resistance. Current Clinical Microbiology Reports. 2 (2), 84-95 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados