Method Article
Production de protéines PRMT recombinantes à l’aide du système vectoriel d’expression du baculovirus
Dans cet article
Résumé
Le système de vecteur d’expression de baculovirus (BEVS) est une plate-forme robuste pour le criblage d’expression et la production des méthyltransférases d’arginine de protéine (PRMTs) à utiliser pour des études biochimiques, biophysiques et structurelles. Des quantités milligrammes de matière peuvent être produites pour la majorité des PRT et d’autres protéines d’intérêt nécessitant une plate-forme d’expression eucaryote.
Résumé
Protéine arginine méthyltransférases (PRMTs) résidus de méthylate arginine sur une grande variété de protéines qui jouent des rôles dans de nombreux processus cellulaires. PrmTs peut mono- ou diméthylate arginine groupes guanidino symétriquement ou asymétriquement. L’enzymologie de ces protéines est un domaine complexe et intensément étudié qui nécessite des quantités de milligrammes de protéines recombinantes de haute qualité. Le système de vecteur d’expression de baculovirus (BEVS) utilisant des cellules d’insectes à nucléopolyédrovirus multiple d’Autographa californica (AcMNPV) et de Spodoptera frugiperda 9 (Sf9) a été utilisé pour le dépistage de l’expression et la production de nombreux PRMT, y compris prmt 1, 2 et 4 à 9. Pour dépister simultanément l’expression de plusieurs constructions de ces protéines, y compris les domaines et les fragments tronqués ainsi que les protéines pleine longueur, nous avons appliqué des méthodes évolutives en utilisant des pipettes multicanaux réglables et programmables, combinées à des plaques et des blocs de 24 et 96 puits. Dans l’ensemble, ces ajustements de méthode ont permis une génération à grande échelle d’ADN bacmid, de virus recombinants et de criblage de l’expression des protéines. L’utilisation de récipients de culture avec un volume de remplissage élevé de suspension cellulaire Sf9 a aidé à surmonter les limitations d’espace dans le pipeline de production pour la production de protéines à grande échelle en lot unique. Ici, nous décrivons des protocoles détaillés pour l’expression efficace et rentable des PRMTs fonctionnels pour des études biochimiques, biophysiques, et structurales.
Introduction
Résidus de méthyltransférases d’arginine de protéine d’arginine d’arginine symétrique ou symétrique/asymétrique. Les séquences répétitives RG/RGG/GRG sont fortement préférées par la plupart des PRMTs et se retrouvent dans une grande variété de protéines1,2. Les protéines méthylées par l’arginine telles que les histones ou les facteurs de transcription et les facteurs d’épissage régulent la transcription, l’épissage et la structure de la chromatine3,4. La connaissance croissante de la régulation diverse de l’utilisation du substrat et des cofacteurs, du chiffre d’affaires et de la cinétique des PRMTs, ainsi que la génération d’inhibiteurs sélectifs, ont apporté une lumière mécaniste sur ces enzymes et leurs complexes5,6. Cependant, tous les membres de la famille prmt ne sont pas étudiés dans la même mesure; par exemple, PRMT9 n’a été découvert que récemment comme appartenant à la famille PRMT1. Les études de structure et de fonction enzymatique de ces protéines nécessitent des quantités suffisantes, souvent en milligramme, de protéines recombinantes pour être disponibles.
Le système d’expression procaryote Escherichia coli (E. coli)est généralement le premier choix pour le criblage d’expression utilisant de multiples constructions pour une protéine donnée7,8,9. Cependant, l’expressionà base de E. coli n’entraîne pas toujours des quantités suffisantes de protéines PRMT sous leurs formes actives, comme nous l’avons noté en particulier pour PRMT5 et PRMT7 (voir ci-dessous). Ainsi, les PRMF qui ne se sont pas exprimé dans E. coli ou qui devaient être produites par la machinerie d’expression eucaryote ont été subclonées en vecteurs appropriés pour le criblage de l’expression dans le système vectoriel d’expression alternative du baculovirus (BEVS). Alors que les échantillons de PRMT1, PRMT3 et PRMT8 exprimés par E. coli ont été largement utilisés pour des essais in vitro et la cristallographie, d’autres PRMT tels que PRMT5, qui nécessite un partenaire de liaison MEP50 de son double domaine de méthyltransférase, et des PRMTts tels que PRMT7 et 9, nécessitent l’expression de cellules d’insectes pour obtenir des quantités suffisantes de protéines actives. Dans l’ensemble, les tests normalisés de méthyltransférase à moyen débit pour PRMT4, 5, 6, 7 et 9 ont utilisé le BEVS dans les cellules d’insectes6. Le système vectoriel d’expression des baculovirus (BEVS) est une plateforme polyvalente pour produire des protéines recombinantes nécessitant la machinerie d’expression eucaryote qui permet des modifications post-traductionnelles essentielles pour les études biochimiques, biophysiques et structurelles10,11,12. Plusieurs BEVS sont devenus disponibles dans le commerce depuis la première utilisation signalée de baculovirus en 1983 pour l’expression des protéines13. La plupart de ces protocoles emploient différentes stratégies pour le transfert du plasmide d’expression dans les cellules d’insectes. Ceux-ci incluent Bac-to-Bac, flashBAC, BaculoGOLD Bright, BacVector-3000, BacMagic, BacPAK, etc. Notre protocole est basé sur le système le plus couramment utilisé dans le BEVS, le système Bac-to-Bac14,qui est conçu pour transférer le gène/ADNc codant pour la protéine d’intérêt (POI, ici les PRMT) dans le génome du baculovirus maintenu dans une souche spécialisée de E. coli via une transposition spécifique au site15.
En bref, le vecteur de transfert de plasmide contenant le gène d’intérêt a été transformé en cellules compétentes DH10Bac E. coli pour générer de l’ADN bacmid viral recombinant. Les cellules Sf9 adhérentes ont ensuite été transfectées avec de l’ADN bacmid. Quatre à cinq jours après transfection, des baculovirus de recombinaison initiaux sécrétés dans le milieu de culture cellulaire ont été récupérés et marqués comme virus P1. Les stocks de baculovirus P1 ont ensuite été utilisés pour l’amplification du virus (c.-à-d. la génération de stocks de baculovirus P2) et le dépistage de l’expression des protéines. Sur la base des résultats du criblage de l’expression, les virus P2 pour la meilleure construction d’expression de la protéine ont été identifiés et utilisés pour générer des cultures en suspension de cellules d’insectes infectées par le baculovirus (SCBIIS) pour la production de protéines à grande échelle. Ici, nous décrivons nos protocoles détaillés et décrivons la raison d’être de nos choix de réactifs et de récipients de culture pour soutenir notre stratégie de développement d’une méthodologie plus rapide, rentable et évolutive pour obtenir des quantités suffisantes de protéines recombinantes souhaitées.
Protocole
Remarque : la vue d’ensemble des étapes du protocole BEVS est décrite dans Figure 1.
1. Génération d’un ADN bacmide recombinant
- Préparation de plaques sélectives de gélose LB pour la transformation du DH10Bac
- Préparer des plaques de gélose LB contenant : 50 μg/mL de kanamycine, 7 μg/mL de gentamicine, 10 μg/mL de tétracycline, 200 μg/mL de Bluo-gal et 40 μg/mL d’IPTG à sélectionner pour les transformants DH10Bac.
- Peser 25 g de bouillon LB prémélangé et 13 g de bacto-agar et mettre dans une fiole de 2 L. Porter le volume à 1 L avec de l’eau distillée et de l’autoclave pendant 15-30 min à 121 °C.
- Régler un bain-marie à 50 °C et refroidir la solution de gélose autoclavée au bain-marie pendant 40 à 60 min jusqu’à ce qu’elle soit refroidie à 50-55 °C.
- Ajouter à la solution refroidie la gentamicine à une concentration finale de 7 μg/mL, la kanamycine à une concentration finale de 50 μg/mL, la tétracycline à une concentration finale de 10 μg/mL, bluo-gal à une concentration finale de 200 μg/mL et IPTG à une concentration finale de 40 μg/mL.
- Mélanger la solution de gélose et la partie aliquote de 7 à 10 mL du milieu à chaque plaque de 60 mm à l’aide d’une pipette de 50 mL. Laisser reposer les plaques à température ambiante (2 h) pour durcir. Inverser, envelopper et conserver à 4 °C. Les plaques contenant des antibiotiques sont stables jusqu’à 4 semaines.
- Transformation du plasmide en cellules compétentes DH10Bac E. coli
- Calculer le volume requis de cellules compétentes.
- Décongelez les cellules compétentes sur la glace, tournez doucement vers le bas et remettez en suspension par un léger tapotement.
- Utilisez une pipette à 12 canaux pour distribuer 4 μL de cellules dans chaque puits de la plaque de PCR de 96 puits.
- Ajouter ~ 0,3-0,5 μg d’ADN plasmidique recombinant aux cellules compétentes et mélanger doucement en tapotant. Incuber le mélange sur de la glace pendant 10-15 min.
- Choc thermique du mélange dans une machine PCR à 42 °C pendant 45 s. Refroidir sur la glace pendant 2 min.
- Distribuer 0,5 mL de milieu SOC à chaque puits des blocs de 96 puits (puits de 96 profondeurs 2,4 mL).
- Utilisez une pipette à 12 canaux pour transférer la suspension bactérienne transformée dans le puits correspondant du bloc et couvrez-la d’une feuille d’airpore.
- Placer le bloc dans un incubateur à secousses à 37 °C avec une agitation moyenne (205 tr/min) pendant 4-5 h.
- Répartir uniformément 30-50 μL de la culture sur la surface de la plaque de gélose LB à l’aide de billes de verre stériles. Conserver le reste de la culture à 4 °C.
- Incuber les plaques à 37 °C jusqu’à ce que la couleur des colonies bleu/blanc soit perceptible (40-48 h). Jetez la culture lorsque suffisamment de grandes colonies blanches sont obtenues sur l’assiette.
- Pour s’assurer que les colonies blanches ne contiennent que de l’ADN bacmid recombinant, re-stries une colonie blanche isolée sur des plaques de gélose fraîches de LB contenant des antibiotiques, du bluo-gal et de l’IPTG pour vérifier le phénotype.
- Incuber pendant 48 h à 37 °C.
- Choisissez une colonie blanche vérifiée à partir d’une plaque re-striée pour l’extraction de l’ADN bacmid recombinant.
- Isolement de l’ADN bacmide recombinant
- Inoculer une seule colonie blanche isolée dans 3 mL de milieu LB complété par 50 μg/mL de kanamycine, 7 μg/mL de gentamicine et 10 μg/mL de tétracycline dans des blocs de 24 puits (blocs de 24 puits ronds) et recouvrir d’une feuille d’airpore.
- Cultiver à 37 °C pendant la nuit avec des secousses à 250 tr/min.
- Centrifuger les blocs de 24 puits à 2 100 x g pendant 10 min. Décantez le surnageant, inversez le bloc et appuyez doucement sur un papier de soie absorbant. Ajouter 250 μL de solution 1 (solution de remise en suspension cellulaire) à chaque puits.
- Scellez les blocs avec des tampons de ruban adhésif ou tout autre film d’étanchéité et placez-les sur une plate-forme de secousse à 75 tr / min pendant 5-10 min. Vérifiez chaque puits pour vous assurer que la lyse cellulaire est appropriée et ressuscitez-le si nécessaire, à l’aide d’une pointe de 1 mL.
- Ajouter 250 μL de solution 2 (solution de lyse cellulaire) à chaque puits, sceller les blocs et les placer sur une plate-forme de secousse à 75 tr/min pendant 30 s (pour éviter la contamination croisée des échantillons, n’inversez pas les blocs de 24 puits) en incubation à température ambiante pendant 4 min.
- Ajouter 250 μL de solution 3 (solution de neutralisation), sceller les blocs et les placer sur la plate-forme de secousse à 75 tr/min pendant 30 s. Un épais précipité blanc de protéines et d’ADN génomique de E. coli se formera. Placez l’échantillon sur de la glace pendant 10-15 min.
- Centrifuger pendant 60 min à 2 100 x g à 4 °C pour enroulé étroitement le matériau précipité blanc. Pendant la centrifugation, étiqueter un nouveau tube à microcentrifugation et ajouter 0,8 mL d’isopropanol absolu.
- Transférer délicatement le surnageant dans le tube contenant de l’isopropanol, en évitant tout matériau précipité blanc. Mélanger en inversant doucement le tube plusieurs fois, puis placer sur de la glace pendant 5 à 10 min. À ce stade, l’échantillon peut être conservé à -20 °C pendant la nuit.
- Centrifuger l’échantillon pendant 15 min à 14 000 x g à 4 °C. Retirer le surnageant et ajouter 0,5 mL d’éthanol à 70 % à chaque tube. Inversez le tube plusieurs fois pour laver le culot. Centrifuger pendant 5 min à 14 000 x g à température ambiante. (Facultatif : lavage répété)
- Apportez des échantillons à l’intérieur de la hotte à flux laminaire pour assurer la stérilité de la préparation du plasmide et retirez autant de surnageant que possible.
REMARQUE: Le culot peut se déloger du bas du tube, alors surveillez attentivement le culot lors de la mise au rebut du surnageant. - Sécher à l’air la pastille à l’intérieur de la hotte d’écoulement laminaire pendant 15 à 20 min et dissoudre l’ADN dans 50 μL de tampon d’élution filtré, 10 mM Tris-Cl, pH 8,5 (assurez-vous que les pastilles ne sont pas trop séchées).
- Étant donné que l’ADN bacmid recombinant est supérieur à 135 kb, pour éviter le cisaillement de l’ADN, dissoudre le culot par tapotement doux.
- Pour vérifier la présence du gène d’intérêt dans l’ADN bacmid, configurez le mélange réactionnel PCR dans une plaque PCR de 96 puits.
- Préparer le mélange pcr comme suit : 1 μL de tampon, 0,2 μL (10 mM chacun) de dNTPs, 0,1 μL d’ADN polymérase Taq, 0,1 μL (25 μM) d’amorces avant et arrière (BACV2FWD : tattccggattattcataccg; BACV2REV : ctctacaaatgtggtatggc), 1 μL d’ADN bacmid et 8 μL d’eau.
- Effectuer une amplification des gènes cibles avec dénéaturation initiale pendant 2 min à 95 °C, suivie de 25 cycles de 94 °C pendant 30 s, 55 °C pendant 30 s et 72 °C pendant 1 min/kb.
- Mettre fin à la réaction après une dernière prolongation pendant 7 min à 72 °C.
- Analyser 10 μL du produit d’amplification sur 1 % (p/v) de gel d’agarose contenant une solution de coloration d’acide nucléique par électrophorèse.
- Conserver les DNAs bacmid vérifiés à 4 °C.
2. Génération de stocks de baculovirus recombinants
REMARQUE: Utilisez des cellules Sf9 à croissance exponentielle avec une viabilité de 95% ou plus pour n’importe quelle étape du protocole d’expression du baculovirus, y compris la transfection cellulaire pour la génération de baculovirus, l’amplification du volume du baculovirus, le criblage de l’expression des protéines et la production de protéines.
- Transfection de cellules Sf9 avec de l’ADN bacmid et des réactifs de transfection (T.R.) tels que JetPrime ou X-tremeGENE 9.
REMARQUE: La coloration trypan blue et un hémocytomètre peuvent être utilisés pour déterminer le nombre de cellules viables et la viabilité des cellules%. Les cellules non viables prennent la tache et apparaissent bleues au microscope tandis que les cellules viables restent non colorées. Pour calculer le pourcentage de viabilité cellulaire, on obtient un nombre total de cellules (non souillées et colorées) et le nombre de cellules viables est divisé par le nombre total de cellules et multiplié par 100.- Diluer les cellules Sf9 à croissance exponentielle à une densité cellulaire finale de 4 x 105 cellules/mL dans un milieu d’insecte sans sérum et verser dans le réservoir de réactif stérile.
- Utilisez une pipette multicanal programmable pour ensemencer 0,5 mL de cellules Sf9 diluées dans chaque puits d’une plaque de 24 puits.
- Étiquetez un puits de la plaque comme un témoin (non transfecté) et utilisez-le comme contrôle pour comparer les cellules transfectées et non transfectées afin d’évaluer les signes potentiels d’infections.
- Après avoir ensemencé les cellules dans les plaques, basculez doucement les plaques d’avant en arrière plusieurs fois pour assurer une monocouche uniforme de cellules. Ne faites pas tourbillonner les plaques car les cellules vont se regrouper au centre du puits.
- Incuber les plaques à 27 °C pendant au moins 1 h pour permettre la fixation des cellules aux plaques de culture.
- Mélangez bien le flacon de réactif de transfection. Pour chaque transfection, ajouter 2 μL du réactif de transfection à 100 μL du tampon de transfection. Tout autre milieu d’insecte non complété peut également être utilisé. Déposer le réactif de transfection dilué dans un réservoir de réactif stérile et mélanger doucement pendant 10 s.
- À l’aide d’une pipette à 12 canaux, transférer 102 μL du réactif de transfection dilué dans une plaque stérile de 96 micropuits.
- Transférer 10 μL d’une solution de 0,2 μg/μL d’ADN bacmid recombinant dans le puits correspondant d’une plaque de micropuit de 96 puits et mélanger en secouant doucement (tapotant) la plaque sur les côtés.
- Incuber le mélange de transfection pendant 15-20 min pour permettre la formation complexe.
- À l’aide d’une pipette réglable à 6 canaux conçue pour le transfert entre des plaques de 96 et 24 puits, ajouter le mélange de transfection sur les cellules goutte à goutte dans les puits correspondants de plaques de transfection et incuber pendant 4-5 h à 27 °C.
- Basculez doucement les plaques d’avant en arrière plusieurs fois pendant le temps d’incubation pour assurer la distribution uniforme du mélange de transfection sur la monocouche cellulaire.
- 4 à 5 h après la transfection, ajouter 1,5 mL de milieu sans sérum d’insecte complété par 10 % (v/v) final de sérum fœtal bovin inactivé thermiquement et d’antibiotique-antimycotique à 1 % (v/v) de volume final (100 unités/mL de pénicilline, 100 μg/mL de streptomycine et 0,25 μg/mL d’amphotéricine B).
- Incuber les cellules dans un incubateur à 27 °C pendant 72-96 h. Basculez doucement les plaques de transfection une fois par jour lorsque cela est possible.
- Recherchez les signes d’infection (SOI), évidents dans les cellules transfectées à 72-96 h après la transfection (Figure 2). Gardez à l’esprit que les cellules transfectées commenceront à produire le virus et infecteront davantage la culture; ainsi, recherchez les signes d’infection.
REMARQUE: Les signes d’infection sont des changements structurels dans les cellules de l’insecte, tels qu’une augmentation de 25 à 50% du diamètre de la cellule, des noyaux cellulaires élargis, une forme uniformément arrondie, une perte de prolifération et d’adhérence à la surface de la boîte de culture, ainsi qu’une diminution de la viabilité cellulaire (Figure 2. Baculovirus Cellules Sf9 infectées et non infectées).
3. Dépistage de l’expression des protéines à petite échelle et amplification du virus
- Infection des cellules Sf9 avec des stocks de baculovirus P1.
REMARQUE: 4-5 jours après la transfection, les signes d’infection devraient être évidents dans les cellules transfectées par rapport aux cellules témoins (non transfectées) sous un microscope inversé. Les baculovirus recombinants initiaux sécrétés dans le milieu de culture cellulaire doivent être prêts à être collectés.- Graines 2 x 105 cellules Sf9 à croissance exponentielle dans des milieux d’insectes sans sérum dans chaque puits des plaques de 24 puits dans un volume total de 2 mL pour l’infection par les virus P1 afin d’amplifier le volume du virus (ce qui entraîne la génération des virus P2).
- Après avoir pipeté les cellules dans les plaques, basculez doucement les plaques, en utilisant un mouvement de va-et-vient pour assurer une monocouche uniforme. Ne faites pas tourbillonner les plaques car les cellules vont se regrouper au centre du puits.
- Incuber les plaques à 27 °C pendant au moins 1 h pour permettre l’adhérence cellulaire à la plaque.
- Distribuer 4 mL de cellules Sf9 à une densité de 3,5-4 x 106 dans un milieu sans sérum d’insecte dans chaque puits de blocs de 24 puits pour infecter avec les virus P1 pour le dépistage de l’expression des protéines.
REMARQUE: Étiquetez un puits des plaques de 24 puits et des blocs de 24 puits comme contrôle et utilisez-le comme contrôle non infecté pour la comparaison des cellules infectées et non infectées lors de la recherche de SOI. - Utiliser un multicanal électronique programmable pour permettre la collecte simultanée des virus P1 (étape 2.1.13), l’infection des cellules Sf9 fraîchement ensemencées (étape 3.1.1) et l’infection des cellules de suspension dans les blocs de 24 puits (étape 3.1.4) avec 150 μL de virus P1.
- Faites tourner le reste des stocks viraux P1 collectés pendant 15 min à 17 970 x g,transférez-les dans des tubes à microcentrifugation et conservez-les dans l’obscurité à 4 °C.
- Balancer doucement les plaques de 24 puits (étape 3.1.1) sur un agitateur alternatif pour assurer une répartition uniforme des virus P1 ajoutés sur la monocouche cellulaire; répétez cela plusieurs fois pendant la période d’incubation.
- Couvrir les blocs de 24 puits avec la culture en suspension de cellules Sf9 infectées (étape 3.1.4) avec une feuille d’airpore.
- Incuber les blocs de 24 puits à 27 °C, en secouant à 245 tr/min pendant 72-96 h.
- Recherchez soi dans les 72-96 h après le temps d’infection dans les plaques de 24 puits avec des virus de P2 (étape 3.1.1) et dans les blocs de 24 puits (étape 3.1.4) avec des cellules infectées pour le criblage d’expression.
REMARQUE: 4-5 jours après l’infection des cellules Sf9 par les virus P1, soi devrait être évident dans les cellules infectées par rapport aux cellules de contrôle non infectées sous un microscope inversé. - Recueillir les virus P2 à partir de plaques de 24 puits, centrifuger pendant 15 min à 17 970 x g,les transférer dans des tubes de microcentrifugation et les stocker dans l’obscurité à 4 °C.
- À 72-96 h après l’infection, vaporiser sur les blocs de 24 puits avec de l’éthanol à 70%, introduire dans la hotte à flux laminaire et vérifier la densité cellulaire et la viabilité dans quelques puits par coloration Trypan Blue.
- Procéder à la purification des protéines si les cellules ont des signes d’infection et la viabilité est proche de 70-75% tel qu’évalué par la coloration Trypan Blue.
- Granuler les cellules en centrifugant les blocs de 24 puits à 525 x g à 4 °C pendant 15 min. Jeter le surnageant et bien suspendre les pastilles dans 1 mL de tampon de lyse comprenant 25 mM tris pH 8,0, 300 mM NaCl, 0,6 % NP-40, 2 mM imidazole, 5% glycérol (v/v) et 1x cocktail inhibiteur de protéase (100x cocktail inhibiteur de protéase comprenant l’aprotinine 0,25 mg/mL, le leupeptine 0,25 mg/mL, pepstatine A 0,25 mg/mL ; E-64 0,25 mg/mL).
- Conserver la suspension cellulaire à -80 °C pour la purification ultérieure (voir 3.2.2).
- Purification de protéines à partir d’une suspension cellulaire congelée dans des blocs d’expression de test de 24 puits.
- Assemblage du bloc de liaison (Figure 3).
- Placer 3 couches de parafilm qui se chevauchent sur le dessus du bloc de puits de 96 profondeurs (puits de 96 profondeurs de 2,4 mL).
- Placez une plaque filtrante de 96 puits (microplaque filtrante, 96 puits, polypropylène avec membrane de polyéthylène de poids moléculaire ultra élevé de 25 μm) sur le dessus du bloc de puits de 96 profondeurs.
- Poussez la plaque filtrante pour fixer les pointes dans le parafilm pour sceller la plaque filtrant du bloc profond de 96 puits.
- Transférer 50 μL de boue de résine Ni-NTA pré-équilibrée à 50 % dans chaque puits de la plaque filtrante.
- Procédure d’expression de testTest expression procedure
- Placer la suspension de cellules congelées (étape 3.1.15) présente dans des blocs de 24 puits dans un bain-marie à RT pendant 5-10 min, puis agiter à 450 rpm pendant 20 min.
- Centrifuger les blocs de 24 puits à 3 275 x g pendant 15 min.
- À l’aide d’une pipette multicanal, transférer les lysats dégagés dans une plaque filtrante contenant 50 μL de boue de résine Ni-NTA pré-équilibrée à 50 % (étape 3.2.1.4) et sceller la plaque filtrante avec un tapis de capuchon de 96 puits (tapis de capuchon de 96 puits, pour une utilisation avec un puits carré, 2 mL).
REMARQUE: Utilisez quelques élastiques pour maintenir le bloc de liaison ensemble pendant les étapes d’incubation et de centrifugation. - Placez le bloc de liaison sécurisé pendant 45-60 min dans un rotateur dans une chambre froide pour incuber les lysats effacés avec de la résine Ni-NTA.
- Après l’incubation, soulevez soigneusement la plaque filtrante et retirez la couche de parafilm de la surface du bloc de puits profond de 96 profondeurs (étape 3.2.1.1).
- Replacez la plaque filtrant sur le dessus du bloc de puits de 96 profondeurs et faites tourner le bloc de liaison sécurisé pendant 2 min à 235 x g.
- Laser la liaison Résine Ni-NTA 2x avec 2 mL de tampon de lavage comprenant 25 mM Tris pH 8,0, 300 mM NaCl, 5% de glycérol, et 15 mM d’imidazole.
- Faites tourner le bloc avec tampon de lavage à chaque fois pendant 5 min à 235 x g pour assurer l’élimination complète du liquide résiduel.
- Transférer la plaque filtrant sur le dessus de la plaque PCR de 96 puits contenant 10 μL de colorant de chargement 4x.
- Ajouter 40 μL de tampon d’élution (25 mM Tris pH 8,0, NaCl 300 mM, 5 % de glycérol, 500 mM d’imidazole) à chaque puits de la plaque filtrante et incuber pendant 5 min.
- Faites glisser le bloc vers le bas pour éluer les protéines dans la plaque pcr de 96 puits à 235 x g pendant 10 min.
- Scellez la plaque PCR de 96 puits avec un tampon tactile résistant aux hautes températures et chauffez à 98 ° C pendant 3 min.
- Chargez 15 μL d’échantillons de protéines éluées dans un tampon Laemmli standard sur un gel SDS-PAGE à 4-20% à côté de l’échelle de protéines et faites fonctionner le gel avec un tampon de fonctionnement standard contenant une FDS.
- Tachez le gel avec du bleu de Coomassie et détachiez avec de l’eau. Analysez les résultats de l’expression de test pour identifier les meilleures constructions express pour la production à grande échelle.
- Assemblage du bloc de liaison (Figure 3).
4. Préparations des cellules d’insectes infectées par le baculovirus (SCBIIC) pour la production de protéines
- 4 jours avant le temps de production prévu, diviser de façon exponentielle les cellules Sf9 à croissance exponentielle à une densité cellulaire finale de 2 x10 6 cellules/mL en 125 mL / 250 mL / 500 mL Erlenmeyer verre shake flacons avec des chicanes dans 50 mL / 100 mL / 200 mL de milieu sans sérum d’insecte contenant 1% (v / v) final antibiotique-antimycotique.
- Ajouter 0,150 mL / 0,300 mL / 0,6 mL de virus P2 appropriés, incuber les cellules infectées à 165 tr / min sur un agitateur orbital d’un pouce et à une température inférieure de 25 °C pour ralentir la division cellulaire.
- À 4 jours après l’infection, vérifiez les cellules au microscope pour soi et procéder à la production si la viabilité cellulaire telle que vérifiée avec la tache trypan bleu est proche de 70-75%.
5. Préparations cellulaires Sf9 pour la production de protéines à grande échelle
- 4 jours avant le temps de production prévu, calculer le volume requis de cellules Sf9 pour la production de protéines à grande échelle.
- Graine 2 L de cellules Sf9 à croissance exponentielle dans un milieu sans sérum d’insecte à une densité cellulaire de 1 x 106 cellules /mL dans des flacons de secouer Fernbach de 2,8 L.
- Incuber les fioles à 27 °C en les agitant à 150 tr/min.
NOTA : Pour prévenir la contamination bactérienne dans la culture cellulaire Sf9, utilisez la gentamicine à une concentration finale de 10 μg/mL ou la pénicilline/streptomycine à 50 U/mL et 50 μg/mL, respectivement.
6. Infection des cellules Sf9 par SCBIIS pour la production de protéines à grande échelle
- Diviser 2 L ou 4 L de cellules Sf9 à croissance exponentielle dans un milieu sans sérum d’insecte en une densité cellulaire finale de 4 x 106 cellules/mL dans des flacons de secouage Tunair de 2,5 L ou des flacons de réactifs de 5 L.
- Ajouter 10 à 12 mL/L de la culture en suspension de cellules d’insectes infectées par le baculovirus (SCBIIC).
- Incuber la culture infectée de cellules Sf9 sur un agitateur à 145 rpm à la température inférieure de 25 °C (pour ralentir la division cellulaire) pendant 72-96 h.
- À 72 h après l’infection, vérifier les cellules au microscope pour le SOI et évaluer la viabilité cellulaire.
- Habituellement, après environ 72 h post-infection, la viabilité des cellules Sf9 tombe à 70%-75% (mesurée à l’aide de la tache trypan blue). Récolter des cellules Sf9 infectées dans une bouteille de polypropylène de 1 L par centrifugation à 900 x g pendant 15 min à 4 °C.
- Remettre en suspension la pastille cellulaire recueillie à partir de 1 L de la culture cellulaire de production avec 20-25 mL de 1x PBS en tourbillonnant doucement et en la transférant dans des tubes coniques de 50 mL.
- Faire tourner la suspension cellulaire à 900 x g pendant 15 min et jeter la solution de PBS.
- Ressusciter le culot de cellules lavées avec 20-25 mL du tampon de suspension (20 mM Tris-HCl pH 8,0, 500 mM NaCl, 5% glycérol, 1x cocktail inhibiteur de protéase) et gel flash dans l’azote liquide; conserver à −80 °C jusqu’à la purification.
NOTE: Les procédures de purification des PRMF ont été décrites en détail dans l’article 6 publié par leCGS.
Résultats
Une vue d’ensemble du protocole BEVS est présentée à la figure 1. De multiples constructions d’expression de PRMTs, y compris des fragments complets, des domaines et tronqués, ont été générées au Consortium de génomique structurelle (SGC, Toronto) selon des stratégies internes dans le but d’augmenter le taux de réussite pour identifier les protéines solubles et stables avec un niveau d’expression relativement élevé7,9. Les lecteurs intéressés sont encouragés à examiner les définitions et la méthodologie de la CGT de la conception d’un « fragment » comme le segment de la séquence de gènes incorporé dans un clone d’expression, « domaine » comme un domaine structurel annoté PFAM et « construction » comme le fragment cloné dans un vecteur d’expression, qui ont tous été décrits en détail dans une publication antérieure7. Les constructions d’expression des PRT présentées dans ce protocole sont destinées à la production des protéines marquées à la polyhistidine clonées dans le vecteur pFBOH-MHL, qui est un dérivé du vecteur pFastBac1. Sur la figure 4,nous présentons l’analyse SDS-PAGE des constructions solubles his-marquées de PRMT1, 2, 4-9 purifiées à partir de pastilles collectées après 4 mL de production dans des cellules Sf9 (étape 3.1.4). Prmt1 pleine longueur (FL) et PRMT9 ne sont pas présentés dans ce gel, puisque FL PRMT1 a été produit à partir de E. coli,et FL PRMT9 produit à partir de BEVS a été purifié par Flag-tag6. Les constructions tronquées de PRMT1, FL PRMT4 et toutes les constructions PRMT8 montrent un rendement relativement élevé, mais les éluats protéiques contiennent des fractions de contaminants co-purifiés. Ces constructions nécessitent une optimisation supplémentaire des protocoles de purification. Des approches supplémentaires sont donc nécessaires pour améliorer la pureté de ces protéines à partir de productions à grande échelle, telles qu’une réduction de la quantité de billes de nickel au stade de l’incubation avec un lysat clarifié; une augmentation des concentrations d’imidazole dans les tampons de lavage; clivage de l’his-tag avec de la TEV protéase, suivi d’une application sur une résine d’affinité Ni ; et des étapes de purification supplémentaires telles que l’exclusion de taille et la chromatographie par échange d’ions. Les constructions de PRMT2 montrent un rendement significativement inférieur par rapport à d’autres protéines et à la protéine PRMT2 pleine longueur accompagnée d’une forte bande de contaminants. La production à grande échelle et deux étapes de purification telles que l’IMAC et l’exclusion de taille ont confirmé un faible niveau d’expression pour cette construction ainsi que la présence persistante du contaminant co-purifiant pour la protéine FL. Des protéines pures ont été obtenues pour le complexe PRMT5 produit et purifié avec son partenaire de liaison obligatoire, MEP50. La construction tronquée de PRMT9 a presque deux ou trois fois plus bas niveau d’expression, près de 1,5 mg/L, par rapport à d’autres PRMT. Néanmoins, les stocks viraux recombinants de cette construction ont été utilisés pour la production à grande échelle, des cristaux diffracting ont été obtenus, et la structure a été résolue pour cette protéine avec PRMT4, 6 et 7(Figure 5).
Pour les productions de scale-up, les virus P2 correspondants ont été utilisés pour infecter la culture en suspension de cellules d’insectes Sf9. Cette étape génère 50/100/200 mL de cellules infectées par le baculovirus contenant des cellules infectées et des virus P3 dans le surnageant. Pour la production de protéines à grande échelle, 2 L de cellules Sf9 ont été cultivées dans chacune des fioles de Fernbach de 2,8 L à 150 tr/min, 27 °C(figure 6). Le jour de la production, 2 L de cellules Sf9 (viabilité cellulaire > 97%) dans des flacons de secouage Tunair de 2,5 L ou 4 L dans des flacons de réactifs de 5 L ont été dilués à une densité cellulaire de 4 x 106/mL. Ces cellules ont été infectées directement par 10-12 mL/L de culture en suspension de cellules d’insectes infectées par le baculovirus et incubées à une température abaissée de 25 °C, à 145 rpm. L’infection du lot de production directement par une culture en suspension de cellules d’insectes infectées par le baculovirus a réduit de manière significative les étapes laborieuses et chronophages dans l’amplification du volume du virus, à l’exclusion de la manipulation supplémentaire des cellules infectées, et a évité la réduction du titre et de la dégradation du virus. L’entretien de la culture cellulaire SF9 et la production à grande échelle ont été effectués dans les récipients de culture avec un volume de remplissage élevé pour adopter une production de protéines à grande échelle dans le lot unique(Figure 6).
Les protéines PRMT 4, 5 (en complexe avec MEP50), 6, 7 et 9 produites à partir de la plate-forme de production médiée par baculovirus ont été utilisées pour la caractérisation cinétique et le criblage des composés inhibiteurs au SGC6. Les structures cristallines ont été résolues et déposées dans la banque de données sur les protéines (PDB) pour les formes pleine longueur ou tronquées des protéines PRMT 4, 6, 7 et 9 avec diverses sondes et inhibiteurs chimiques. Les plasmides d’expression de ces PRT ont été déposés dans le dépôt de plasmides Addgene (Addgene est un partenaire distributrice de la CGT, https://www.addgene.org/) et sont à la disposition du milieu de la recherche(figure 5).
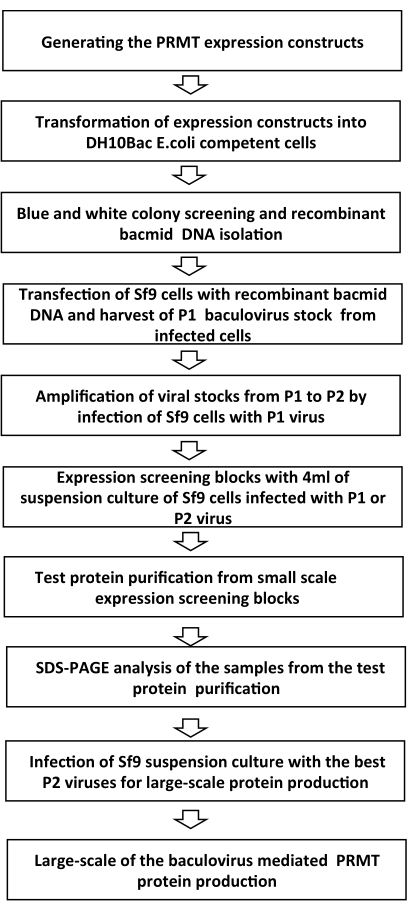
Figure 1: Aperçu schématique des étapes du processus d’expression du baculovirus Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Baculovirus Cellules Sf9 infectées et non infectées. Les signes d’infection sont des changements structurels dans les cellules de l’insecte, tels qu’une augmentation de 25 à 50% du diamètre de la cellule, des noyaux cellulaires élargis, une forme uniformément arrondie, une perte de prolifération et une adhérence à la surface de la boîte de culture, ainsi qu’une diminution de la viabilité cellulaire. Barre d’échelle blanche 200 μm. Les signes d’infection présentés ici sont les mêmes pour les cellules transfectées utilisant les deux réactifs de transfection, JetPrime et X-tremeGene 9. L’exemple particulier montré est pour le réactif de transfection JetPrime. (A) Cellules Sf9 non infectées comme témoin. (B) Cellules Sf9 infectées par le baculovirus. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Assemblage de plaque de liaison pour une purification rapide des protéines d’expression de test. S’il vous plaît voir le texte pour plus de détails, étapes 3.2.1-2 S’il vous plaît cliquez ici pour voir une version plus grande de cette figure.
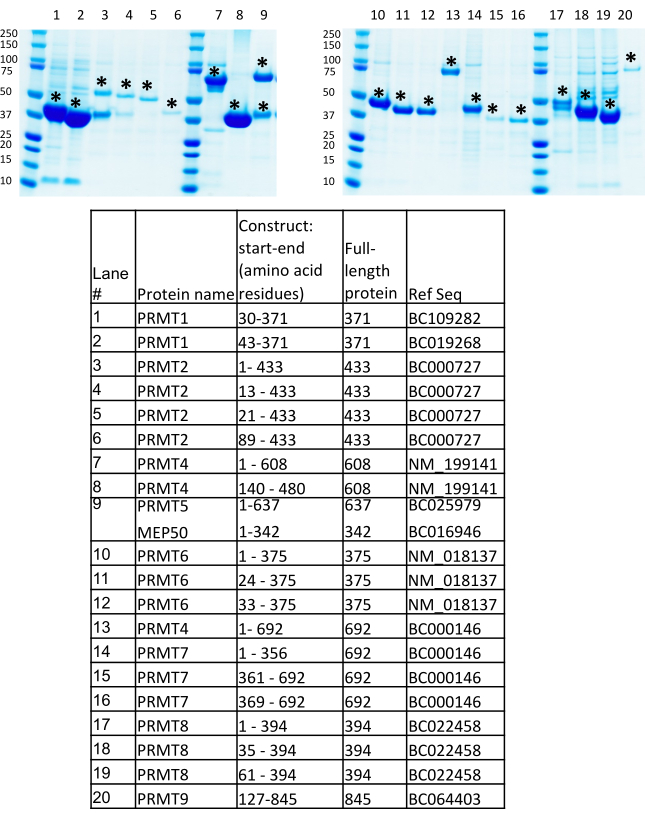
Figure 4: Résultats du criblage de l’expression protéique. Résultats de criblage d’expression de protéine de la production négociée par baculovirus dans 4 mL de culture de suspension sf9 infectée par les virus recombinants P1 correspondants pour différents PRMT et le complexe PRMT5-MEP50. Veuillez cliquer ici pour voir une version plus grande de cette figure.
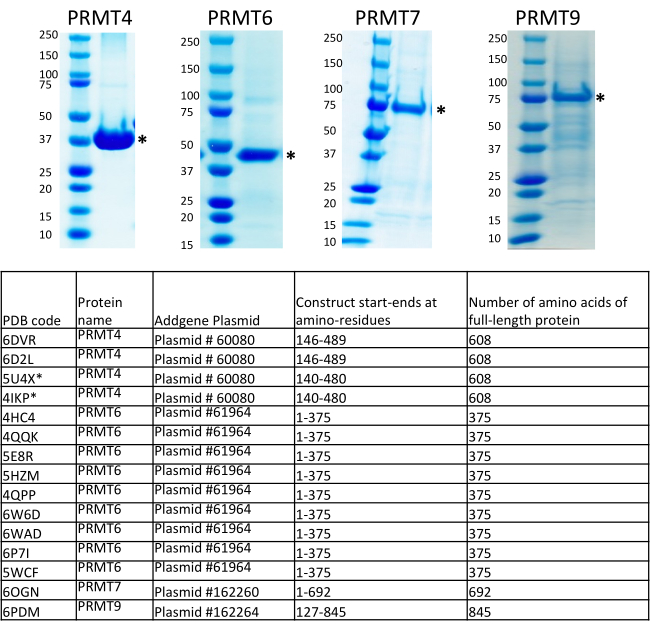
Figure 5: Résumé des constructions d’expression pour PRMT4, 6, 7 et 9 utilisées pour les études sur la structure cristalline au Structural Genomics Consortium, Toronto (SGC). Les structures cristallines ont été résolues et déposées dans la banque de données sur les protéines (APB) pour les formes pleine longueur ou tronquées des protéines PRMT 4, 6, 7 et 9 avec diverses sondes chimiques et inhibiteurs. Les plasmides d’expression de ces PRT ont été déposés dans le dépôt de plasmides Addgene et sont à la disposition de la communauté de recherche (Addgene est un partenaire distributrice du CGT, https://www.addgene.org/). Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 6: Entretien des cellules d’insectes Sf9 et production de protéines dans les différents récipients de culture : (A)Fiole de Fernbach de 2,8 L pour l’entretien des cellules et la production de protéines. L’utilisation du volume de remplissage de 72% augmente le débit de 2,5 fois dans une plate-forme de secousse. (B) Les fioles de secouage Tunair (seules 9 fioles sur 10 sont présentées sur cette photo) et les bouteilles de réactifs avec un volume de remplissage de 80 % augmentent considérablement la capacité de production de la plate-forme de secousse. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
L’un des avantages du BEVS dans les cellules d’insectes se concentre sur la capacité de la machinerie de modification post-traductionnelle à permettre des modifications plus complexes telles que la phosphorylation, la myristoylation et la glycosylation. Associées au repliement très efficace des protéines de mammifères, ces modifications facilitent de grandes quantités de protéines modifiées et repliées adaptées aux expériences en aval physiologiquement pertinentes16.
Ici, nous avons décrit les protocoles détaillés du BEVS mettant l’accent sur les éléments critiques pour le criblage réussi de l’expression de multiples constructions de protéines PRMT et la production à grande échelle de protéines PRMT dans la plate-forme d’expression de Baculovirus: 1) L’utilisation de pipettes multicanaux régulières, réglables et programmables pour transférer les matériaux biologiques entre 24 et 96 - plaques et blocs de culture cellulaire de puits aux stades de la génération d’ADN bacmid et de virus; une collection des virus recombinants, une amplification des volumes viraux des virus recombinants et la préparation des blocs de criblage de l’expression protéique. 2) Réactifs de transfection haute performance et rentables pour la génération de virus recombinants. 3) Culture en suspension de cellules d’insectes infectées par le baculovirus (SCBIIC) pour la production de protéines à grande échelle. 4) Utilisation de fioles de secouage Fernbach à volume élevé de 2,8 L pour maintenir la culture en suspension sf9 et de flacons de secouer Tunair de 2,5 L et de bouteilles de réactifs de 5 L pour la production de protéines à grande échelle.
Considérations spéciales et justification des étapes de transformation et de transfection.
Bien qu’un protocole commercial recommande d’utiliser 100 μL de cellules compétentes pour une transformation14,l’efficacité de transformation des cellules commerciales compétentes en DH10Bac E. coli est aussi élevée que 1 x 108 ufc / μg d’ADN, nous n’utilisons donc que 4 μL. Ceci est suffisant pour que chaque transformant obtienne des colonies recombinantes blanches isolées pour l’isolement de l’ADN bacmid. Les cellules Sf9 adhérentes dans la plaque de transfection de 24 puits ont été ensemencées à une densité cellulaire de 2 x10 5 /mL dans 0,5 mL de milieux d’insectes sans sérum. Ce volume est suffisant pour assurer une couverture uniforme de la surface de travail du puits. Dans le même temps, il ne dilue pas trop le mélange de transfection, ce qui améliore l’efficacité de la transfection. Les réactifs de transfection ne sont pas toxiques pour les cellules Sf9, et l’échange de médias n’est pas nécessaire. Au lieu d’un changement de support, un support supplémentaire de 1,5 mL contenant 10% (v / v) FBS est ajouté dans la plaque de transfection à 4-5 heures après le temps de transfection pour faciliter la croissance cellulaire. L’efficacité de transfection des deux réactifs de transfection est élevée. Pourtant, avec X-tremeGene 9, les signes d’infection dans les cellules transfectées (Figure 2) apparaissent 10-12 h plus tôt qu’avec le réactif JetPrime, nous choisissons donc entre ces réactifs en fonction du calendrier de travail des prochaines étapes des protocoles, ce qui offre une certaine flexibilité dans le processus global.
Le criblage d’expression de test de protéine peut être mis en place avec des virus P2 si la quantité des virus recombinants initiaux, recueillis à partir de la plaque de transfection et étiquetés comme P1, est un facteur limitant à utiliser pour le criblage d’expression de protéine.
Considérations lors du passage de petits à grands volumes de culture.
Historiquement, on croyait que la croissance cellulaire optimale nécessite un espace d’air élevé dans la culture de suspension de la maintenance des cellules Sf9 et des productions à l’échelle. Cependant, en 2014, il a été signalé que l’espace en haute mer dans les navires de culture est moins critique qu’on ne le pensait auparavant17. Un récipient de culture installé à l’aide d’une vitesse de secousse ajustée de manière appropriée au jet orbital de la plate-forme de secousse fournira un transfert d’oxygène suffisant même dans la culture de suspension à volume de remplissage élevé en créant et en maintenant de petites bulles d’air pendant une période plus longue. Avec cette approche, les cellules d’insectes disponibles dans le commerce peuvent être cultivées à une vitesse de secousse plus élevée dans une plage normale du temps de doublement des cellules sans sacrifier la viabilité cellulaire élevée.
Ainsi, il y a 6 ans, nous avons commencé à augmenter le volume de culture en suspension dans une fiole secouée pendant l’entretien des cellules et avons introduit un type différent de récipient de culture pour la production de protéines tout en ajustant et en surveillant les conditions de secousse (Figure 6). Pour établir des conditions optimales dans ces vaisseaux de culture, nous avons surveillé les paramètres de culture cellulaire Sf9 tels que le temps de doublement cellulaire ainsi que la viabilité, la taille et la forme des cellules, l’état d’agrégation et l’infectiosité des cellules.
Par exemple, pour l’entretien des cellules Sf9, dans les flacons de shake de Fernbach de 2,8 L, nous cultures 2 L au lieu de 0,8 L des cellules de suspension Sf9 secouant à 150 tr / min à 27 ° C et la viabilité cellulaire est proche de 99%, avec des cellules de division saines de forme uniforme. Pour la production à grande échelle, nous infectons 4 L de cellules dans des bouteilles de réactifs de 5 L secouant à grande vitesse à 145 tr / min à une température abaissée de 25 ° C. Les incubateurs les plus couramment utilisés avec une plate-forme de secousse intégrée peuvent contenir des flacons de secouage de 6 x 2,8 L ou des bouteilles de réactif de 6 x 5 L, ou des flacons de secouage Tunair de 10 x 2,5 L. Ainsi, la capacité de la plate-forme de secousse unique, si nous remplissons les flacons de secouage Fernbach et les bouteilles de réactifs à 1/3 par rapport au volume de remplissage élevé des récipients est de 4,8 L contre 12 L en utilisant des flacons de secouer Fernbach de 2,8 L et de 10 L contre 24 L en utilisant des bouteilles de réactifs de 5 L(Figure 6). L’entretien de la culture cellulaire en suspension et la production à grande échelle dans les récipients de culture avec un volume de remplissage élevé nous ont aidés à surmonter les limites des volumes de production et à adopter une plate-forme à grande échelle. Ainsi, cela est très utile pour les laboratoires qui n’ont pas accès aux bioréacteurs et/ou dont l’espace dans les pipelines de production est limité.
Ce protocole pourrait être facilement adapté à la production et à la purification de constructions protéiques avec différentes étiquettes d’affinité en utilisant des résines appropriées et en modifiant les tampons de purification comme cela a été décrit dans l’article6 publié par SGC pour les protéines pleine longueur marquées par drapeau de PRMT4, 7, 9, et le complexe PRMT5-MEP50 marqué par His et PRMT6. Bien que nous décrivions un protocole BEVS pour la famille prmt des protéines, la même approche peut être appliquée à n’importe quelle autre famille de protéine.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs souhaitent remercier Dalia Barsyte-Lovejoy d’avoir pris le temps de fournir des commentaires précieux et critiques sur le manuscrit et tous nos collègues de la CGT qui ont travaillé avec la famille de protéines PRMT exprimées à partir du système vectoriel d’expression du baculovirus.
Le CGS est un organisme de bienfaisance enregistré (numéro 1097737) qui reçoit des fonds d’AbbVie, bayer AG, Boehringer Ingelheim, Genentech, Génome Canada par l’entremise de l’Institut de génomique de l’Ontario [OGI-196], de l’UE et de l’EFPIA par l’entremise de l’entreprise conjointe Innovative Medicines Initiative 2 [subvention EUbOPEN 875510], de Janssen, de Merck KGaA (alias EMD au Canada et aux États-Unis), de Pfizer, de Takeda et du Wellcome Trust [106169/ZZ14/Z].
matériels
| Name | Company | Catalog Number | Comments |
| 2.8L Nalgene Fernbach Culture Flask, Polycarbonate, | Nalgene | 29171-854 | For large scale maintenance of suspension culture of Sf9 cells |
| 24-Well Blocks RB | Qiagen | 19583 | For incubation of 4ml of suspension Sf9 cells for protein expression screening |
| 4-20 Criterion TGX Gel 26W 15 ul | Biorad | 5671095 | For SDS-PAGe analysis of the purified proteins |
| 50ml Reagent Reservoir | Celltreat Scientific Products | 229290 | Reservoir used for diluted transfection reagent and Sf9 cells suspension |
| 96-well cap mat, for use with square well, 2 mL | Greiner Bio-One | 381080 | Used to cover 96 well block |
| 96 well PCR plate | Eppendorf | 30129300 | |
| Bacto agar | BD | 214010 | For LB-agar selection paltes |
| Airpore Tape Sheets | Qiagen | 19571 | To cover 24 well blocks for protein expression screening |
| Allega X-15R Centrifuge | Beckman Coulter | 392932 | |
| Antibiotic Antimycotic (100x) | Gibco | 15240112 | |
| Bacmid DNA | in-house | non-catalog item | Bacmid DNA for baculovirus production |
| Bluo-Gal, 1g | Thermo Fisher | 15519028 | |
| Beckman JLA 8.1000 | |||
| Cell Culture Plates, 24-Well, with lid, flat bottom, sterile | Eppendorf | 30722116 | Tissue culture treated plate |
| Cell Resuspension Solution 0.5 L | Millipore Sigma | LSKCRS500 | For Bacmid DNA extraction |
| Cell Lysis Solution 0.5 L | Millipore Sigma | LSKCLS500 | For Bacmid DNA extraction |
| CELLSTAR Tissue Culture Plates, 96 well | Greiner Bio-One | 655180 | For transfection mix |
| ClipTip 1250, filter reload, sterile | ThermoFisher Scientific | 94420818 | Tips for programmable and adjustable multichannel pipette |
| dNTP Mix (25 mM each) | Thermo Fisher Scientific | R1121 | |
| E1-ClipTip Electronic Adjustable Tip Spacing Multichannel Equalizer Pipette, 15 to 1250 μL | ThermoFisher Scientific | 4672090BT | Programmable and adjustable multichannel pipette |
| E4 XLS adjustable spacer 6-channel pipette, 20-300 μL | Ranin | LTS EA6-300XLS | Ranin adjustable multichannel pipette |
| Filter microplate, 96-well, polypropylene, with 25 µm ultra high molecular weight polyethylene membrane | Agilent | 201005-100 | For protein purification in expression screening |
| Full-Baffle Flask Kit Tunair, 2.5L | IBI Scientific | SS-6003C | For large scale protein production in suspension culture of SF9 cells |
| Gentamicin 10x10ml | BioShop | 15750078 | |
| Heat Inactivated Fetal Bovine Serum | Wisent Biocenter | 080-450 | |
| I-Max Insect Media W/ L-Glutamine, 1 L | Wisent Biocenter | 301-045-LL | Serum free insect cells growth medium |
| InstantBlue, Ultrafast Protein Stain | Expedeon Protein Solutions | ISB1L-1L | For protein gel (SDS-PAGE) staining |
| Iptg, Ultra Pure, Dioxane Free, Min 99.5% | BioShop | IPT001.100 | |
| JetPRIME Transfection Reagent Provided with jetPRIME buffer | POLYPLUS TRANSFECTION Inc | 114-01 | For Sf9 cells transfection to generate baculovirus |
| Kanamycin Monosulfate | BioShop | KAN201.100 | |
| Lb Broth (Lennox), Powder Microbial Gro& | Sigma | L3022-1KG | |
| Masterblock 96 deep well 2.4mL | Greiner Bio-One | 780285-FD | Used in the transformation and expression screening procedures |
| Max Efficiency DH10Bac Competent Cells , 0.5ml | Thermo Fisher | 10361012 | Competent cells for bacmid DNA generation |
| mLINE 12-Channel Pipette, adjustable 30 - 300 uL | Sartorius | Sartorius 725240 | 12 channel pipette |
| Neutralization Solution, 0.5 L | Millipore Sigma | LSKNS0500 | For bacmid DNA extraction |
| New Brunswick Innova 44R, 120V, orbit 2.5 cm (1 in) | Eppendorf | M1282-0004 | Shaker incubator for incubaion of suspension of Sf9 cells |
| Ni-NTA Agarose | Qiagen | 30250 | For protein purification |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | LS15140122 | |
| PYREX Delong Shaker Erlenmeyer Flask with Baffles, Corning 500ml | Pyrex | 4444-500 | For suspension culture of Sf9 cells |
| PYREX Delong Shaker Erlenmeyer Flask with Baffles, Corning 125ml | Pyrex | 4444-125 | For suspension culture of Sf9 cells |
| PYREX Delong Shaker Erlenmeyer Flask with Baffles, Corning 250ml | Pyrex | 4444-250 | For suspension culture of Sf9 cells |
| RedSafe Nucleic Acid Staining Solution | Froggabio | 21141 | |
| RNase A, 0.9 mL | Millipore Sigma | LSKPMRN30 | For suspension buffer for bacmid DNA extraction |
| Roll & Grow Spherical Glass Plating Beads | MP Biomedicals | 115000550 | For spread of bacterial cells across the surface of an agar plate. |
| RT-LTS-A-300μL-768/8 (tips) | Ranin | 30389253 | Tips for ranin multichannel pipette |
| S.O.C. Medium | Thermo Fisher Scientific | 15544034 | |
| Serum, Cell Culture, Fetal Bovine Serum (Fbs), Hyclone, Characterized Canadian | cytivalifesciences | SH3039602 | Addition to the serum free medim for the transfected cells |
| Sf9 cells | Thermo Fisher | 12659017 | Insect cells |
| Sfx-Insect Cell Culture Media | Cytiva (Formerly GE Healthcare Life Sciences) | SH3027802 | Serum free insect cells growth medium |
| Tape Pad | Qiagen | 19570 | Tape Pad |
| Taq DNA Polymerase with ThermoPol Buffer - 2,000 units | New England Biolabs | M0267L | |
| Tetracycline Hcl | BioShop | TET701.10 | |
| Trypan Blue 0.4% Solution | Gibco | 15250061 | For assessment of cell viability |
| VITLAB Reagent Bottles, PP with Screw Caps, PP, BrandTech, 5L | VITLAB | V100889 | For large scale protein production in suspension culture of Sf9 cells |
| VWR Digital Mini Incubator | VWR | 10055-006 | Incubator for adherent Sf9 cells |
| VWR Incubating Microplate Shaker | VWR | 97043-606 | Incubator for suspension culture of Sf9 cells in 24 well blocks |
| VWR Petri Dishes | VWR | CA73370-037 | |
| X-tremeGene 9 DNA Transfection Reagent 1.0 M | Roche | 6365787001 | For Sf9 cells transfection to generate recombinant baculovirus |
Références
- Guccione, E., Richard, S. The regulation, functions and relevance of arginine methylation. Nature Reviews in Molecular Cell Biology. 20 (10), 642-657 (2019).
- Thandapani, P., O'Connor, T. R., Bailey, T. L., Richard, S. Defining the RGG/RG motif. Molecular Cell. 50 (5), 613-623 (2013).
- Lorton, B. M., Shechter, D. Cellular consequences of arginine methylation. Cell and Molecular Life Sciences. 76 (15), 2933-2956 (2019).
- Bedford, M. T., Clarke, S. G. Protein arginine methylation in mammals: Who, what, and why. Molecular Cell. 33 (1), 1-13 (2008).
- Frankel, A., Brown, J. I. Evaluation of kinetic data: What the numbers tell us about PRMTs. Biochimica Biophysica Acta Proteins Proteomics. 1867 (3), 306-316 (2018).
- Li, A. S. M., Li, F., Eram, M. S., Bolotokova, A., Dela Seña, C. C., Vedadi, M. Chemical probes for protein arginine methyltransferases. Methods. 175, 30-43 (2020).
- Savitsky, P., et al. High-throughput production of human proteins for crystallization: The SGC experience. Journal of Structural Biology. 172, 3-13 (2010).
- Gileadi, O., et al. Expressing the human proteome for affinity proteomics: Optimizing expression of soluble protein domains and in vivo biotinylation. New Biotechnology. 29 (5), 515-525 (2012).
- Graslund, S., et al. Protein production and purification. Nature Methods. 5, 135 (2008).
- Kost, T. A., Condreay, J. P., Jarvis, D. L. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nature Biotechnology. 23, 567-575 (2005).
- Jarvis, D. L. Baculovirus-insect cell expression systems. Methods in Enzymology. 463, 191-222 (2009).
- Shrestha, B., et al. Baculovirus expression vector system: an emerging host for high-throughput eukaryotic protein expression. Methods in Molecular Biology. 439, 269-289 (2008).
- Smith, G. E., Summers, M. D., Fraser, M. J. Production of human beta interferon in insect cells infected with a baculovirus expression vector. Molecular Cell Biology. 3, 2156-2165 (1983).
- Invitrogen Life Technologies. . Invitrogen, Bac-to-Bac Baculovirus expression system. , (2010).
- Luckow, V. A., Lee, S. C., Barry, G. F., Olins, P. O. Efficient generation of infectious recombinant baculoviruses by site-specific transposon-mediated insertion of foreign genes into a baculovirus genome propagated in Escherichia coli. Journal of Virology. 67, 4566-4579 (1993).
- Irons, S. L., Chambers, A. C., Lissina, O., King, L. A., Possee, R. D. Protein Production Using the Baculovirus Expression System. Current Protocol in Protein Sciences. 91, 1-22 (2018).
- Rieffel, S., et al. Insect cell culture in reagent bottles. MethodsX. 1, 155-161 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon