Method Article
Interventions thérapeutiques pour les amputés des membres supérieurs subissant des transferts nerveux sélectifs
Dans cet article
Résumé
Ce travail présente un protocole pour améliorer la fonction prothétique après une chirurgie de transfert nerveux sélectif. Les interventions de réadaptation comprennent l’information et la sélection du patient, le soutien à la cicatrisation des plaies, la réactivation corticale des zones sensori-motrices du membre supérieur, l’entraînement de l’activation musculaire sélective, la manipulation prothétique dans la vie quotidienne et des évaluations de suivi régulières.
Résumé
La réinnervation musculaire ciblée (TMR) améliore l’interface de contrôle biologique des prothèses myoélectriques après amputation au-dessus du coude. L’activation sélective des unités musculaires est rendue possible par le réacheminement chirurgical des nerfs, produisant un grand nombre de signaux de contrôle myoélectriques indépendants. Cependant, cette intervention nécessite une sélection minutieuse des patients et une thérapie de réadaptation spécifique. Ici, un protocole de rééducation est présenté pour les amputés de haut niveau des membres supérieurs subissant une TMR, basé sur une étude d’expert Delphi. Les interventions avant la chirurgie comprennent une évaluation détaillée du patient et des mesures générales pour le contrôle de la douleur, l’endurance et la force musculaires, l’équilibre et l’amplitude de mouvement des articulations restantes. Après la chirurgie, d’autres interventions thérapeutiques se concentrent sur le contrôle de l’œdème et le traitement des cicatrices et l’activation sélective des zones corticales responsables du contrôle des membres supérieurs. Après une réinnervation réussie des muscles cibles, le biofeedback électromyographique de surface (sEMG) est utilisé pour entraîner l’activation des nouvelles unités musculaires. Plus tard, une prothèse de table peut fournir la première expérience de contrôle prothétique. Après avoir ajusté la prothèse proprement dite, la formation comprend des exercices répétitifs sans objets, la manipulation d’objets et, enfin, les activités de la vie quotidienne. En fin de compte, les rendez-vous réguliers des patients et les évaluations fonctionnelles permettent de suivre la fonction prothétique et de permettre des interventions précoces en cas de dysfonctionnement.
Introduction
Les amputations élevées du membre supérieur constituent un défi pour le remplacement prothétique1. Outre la fonction articulaire du coude, les systèmes prothétiques actifs devraient inclure l’ouverture / fermeture de la main prothétique et, idéalement, la pronation / supination et / ou l’extension / flexion du poignet. Cependant, le contrôle des appareils myoélectriques standard repose généralement sur les signaux d’entrée de deux muscles seulement2. Il s’agit traditionnellement des muscles biceps et triceps après amputations transhumérales et des muscles majeurs latissimus dorsi et pectoraux après amputations gléno-humérales3. Pour contrôler toutes les articulations prothétiques, les amputés doivent basculer entre les articulations actives (par exemple, en utilisant une co-contraction des deux muscles)1. Bien que cela fournisse un paradigme de contrôle stable, une restriction importante s’ensuit avec un contrôle lent et peu intuitif qui en résulte, qui ne permet pas les mouvements simultanés de deux articulations prothétiques ou plus4. Cela limite la fonctionnalité de la prothèse et est l’une des raisons des taux élevés d’abandon prothétique après des amputations au-dessus du coude5.
Pour surmonter le contrôle limité et peu intuitif de ces types de raccords prothétiques, des transferts nerveux sélectifs peuvent être utilisés. Cette approche, également connue sous le nom de réinnervation musculaire ciblée (TMR), consiste à établir chirurgicalement des signaux de myo-contrôle en réacheminant les nerfs qui servaient initialement la main et le bras amputés vers différents muscles cibles dans le membre résiduel 6,7. Après une réinnervation réussie, une activation plus sélective des unités musculaires réinnervées devient possible8. L’activité électromyographique (EMG) qui en résulte peut ensuite être utilisée pour le contrôle prothétique et peut produire jusqu’à six signaux de contrôle.
Bien qu’il existe un large consensus sur le fait que la TMR peut améliorer considérablement la fonction prothétique9, l’activation sélective et le contrôle approprié de plusieurs muscles dans le moignon posent un défi aux patients, en particulier au début de la période postopératoire. Cette complexité accrue du contrôle prothétique associée à la rétroaction multisensorielle réduite après l’amputation nécessite une rééducation spécifique pour bénéficier pleinement de l’intervention chirurgicale. Ici, une ligne directrice étape par étape pour les interventions thérapeutiques est fournie sur la base des recommandations récentes10. Un aperçu des interventions et du temps estimé qu’elles prennent dans un cadre idéal se trouve à la figure 1.
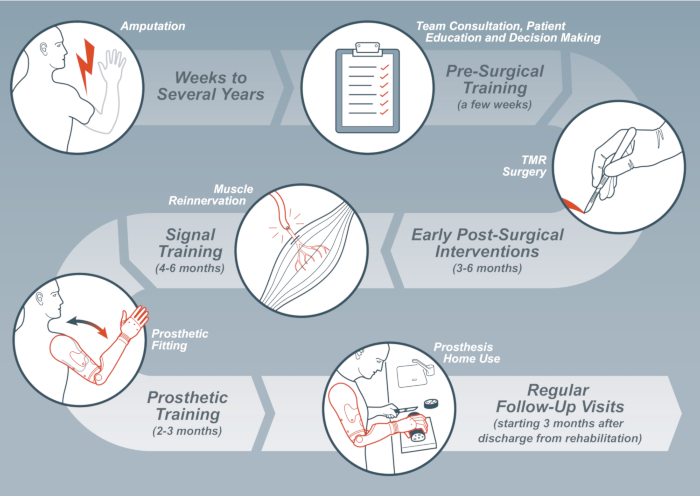
Figure 1: Aperçu des étapes du processus de réadaptation, y compris les jalons qui marquent le début d’une nouvelle étape. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Protocole
Le protocole a été développé dans le cadre d’une étude européenne Delphi10. L’évaluation de son application sur les patients a été approuvée par le comité local d’éthique de la recherche de l’Université de médecine de Vienne et réalisée conformément à la Déclaration d’Helsinki. Sauf mention contraire, les étapes décrites ici doivent être effectuées par un ergothérapeute ou un physiothérapeute.
1. Interventions pré-chirurgicales
- Consultez le patient pour une consultation multidisciplinaire.
REMARQUE: L’équipe médicale de base devrait comprendre un chirurgien, un ergothérapeute et / ou un physiothérapeute, un prothésiste et un psychologue. - Recueillir les antécédents du patient (raison et date de l’amputation, interventions médicales / thérapeutiques antérieures après l’amputation, comorbidités, antécédents médicaux, antécédents médicaux, satisfaction prothétique) et poser des questions sur les attentes en matière de réadaptation prothétique et les demandes d’un système prothétique dans la vie quotidienne.
- Vérifiez les critères d’inclusion et d’exclusion pertinents.
- Considérez le patient pour TMR s’il remplit les critères suivants: amputation au-dessus du coude, bonne santé générale, désir personnel d’une bonne fonction prothétique, volonté de participer à un traitement post-chirurgical jusqu’à 15 mois.
- Exclure les patients qui ont des comorbidités psychologiques non traitées.
- Effectuez un examen physique du membre résiduel, en vous concentrant sur les problèmes de peau et de tissus mous, les névromes, l’amplitude des mouvements et les lésions nerveuses supplémentaires possibles.
REMARQUE: Si des interventions chirurgicales pour le membre résiduel sont nécessaires (par exemple, des corrections des tissus mous), le chirurgien les traite pendant la chirurgie TMR. - Évaluez l’état de forme générale du patient pour savoir s’il sera capable de porter une prothèse myoélectrique après une TMR (~ 3 kg) et déterminez d’autres interventions dont il pourrait avoir besoin pendant la rééducation (comme le renforcement du membre, des exercices d’endurance ou la stabilité du tronc). Si le patient a une prothèse, évaluez sa fonction, de préférence avec des instruments d’évaluation standardisés.
- Évaluer le bien-être mental du patient et reconnaître les maladies psychiatriques, telles que la dépression ou le trouble de stress post-traumatique (psychologue). Si l’évaluation montre la nécessité d’un traitement, assurez-vous en équipe que le patient le reçoit.
- En fonction des besoins du patient, des antécédents du patient et de l’examen, discutez des options prothétiques disponibles avec le patient. Assurez-vous que le patient comprend que la TMR implique une longue rééducation, où une participation active est nécessaire.
- Déterminez si la TMR est la meilleure option pour le patient. Donnez au patient suffisamment de temps pour envisager différentes options et/ou en discuter avec ses amis et sa famille.
- Revoyez le patient (soit dans l’équipe interdisciplinaire complète, soit en tant que professionnel de la réadaptation avec le chirurgien) pour planifier la procédure, sauf si le patient avait déjà décidé de la TMR lors de la consultation initiale.
- Si l’équipe médicale et le patient conviennent que la TMR doit être effectuée, assurez-vous que le remboursement financier de l’ensemble du processus est garanti et que la rééducation et l’ajustement prothétique seront organisés.
- Voir le patient pour des séances de thérapie avant la chirurgie. Selon les besoins du patient, inclure des exercices pour le traitement de la douleur, l’endurance, la symétrie corporelle, la stabilité du tronc, le renforcement du membre et de la posture, et les tâches d’imagerie motrice.
- De plus, entraînez-vous à des activités d’une seule main et soutenez le patient avec des appareils fonctionnels, ce qui peut être utile pour soutenir l’indépendance dans les activités de la vie quotidienne.
REMARQUE: Au moins une séance de traitement pré-chirurgical est recommandée. Il faudra peut-être en faire plus pour résoudre des problèmes spécifiques. Si seulement peu de temps avant la chirurgie est disponible, inclure des interventions particulières dans le traitement post-chirurgical.
- De plus, entraînez-vous à des activités d’une seule main et soutenez le patient avec des appareils fonctionnels, ce qui peut être utile pour soutenir l’indépendance dans les activités de la vie quotidienne.
- Effectuer la chirurgie TMR (chirurgien)9.
2. Interventions post-chirurgicales précoces
- Dans les premiers jours après la chirurgie, mobilisez le patient et assurez-vous qu’il retrouve sa forme physique. Une fois de plus, rappelez au patient que la réinnervation peut prendre ~ 3-6 mois.
REMARQUE: Les interventions post-chirurgicales précoces doivent avoir lieu une ou deux fois par jour pendant que le patient est hospitalisé. Si le patient peut effectuer lui-même les interventions énumérées ci-dessous après les explications initiales, une séance de thérapie une fois par mois est suffisante et peut également se produire en téléthérapie dans un cadre en ligne. Sinon, il est recommandé de voir le patient deux fois par semaine pendant 30 à 60 minutes. - Traiter les œdèmes possibles dans la zone de la chirurgie en bandant, en utilisant des doublures sur mesure, en soutenant le membre résiduel et / ou en offrant un drainage lymphatique. S’assurer que le patient reçoit des analgésiques adéquats.
- Commencez par un traitement des cicatrices (application de crème cicatricielle et massage des cicatrices) lorsque les plaies sont complètement fermées. Améliorer l’amplitude de mouvement dans l’articulation de l’épaule pour les amputations transhumérales en déplaçant passivement le bras et en demandant au patient d’effectuer des exercices actifs en utilisant toute l’amplitude de mouvement.
REMARQUE: Les patients sont invités à utiliser la crème cicatricielle à leur disposition; rien de spécifique n’est recommandé.- Communiquez toutes les interventions avec le chirurgien et/ou voyez le patient avec le chirurgien au moins une fois.
- Si le patient a subi un ajustement prothétique avant la chirurgie, évaluez s’il peut être réajusté. Si nécessaire, demandez à un prothésiste de changer la douille ou de remplacer les électrodes dans un raccord myoélectrique.
REMARQUE: Dans certains cas, un réajustement de la prise peut ne pas être réalisable. - Faciliter le processus de réinnervation au niveau cortical avec des méthodes telles que la thérapie par le miroir11,12, les mouvements imaginés13 ou l’entraînement à la latéralisation14 (ou suivre la structure de l’imagerie motrice graduée, qui comprend ces interventions15) pour activer les zones du cortex sensori-moteur responsables du membre supérieur.
REMARQUE: Cela permet au patient d’activer les muscles réinnervés plus efficacement à un stade ultérieur du traitement.- Pour la thérapie par le miroir, installez un miroir devant le patient et demandez-lui de cacher le membre résiduel derrière le miroir. Demandez-leur d’effectuer différents mouvements avec la main saine tout en regardant son reflet dans le miroir.
- Demandez au patient d’imaginer différents mouvements de la main et du bras amputés tout en gardant les yeux fermés. Si cela est utile, assurez-vous que le patient peut le faire dans un environnement calme et non perturbé.
- Pour l’entraînement à la latéralisation, présentez au patient des cartes qui montrent les mains et les bras gauches ou droits. Demandez au patient de nommer le côté et donnez-lui son avis sur son choix.
REMARQUE: Si le patient préfère les nouvelles technologies, présentez-lui des programmes informatiques ou des applications qui offrent la même fonction.
- Poursuivre toute intervention pré-chirurgicale en fonction des besoins du patient.
3. Formation sur les signaux
- Étudiez le rapport de chirurgie pour comprendre quelles parties musculaires sont réinnervées et quels nerfs ont été transférés. Comprenez que le nerf transféré détermine le ou les mouvements dont le patient a besoin pour tenter d’activer les muscles réinnervés (par exemple, tout muscle innervé par le nerf ulnaire peut être activé par l’imagerie de la fermeture de la main ou de la flexion du poignet après une réinnervation réussie).
REMARQUE: Si quelque chose n’est pas clair, rencontrez le chirurgien pour discuter des transferts nerveux et du plan de réadaptation. - Trois mois après la chirurgie, commencez à tester les premières contractions volontaires des muscles réinnervés. Si une activité peut être trouvée, continuez avec les étapes ci-dessous et visez à voir le patient pour des séances de thérapie hebdomadaires ou bihebdomadaires jusqu’à ce que le contrôle EMG de surface (sEMG) soit maîtrisé. Si aucune activité ne peut être trouvée, continuez avec les interventions post-chirurgicales précoces et effectuez un autre test quelques semaines plus tard.
- Pour évaluer l’activité musculaire volontaire, mettez en place un système de biofeedback sEMG.
REMARQUE: Ici, un système qui peut afficher jusqu’à six signaux EMG et permettre une amplification individuelle de chaque canal est préférable. - Préparez la peau du patient à réduire l’impédance en éliminant les poils excessifs, les flocons de peau morte, l’huile ou la crème pour la peau16. Expliquer l’objectif de l’évaluation et la fonctionnalité du système au patient.
REMARQUE: Planifiez des séances de thérapie de 30 minutes ou moins à ce stade. Sinon, les muscles peuvent devenir facilement fatigués et le patient peut perdre la concentration nécessaire. Si de courtes séances ne sont pas possibles, mélangez différentes interventions thérapeutiques (EMG et entraînement à la posture) pour éviter la fatigue. La figure 2 montre une configuration standard pour la formation au biofeedback EMG.
- Pour évaluer l’activité musculaire volontaire, mettez en place un système de biofeedback sEMG.
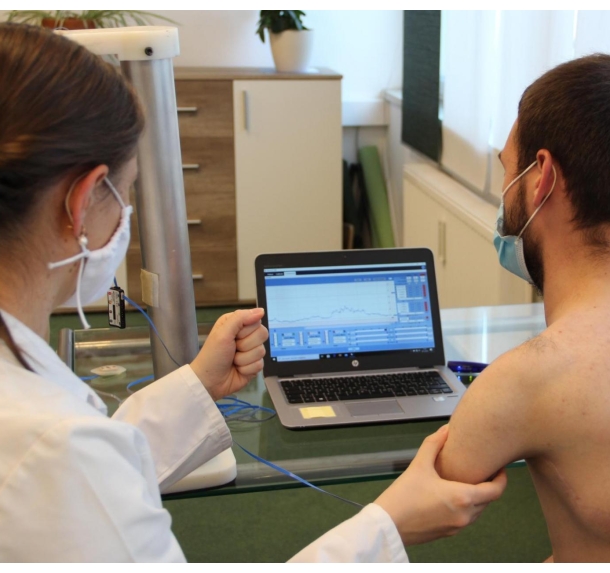
Figure 2 : Configuration du biofeedback EMG de surface. Le thérapeute place une électrode sur la peau du patient où le signal EMG est attendu tout en expliquant le signal de mouvement nécessaire (faire un poing). Le patient et le thérapeute peuvent voir l’activité musculaire (EMG) du patient sur l’écran de l’ordinateur et utiliser cette rétroaction pour trouver la meilleure position de l’électrode et le meilleur signal de mouvement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Demandez au patient d’effectuer des mouvements de la main et du bras en fonction de la fonction initiale des nerfs du donneur (p. ex., fermeture de la main si le nerf ulnaire a été utilisé) et essayez de palper le muscle.
- Placez une électrode EMG de surface sur la peau au-dessus du muscle. Considérez que la réinnervation est réussie si l’amplitude du signal pendant l’activation est 2 à 3 fois plus élevée que pendant la relaxation17.
- Si une telle activation n’est pas possible, indiquez d’autres mouvements liés au nerf du donneur (par exemple, flexion du poignet ou du petit doigt, si le nerf ulnaire est le donneur) et déplacez l’électrode légèrement au-dessus du muscle du receveur.
- Répétez l’évaluation de l’activation volontaire avec tous les nerfs en fonction des rapports de chirurgie et notez quels muscles peuvent être activés et avec quelle commande motrice. Demandez au patient d’entraîner les commandes motrices à la maison.
- Entraînez l’activation sélective des muscles réinnervés.
- Utilisez le biofeedback EMG pour afficher l’activité d’un muscle. Demandez au patient de réfléchir aux schémas de mouvement précédemment évalués et d’utiliser une électrode sEMG (voir Tableau des matériaux) pour capter les signaux musculaires du receveur.
- Utilisez les notes de l’évaluation précédente. Si c’est plus facile pour le patient, demandez-lui d’effectuer les mouvements souhaités bilatéralement.
- Dès que le patient peut activer le muscle de manière répétitive, entraînez également la relaxation musculaire.
REMARQUE: La relaxation musculaire correspond à des amplitudes EMG proches de zéro et est parfois difficile à réaliser. - Demandez au patient d’activer le muscle et de le détendre complètement à plusieurs reprises. Assurez-vous qu’il y a 5 à 10 s de pause entre les activations.
- Demandez au patient d’effectuer différents mouvements et de faire varier les positions des électrodes pour trouver la combinaison conduisant à la plus grande amplitude (point chaud). Prenez une photo de la meilleure position ou marquez-la sur la peau.
- Si plus de muscles peuvent déjà être activés, entraînez l’activation et la relaxation de chaque muscle individuellement.
- Après qu’un contrôle raisonnable des muscles simples est possible, affichez l’activité de deux muscles. Commencez par des muscles /mouvements antagonistes tels que l’ouverture et la fermeture de la main. Demandez au patient d’activer un muscle tandis que l’autre doit être aussi détendu que possible.
- Essayez différents signaux de mouvement pour les deux muscles si une telle activation sélective n’est pas possible. Expliquez au patient que la sélectivité a besoin d’une formation et prenez suffisamment de temps pour cette étape.
- Dès que l’activation sélective de deux muscles est réalisée, ajoutez un troisième muscle et répétez les étapes précédentes. De la même manière, ajoutez un muscle à la fois jusqu’à ce que le patient puisse activer sélectivement chacun d’eux. Planifiez plusieurs séances de thérapie pour entraîner cela.
REMARQUE: Pour permettre un contrôle prothétique simultané direct à un stade ultérieur, le patient a besoin de la capacité d’activer à plusieurs reprises chaque muscle tout en maintenant aucune / très peu d’activation de tous les autres. La figure 3 montre un dessin schématique de l’excellente séparation de six signaux différents dans un système de biofeedback EMG.
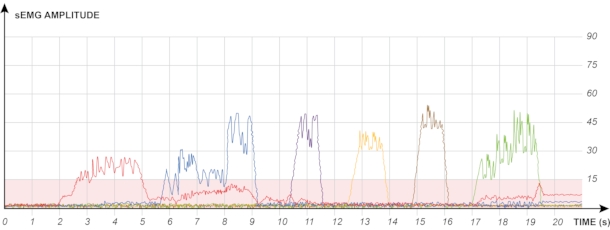
Figure 3 : Dessin schématique des signaux EMG affichés via le biofeedback. Chaque canal (avec une couleur différente) est mappé à une partie musculaire spécifique et sera plus tard responsable d’un mouvement prothétique particulier. Une bonne séparation, telle que décrite ici, garantit que la prothèse n’effectue que les mouvements prévus. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Une fois l’activation sélective de tous les signaux établie, introduisez une prothèse de table comme illustré à la figure 4.
REMARQUE: Certains systèmes permettent d’afficher des signaux EMG tout en déplaçant la prothèse simultanément. Ces systèmes sont préférés pour la formation car ils permettent une rétroaction plus précise.

Figure 4 : Patient contrôlant une prothèse de table avec des électrodes de surface montées sur son membre résiduel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Tout d’abord, n’activez qu’une seule articulation prothétique, par exemple la main, et demandez au patient de la contrôler tout en surveillant attentivement la prothèse. Si le matériel prothétique le permet, expliquez au patient qu’une faible amplitude EMG correspond à un mouvement lent tandis qu’un mouvement rapide est obtenu grâce à un signal élevé. Laissez-les tester différentes vitesses de mouvement.
- Changez l’articulation prothétique active (par exemple, l’articulation du coude ou du poignet) et laissez le patient contrôler ces niveaux avec ses signaux EMG.
- Une fois qu’un bon contrôle des niveaux individuels est possible, allumez toutes les articulations prothétiques et activez le contrôle simultané. Indiquez aux patients que les mouvements prothétiques indésirables sont normaux à ce stade initial du contrôle prothétique.
REMARQUE: Une activation légère de leurs muscles peut soutenir le contrôle sélectif des articulations prothétiques simples. - Lorsque cela est maîtrisé, donnez au patient une première impression de saisir avec un dispositif prothétique (la prothèse de table) en tenant des objets (petites boules, tubes de bouteilles) près de la main prothétique ouverte et en leur demandant de fermer.
- S’il le souhaite, laissez le patient jouer à saisir et à libérer les objets qu’il tient avec sa main non affectée (pour les amputations unilatérales). Faites savoir au patient que parfois ne pas saisir ou libérer des objets est normal, mais devrait s’améliorer avec l’entraînement.
- Assurez-vous qu’un prothésiste certifié fournit un raccord de test avec toutes les électrodes pour le contrôle myoélectrique placées correctement dans la prise.
- Pour soutenir le placement correct de l’électrode dans la prise, marquez les points chauds EMG sur la peau du patient et notez les mouvements prothétiques pour chaque point chaud.
- Si possible, consultez le patient avec le prothésiste pour le moulage en plâtre et répondez à toutes les questions que le prothésiste pourrait avoir concernant le placement des électrodes.
- Lorsque la première douille (test-) est prête, vérifiez son ajustement avec le prothésiste. Demandez au patient de le porter et signalez tout problème avec l’ajustement (comme trop de pression à des points spécifiques). Vérifiez la position des électrodes en connectant les électrodes de la prise à un système de biofeedback EMG ou à une prothèse de table et en demandant au patient de la contrôler.
- Si aucun contrôle suffisant de la prothèse de table n’est possible lors du port de la douille alors que cela peut être fait avec des électrodes montées sur la peau, réévaluez les positions de l’électrode dans la douille avec le prothésiste et changez-les (et / ou la douille) si nécessaire.
4. Entraînement prothétique
- Une fois que la douille (test) s’adapte bien et que le patient peut contrôler une prothèse de table avec les électrodes intégrées dans la douille, demandez au prothésiste d’assembler l’ajustement prothétique complet.
- Voyez le patient avec son nouvel ajustement prothétique avec le prothésiste et le chirurgien. Vérifiez l’ajustement de la prothèse, discutez avec l’équipe si les changements sont nécessaires et répondez à toutes les questions que le patient pourrait avoir.
- Expliquer les fonctionnalités de base de la prothèse au patient, telles que les degrés de liberté, le fonctionnement de la commutation entre les articulations actives (si nécessaire). Expliquez également si la prothèse est imperméable à l’eau et comment elle doit être nettoyée.
- Entraînez-vous à enfiler et à enlever la prothèse.
REMARQUE: La durée et la fréquence de l’entraînement prothétique dépendent de la complexité de l’ajustement prothétique, de l’expérience du thérapeute et de la capacité d’apprentissage moteur du patient. Les changements nécessaires dans la prise (p. ex., pour les positions des électrodes) peuvent retarder l’entraînement. Dans des contextes optimaux, le patient suit une thérapie deux fois par semaine pendant 30 à 60 minutes au cours des premières semaines et a la possibilité d’utiliser l’ajustement de test pour l’entraînement à domicile entre les deux. - Entraînez les mouvements prothétiques sans objets externes.
- Demandez au patient d’effectuer des mouvements faciles de la prothèse, tels que l’ouverture / fermeture de la main. Si possible, connectez la prothèse via Bluetooth à son logiciel pour afficher les signaux EMG.
REMARQUE: Si la prothèse ne réagit pas aux commandes motrices du patient ou effectue des mouvements involontaires, utilisez le biofeedback EMG pour en comprendre la raison. Si le problème est lié au matériel (ajustement de la prise ou placement de l’électrode), contactez le prothésiste pour le résoudre. Sinon, essayez d’adapter les paramètres du logiciel et/ou demandez au patient d’ajuster ses commandes motrices (par exemple, une contraction plus légère). - Continuez avec l’entraînement des mouvements uniques de toutes les articulations prothétiques comme décrit à l’étape 3. Si la prothèse permet différentes vitesses de mouvement, demandez au patient de faire varier la vitesse de mouvement. Assurez-vous que le patient fait exactement ce qu’il a l’intention de faire.
- Pour ajouter plus de complexité, demandez au patient de contrôler la prothèse dans différentes positions (debout, assis ou avec différentes positions d’épaule pour les amputés transhumeraux) et de combiner plus de degrés de liberté simultanément (par exemple, fermer la main en fléchissant le coude en même temps).
- Demandez au patient d’effectuer des mouvements faciles de la prothèse, tels que l’ouverture / fermeture de la main. Si possible, connectez la prothèse via Bluetooth à son logiciel pour afficher les signaux EMG.
- Entraîner la manipulation d’objets
- Fournir au patient différents objets tels que des balles de stress ou des blocs de bois. Expliquez que la manipulation d’objets ajoute une autre couche de complexité.
REMARQUE: Normalement, le patient doit s’entraîner pendant un certain temps pour avoir un contrôle complet sur la prothèse tout en travaillant avec des objets externes. - Demandez au patient d’utiliser sa main saine (pour les amputés unilatéraux) pour mettre l’objet dans la main prothétique. Ensuite, demandez de fermer la main prothétique, de déplacer le coude prothétique et / ou l’articulation du poignet et, enfin, de libérer l’objet.
- Comme étape suivante, placez les objets sur la table / étagère / etc. Demandez au patient de les ramasser avec la main prothétique et de les placer ailleurs.
- Enfin, les tâches qui nécessitent plus de précision, comme empiler des blocs de bois ou saisir une balle roulant sur une table, peuvent être entraînées.
- Fournir au patient différents objets tels que des balles de stress ou des blocs de bois. Expliquez que la manipulation d’objets ajoute une autre couche de complexité.
- Activités de train de la vie quotidienne
- Demandez au patient quelles activités courantes (comme porter un sac, faire la lessive, cuisiner, s’habiller, manger avec des couverts, ouvrir / fermer une porte, etc.) qu’il fait régulièrement dans sa vie quotidienne. Priorisez quelques-uns d’entre eux et formez-les en thérapie.
REMARQUE: Discutez du fait que la prothèse ne peut pas être utilisée pour le bain et la douche. - Pour l’entraînement des activités quotidiennes, suggérez de les effectuer avec la prothèse en fonction de l’expérience (par exemple, avec certaines mains prothétiques, il est plus facile de ramasser de petits objets si la main est dans une position pronée maximale). Laissez le patient effectuer les tâches en fonction des suggestions fournies. S’ils ont d’autres idées sur la façon de les exécuter, laissez le patient essayer leur approche et encouragez-le à essayer de nombreuses stratégies et à être créatif.
REMARQUE: Il est essentiel d’expliquer aux patients que l’entraînement à la prothèse prend du temps et de la patience. - Donnez au patient des commentaires sur la performance pendant l’achèvement de la tâche. La rétroaction doit être basée sur les mouvements compensatoires (peu ou pas du tout est préférable) et le temps du patient pour effectuer la tâche. Si vous ou le patient n’êtes pas satisfait de la façon dont la tâche pourrait être accomplie, essayez différentes stratégies.
- Demandez au patient quelles autres activités plus spécifiques sont essentielles dans sa vie quotidienne (par exemple, les sports, les loisirs, la garde d’enfants ou des tâches spécifiques requises pour son travail) et discutez de la façon dont il peut utiliser la prothèse dans le cadre de ces tâches.
REMARQUE: Si possible, entraînez directement quelques-unes de ces tâches avec le patient pendant les séances de thérapie (soit à la clinique ou à la maison du patient). Toutes les tâches ne peuvent pas être effectuées avec une prothèse. Dans certains cas, des accessoires prothétiques ou des appareils fonctionnels spécifiques sont nécessaires (par exemple, pour certains sports ou instruments de jeu). Bien qu’il y ait eu des progrès significatifs ces dernières années, les prothèses sont encore loin d’être équivalentes aux mains humaines dans la fonction18. - Demandez au patient d’utiliser la prothèse à la maison et de prendre des notes (ou des photos et des vidéos) des tâches qu’il fait ou qu’il sent qu’il ne peut pas faire.
- Utilisez ces notes pour discuter des différentes stratégies d’utilisation des prothèses lors des séances de thérapie suivantes.
- Répétez l’entraînement prothétique pendant les séances de thérapie et à la maison jusqu’à ce que le thérapeute et le patient comprennent que la prothèse peut être bien utilisée dans la vie quotidienne.
- Libérer le patient du traitement.
- Demandez au patient quelles activités courantes (comme porter un sac, faire la lessive, cuisiner, s’habiller, manger avec des couverts, ouvrir / fermer une porte, etc.) qu’il fait régulièrement dans sa vie quotidienne. Priorisez quelques-uns d’entre eux et formez-les en thérapie.
5. Évaluations de suivi
- Invitez le patient à une consultation médicale multidisciplinaire 3 mois après sa sortie de réadaptation.
- Demandez au patient comment il utilise sa prothèse à la maison et au travail et discutez de tout problème.
- Si le patient signale des problèmes, discutez/fournissez des solutions pour eux.
- Évaluer la fonction prothétique du patient à l’aide de tests standardisés (tels que la procédure d’évaluation de la main de Southampton (SHAP)19, le test du bras de recherche-action (ARAT)20,21 ou l’évaluation de la capacité de contrôle myoélectrique (ACMC)22,23). Demandez au patient de remplir des questionnaires normalisés sur la qualité de vie et l’utilisation des mains dans la vie quotidienne (comme le formulaire abrégé 36 (SF-36)24 et les incapacités du bras, de l’épaule et de la main (DASH)25).
- Si les résultats des tests montrent un problème, discutez-en avec le patient et proposez des solutions à ses problèmes (si possible).
- Après la première consultation de suivi, invitez le patient tous les 6 mois à une consultation multidisciplinaire et à des évaluations structurées pour assurer une bonne fonction prothétique continue.
Résultats
Le protocole de réadaptation décrit a été mis en œuvre dans un cadre clinique à l’Université de médecine de Vienne, et sa faisabilité et ses résultats ont été évalués dans une étude clinique, qui a été récemment publiée9. Comme indiqué9, 30 patients ont participé à l’essai pour évaluer la faisabilité de la chirurgie TMR et de la réadaptation ultérieure. La figure 5 montre que sur ces 30 patients, 11 ont subi une TMR comme traitement de la douleur plutôt que comme moyen d’améliorer la fonction par l’ajustement prothétique. Sur les 19 patients restants qui visaient à l’origine un ajustement prothétique, cinq ont décidé de ne pas le faire en raison des coûts élevés de l’ajustement (estimés entre 75 000 et 150 000 €), du temps insuffisant pour la rééducation ou du poids élevé de la prothèse. Chez un patient, l’exploration peropératoire a révélé une lésion globale du plexus brachial, rendant impossible d’autres transferts nerveux. Ce patient a continué à utiliser son appareil alimenté par le corps. Sur les 13 patients restants en rééducation prothétique, 10 étaient disponibles pour une évaluation de suivi.
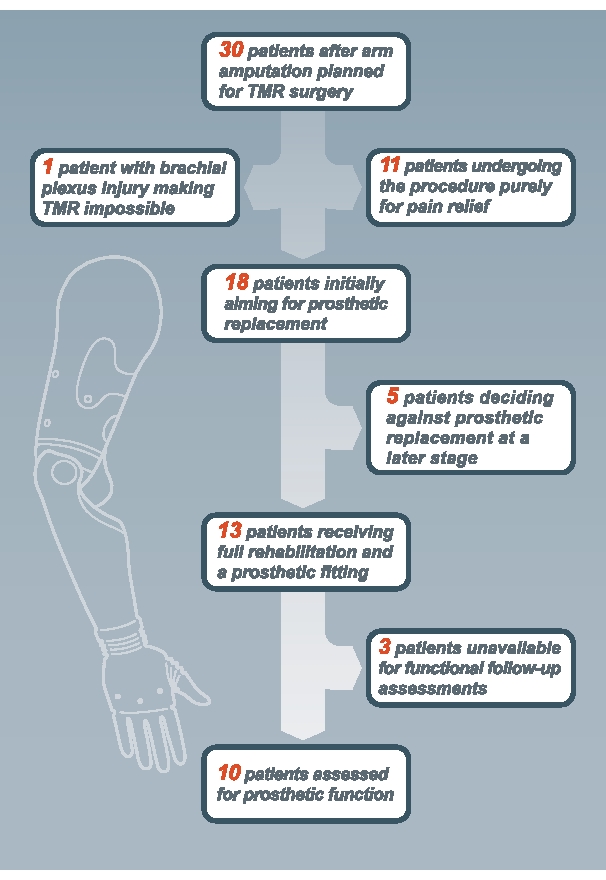
Figure 5: Organigramme montrant les patients inclus dans l’étude de faisabilité. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Les résultats ont été évalués à l’aide de la procédure d’évaluation de la main de Southampton (SHAP)19, du test du bras de recherche-action (ARAT)20,21 et du test de relocalisation des pinces à linge (CPRT)6,26. Ces évaluations sont des tests couramment utilisés pour évaluer la fonction prothétique. L’évaluation a eu lieu au moins 6 mois après l’ajustement final de la prothèse. De plus, les patients ont été interrogés sur leurs habitudes de port de prothèses.
Comme décrit par Salminger et al.9, l’évaluation des 10 patients après une chirurgie TMR a révélé un score SHAP de 40,5 ± 8,1 (avec un membre supérieur sain ayant un score d’environ 100) et un score ARAT de 20,4 ± 1,9 (57 étant le score maximum et 0 ne représentant aucune fonction des membres supérieurs) (tableau 1). Dans la CPRT, les patients ont pu accomplir les tâches en 34,3 ± 14,4 s. Ils ont déclaré porter leur prothèse quotidiennement avec un temps de port allant de 3 à 10 heures par jour.
| Évaluation des résultats | Score | Score attendu pour un membre supérieur sain |
| SHAP | 40,5 ± 8,1 | 100 |
| L’ARAT | 20,4 ± 1,9 | 57 |
| Le | 34,3 ± 14,4 s | - |
Tableau 1 : Fonction prothétique des patients après une chirurgie TMR et une rééducation. Dans le SHAP et l’ARAT, des scores plus élevés signifient une meilleure fonction, ce qui est également indiqué par moins de temps nécessaire dans le CPRT. Nombre total de patients évalués : n = 10. Adapté avec la permission de la référence9.
Discussion
Ces dernières années, les transferts nerveux sélectifs ont été de plus en plus utilisés pour améliorer la fonction prothétique27. Les cliniciens expérimentés dans ce domaine en sont venus à comprendre que la rééducation est essentielle pour permettre aux amputés d’utiliser une prothèse après l’intervention chirurgicale habilement27. Cependant, il y a un manque de programmes de thérapie structurés. Le protocole actuel visait à fournir aux ergothérapeutes et aux physiothérapeutes les outils et la structure nécessaires pour guider les patients tout au long du long processus de TMR. Contrairement aux suggestions précédentes de thérapie (développées pour des transferts nerveux moins complexes)28, l’accent est davantage mis sur l’entraînement pré-prothétique et l’utilisation du biofeedback EMG pour permettre un contrôle musculaire sélectif.
Comme le montre l’étude de faisabilité9, discuter des attentes du patient est essentiel pour le succès postopératoire. L’inclusion de patients très motivés a certainement contribué à l’obtention des excellents résultats décrits. Une moins grande conformité au protocole décrit pourrait entraîner une réduction de la fonction prothétique. De plus, tous les patients ne souhaitent pas recevoir un ajustement prothétique (ou ne peuvent pas se permettre d’en obtenir un). Cependant, la TMR peut encore être réalisable pour améliorer le névrome ou la douleur du membre fantôme puisque des études récentes ont montré le potentiel des transferts nerveux pour soulager ces conditions 29,30,31. Dans de tels cas, le programme de réadaptation est raccourci. Pourtant, nous avons constaté qu’un entraînement régulier de l’activation contrôlée des muscles réinnervés et d’une prothèse peut encore améliorer la situation de la douleur32. Ici, la prise de décision partagée est essentielle car certains patients peuvent porter une prothèse pour son potentiel à réduire la douleur à long terme32, tandis que d’autres pourraient ne pas être intéressés.
D’après notre expérience, une discussion détaillée avec le patient est essentielle pour évaluer l’observance future. Selon le temps de réinnervation, la capacité d’apprentissage moteur et la disponibilité du patient, le processus de réadaptation est susceptible de prendre entre 9 et 15 mois. Supposons qu’un patient ne s’efforce pas d’améliorer la fonction des membres supérieurs ou qu’il puisse faire un meilleur usage d’un autre dispositif (p. ex., des prothèses corporelles). Dans ce cas, on pourrait ne pas considérer que l’engagement de temps (et peut-être financier) en vaut la peine. Pour économiser des ressources, nous recommandons fortement de n’inclure que les patients qui expriment un fort intérêt pour la procédure et d’effectuer la chirurgie à des fins fonctionnelles uniquement lorsque la procédure de réadaptation complète est prévue. Enfin, les coûts de la chirurgie, de la thérapie et de l’ajustement devraient probablement être couverts à ce stade.
Le protocole d’étude décrit doit être adapté à chaque individu en fonction du raisonnement clinique pour répondre à ses besoins spécifiques. Les comorbidités physiques et psychologiques doivent être prises en compte et un traitement adéquat (p. ex., psychothérapie) doit être offert en plus des interventions décrites ici. Chez les patients recevant une TMR immédiatement après l’amputation, un dépistage plus approfondi des conditions psychologiques se développant au fil du temps peut être nécessaire. En dehors de cela, aucun changement dans le protocole n’est nécessaire pour ce groupe de patients. Ils pourraient même progresser plus rapidement dans l’apprentissage moteur car ils pourraient encore être habitués à des activités bimanuelles. Dans ce protocole, les transferts nerveux opérés par le chirurgien définissent, quelles commandes motrices doivent être entraînées et sont attendues pour quelles parties musculaires. Le choix de l’extrémité prothétique influence l’entraînement prothétique. Pour les prothèses multi-articulées, le passage d’un type de préhension à l’autre et à la façon de les utiliser doit être inclus dans la thérapie, si nécessaire.
Pour les patients vivant loin du centre clinique ou ceux qui ne peuvent pas assister régulièrement à la réadaptation en personne, des adoptions dans le protocole de réadaptation sont nécessaires. Ils comprennent un accent plus fort sur la formation à domicile, l’implication possible d’un thérapeute près du domicile du patient et des séances de téléréadaptation via des appels vidéo en ligne. Les solutions de téléréadaptation doivent fournir une connexion vidéo et audio stable tout en répondant à toutes les exigences en matière de protection des données. Chez ces patients, une première visite au centre clinique doit être planifiée 6 à 9 mois après la chirurgie pour la formation au signal. La visite dure généralement 1 semaine, avec des séances de thérapie deux fois par jour. Dans la majorité des cas, une bonne séparation du signal peut être obtenue à ce moment-là. Sinon, un autre séjour pour l’entraînement au signal est nécessaire, et le patient peut obtenir un simple dispositif de biofeedback sEMG pour l’entraînement à domicile. Lorsqu’une bonne séparation du signal est établie, le prothésiste peut fabriquer une prise de test et les positions du signal peuvent être définies pendant le séjour. Cela permet au prothésiste de créer l’ajustement final lorsque le patient rentre chez lui. La prothèse finale peut être ajustée lors d’une deuxième visite de 1 semaine 1 à 2 mois plus tard, et un entraînement prothétique peut être initié. Une formation prothétique avancée et d’autres visites de suivi peuvent avoir lieu dans un cadre éloigné ou lors d’une visite supplémentaire au centre, en fonction des besoins du patient.
En outre, d’autres interventions chirurgicales, telles que l’ostéointégration33 pour améliorer l’interface mécanique de la prothèse, peuvent être combinées avec TMR34. Si tel est le cas, des interventions spécifiques doivent être incluses (comme l’entraînement gradué au port de poids après ostéointégration35). De plus, bien que le protocole décrit soit destiné aux systèmes de contrôle prothétique direct (où une électrode correspond à un mouvement), ses principes restent les mêmes si un système de contrôle de reconnaissance de formes est prévu. La principale différence dans la rééducation est que l’activation sélective de muscles individuels devient moins pertinente, tandis que des modèles d’activation particuliers et reproductibles de plusieurs muscles doivent être entraînés36.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Cette étude a reçu un financement du Conseil européen de la recherche (CER) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’Union européenne (convention de subvention n° 810346). Les auteurs remercient Aron Cserveny d’avoir préparé les illustrations utilisées dans cette publication.
matériels
| Name | Company | Catalog Number | Comments |
| Dynamic Arm Plus® system with a Variplus Speed prosthetic hand | Ottobock Healthcare, Duderstadt, Germany | This prosthetic system was used together with a computer (and Bluetooth connection) for sEMG Biofeedback. Later, it was used for table top prosthetic training and as the patient's prosthetic fitting. | |
| ElbowSoft TMR | Ottobock Healthcare, Duderstadt, Germany | In combination with the Dynamic Arm Plus system and a standard computer (with Windows 7, 8 or 10), this software allows the visualisation of EMG signals as well as changing settings in the prosthetic system. | |
| EMG electrodes | Ottobock Healthcare, Duderstadt, Germany | electrodes 13E202 = 50 | The EMG electrodes used in this study were bipolar and included a ground and a 50 Hz filter. They were used with the Dynamic Arm Plus®. |
| Folding Mirror Therapy Box (Arm/Foot/Ankle) | Reflex Pain Management Therapy Store | This box was used for mirror therapy. |
Références
- Vujaklija, I., Farina, D., Aszmann, O. C. New developments in prosthetic arm systems. Orthopedic Research and Reviews. 8, 31-39 (2016).
- Zhou, P., et al. Decoding a new neural machine interface for control of artificial limbs. Journal of Neurophysiology. 98 (5), 2974-2982 (2007).
- Sturma, A., Salminger, S., Aszmann, O. Proximale Amputationen des Armes: Technische, chirurgische und handtherapeutische Möglichkeiten. Zeitschrift für Handtherapie. 21 (1), 18-25 (2018).
- Uellendahl, J. E. Upper extremity myoelectric prosthetics. Physical Medicine & Rehabilitation Clinics of North America. 11 (3), 639-652 (2000).
- Biddiss, E., Chau, T. Upper-limb prosthetics: critical factors in device abandonment. American Journal of Physical Medicine & Rehabilitation. 86 (12), 977-987 (2007).
- Kuiken, T. A., Dumanian, G. A., Lipschutz, R. D., Miller, L. A., Stubblefield, K. A. The use of targeted muscle reinnervation for improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee. Prosthetics and Orthotics International. 28 (3), 245-253 (2004).
- Aszmann, O. C., Dietl, H., Frey, M. Selective nerve transfers to improve the control of myoelectrical arm prostheses. Handchirurgie, Mikrochirurgie, plastische Chirurgie. 40 (1), 60-65 (2008).
- Cheesborough, J. E., Smith, L. H., Kuiken, T. A., Dumanian, G. A. Targeted muscle reinnervation and advanced prosthetic arms. Seminars in Plastic Surgery. 29 (1), 62-72 (2015).
- Salminger, S., et al. Outcomes, challenges and pitfalls after targeted muscle reinnervation in high level amputees. Is it worth the effort. Plastic and Reconstructive Surgery. 144 (6), 1037-1043 (2019).
- Sturma, A., et al. Rehabilitation of high upper limb amputees after Targeted Muscle Reinnervation. Journal of Hand Therapy: Official Journal of the American Society of Hand Therapists. , (2020).
- Ramachandran, V. S., Rogers-Ramachandran, D. Synaesthesia in phantom limbs induced with mirrors. Proceedings Biological Sciences. 263 (1369), 377-386 (1996).
- Rothgangel, A. S., Braun, S. M., Beurskens, A. J., Seitz, R. J., Wade, D. T. The clinical aspects of mirror therapy in rehabilitation. International Journal of Rehabilitation Research. 34 (1), 1-13 (2011).
- Dickstein, R., Deutsch, J. E. Motor imagery in physical therapist practice. Physical Therapy. 87 (7), 942-953 (2007).
- Bowering, K. J., et al. The effects of graded motor imagery and its components on chronic pain: A systematic review and meta-analysis. The Journal of Pain. 14 (1), 3-13 (2013).
- Moseley, G. L. . The graded motor imagery handbook. , (2012).
- Merletti, R., Parker, P. . Electromyography: Physiology, engineering, and non-invasive applications. , (2004).
- Sturma, A., Hruby, L. A., Prahm, C., Mayer, J. A., Aszmann, O. C. Rehabilitation of upper extremity nerve injuries using surface EMG biofeedback: Protocols for clinical application. Frontiers in Neuroscience. 12 (906), (2018).
- Farina, D., Aszmann, O. Bionic limbs: clinical reality and academic promises. Science Translational Medicine. 6 (257), 212 (2014).
- Kyberd, P., et al. Practice evaluation. Case studies to demonstrate the range of applications of the Southampton Hand Assessment Procedure. British Journal of Occupational Therapy. 72 (5), 212-218 (2009).
- Lyle, R. C. A performance test for assessment of upper limb function in physical rehabilitation treatment and research. Internationale Journal of Rehabilitation Research. 4, 483-492 (1981).
- Yozbatiran, N., Der-Yeghiaian, L., Cramer, S. C. A standardized approach to performing the action research arm test. Neurorehabil Neural Repair. 22 (1), 78-90 (2008).
- Hermansson, L. M., Bernspang, B., Eliasson, A. C. Assessment of capacity for myoelectric control: a new Rasch-built measure of prosthetic hand control. Journal of rehabilitation medicine. 37 (3), 166-171 (2005).
- Hermansson, L. M., Fisher, A. G., Bernspång, B., Eliasson, A. -. C. Intra- and inter-rater reliability of the assessment of capacity for myoelectric control. Journal of Rehabilitation Medicine. 38 (2), 118-123 (2006).
- McHorney, C. A., Ware Jr, ., E, J., Raczek, A. E. The MOS 36-item short-form health survey (SF-36): II. Psychometric and clinical tests of validity in measuring physical and mental health constructs. Medical Care. 31, 247-263 (1993).
- Gummesson, C., Atroshi, I., Ekdahl, C. The disabilities of the arm, shoulder and hand (DASH) outcome questionnaire: longitudinal construct validity and measuring self-rated health change after surgery. BMC Musculoskeletal Disorders. 4 (1), 11 (2003).
- Stubblefield, K. A. Occupational therapy outcomes with targeted hyper-reinnervation nerve transfer surgery: Two case studies. MEC '05 Intergrating Prosthetics and Medicine, Proceedings of the 2005 MyoElectric Controls/Powered Prosthetics. , (2005).
- Geary, M., Gaston, R. G., Loeffler, B. Surgical and technological advances in the management of upper limb amputees. The Bone & Joint Journal. 103 (3), 430-439 (2021).
- Stubblefield, K. A., Miller, L. A., Lipschutz, R. D., Kuiken, T. A. Occupational therapy protocol for amputees with targeted muscle reinnervation. Journal of Rehabilitation Research & Development. 46 (4), 481-488 (2009).
- Dumanian, G. A., et al. Targeted muscle reinnervation treats neuroma and phantom pain in major limb amputees: A randomized clinical trial. Annals of Surgery. 270 (2), 238-246 (2018).
- Pet, M. A., Ko, J. H., Friedly, J. L., Mourad, P. D., Smith, D. G. Does targeted nerve implantation reduce neuroma pain in amputees. Clinical Orthopaedics and Related Research. 472 (10), 2991-3001 (2014).
- Souza, J. M., et al. Targeted muscle reinnervation: a novel approach to postamputation neuroma pain. Clinical Orthopaedics and Related Research. 472 (10), 2984-2990 (2014).
- Sturma, A., Hruby, L. A., Vujaklija, I., Østlie, K., Farina, D., Aszmann, O. C., Farina, D. Treatment strategies for phantom limb pain. Bionic Limb Reconstruction. , 113-124 (2021).
- Li, Y., Branemark, R. Osseointegrated prostheses for rehabilitation following amputation : The pioneering Swedish model. Der Unfallchirurg. 120 (4), 285-292 (2017).
- Vincitorio, F., et al. Targeted muscle reinnervation and osseointegration for pain relief and prosthetic arm control in a woman with bilateral proximal upper limb amputation. World Neurosurgery. 143, 365-373 (2020).
- Jonsson, S., Caine-Winterberger, K., Branemark, R. Osseointegration amputation prostheses on the upper limbs: methods, prosthetics and rehabilitation. Prosthetics and Orthotics International. 35 (2), 190-200 (2011).
- Stubblefield, K., Kuiken, T., Kuiken, T., Schultz-Feuser, A., Barlow, A. Occupational therapy for the targeted muscle reinnervation patient. Targeted Muscle Reinnervation. , 99-119 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon