Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Optrode Array pour la modulation optogénétique simultanée et l’enregistrement neuronal électrique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons la méthode de fabrication d’un système optrode avec des fibres optiques pour la livraison de lumière et un réseau d’électrodes pour l’enregistrement neuronal. Des expériences in vivo avec des souris transgéniques exprimant la channelrhodopsine-2 montrent la faisabilité du système pour la stimulation optogénétique simultanée et l’enregistrement électrophysiologique.
Résumé
Au cours de la dernière décennie, l’optogénétique est devenue un outil essentiel pour l’étude de la signalisation neuronale en raison de sa capacité unique de modulation ou de surveillance neuronale sélective. Comme des types spécifiques de cellules neuronales peuvent être génétiquement modifiés pour exprimer les protéines d’opsine, l’optogénétique permet la stimulation optique ou l’inhibition des neurones sélectionnés. Il y a eu plusieurs avancées technologiques dans le système optique pour l’optogénétique. Récemment, il a été proposé de combiner le guide d’ondes optique pour la livraison de lumière avec l’enregistrement électrophysiologique pour surveiller simultanément les réponses neuronales à la stimulation ou à l’inhibition optogénétique. Dans cette étude, un réseau d’optrode implantable (2x2 fibres optiques) a été développé avec des électrodes multicanaux intégrées.
Une diode électroluminescente (LED) a été utilisée comme source lumineuse et un réseau de microlentilles préfabriquées a été intégré pour fournir une puissance lumineuse suffisante à l’extrémité des fibres optiques. Le système optrode array comprend la partie jetable et la partie réutilisable. La partie jetable a des fibres optiques et des électrodes, tandis que la partie réutilisable a la LED et les circuits électroniques pour le contrôle de la lumière et le traitement du signal neuronal. La nouvelle conception du système implantable optrode array est présentée dans la vidéo d’accompagnement en plus de la procédure de la chirurgie d’implantation optrode, de la stimulation lumineuse optogénétique et de l’enregistrement neuronal électrophysiologique. Les résultats d’expériences in vivo ont montré avec succès des pics neuronaux verrouillés dans le temps évoqués par les stimuli lumineux des neurones excitateurs de l’hippocampe de souris.
Introduction
L’enregistrement et le contrôle de l’activité neuronale sont essentiels pour comprendre le fonctionnement du cerveau dans un réseau neuronal et au niveau cellulaire. Les méthodes d’enregistrement électrophysiologique conventionnelles comprennent la pince de patch 1,2,3,4 à l’aide d’une micropipette et l’enregistrement extracellulaire à l’aide d’électrodes microneurales 5,6,7,8. En tant que méthode de neuromodulation, la stimulation électrique a été fréquemment utilisée pour stimuler directement une région focale du cerveau par dépolarisation directe ou indirecte des cellules neuronales. Cependant, la méthode électrique ne peut pas distinguer les types de cellules neuronales pour l’enregistrement ou la stimulation parce que les courants électriques se propagent dans toutes les directions.
En tant que technologie émergente, l’optogénétique a inauguré une nouvelle ère dans la compréhension du fonctionnement du système nerveux 9,10,11,12,13,14,15,16. L’essence des techniques optogénétiques est d’utiliser la lumière pour contrôler l’activité des protéines d’opsine sensibles à la lumière exprimées par des cellules génétiquement modifiées. Ainsi, l’optogénétique permet la modulation sophistiquée ou la surveillance de cellules génétiquement sélectionnées dans des circuits neuronaux compliqués14,17. L’utilisation plus large de l’approche optogénétique a nécessité un enregistrement neuronal simultané pour confirmer directement la neuromodulation optique. Par conséquent, un appareil intégré avec des fonctions de contrôle et d’enregistrement de la lumière serait extrêmement précieux 16,18,19,20,21,22,23,24,25.
Il existe des limites à la stimulation optogénétique conventionnelle à base de laser, qui nécessite un système de livraison de lumière volumineux et coûteux 26,27,28,29,30. Par conséquent, certains groupes de recherche ont utilisé des sondes en silicium à base de μLED pour minimiser la taille du système de distribution de lumière 31,32,33,34. Cependant, il existe un risque de lésions thermiques du cerveau causées par un contact direct avec les μLED en raison de la faible efficacité de conversion d’énergie des LED. Des guides d’ondes lumineuses, tels que les fibres optiques, le SU-8 et l’oxynitrure de silicium (SiON), ont été appliqués pour éviter les dommages thermiques 30,35,36,37,38,39. Cependant, cette stratégie présente également un inconvénient en raison de sa faible efficacité de couplage entre les sources lumineuses et les guides d’ondes.
Le réseau de microlentilles a déjà été introduit pour améliorer l’efficacité du couplage lumineux entre les LED et les fibres optiques40. Un système optrode a été développé sur la base des technologies de systèmes microélectromécaniques (MEMS) pour la stimulation optique et l’enregistrement électrique à l’échellemicrométrique 40. Le réseau de microlentilles entre une LED et des fibres optiques a augmenté l’efficacité lumineuse de 3,13 dB. Comme le montre la figure 1, un réseau de fibres optiques 2x2 est aligné sur le réseau de microlentilles 4x4 et le voyant est positionné sous le réseau de microlentilles. Les fibres optiques 2x2 sont montées au lieu de 4x4 pour réduire les lésions cérébrales. Un réseau d’électrodes en tungstène est positionné à côté du réseau d’optrode à l’aide de silicium via des trous pour l’enregistrement électrophysiologique (Figure 1B).
Le système se compose d’une partie supérieure jetable et de pièces inférieures détachables. La partie supérieure jetable, qui comprend le réseau de fibres optiques, le réseau de microlentilles et le réseau d’électrodes en tungstène, est conçue pour être implantée de manière permanente dans le cerveau pour des expériences in vivo . La partie inférieure comprend une source de lumière LED et une ligne d’alimentation externe, qui est facilement amovible et réutilisable pour une autre expérience sur les animaux. Un couvercle en plastique attachable protège la pièce jetable lorsque la partie détachable est retirée.
La faisabilité du système est vérifiée par implantation dans le cerveau de souris transgéniques exprimant la channelrhodopsine-2 (ChR2) dans des neurones ca2+/calmoduline-dépendante de la protéine kinase II positives (CaMKIIα::ChR2 souris). Des électrodes d’enregistrement ont été utilisées pour enregistrer les activités neuronales des neurones individuels lors de la stimulation optique des neurones.
Protocole
Les soins aux animaux et les interventions chirurgicales ont été approuvés par l’Institutional Animal Care and Use Committee (IACUC) de l’Ewha Womans University (n° 20-029).
1. Préparation d’un réseau d’optrode (Figure 1 et Figure 2)
- Fixez des fibres optiques avec le réseau de microlentilles.
- Retirez le revêtement de passivation de la fibre optique et coupez-le en morceaux de 5 mm de long à l’aide d’un couperet à fibre optique de précision.
- Trempez la fibre optique dans la résine UV transparente et placez les fibres optiques sur le réseau de microlentilles.
- Durcissez la résine à l’aide d’une lampe UV.
- Fixez le réseau de microlentilles au boîtier imprimé en 3D à l’aide d’époxy.
- Aligner les fils de tungstène revêtus de perfluoroalkyoxy (PFA).
- Souder les 4 pièces de fils de tungstène PFA de 30 mm de long et 1 fil d’argent au connecteur femelle à 5 broches et 1,27 mm de pas. Utilisez du fil d’argent comme électrode de référence.
- Connectez le connecteur femelle à pas de 1,27 mm au préamplificateur de la scène de tête.
- Placez soigneusement des fils de tungstène à travers le silicium via les trous (Figure 1B) pour faciliter l’alignement fin des électrodes en tungstène.
- Coupez les fils de tungstène alignés 1 mm plus courts que la longueur de la fibre optique.
- Fixez le connecteur au boîtier imprimé en 3D à l’aide d’époxy.
- Placement des LED
- Placez la LED dans le boîtier imprimé en 3D.
- Connectez la LED au circuit d’entraînement qui génère la modulation de largeur d’impulsion (PWM).
REMARQUE: L’impulsion PWM est générée par le microcontrôleur. - Compte tenu du bruit induit par le circuit d’entraînement LED, assurez-vous que les électrodes d’enregistrement sont espacées de 50 mm du circuit d’entraînement LED.
- Mesurez l’intensité lumineuse à l’extrémité de la pointe de la fibre optique à l’aide d’une photodiode.
- Immerger les électrodes en tungstène et les fibres optiques dans de l’alcool pendant 15 min. Ensuite, immergez le système dans de l’eau stérile D.I et stérilisez avec de l’oxyde d’éthylène gazeux.
2. Chirurgie d’implantation (Figure 3 et Figure 4)
REMARQUE: La technique stérile doit être suivie pendant la chirurgie.
- Préparez les animaux transgéniques, qui sont génétiquement modifiés pour exprimer des protéines d’opsine sensibles à la lumière dans le type spécifique de cellules neuronales.
REMARQUE: Une souris transgénique mâle, âgée de 2 mois, exprimant la channelrhodopsine-2 (ChR2) dans les neurones Ca2+/calmodulin-dependent protein kinase II-positive (CaMKIIα::ChR2 mouse) a été utilisée dans cette étude41. - Anesthésier la souris avec un cocktail kétamine-xylazine - un mélange de kétamine (100 mg / kg) et de xylazine (10 mg / kg) - par administration intrapéritonéale.
- Vérifiez l’animal anesthésié toutes les 30 minutes en surveillant le mouvement des moustaches et la réaction au pincement des pattes.
- Injecter le cocktail kétamine-xylazine à la moitié de la dose initiale si une anesthésie supplémentaire est nécessaire.
- Rasez la peau de la tête et placez la souris anesthésiée dans le cadre stéréotaxique.
REMARQUE: Effectuer une préparation chirurgicale de la peau et draper l’animal. La préparation de la peau implique l’épilation suivie d’un nettoyage de la peau avec des agents antimicrobiens.- Placez la tête dans le cadre stéréotaxique et insérez des barres d’oreille dans le méat.
- Centrez la tête de la souris dans le cadre stéréotaxique en desserrant et en resserrant à plusieurs reprises les barres d’oreille pour un positionnement exact.
- Placez la barre d’incisive de sorte que les incisives supérieures s’accrochent sur le bord intérieur avant.
- Ajustez la barre d’incisive pour régler la hauteur de la barre d’incisive et serrez la pince du nez contre le museau.
- Allumez à l’avance le coussin chauffant thermique intégré dans le cadre stéréotaxique pour maintenir la température corporelle à 37 °C tout au long des interventions chirurgicales.
- Placez la sonde thermique dans le rectum de la souris pour la régulation homéotherme.
REMARQUE: Le placement de la barre auriculaire doit être vérifié en saisissant et en balançant doucement le museau. La barre auriculaire doit être réajustée si le museau peut être déplacé latéralement de plus de 4 mm.
- Couvrez les yeux avec de la vaseline (voir la table des matériaux) pour éviter la sécheresse.
- Injecter 1% de lidocaïne dans le cuir chevelu. Soulevez la peau de la tête avec une pince, fixez un espace d’injection et injectez la lidocaïne sous le cuir chevelu.
- Effectuez une incision sagittale à l’aide d’un scalpel et de ciseaux fins. Tenez la peau incisée avec un micro-poil pour élargir la visibilité de la zone chirurgicale.
REMARQUE: La longueur de l’incision est de <1 cm au-dessus du bregma et du bord caudal de l’os interpariétal. - Retirez le périoste à l’aide de cotons-tiges. S’il y a des saignements, cautériser le crâne à l’aide d’un bovie pour sceller les vaisseaux sanguins.
- Nettoyez le crâne avec une solution saline et marquez les sites de craniotomie à l’aide d’un bras manipulateur : hippocampe antérieur-postérieur (AP) -1,8 à -2,8 mm, médial-latéral (ML) 0,5-2,5 mm et dorsal-ventral (DV) -1 à -2 mm.
REMARQUE: Compte tenu de l’épaisseur du crâne de la souris, insérez le réseau d’optrode -1,2 à -2,2 mm de la zone cérébrale exposée. Compte tenu de la voie hippocampique, les cellules pyramidales de CA3 envoient leurs axones à CA1. Par conséquent, les fibres optiques sont 1 mm plus longues que les électrodes d’enregistrement, de sorte que les fibres optiques sont placées en CA3 et les électrodes d’enregistrement en CA1. - Percez un trou au-dessus du cervelet et insérez une vis pour le sol. Placez la vis de terre à 0,5 mm de profondeur avec une vis de précision jusqu’à ce qu’elle atteigne le sommet du cervelet.
REMARQUE: Assurez l’insertion serrée de la vis, qui sera utilisée comme électrode de masse et structure de support pour maximiser la stabilité à long terme de l’implantation, car elle augmente la surface tridimensionnelle pour l’adhérence du ciment dentaire. - Percez la zone marquée et retirez un morceau du crâne avec une pince.
- Pliez une pointe d’aiguille de 26 G dans le sens des aiguilles d’une montre à 120 ° et exposez la zone du cerveau en insérant le côté biseauté de l’aiguille orientée vers le haut. Veillez à ne pas endommager le cerveau et les vaisseaux sanguins.
- Nettoyez le cerveau exposé avec une solution saline pour éliminer la poussière osseuse et les matières étrangères.
- Fixez le réseau d’optrode dans le bras manipulateur et rapprochez-vous de la zone exposée.
REMARQUE: Lors du placement de l’appareil, le recalcul de la zone cible à partir du bregma peut augmenter la précision du placement. - Insérez lentement le réseau optrode et connectez la vis de terre au fil d’argent fixé au système42.
REMARQUE: Dans ce processus, la matrice doit être étroitement fixée au bras manipulateur pour minimiser les oscillations afin d’éviter les lésions cérébrales dues aux micromouvements lors de l’insertion. L’insertion doit être effectuée lentement, avec un repos de 10 minutes pour tenir compte de l’enflure du cerveau qui peut avoir été pressé après l’insertion. Une vitesse d’insertion inférieure à 1 μm/s dans le tissu cérébral est recommandée pour la haute qualité du rapport signal/bruit et le nombre d’unités uniques séparables42. - En cas de saignement, appliquez une pression directe sur les saignements avec un coton-tige sec ou utilisez une cautérisation. Ne passez pas aux étapes suivantes jusqu’à ce que le saignement soit complètement arrêté.
- Insérez de la mousse de gel entre le cerveau exposé et l’appareil pour protéger les produits chimiques du contact direct avec le cerveau.
REMARQUE: La mousse de gel aide également l’hémostase et maintient le cerveau humide. - Essuyez le crâne avec des cotons-tiges pour éliminer autant d’humidité que possible et passez à l’étape de fixation suivante.
- Appliquez soigneusement du ciment dentaire sur le crâne pour fixer l’appareil et couvrir la mousse de gel. Avant que le ciment dentaire ne soit complètement durci, séparez le cuir chevelu s’il est attaché au ciment dentaire. Tirez la peau incisée avec une pince pour couvrir le ciment dentaire durci et suturer le cuir chevelu. Ensuite, relâchez l’appareil du bras manipulateur.
REMARQUE: Assurez-vous que le ciment dentaire ne colle pas à la peau et ne couvre que la région du crâne. Lorsque la peau se développe, elle peut repousser le ciment et, éventuellement, l’appareil tombera. Cela posera un problème critique pour les expériences in vivo à long terme.
3. Récupération et soins des implants
- Sortez la souris du cadre stéréotaxique.
- Administrer la solution de carprofène à l’aide d’une aiguille de 26 G. Injecter une fois avant la chirurgie et 12 h (le lendemain matin en cas de chirurgie de l’après-midi) et 24 h après la chirurgie pour réduire la douleur.
REMARQUE: La concentration du médicament dans le flacon est de 50 mg / mL et il est stocké à 4 ° C. Le carprofène est visqueux et doit être dilué dans de l’eau stérile 1:10. Si la stérilité est maintenue, la solution peut être conservée jusqu’à 4 semaines. Pour maintenir la durée efficace du médicament, injecter la solution de carprofène à des intervalles de 12 heures. - Placez la souris sur le coussin chauffant et vérifiez si elle récupère bien de l’anesthésie.
REMARQUE: L’animal n’est pas laissé sans surveillance jusqu’à ce qu’il retrouve une conscience suffisante. - Retirez les fils de suture 7 à 10 jours après la chirurgie.
- Laissez l’animal récupérer pendant 1 semaine. Surveillez la consommation de nourriture et d’eau pendant le temps de récupération. Administrer l’analgésique et vérifier les signes d’inconfort ou de douleur.
REMARQUE: Les animaux qui ont subi une intervention chirurgicale ne peuvent pas rester avec les autres animaux jusqu’à ce qu’ils se rétablissent complètement.- Pendant la période de récupération, pesez la souris tous les jours pour vérifier les changements de poids. Sacrifiez la souris (voir rubrique 6) s’il y a une perte de poids de 20% par rapport aux animaux témoins appariés selon l’âge et le sexe.
4. Stimulation optogénétique et enregistrement électrophysiologique
- Anesthésiez la souris et placez la souris anesthésiée dans le cadre stéréotaxique.
- Configurez les paramètres de stimulation.
- Réglez la recette d’impulsion lumineuse sur un rapport cyclique de 4 % et une fréquence de 10 Hz43. Configurez la stimulation lumineuse pendant 2 s (20 impulsions) pendant l’enregistrement neuronal.
- Utilisez un courant de 50 mA pour piloter une intensité lumineuse de 3 mW/mm2 à l’extrémité de la fibre optique. Mesurez la puissance lumineuse à l’aide d’une photodiode et d’un capteur de puissance et divisez la puissance lumineuse par la zone de la facette de la fibre optique.
- Retirez le couvercle en plastique et fixez la partie supérieure contenant le système de distribution de lumière avec la LED réutilisable et les circuits.
- Connectez le préamplificateur headstage au connecteur 5 broches implanté.
- Ouvrez le logiciel pour enregistrer les signaux neuronaux.
- Configurez les filtres logiciels. Utilisez un filtre passe-bande à 0,1-20 kHz et un filtre à encoche à 60 Hz. Réglez la fréquence d’échantillonnage de l’amplificateur sur 20 kHz.
- Avant l’enregistrement, vérifiez si les signaux de pic neuronal sont détectés.
REMARQUE: L’annulation du bruit est importante car les signaux neuronaux sont trop petits. Si le niveau de bruit est trop élevé, les signaux neuronaux peuvent être obscurcis par le bruit et devenir invisibles. Utilisez une mise à la terre et un blindage contre les ondes électromagnétiques appropriés pour réduire le bruit. - Après la vérification du signal, enregistrez les signaux neuronaux sans stimulation lumineuse pour l’enregistrement de base.
- Délivrez de la lumière LED et enregistrez simultanément les réponses neuronales (Figure 5 et Figure 6).
REMARQUE: Une fois stimulée, l’expérience de stimulation suivante doit être effectuée après un intervalle d’au moins 5 minutes afin que l’activité neuronale évoquée par la stimulation précédente n’affecte pas l’expérience suivante.
5. Analyse des données
- Chargez les données acquises à l’aide du programme MATLAB.
- Obtenez des activités neuronales uniques à l’aide d’un algorithme de tri de pics « Wave-Clus"44,45. Détectez les pics dans chaque canal par un seuil d’amplitude comme dans Eq (1)45.
Seuil = 5 × médiane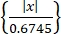 (1)
(1)
Où x est le signal filtré par passe-bande.- Pour installer « Wave-Clus », reportez-vous au lien de téléchargement dans le Tableau des matériaux.
- Pour ouvrir l’interface utilisateur graphique (GUI), tapez wave_clus dans l’invite de commandes de MATLAB.
- Tapez Get_spikes('filename.ext') pour l’extension de fichier préparée à la détection des pics. Ensuite, exécutez Do_clustering('filename_spikes.mat') pour le tri des pointes.
- Comptez les pointes triées avant, pendant et après la stimulation lumineuse avec des bacs temporels spécifiques. Utilisez des bacs de temps de 0,2 s et 2 s pour l’analyse.
- Tracez le nombre de pics de chaque canal d’enregistrement.
NOTE: La moyenne avec erreur-type des moyennes (SEM) des données des résultats de 8 expériences répétées a été calculée et tracée.
6. Euthanasie
- Après toutes les expériences, sacrifiez la souris par inhalation de dioxyde de carbone (CO2).
- Sans précharger la chambre, placez la souris dans la chambre d’euthanasie transparente, sans apport de CO2 et/ou fuites.
- Allumez le gaz CO2 et déplacez l’air à une vitesse de 30 à 50% du volume d’air de la chambre d’euthanasie par minute.
REMARQUE: Un débitmètre doit être connecté à la bouteille de gaz CO2 pour s’assurer que le taux de déplacement de l’air est de 30 à 50% du volume de la chambre d’euthanasie par minute. - Surveillez la souris sacrifiée pour le manque de respiration et le changement de couleur des yeux.
REMARQUE: Le temps prévu pour l’euthanasie est généralement dans les 10 à 15 minutes. - Après avoir observé les signes de décès, retirez la souris de la chambre d’euthanasie.
- Pour compléter la procédure d’euthanasie, vérifiez le décès en confirmant l’arrêt respiratoire et cardiaque.
Résultats
Le système optrode est fabriqué avec succès pour fournir une puissance lumineuse suffisante pour activer les neurones cibles. L’alignement fin des électrodes en tungstène est obtenu grâce au silicium microfabriqué via les trous. L’intensité lumineuse mesurée est de 3,6 mW/mm2 à l’extrémité de la fibre optique lorsque du courant de 50 mA est appliqué. Les microlentilles ont augmenté l’efficacité lumineuse de 3,13 dB. En raison du réseau de microlentilles, qui améliore le couplage de la ...
Discussion
La faisabilité du système de stimulation optogénétique simultanée et d’enregistrement électrophysiologique a été vérifiée (figure 6). Les gros pics lors de la stimulation lumineuse sont des artefacts photoélectriques se produisant en même temps que la stimulation lumineuse (Figure 6A). Cela est clair dans la vue agrandie de la forme d’onde dans le rectangle pointillé rouge (Figure 6A). Comme le montre la
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette recherche a été soutenue par le programme de R&D convergent Technology pour l’augmentation humaine par l’intermédiaire de la National Research Foundation of Korea (NRF), financé par le ministère des Sciences et des TIC (NRF-2019M3C1B8090805), et soutenu par une subvention de la National Research Foundation of Korea (NRF) financée par le gouvernement coréen (MSIT) (n° 2019R1A2C1088909). Nous remercions le laboratoire de Seung-Hee Lee au Département des sciences biologiques, KAIST, Daejeon, Corée, d’avoir aimablement fourni les souris transgéniques.
matériels
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
Références
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon