Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Массив Optrode для одновременной оптогенетической модуляции и электрической нейронной записи
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем метод изготовления оптроодной системы с оптическими волокнами для доставки света и электродной решеткой для нейронной записи. Эксперименты in vivo с трансгенными мышами, экспрессирующими каналродопсин-2, показывают целесообразность системы одновременной оптогенетической стимуляции и электрофизиологической регистрации.
Аннотация
В течение последнего десятилетия оптогенетика стала важным инструментом для исследования нейронной сигнализации из-за ее уникальной способности селективной нейронной модуляции или мониторинга. Поскольку определенные типы нейронных клеток могут быть генетически модифицированы для экспрессии белков опсина, оптогенетика позволяет оптическую стимуляцию или ингибирование выбранных нейронов. Было несколько технологических достижений в оптической системе для оптогенетики. Недавно было предложено объединить оптический волновод для доставки света с электрофизиологической записью для одновременного мониторинга нейронных реакций на оптогенетическую стимуляцию или ингибирование. В этом исследовании была разработана имплантируемая матрица оптродов (оптические волокна 2x2) со встроенными многоканальными электродами.
В качестве источника света использовался светодиод (LED), а микрофабрикированная микролинзированная матрица была интегрирована для обеспечения достаточной мощности света на кончике оптических волокон. Система массива optrode состоит из одноразовой и многоразовой частей. Одноразовая часть имеет оптические волокна и электроды, в то время как многоразовая часть имеет светодиодную и электронную схему для управления светом и обработки нейронных сигналов. Новый дизайн имплантируемой системы массива оптродов представлен в сопроводительном видео в дополнение к процедуре имплантации оптрода, оптогенетической световой стимуляции и электрофизиологической нейронной записи. Результаты экспериментов in vivo успешно показали зафиксированные во времени нейронные всплески, вызванные световыми раздражителями от возбуждающих нейронов гиппокампа мышей.
Введение
Запись и контроль нейронной активности необходимы для понимания того, как мозг функционирует в нейронной сети и на клеточном уровне. Традиционные электрофизиологические методы записи включаютзажим пластыря 1,2,3,4 с использованием микропипетки и внеклеточную запись с использованием микронейральных электродов 5,6,7,8. В качестве метода нейромодуляции электрическая стимуляция часто используется для прямой стимуляции очаговой области мозга путем прямой или косвенной деполяризации нейрональных клеток. Однако электрический метод не может различать типы нейронных клеток для записи или стимуляции, потому что электрические токи распространяются во всех направлениях.
Как новая технология, оптогенетика открыла новую эру в понимании того, как работает нервная система 9,10,11,12,13,14,15,16. Суть оптогенетических методик заключается в использовании света для контроля активности светочувствительных белков опсина, экспрессируемых генетически модифицированными клетками. Таким образом, оптогенетика позволяет осуществлять сложную модуляцию или мониторинг генетически отобранных клеток в сложных нейронных цепях14,17. Более широкое использование оптогенетического подхода потребовало одновременной нейронной записи для прямого подтверждения оптической нейромодуляции. Поэтому интегрированное устройство с функциями управления светом и записи было бы чрезвычайно ценным 16,18,19,20,21,22,23,24,25.
Существуют ограничения обычной лазерной оптогенетической стимуляции, которая требует громоздкой и дорогой системы доставки света 26,27,28,29,30. Поэтому некоторые исследовательские группы использовали кремниевые зонды на основе μLED, чтобы минимизировать размер системы доставки света 31,32,33,34. Тем не менее, существует риск теплового повреждения головного мозга, вызванного прямым контактом с μLED из-за низкой эффективности преобразования энергии светодиодов. Световые волноводы, такие как оптические волокна, SU-8 и оксинитрид кремния (SiON), были применены для предотвращения термического повреждения 30,35,36,37,38,39. Однако эта стратегия также имеет недостаток из-за низкой эффективности связи между источниками света и волноводами.
Массив микролинз был ранее представлен для повышения эффективности световой связи между светодиодами и оптическими волокнами40. Разработана система оптродов на основе технологий микроэлектромеханических систем (МЭМС) для оптической стимуляции и электрической записи на микроуровне40. Массив микролинз между светодиодом и оптическими волокнами увеличил эффективность света на 3,13 дБ. Как показано на рисунке 1, волоконно-оптическая решетка 2x2 выровнена на массиве микролинз 4x4, а светодиод расположен под массивом микролинз. Оптические волокна 2x2 установлены вместо 4x4 для уменьшения повреждения головного мозга. Матрица вольфрамовых электродов расположена рядом с массивом оптродов с использованием кремния через отверстия для электрофизиологической записи (рисунок 1B).
Система состоит из верхней одноразовой части и съемных нижних частей. Верхняя одноразовая часть, которая включает в себя матрицу оптического волокна, матрицу микролинзов и решетку вольфрамовых электродов, предназначена для постоянной имплантации в мозг для экспериментов in vivo . Нижняя часть включает в себя светодиодный источник света и внешнюю линию питания, которая легко снимается и многократно используется для другого эксперимента на животных. Прикрепляемая пластиковая крышка защищает одноразовую часть при снятии съемной части.
Осуществимость системы проверяется путем имплантации в мозг трансгенных мышей, экспрессирующих каналродопсин-2 (ChR2) в Ca2+/кальмодулин-зависимых протеинкиназных II-положительных нейронах (CaMKIIα::ChR2 мыши). Записывающие электроды использовались для записи нейронной активности отдельных нейронов во время оптической стимуляции нейронов.
протокол
Уход за животными и хирургические процедуры были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) в Женском университете Ихва (No 20-029).
1. Подготовка массива оптродов (рисунок 1 и рисунок 2)
- Подключите оптические волокна с помощью матрицы микролинз.
- Снимите пассивационное покрытие оптического волокна и разрежьте его на куски длиной 5 мм с помощью прецизионного тесака оптического волокна.
- Окуните оптическое волокно в прозрачную УФ-смолу и поместите оптические волокна на массив микролинз.
- Отверните смолу с помощью УФ-лампы.
- Прикрепите массив микролинз к 3D-печатному корпусу с помощью эпоксидной смолы.
- Выровняйте вольфрамовые провода с перфторалкокси (PFA) покрытием.
- Припаяйте 4 куска вольфрамовых проводов PFA длиной 30 мм и 1 серебряную проволоку к 5-контактному разъему с шагом 1,27 мм. Используйте серебряную проволоку в качестве опорного электрода.
- Подключите гнездовой разъем с шагом 1,27 мм к предусилителю головной ступени.
- Осторожно пропустите вольфрамовые провода через кремний через отверстия (рисунок 1B), чтобы помочь точному выравниванию вольфрамовых электродов.
- Вырежьте выровненные вольфрамовые провода на 1 мм короче длины оптического волокна.
- Прикрепите разъем к корпусу, напечатанному на 3D-принтере, с помощью эпоксидной смолы.
- Размещение светодиодов
- Поместите светодиод в 3D-печатный корпус.
- Подключите светодиод к цепи привода, которая генерирует широтно-импульсную модуляцию (ШИМ).
ПРИМЕЧАНИЕ: ИМПУЛЬС ШИМ генерируется микроконтроллером. - Учитывая шум, индуцируемый светодиодной схемой вождения, убедитесь, что записывающие электроды находятся на расстоянии 50 мм друг от друга от светодиодной схемы вождения.
- Измерьте интенсивность света в конце наконечника оптического волокна с помощью фотодиода.
- Погрузить вольфрамовые электроды и оптические волокна в спирт на 15 мин. Затем погрузите систему в стерильную воду D.I и стерилизуйте газом окиси этилена.
2. Имплантационная хирургия (Рисунок 3 и Рисунок 4)
ПРИМЕЧАНИЕ: Стерильная техника должна соблюдаться во время операции.
- Готовят трансгенных животных, которые генетически модифицированы для экспрессии светочувствительных белков опсина в определенном типе нейрональных клеток.
ПРИМЕЧАНИЕ: Самец, 2 месяца, трансгенный мыши, экспрессирующий каналродопсин-2 (ChR2) в Ca2 +/кальмодулин-зависимых протеинкиназных II-положительных нейронах (CaMKIIα::ChR2 мышь), был использован в этом исследовании41. - Обезболить мышь коктейлем кетамин-ксилазин - смесь кетамина (100 мг/кг) и ксилазина (10 мг/кг) - путем внутрибрюшинного введения.
- Проверяйте обезболивающее животное каждые 30 минут, контролируя движение усов и реакцию на ущемление лапы.
- Вводят коктейль кетамин-ксилазин в половину начальной дозы, если требуется дополнительная анестезия.
- Сбрить кожу головы и поместить обезболенную мышь в стереотаксическую рамку.
ПРИМЕЧАНИЕ: Выполните хирургическую подготовку кожи и драпируйте животное. Подготовка кожи включает в себя удаление волос с последующей очисткой кожи противомикробными средствами.- Поместите головку в стереотаксическую рамку и вставьте ушные вкладыши в меатус.
- Центрируйте головку мыши в стереотаксическом кадре, многократно ослабляя и затягивая ушные вкладыши для точного позиционирования.
- Поместите резцовый брус так, чтобы верхние резцы зацепились за передний внутренний край.
- Отрегулируйте резцовый стержень для установки высоты резцовой планки и затяните зажим носа к морде.
- Заранее включите тепловую грелку, встроенную в стереотаксическую рамку, чтобы поддерживать температуру тела на уровне 37 °C на протяжении всех хирургических процедур.
- Поместите термозонд в прямую кишку мыши для гомеотермической регуляции.
ПРИМЕЧАНИЕ: Расположение ушной балки должно быть проверено путем осторожного захвата и покачивания морды. Ушная перекладина должна быть перенастроена, если морда может быть перемещена более чем на 4 мм в боковом направлении.
- Накройте глаза вазелином (см. Таблицу материалов) для предотвращения сухости.
- Вводят 1% лидокаина в кожу головы. Поднимите кожу головы щипцами, закрепите пространство для инъекций и введите лидокаин под кожу головы.
- Выполните сагиттальный разрез с помощью скальпеля и тонких ножниц. Удерживайте разрезанную кожу микрозажимом, чтобы расширить видимость хирургической области.
ПРИМЕЧАНИЕ: Длина разреза составляет <1 см над брегмой и каудальным краем межтеменной кости. - Удалите надкостницу ватными тампонами. Если есть кровотечение, прижигайте череп, используя бульон, чтобы запечатать кровеносные сосуды.
- Очистите череп физиологическим раствором и отметьте места трепанации черепа с помощью манипулятора: гиппокампа передне-заднего (AP) от −1,8 до −2,8 мм, медиально-латерального (ML) 0,5-2,5 мм и дорсально-вентрального (DV) от −1 до −2 мм.
ПРИМЕЧАНИЕ: Учитывая толщину черепа мыши, вставьте массив оптродов от -1,2 до -2,2 мм от открытой области мозга. Учитывая гиппокампальный путь, пирамидальные клетки CA3 посылают свои аксоны в CA1. Таким образом, оптические волокна на 1 мм длиннее записывающих электродов, так что оптические волокна помещаются в CA3, а записывающие электроды в CA1. - Просверлите отверстие над мозжечком и вставьте винт для земли. Поместите заземляющий винт глубиной 0,5 мм с помощью прецизионного винта до тех пор, пока он не достигнет верхней части мозжечка.
ПРИМЕЧАНИЕ: Обеспечьте плотное вставление винта, который будет использоваться в качестве заземляющего электрода и несущей конструкции для максимизации долгосрочной стабильности имплантации, так как он увеличивает трехмерную поверхность для адгезии зубного цемента. - Просверлите отмеченный участок и удалите кусок черепа щипцами.
- Согните наконечник иглы весом 26 г до 120° по часовой стрелке и обнажите область мозга, вставив коническую сторону иглы, обращенную вверх. Будьте осторожны, чтобы не повредить мозг и кровеносные сосуды.
- Очистите открытый мозг физиологическим раствором, чтобы вымыть костную пыль и посторонние вещества.
- Зафиксируйте массив optrode в манипуляторе и подойдите близко к открытой области.
ПРИМЕЧАНИЕ: При размещении устройства повторный расчет целевой площади из брегмы может повысить точность размещения. - Медленно вставьте матрицу optrode и подключите заземляющий винт к серебряному проводу, прикрепленному к системе42.
ПРИМЕЧАНИЕ: В этом процессе массив должен быть плотно прикреплен к манипулятору, чтобы свести к минимуму колебания, чтобы предотвратить повреждение мозга от микродвижения во время введения. Введение должно выполняться медленно, с отдыхом в течение 10 минут, чтобы учесть отек мозга, который, возможно, был нажат после введения. Скорость введения менее 1 мкм/с в ткани головного мозга рекомендуется для обеспечения высокого качества отношения сигнал/шум и количества отделяемых единичных блоков42. - Если есть кровотечение, нанесите прямое давление на кровопускатели сухим ватным тампоном или используйте прижигание. Не переходите к следующим шагам до тех пор, пока кровотечение не будет полностью остановлено.
- Вставьте гелевую пену между открытым мозгом и устройством, чтобы защитить химические вещества от прямого контакта с мозгом.
ПРИМЕЧАНИЕ: Гелевая пена также помогает гемостазу и сохраняет мозг влажным. - Протрите череп ватными тампонами, чтобы максимально удалить влагу, и приступайте к следующему этапу фиксации.
- Осторожно нанесите зубной цемент на череп, чтобы зафиксировать устройство и покрыть гель-пену. Прежде чем зубной цемент полностью затвердеет, отделите кожу головы, если она прикреплена к зубному цементу. Потяните разрезанную кожу щипцами, чтобы покрыть затвердевший зубной цемент и зашить кожу головы. Затем отпустите устройство от рычага манипулятора.
ПРИМЕЧАНИЕ: Убедитесь, что зубной цемент не прилипает к коже и покрывает только область черепа. Когда кожа растет, она может оттолкнуть цемент и, в конце концов, устройство отвалится. Это вызовет критическую проблему для долгосрочных экспериментов in vivo .
3. Восстановление и уход за имплантатами
- Выньте мышь из стереотаксического кадра.
- Вводят раствор карпрофена с помощью иглы 26 г. Инъекция один раз перед операцией и через 12 ч (на следующее утро в случае послеобеденной операции) и через 24 ч после операции для уменьшения боли.
ПРИМЕЧАНИЕ: Концентрация препарата во флаконе составляет 50 мг/мл, и он хранится при 4 °C. Карпрофен вязкий и его нужно разбавлять в стерильной воде 1:10. При сохранении стерильности раствор можно хранить до 4 недель. Для поддержания эффективной продолжительности действия препарата вводят раствор Карпрофена с интервалом 12 ч. - Положите мышь на грелку и проверьте, хорошо ли она восстанавливается после анестезии.
ПРИМЕЧАНИЕ: Животное не остается без присмотра до тех пор, пока оно не придет в достаточное сознание. - Удаляют шовные нити через 7 - 10 дней после операции.
- Дайте животному восстановиться в течение 1 недели. Контролируйте потребление пищи и воды во время восстановления. Введите анальгетик и проверьте наличие признаков дискомфорта или боли.
ПРИМЕЧАНИЕ: Животные, перенесшие операцию, не могут оставаться с другими животными до тех пор, пока они полностью не выздоровеют.- Во время восстановительного периода взвешивайте мышь каждый день, чтобы проверить изменения веса. Принесите в жертву мышь (см. раздел 6), если потеря веса составляет 20% по сравнению с контрольными животными, соответствующими возрасту и полу.
4. Оптогенетическая стимуляция и электрофизиологическая запись
- Обезбольте мышь и поместите обезболенную мышь в стереотаксическую рамку.
- Настройте параметры стимуляции.
- Установите рецепт светового импульса на рабочий цикл 4% и частоту 10 Гц43. Настройте световую стимуляцию на 2 с (20 импульсов) во время нейронной записи.
- Используйте ток 50 мА для управления интенсивностью света 3 мВт/мм2 на наконечнике оптического волокна. Измерьте мощность света с помощью фотодиода и измерителя мощности и разделите мощность света на область фасетки оптического волокна.
- Снимите пластиковую крышку и прикрепите верхнюю часть, содержащую систему подачи света, с многоразовым светодиодом и цепями.
- Подключите предусилитель головной ступени к имплантированному 5-контактному разъему.
- Откройте программное обеспечение для записи нейронных сигналов.
- Настройте программные фильтры. Используйте полосовой фильтр на частоте 0,1-20 кГц и фильтр с насечкой на частоте 60 Гц. Установите частоту дискретизации усилителя на 20 кГц.
- Перед записью проверьте, обнаружены ли сигналы нейронного всплеска.
ПРИМЕЧАНИЕ: Шумоподавление важно, потому что нейронные сигналы слишком малы. Если уровень шума слишком высок, нейронные сигналы могут быть скрыты шумом и стать невидимыми. Используйте соответствующее заземление и экранирование электромагнитными волнами для снижения шума. - После проверки сигнала записывайте нейронные сигналы без световой стимуляции для базовой записи.
- Подавайте светодиодный свет и одновременно записывайте нейронные реакции (рисунок 5 и рисунок 6).
ПРИМЕЧАНИЕ: После стимуляции следующий эксперимент по стимуляции должен быть выполнен через интервал не менее 5 минут, чтобы активность нейронов, вызванная предыдущей стимуляцией, не повлияла на следующий эксперимент.
5. Анализ данных
- Загрузите полученные данные с помощью программы MATLAB.
- Получение одиночных нейронных активностей с помощью алгоритма сортировки шипов "Wave-Clus"44,45. Обнаружение пиков в каждом канале по порогу амплитуды, как в Eq (1)45.
Порог = 5 × медиана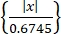 (1)
(1)
Где x — сигнал с полосовой фильтрацией.- Чтобы установить "Wave-Clus", перейдите по ссылке для скачивания в Таблице материалов.
- Чтобы открыть графический интерфейс пользователя( GUI), введите wave_clus в командной строке MATLAB.
- Введите Get_spikes('filename.ext') для расширения файла, готового к обнаружению пиков. Затем запустите Do_clustering ('filename_spikes.mat') для сортировки шипов.
- Подсчитайте отсортированные всплески до, во время и после световой стимуляции с помощью определенных временных бункеров. Используйте временные бункеры 0,2 с и 2 с для анализа.
- График количества пиков от каждого канала записи.
ПРИМЕЧАНИЕ: Рассчитано и построено среднее со стандартной погрешностью средств (СЭМ) данных по результатам 8 повторных экспериментов.
6. Эвтаназия
- После всех экспериментов принесите мышь в жертву вдыханием углекислого газа (СО2).
- Без предварительной зарядки камеры поместите мышь в прозрачную камеру эвтаназии, без подачиCO2 и / или утечек.
- Включите газСО2 и вытесните воздух со скоростью 30 - 50% от объема воздуха в камере эвтаназии в минуту.
ПРИМЕЧАНИЕ: Расходомер должен быть подключен к газовому баллону CO2 для обеспечения того, чтобы скорость вытеснения воздуха составляла 30-50% от объема камеры эвтаназии в минуту. - Следите за принесенной в жертву мышью на предмет отсутствия дыхания и изменения цвета глаз.
ПРИМЕЧАНИЕ: Ожидаемое время эвтаназии обычно составляет от 10 до 15 минут. - После наблюдения за признаками смерти удалите мышь из камеры эвтаназии.
- Чтобы завершить процедуру эвтаназии, подтвердите смерть, подтвердив остановку дыхания и сердца.
Результаты
Система оптродов успешно изготовлена для обеспечения достаточной световой мощности для активации целевых нейронов. Тонкое выравнивание вольфрамовых электродов достигается за счет микрофабрикатного кремния через отверстия. Измеренная интенсивность света составляет 3,6 мВт/мм2 ...
Обсуждение
Проверена целесообразность системы одновременной оптогенетической стимуляции и электрофизиологической регистрации (рисунок 6). Большие всплески во время световой стимуляции представляют собой фотоэлектрические артефакты, происходящие одновременно со световой стим...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Это исследование было поддержано Программой исследований и разработок в области конвергентных технологий для увеличения человека через Национальный исследовательский фонд Кореи (NRF), финансируемым Министерством науки и ИКТ (NRF-2019M3C1B8090805) и поддержано грантом Национального исследовательского фонда Кореи (NRF), финансируемым правительством Кореи (MSIT) (No 2019R1A2C1088909). Мы благодарим лабораторию Сын Хи Ли в Департаменте биологических наук, KAIST, Тэджон, Корея, за любезное предоставление трансгенных мышей.
Материалы
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
Ссылки
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены