É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Oprode Array para modulação optogenética simultânea e gravação neural elétrica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos o método de fabricação de um sistema optrode com fibras ópticas para entrega de luz e uma matriz de eletrodos para gravação neural. Experimentos in vivo com camundongos transgênicos expressando channelrhodopsin-2 mostram a viabilidade do sistema para estimulação optogenética simultânea e gravação eletrofisiológica.
Resumo
Durante a última década, a optogenética tornou-se uma ferramenta essencial para a investigação da sinalização neural devido à sua capacidade única de modulação ou monitoramento neural seletivo. Como tipos específicos de células neuronais podem ser geneticamente modificados para expressar proteínas de opsina, a optogenética permite estimulação óptica ou inibição dos neurônios selecionados. Houve vários avanços tecnológicos no sistema óptico para optogenética. Recentemente, foi proposto combinar o guia óptico de ondas para entrega de luz com gravação eletrofisiológica para monitorar simultaneamente as respostas neurais à estimulação ou inibição optogenética. Neste estudo, foi desenvolvido um conjunto de optrode implantável (fibras ópticas 2x2) com eletrodos multicanais incorporados.
Um diodo emissor de luz (LED) foi empregado como fonte de luz, e uma matriz de microluvas microfrágico foi integrada para fornecer energia de luz suficiente na ponta das fibras ópticas. O sistema de matriz optrode compreende a parte descartável e a parte reutilizável. A peça descartável possui fibras ópticas e eletrodos, enquanto a parte reutilizável possui o LED e circuitos eletrônicos para controle de luz e processamento de sinal neural. O novo desenho do sistema de matriz optrode implantável é introduzido no vídeo que acompanha, além do procedimento da cirurgia de implantação de optrode, estimulação de luz optogenética e gravação neural eletrofisiológica. Os resultados de experimentos in vivo mostraram com sucesso picos neurais bloqueados pelo tempo evocados pelos estímulos de luz dos neurônios excitatórios hipocampais de camundongos.
Introdução
Gravar e controlar a atividade neural é essencial para entender como o cérebro funciona em uma rede neural e em níveis celulares. Os métodos convencionais de gravação eletrofisiológica incluem o grampode remendo 1,2,3,4 utilizando um micropipette e gravação extracelular usando eletrodos microneurais 5,6,7,8. Como método de neuromodulação, a estimulação elétrica tem sido frequentemente usada para estimular diretamente uma região cerebral focal através da despolarização direta ou indireta das células neuronais. No entanto, o método elétrico não pode distinguir tipos de células neuronais para gravação ou estimulação porque as correntes elétricas se espalham em todas as direções.
Como tecnologia emergente, a optogenética iniciou uma nova era na compreensão de como funciona o sistema nervoso 9,10,11,12,13,14,15,16. A essência das técnicas optogenéticas é usar a luz para controlar a atividade de proteínas de opsina sensíveis à luz expressas por células geneticamente modificadas. Assim, a optogenética permite a modulação ou monitoramento sofisticado de células geneticamente selecionadas em circuitos neurais complicados14,17. O uso mais amplo da abordagem optogenética exigiu registro neural simultâneo para confirmar diretamente a neuromodulação óptica. Portanto, um dispositivo integrado com funções de controle de luz e gravação seria extremamente valioso 16,18,19,20,21,22,23,24,25.
Há limitações da estimulação optogenética convencional baseada em laser, que requer um sistema de entrega de luz volumoso e caro 26,27,28,29,30. Portanto, alguns grupos de pesquisa utilizaram sondas de silício baseadas em μLED para minimizar o tamanho do sistema de entrega de luz 31,32,33,34. No entanto, há risco de danos cerebrais térmicos causados pelo contato direto com μLEDs devido à baixa eficiência de conversão de energia dos LEDs. Guias de ondas leves, como fibras ópticas, SU-8 e oxírio de silício (SiON), foram aplicados para evitar danos térmicos 30,35,36,37,38,39. No entanto, essa estratégia também tem uma desvantagem devido à sua baixa eficiência de acoplamento entre fontes de luz e os guias de onda.
O conjunto de microlens foi introduzido anteriormente para aumentar a eficiência de acoplamento de luz entre LEDs e fibras ópticas40. Um sistema optrode foi desenvolvido com base em tecnologias de sistemas microeletromecânicos (MEMS) para estimulação óptica e gravação elétrica em uma microescala40. O conjunto de microlens entre um LED e fibras ópticas aumentou a eficiência da luz em 3,13 dB. Como mostrado na Figura 1, uma matriz de fibra óptica 2x2 está alinhada na matriz de microlens 4x4, e o LED está posicionado abaixo da matriz de microlens. As fibras ópticas 2x2 são montadas em vez de 4x4 para reduzir os danos cerebrais. Uma matriz de eletrodo de tungstênio é posicionada adjacente à matriz optrode usando silício através de orifícios para gravação eletrofisiológica (Figura 1B).
O sistema consiste em uma peça descartável superior e partes inferiores destacáveis. A parte descartável superior, que inclui o conjunto de fibra óptica, a matriz de microlens e a matriz de eletrodo de tungstênio, foi projetada para ser permanentemente implantada no cérebro para experimentos in vivo . A parte inferior inclui uma fonte de luz LED e uma linha de alimentação externa, que é facilmente removível e reutilizável para outro experimento animal. Uma tampa de plástico anexável protege a parte descartável quando a parte destacável é removida.
A viabilidade do sistema é verificada pela implantação nos cérebros de camundongos transgênicos que expressam channelrhodopsin-2 (ChR2) em Neurônios kinase II-positivos de proteína dependente de Ca2+/calmodulin (CaMKIIα::ChR2 mouse). Os eletrodos de gravação foram utilizados para registrar as atividades neurais de neurônios individuais durante a estimulação óptica dos neurônios.
Protocolo
Os procedimentos cirúrgicos e de cuidados com animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade da Mulher de Ewha (nº 20-029).
1. Preparação de uma matriz optrode (Figura 1 e Figura 2)
- Conecte fibras ópticas com a matriz de microlens.
- Remova o revestimento de passivação da fibra óptica e corte-a em pedaços de 5 mm de comprimento usando um cutelo de fibra óptica de precisão.
- Mergulhe a fibra óptica na resina UV clara e coloque as fibras ópticas na matriz de microlens.
- Cure a resina usando uma lâmpada UV.
- Conecte a matriz de microlens à carcaça impressa 3D usando epóxi.
- Alinhe os fios de tungstênio revestidos de perfluoroalkoxy (PFA).
- Soldar as 4 peças de fios de tungstênio PFA de 30 mm de comprimento e 1 fio de prata para o conector feminino de 5 pinos e 1,27 mm de arremesso. Use fio prateado como um eletrodo de referência.
- Conecte o conector feminino de 1,27 mm ao pré-amplificador do palco.
- Coloque cuidadosamente fios de tungstênio através do silício através dos orifícios (Figura 1B) para ajudar o alinhamento fino dos eletrodos de tungstênio.
- Corte os fios de tungstênio alinhados 1 mm mais curto que o comprimento da fibra óptica.
- Conecte o conector à carcaça impressa 3D usando epóxi.
- Colocação de LED
- Coloque o LED na carcaça impressa 3D.
- Conecte o LED ao circuito de condução que gera modulação da largura de pulso (PWM).
NOTA: O pulso PWM é gerado pelo microcontrolador. - Dado o ruído induzido pelo circuito de condução led, certifique-se de que os eletrodos de gravação estão a 50 mm de distância do circuito de condução led.
- Meça a intensidade da luz no final da ponta de fibra óptica usando um fotodiodo.
- Mergulhe os eletrodos de tungstênio e fibras ópticas em álcool por 15 minutos. Em seguida, mergulhe o sistema em água d.I estéril e esterilize com gás óxido de etileno.
2. Cirurgia de implantação (Figura 3 e Figura 4)
NOTA: A técnica estéril deve ser seguida durante a cirurgia.
- Prepare os animais transgênicos, que são geneticamente modificados para expressar proteínas de opsina sensíveis à luz no tipo específico de células neuronais.
NOTA: Um camundongo macho, de 2 meses, que expressa canalrhodopsin-2 (ChR2) em Ca2+/calmodulin-dependent protein kinase II-positive neurônios (CaMKIIα::ChR2 mouse) foi utilizado neste estudo41. - Anestesiar o rato com um coquetel de cetamina-xylazine- uma mistura de cetamina (100 mg/kg) e xilazina (10 mg/kg)-por administração intraperitoneal.
- Verifique o animal anestesiado a cada 30 minutos monitorando o movimento do bigode e a reação ao aperto da pata.
- Injete o coquetel de cetamina-xilazina em metade da dose inicial se for necessária anestesia adicional.
- Raspe a pele da cabeça e coloque o rato anestesiado na moldura estereotática.
NOTA: Realize a preparação cirúrgica da pele e o animal de cortina. A preparação da pele envolve depilação seguida de limpeza da pele com agentes antimicrobianos.- Posicione a cabeça dentro do quadro estereotático e insira barras de ouvido no meatus.
- Centralizar a cabeça do mouse no quadro estereotático afrouxando e apertando repetidamente as barras de ouvido para posicionamento exato.
- Coloque a barra incisivo para que os incisivos superiores engancharem sobre a borda interna dianteira.
- Ajuste a barra incisora para definir a altura da barra incisora e aperte o grampo do nariz contra o focinho.
- Ligue a almofada de aquecimento térmico embutida no quadro estereotático com antecedência para manter a temperatura corporal a 37 °C durante os procedimentos cirúrgicos.
- Coloque a sonda térmica no reto do mouse para regulação homeotérmica.
NOTA: A colocação da barra de ouvido deve ser verificada agarrando suavemente e balançando o focinho. A barra de ouvido deve ser reajustada se o focinho puder ser movido mais de ~4 mm lateralmente.
- Cubra os olhos com geleia de petróleo (veja a Tabela de Materiais) para evitar o ressecamento.
- Injete 1% de lidocaína no couro cabeludo. Levante a pele da cabeça com fórceps, proteja um espaço de injeção e injete a lidocaína sob o couro cabeludo.
- Realize uma incisão sagital usando um bisturi e uma tesoura fina. Segure a pele incisada com um microclamp para ampliar a visibilidade da área cirúrgica.
NOTA: O comprimento da incisão é de <1 cm acima da borda bregma e caudal do osso interparietal. - Remova o periosteum usando cotonetes de algodão. Se houver sangramento, cauterize o crânio usando um bovie para selar os vasos sanguíneos.
- Limpe o crânio com soro fisiológico e marque os sítios de craniotomia usando um braço manipulador: hipocampo Anterior-Posterior (AP) −1,8 a −2,8 mm, Medial-Lateral (ML) 0,5-2,5 mm e Dorsal-Ventral (DV) −1 a −2 mm.
NOTA: Considerando a espessura do crânio do rato, insira a matriz optrode -1,2 a -2,2 mm da área cerebral exposta. Dada a via hipocampal, células piramidas de CA3 enviam seus axônios para CA1. Portanto, as fibras ópticas são 1 mm mais longas que a gravação de eletrodos, de modo que as fibras ópticas são colocadas em CA3 e os eletrodos de gravação em CA1. - Faça um furo acima do cerebelo e insira um parafuso para o chão. Coloque o parafuso moído 0,5 mm de profundidade com um parafuso de precisão até atingir a parte superior do cerebelo.
NOTA: Certifique-se de uma inserção apertada do parafuso, que será usado como um eletrodo moído e uma estrutura de suporte para maximizar a estabilidade a longo prazo da implantação, pois aumenta a superfície tridimensional para a adesão do cimento dental. - Perfurar a área marcada e remover um pedaço do crânio com fórceps.
- Dobre uma ponta de agulha de 26 G no sentido horário 120°, e exponha a área cerebral inserindo o lado bevel da agulha virada para cima. Tenha cuidado para não danificar o cérebro e os vasos sanguíneos.
- Limpe o cérebro exposto com soro fisiológico para lavar o pó ósseo e matéria íntenua.
- Fixar a matriz optrode no braço manipulador e mover-se perto da área exposta.
NOTA: Ao colocar o dispositivo, recalcular novamente a área alvo do bregma pode aumentar a precisão da colocação. - Insira lentamente a matriz optrode e conecte o parafuso moído ao fio de prata ligado ao sistema42.
NOTA: Neste processo, a matriz deve ser firmemente fixada ao braço manipulador para minimizar a oscilação para evitar danos cerebrais de microsoção durante a inserção. A inserção deve ser realizada lentamente, com descanso de 10 minutos para explicar o inchaço do cérebro que pode ter sido pressionado após a inserção. A velocidade de inserção abaixo de 1 μm/s no tecido cerebral é recomendada para a alta qualidade da relação sinal-ruído e o número de unidades únicas separáveis42. - Se houver sangramento, aplique pressão direta aos sangradores com um cotonete seco ou use cautery. Não passe para os próximos passos até que o sangramento esteja completamente parado.
- Insira espuma de gel entre o cérebro exposto e o dispositivo para proteger os produtos químicos do contato direto com o cérebro.
NOTA: A espuma de gel também ajuda a hemostasia e mantém o cérebro úmido. - Limpe o crânio com cotonetes para remover a umidade o máximo possível, e prossiga para a próxima etapa de fixação.
- Aplique cuidadosamente cimento dentário no crânio para fixar o dispositivo e cobrir a espuma de gel. Antes que o cimento dentário seja completamente endurecido, separe o couro cabeludo se estiver preso ao cimento dental. Puxe a pele incisada com fórceps para cobrir o cimento dentário endurecido e suturar o couro cabeludo. Em seguida, solte o dispositivo do braço manipulador.
NOTA: Certifique-se de que o cimento dental não gruda na pele e cobre apenas a região do crânio. Quando a pele cresce, pode afastar o cimento e, eventualmente, o dispositivo cairá. Isso causará um problema crítico para experimentos in vivo de longo prazo.
3. Cuidados com recuperação e implante
- Tire o mouse do quadro estereotático.
- Administre a solução Carprofen usando uma agulha de 26 G. Injete uma vez antes da cirurgia e 12h (na manhã seguinte em caso de cirurgia à tarde) e 24h após a cirurgia para reduzir a dor.
NOTA: A concentração da droga na garrafa é de 50 mg/mL, e é armazenada a 4 °C. Carprofeno é viscoso e precisa ser diluído em água estéril 1:10. Se a esterilidade for mantida, a solução pode ser armazenada por até 4 semanas. Para manter a duração efetiva da droga, injete a solução Carprofen em intervalos de 12h. - Coloque o mouse na almofada de aquecimento e verifique se ele se recupera bem da anestesia.
NOTA: O animal não fica sozinho até recuperar a consciência suficiente. - Remova os fios de sutura 7 a 10 dias após a cirurgia.
- Deixe o animal se recuperar por 1 semana. Monitore a ingestão de alimentos e água durante o tempo de recuperação. Administre o analgésico e verifique os sinais de desconforto ou dor.
NOTA: Os animais submetidos à cirurgia não podem ficar com os outros animais até que se recuperem totalmente.- Durante o período de recuperação, pese o mouse todos os dias para verificar se há mudanças de peso. Sacrifique o camundongo (ver seção 6) se houver perda de peso de 20% em comparação com animais de controle de idade e sexo.
4. Estimulação optogenética e gravação eletrofisiológica
- Anestesiar o mouse e colocar o mouse anestesiado na moldura estereotática.
- Configure os parâmetros de estimulação.
- Coloque a receita de pulso de luz em 4% de ciclo de imposto e frequência de 10 Hz43. Configure a estimulação da luz para 2 s (20 pulsos) durante a gravação neural.
- Use uma corrente de 50 mA para conduzir 3 mW/mm2 intensidade de luz na ponta da fibra óptica. Meça a energia da luz usando um fotodiodo e um medidor de energia e divida a energia da luz pela área de faceta de fibra óptica.
- Tire a tampa plástica e conecte a parte superior contendo o sistema de entrega de luz com o LED reutilizável e circuitos.
- Conecte o preamplificador do palco ao conector de 5 pinos implantado.
- Abra o software para gravar sinais neurais.
- Configure os filtros de software. Use um filtro bandpass a 0,1-20 kHz e um filtro de entalhe a 60 Hz. Defina a taxa de amostragem do amplificador para 20 kHz.
- Antes da gravação, verifique se os sinais de espigão neural são detectados.
NOTA: O cancelamento de ruído é importante porque os sinais neurais são muito pequenos. Se o nível de ruído for muito alto, sinais neurais podem ser obscurecidos pelo ruído e se tornar invisíveis. Use aterramento adequado e blindagem de ondas eletromagnéticas para reduzir o ruído. - Após a verificação do sinal, grave sinais neurais sem estimulação de luz para gravação da linha de base.
- Fornecer luz LED e registrar simultaneamente respostas neuronais (Figura 5 e Figura 6).
NOTA: Uma vez estimulado, o próximo experimento de estimulação deve ser realizado após um intervalo de pelo menos 5 minutos para que a atividade neuronal evocada pela estimulação anterior não afete o próximo experimento.
5. Análise de dados
- Carregue os dados adquiridos usando o programa MATLAB.
- Obtenha atividades neurais únicas usando um algoritmo de classificação de picos "Wave-Clus"44,45. Detecte os picos em cada canal por um limiar de amplitude como em Eq (1)45.
Limiar = 5 × mediana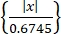 (1)
(1)
Onde x está o sinal filtrado do bandpass.- Para instalar "Wave-Clus", consulte o link de download na Tabela de Materiais.
- Para abrir a interface gráfica do usuário (GUI), digite wave_clus no prompt de comando do MATLAB.
- Digite Get_spikes ('filename.ext') função para extensão de arquivo preparada para detecção de pico. Em seguida, execute Do_clustering ('filename_spikes.mat') para a classificação de picos.
- Conte os picos classificados antes, durante e depois da estimulação da luz com caixas de tempo específicas. Use caixas de tempo de 0,2 s e 2 s para análise.
- Plote o número de picos de cada canal de gravação.
NOTA: Média com erro padrão dos meios (SEM) dos dados dos resultados de 8 experimentos repetidos foi calculada e plotada.
6. Eutanásia
- Depois de todos os experimentos, sacrifique o rato por inalação de dióxido de carbono (CO2).
- Sem precarregar a câmara, coloque o mouse na câmara transparente de eutanásia, sem fornecimento de CO2 e/ou vazamentos.
- Ligue o gás CO2 e desloque o ar a uma taxa de 30 a 50% do volume de ar da câmara de eutanásia por minuto.
NOTA: Um medidor de fluxo deve ser conectado ao cilindro de gás CO2 para garantir que a taxa de deslocamento do ar seja de 30-50% do volume da câmara de eutanásia por minuto. - Monitore o rato sacrificado por falta de respiração e mude a cor dos olhos.
NOTA: O tempo esperado para eutanásia é geralmente de 10 a 15 minutos. - Depois de observar os sinais de morte, remova o rato da câmara de eutanásia.
- Para completar o procedimento de eutanásia, verifique a morte confirmando parada respiratória e cardíaca.
Resultados
O sistema optrode é fabricado com sucesso para fornecer energia de luz suficiente para ativar os neurônios alvo. O fino alinhamento dos eletrodos de tungstênio é alcançado através do silício microfrágico através dos orifícios. A intensidade da luz medida é de 3,6 mW/mm2 na ponta da fibra óptica quando a corrente de 50 mA é aplicada. Os microlens aumentaram a eficiência da luz em 3,13 dB. Devido à matriz de microlens, que melhora o acoplamento de luz, a corrente aplicada é aproximadamente metade...
Discussão
Verificou-se a viabilidade do sistema para estimulação optogenética simultânea e registro eletrofisiológico (Figura 6). Os grandes picos durante a estimulação da luz são artefatos fotoelétricos que ocorrem ao mesmo tempo que a estimulação da luz (Figura 6A). Isso é claro na visão ampliada da forma de onda no retângulo tracejado vermelho (Figura 6A). Como mostrado na Figura 6A, os artefatos...
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Esta pesquisa foi apoiada pelo Convergent Technology P&D Program for Human Augmentation através da National Research Foundation of Korea (NRF), financiada pelo Ministério da Ciência e TIC (NRF-2019M3C1B8090805), e apoiada por uma bolsa da Fundação Nacional de Pesquisa da Coreia (NRF) financiada pelo governo da Coreia (MSIT) (nº 2019R1A2C10888909). Agradecemos ao laboratório de Seung-Hee Lee no Departamento de Ciências Biológicas, KAIST, Daejeon, Coreia, por fornecer gentilmente os ratos transgênicos.
Materiais
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
Referências
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados