JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
동시 광유전학적 변조 및 전기 신경 기록을 위한 광섬유 어레이
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 광 전달을위한 광섬유와 신경 기록을위한 전극 어레이가있는 옵트로드 시스템의 제조 방법을 제시합니다. 채널로돕신-2를 발현하는 트랜스제닉 마우스를 이용한 생체내 실험은 광유전학적 자극 및 전기생리학적 기록을 동시에 위한 시스템의 실현가능성을 보여준다.
초록
지난 십 년 동안, 광유전학은 선택적 신경 조절 또는 모니터링의 독특한 능력으로 인해 신경 신호 전달의 조사에 필수적인 도구가되었습니다. 특정 유형의 뉴런 세포가 옵신 단백질을 발현하도록 유전적으로 변형될 수 있기 때문에, 광유전학은 선택된 뉴런의 광학 자극 또는 억제를 가능하게 한다. 광유전학을 위한 광학 시스템에는 몇 가지 기술적 진보가 있었다. 최근에, 광전달을 위한 광학 도파관과 전기생리학적 기록을 결합하여 광유전학적 자극 또는 억제에 대한 신경 반응을 동시에 모니터링하는 것이 제안되었다. 이 연구에서, 이식형 옵트로드 어레이(2x2 광섬유)가 내장된 다채널 전극으로 개발되었다.
발광 다이오드(LED)를 광원으로 사용하였고, 광섬유의 팁에 충분한 광 전력을 제공하기 위해 미세제작된 마이크로렌즈 어레이가 집적되었다. 옵트로드 어레이 시스템은 일회용 부분과 재사용 가능한 부분을 포함한다. 일회용 부품에는 광섬유와 전극이 있으며 재사용 가능한 부분에는 광 제어 및 신경 신호 처리를위한 LED 및 전자 회로가 있습니다. 이식형 옵트로드 어레이 시스템의 신규한 설계는 옵트로피드 이식 수술, 광유전학적 광 자극, 및 전기생리학적 신경 기록의 절차 이외에 수반되는 비디오에 도입된다. 생체 내 실험의 결과는 마우스의 해마 흥분성 뉴런으로부터의 빛 자극에 의해 유발되는 시간 고정 신경 스파이크를 성공적으로 보여주었습니다.
서문
신경 활동을 기록하고 제어하는 것은 뇌가 신경망과 세포 수준에서 어떻게 기능하는지 이해하는 데 필수적입니다. 통상적인 전기생리학적 기록 방법은 마이크로피펫을 사용하는 패치 클램프 1,2,3,4 및 미세신경 전극(5,6,7,8)을 이용한 세포외 기록을 포함한다. 신경 조절 방법으로서, 전기 자극은 신경 세포의 직접 또는 간접적 탈분극을 통해 초점 뇌 영역을 직접 자극하기 위해 자주 사용되어 왔다. 그러나, 전기적 방법은 전류가 모든 방향으로 확산되기 때문에 기록 또는 자극을 위한 뉴런 세포 유형을 구별할 수 없다.
신흥 기술로서, 광유전학은 신경계가어떻게 작동하는지 이해하는 새로운 시대를 열었습니다 9,10,11,12,13,14,15,16. 광유전학 기술의 본질은 빛을 사용하여 유전자 변형 세포에 의해 발현되는 빛에 민감한 옵신 단백질의 활성을 조절하는 것이다. 따라서, 광유전학은 복잡한 신경 회로(14,17)에서 유전적으로 선택된 세포의 정교한 변조 또는 모니터링을 가능하게 한다. 광유전학적 접근법의 광범위한 사용은 광학 신경 조절을 직접 확인하기 위해 동시 신경 기록이 필요했다. 따라서 조명 제어 및 기록 기능을 갖춘 통합 장치는16,18,19,20,21,22,23,24,25 매우 유용합니다.
기존의 레이저 기반 광유전학적 자극에는 한계가 있으며, 이는 부피가 크고 고가의 광 전달 시스템(26,27,28,29,30)을 필요로 한다. 따라서, 일부 연구 그룹은 광 전달 시스템(31,32,33,34)의 크기를 최소화하기 위해 μLED 기반 실리콘 프로브를 사용했다. 그러나 LED의 낮은 에너지 변환 효율로 인해 μLED와의 직접 접촉으로 인한 열적 뇌 손상의 위험이 있습니다. 광섬유, SU-8 및 실리콘 산화 질화물 (SiON)과 같은 광 도파관은 열 손상 30,35,36,37,38,39를 피하기 위해 적용되었습니다. 그러나 이 전략은 광원과 도파관 간의 결합 효율이 낮기 때문에 단점도 있습니다.
마이크로렌즈 어레이는 LED와 광섬유(40) 사이의 광 결합 효율을 향상시키기 위해 이전에 도입되었다. 옵트로드 시스템은 마이크로스케일(40)에서 광학 자극 및 전기 기록을 위한 미세전자기계 시스템(MEMS) 기술에 기초하여 개발되었다. LED와 광섬유 사이의 마이크로렌즈 어레이는 광 효율을 3.13dB까지 높였습니다. 그림 1에서 볼 수 있듯이 2x2 광섬유 어레이는 4x4 마이크로렌즈 어레이에 정렬되고 LED는 마이크로렌즈 어레이 아래에 위치합니다. 뇌 손상을 줄이기 위해 4x4 대신 2x2 광섬유가 장착됩니다. 텅스텐 전극 어레이는 전기 생리학적 기록을 위해 실리콘 비아홀을 사용하는 옵트로드 어레이에 인접하게 위치한다(그림 1B).
이 시스템은 상단 일회용 부품과 탈착식 하단 부품으로 구성됩니다. 광섬유 어레이, 마이크로 렌즈 어레이 및 텅스텐 전극 어레이를 포함하는 상단 일회용 부분은 생체 내 실험을 위해 뇌에 영구적으로 이식되도록 설계되었습니다. 하단 부분에는 LED 광원과 외부 전원 공급 장치 라인이 포함되어있어 쉽게 분리 할 수 있으며 다른 동물 실험에 재사용할 수 있습니다. 부착 가능한 플라스틱 커버는 탈착식 부품을 제거할 때 일회용 부품을 보호합니다.
시스템의 타당성은 Ca2+/calmodulin-의존성 단백질 키나제 II 양성 뉴런(CaMKIIα::ChR2 마우스)에서 채널로돕신-2(ChR2)를 발현하는 트랜스제닉 마우스의 뇌에 이식함으로써 검증된다. 기록 전극은 뉴런의 광학 자극 동안 개별 뉴런으로부터의 신경 활동을 기록하기 위해 사용되었다.
프로토콜
동물 관리 및 외과 수술은 이화여자대학교 기관동물보호이용위원회(IACUC)의 승인을 받았다(제20-029호).
1. 옵트로드 어레이의 제조(도 1 및 도 2)
- 마이크로렌즈 어레이로 광섬유를 부착합니다.
- 광섬유의 패시베이션 코팅을 제거하고 정밀 광섬유 절단기를 사용하여 5mm 길이의 조각으로 자릅니다.
- 광섬유를 투명한 UV 수지에 담그고 광섬유를 마이크로 렌즈 어레이 위에 놓습니다.
- UV 램프를 사용하여 수지를 경화하십시오.
- 에폭시를 사용하여 마이크로렌즈 어레이를 3D 프린트된 하우징에 부착합니다.
- 퍼플루오로알콕시(PFA) 코팅 텅스텐 와이어를 정렬합니다.
- 30mm 길이의 PFA 텅스텐 와이어 4개와 은선 1개를 5핀, 1.27mm 피치 암 커넥터에 납땜합니다. 은선을 기준 전극으로 사용하십시오.
- 1.27mm 피치 암 커넥터를 헤드스테이지 프리앰프에 연결합니다.
- 텅스텐 전극의 미세 정렬을 돕기 위해 구멍을 통해 실리콘을 통해 텅스텐 와이어를 조심스럽게 넣으십시오 (그림 1B).
- 정렬 된 텅스텐 와이어를 광섬유 길이보다 1mm 짧게 자릅니다.
- 에폭시를 사용하여 커넥터를 3D 인쇄 하우징에 연결합니다.
- LED 배치
- LED를 3D 인쇄 하우징에 넣습니다.
- LED를 펄스 폭 변조(PWM)를 생성하는 구동 회로에 연결합니다.
주: PWM 펄스는 마이크로 컨트롤러에 의해 생성됩니다. - LED 구동 회로에 의해 유도되는 잡음을 감안할 때, 기록 전극이 LED 구동 회로와 50mm 떨어져 있는지 확인하십시오.
- 광 다이오드를 사용하여 광섬유 팁의 끝에서 광 강도를 측정하십시오.
- 텅스텐 전극과 광섬유를 알코올에 15 분 동안 담그십시오. 그런 다음 시스템을 멸균 D.I 물에 담그고 에틸렌 옥사이드 가스로 살균하십시오.
2. 이식 수술 (그림 3 및 그림 4)
참고 : 수술 중에 멸균 기술을 따라야합니다.
- 특정 유형의 신경 세포에서 광감응성 옵신 단백질을 발현하도록 유전적으로 변형된 형질전환 동물을 제조하였다.
참고: Ca2+/칼모듈린 의존성 단백질 키나제 II 양성 뉴런(CaMKIIα::ChR2 마우스)에서 채널로돕신-2(ChR2)를 발현하는 형질전환 마우스 2개월의 남성을 본 연구41에 사용하였다. - 복강 내 투여에 의해 케타민 - 자일라진 칵테일 - 케타민 (100 mg / kg)과 자일라진 (10 mg / kg)의 혼합물로 마우스를 마취하십시오.
- 30분마다 마취된 동물을 검사하여 수염의 움직임과 발 꼬집음에 대한 반응을 모니터링한다.
- 추가 마취가 필요한 경우 케타민-자일라진 칵테일을 초기 용량의 절반으로 주사하십시오.
- 머리 피부를 면도하고 마취 된 마우스를 입체 프레임에 놓습니다.
참고 : 외과 적 피부 준비 및 드레이프 동물을 수행하십시오. 피부 준비는 제모를 한 다음 항균제로 피부를 청소하는 것을 포함합니다.- 스테레오택틱 프레임 안에 머리를 놓고 이어 바를 고기에 삽입하십시오.
- 정확한 위치를 위해 이어 바를 반복적으로 풀고 조여서 마우스 헤드를 입체 프레임에 집중시킵니다.
- 위쪽 절치가 앞쪽 안쪽 가장자리에 후크되도록 절치 막대를 놓습니다.
- 절치 막대의 높이를 설정하기 위해 절개 막대를 조정하고 주둥이에 대해 코 클램프를 조이십시오.
- 입체 프레임에 내장된 열 가열 패드를 미리 켜서 수술 과정 전반에 걸쳐 체온을 37°C로 유지한다.
- 동종 발열 조절을 위해 열 프로브를 마우스의 직장에 넣으십시오.
참고: 이어 바 배치는 주둥이를 부드럽게 잡고 흔들어서 확인해야 합니다. 주둥이를 옆으로 ~ 4mm 이상 움직일 수있는 경우 이어 바를 다시 조정해야합니다.
- 건조를 방지하기 위해 석유 젤리 ( 재료 표 참조)로 눈을 가리십시오.
- 두피에 1 % 리도카인을 주사하십시오. 포셉으로 머리 피부를 들어 올리고 주사 공간을 확보 한 다음 두피 아래에 리도카인을 주사하십시오.
- 메스와 미세한 가위를 사용하여 시상 절개를 수행하십시오. 절개 된 피부를 마이크로 클램프로 잡고 수술 부위의 시야를 넓히십시오.
참고 : 절개 길이는 정수리 뼈의 브레그마와 꼬리 가장자리에서 <1cm입니다. - 면봉을 사용하여 골막을 제거하십시오. 출혈이있는 경우, 혈관을 봉인하기 위해 보비를 사용하여 두개골을 소작하십시오.
- 두개골을 식염수로 청소하고 조작기 팔을 사용하여 두개골 절제술 부위를 표시하십시오 : 해마 전방 - 후부 (AP) -1.8 ~ -2.8 mm, 내측 측부 (ML) 0.5-2.5 mm 및 등쪽 복부 (DV) -1 ~ -2 mm.
참고 : 마우스 두개골의 두께를 고려하여 노출 된 뇌 영역에서 -1.2 ~ -2.2mm의 optrode 배열을 삽입하십시오. 해마 경로를 감안할 때, CA3의 피라미드 세포는 축삭을 CA1로 보냅니다. 따라서 광섬유는 기록 전극보다 1mm 더 길기 때문에 광섬유는 CA3에 배치되고 CA1의 기록 전극에 배치됩니다. - 소뇌 위에 구멍을 뚫고 접지 용 나사를 삽입하십시오. 소뇌 꼭대기에 도달 할 때까지 정밀 나사로 0.5mm 깊이의 접지 나사를 넣으십시오.
참고 : 치과 시멘트의 부착을위한 입체 표면을 증가시키기 때문에 이식의 장기적인 안정성을 극대화하기 위해 접지 전극 및 지지 구조로 사용될 나사를 단단히 삽입하십시오. - 표시된 부분을 뚫고 집게로 두개골 조각을 제거하십시오.
- 26G 바늘 끝을 시계 방향으로 120°로 구부리고 바늘의 경사면을 위쪽으로 향하게 삽입하여 뇌 영역을 노출시킵니다. 뇌와 혈관을 손상시키지 않도록 주의하십시오.
- 노출 된 뇌를 식염수로 닦아 뼈 먼지와 외부 물질을 씻어냅니다.
- 조작기 암에 옵트로드 어레이를 고정하고 노출 된 영역 가까이로 이동하십시오.
참고: 장치를 배치할 때 브레그마에서 대상 영역을 다시 계산하면 배치의 정확도가 높아질 수 있습니다. - 옵트로드 어레이를 천천히 삽입하고 접지 스크류를 시스템(42)에 부착된 은선에 연결한다.
참고: 이 과정에서 어레이를 조작기 암에 단단히 고정하여 흔들림을 최소화하여 삽입 중 미세 운동으로 인한 뇌 손상을 방지해야 합니다. 삽입은 천천히 수행되어야하며, 삽입 후 눌렀을 수도있는 뇌의 붓기를 설명하기 위해 10 분 동안 휴식을 취해야합니다. 뇌 조직으로의 1 μm/s 미만의 삽입 속도는 신호-대-잡음비의 높은 품질 및 분리가능한 단일 유닛(42)의 수를 위해 추천된다. - 출혈이있는 경우 마른 면봉으로 출혈제에 직접 압력을 가하거나 소작을 사용하십시오. 출혈이 완전히 멈출 때까지 다음 단계로 넘어 가지 마십시오.
- 노출 된 뇌와 장치 사이에 젤 폼을 삽입하여 화학 물질이 뇌와 직접 접촉하지 않도록 보호하십시오.
참고 : 젤 폼은 지혈을 돕고 뇌를 촉촉하게 유지합니다. - 면봉으로 두개골을 닦아 가능한 한 많은 수분을 제거하고 다음 고정 단계로 진행하십시오.
- 조심스럽게 두개골에 치과 시멘트를 바르고 장치를 고정하고 젤 폼을 덮으십시오. 치과 시멘트가 완전히 경화되기 전에 치과 시멘트에 부착 된 경우 두피를 분리하십시오. 절개된 피부를 포셉으로 당겨 경화된 치과 시멘트를 덮고 두피를 봉합합니다. 그런 다음 조작기 암에서 장치를 분리합니다.
참고 : 치과 시멘트가 피부에 달라 붙지 않고 두개골 부위 만 덮고 있는지 확인하십시오. 피부가 자라면 시멘트를 밀어 낼 수 있으며 결국 장치가 떨어집니다. 이것은 장기간의 생체내 실험에 심각한 문제를 야기할 것이다.
3. 회복 및 임플란트 관리
- 마우스를 스테레오택틱 프레임에서 꺼냅니다.
- 26 G 바늘을 사용하여 카프로펜 용액을 투여하십시오. 통증을 줄이기 위해 수술 전에 한 번, 수술 후 12 시간 (오후 수술의 경우 다음날 아침)과 수술 후 24 시간을 주사하십시오.
참고 : 병의 약물 농도는 50mg / mL이며 4 °C에 보관됩니다. 카프로펜은 점성이 있으며 멸균수 1:10에 희석해야합니다. 멸균이 유지되면 용액을 최대 4 주 동안 저장할 수 있습니다. 약물의 유효 기간을 유지하려면 Carprofen 용액을 12 시간 간격으로 주사하십시오. - 마우스를 가열 패드에 놓고 마취에서 잘 회복되는지 확인하십시오.
참고 : 동물은 충분한 의식을 회복 할 때까지 방치되지 않습니다. - 수술 후 7-10 일 후에 봉합사 실을 제거하십시오.
- 동물이 1 주 동안 회복되도록 허용하십시오. 회복 시간 동안 음식과 물 섭취량을 모니터링하십시오. 진통제를 관리하고 불편 함이나 통증의 징후를 확인하십시오.
참고 : 수술을받은 동물은 완전히 회복 될 때까지 다른 동물과 함께 머물 수 없습니다.- 회복 기간 동안 매일 마우스의 무게를 측정하여 체중 변화를 확인하십시오. 마우스를 희생시키면(섹션 6 참조) 연령 및 성매칭 대조군 동물에 비해 20%의 체중 감소가 존재한다.
4. 광유전학적 자극 및 전기생리학적 기록
- 마우스를 마취시키고 마취 된 마우스를 입체 프레임에 놓습니다.
- 자극 매개 변수를 설정합니다.
- 라이트 펄스 레시피를 4% 듀티 사이클 및 10Hz 주파수43으로 설정하십시오. 신경 기록 중에 2 초 (20 펄스) 동안 광 자극을 설정하십시오.
- 50mA 전류를 사용하여 광섬유 팁에서 3mW/mm2 광도를 구동합니다. 광 다이오드와 파워 미터를 사용하여 광 전력을 측정하고 광섬유 패싯 영역으로 광 전력을 나눕니다.
- 플라스틱 커버를 벗고 광 전달 시스템이 들어있는 윗부분을 재사용 가능한 LED 및 회로로 부착하십시오.
- 헤드스테이지 프리앰프를 이식된 5핀 커넥터에 연결합니다.
- 신경 신호를 기록하기 위해 소프트웨어를 엽니 다.
- 소프트웨어 필터를 설정합니다. 0.1-20kHz에서 대역통과 필터를 사용하고 60Hz에서 노치 필터를 사용합니다. 증폭기 샘플링 속도를 20kHz로 설정하십시오.
- 녹음하기 전에 신경 스파이크 신호가 감지되었는지 확인하십시오.
참고: 신경 신호가 너무 작기 때문에 노이즈 캔슬링이 중요합니다. 노이즈 레벨이 너무 높으면 신경 신호가 노이즈에 의해 가려져 보이지 않게 될 수 있습니다. 소음을 줄이기 위해 적절한 접지 및 전자파 차폐를 사용하십시오. - 신호 확인 후, 기준선 기록을 위해 광 자극 없이 신경 신호를 기록한다.
- LED 조명을 전달하고 동시에 뉴런 반응을 기록합니다(그림 5 및 그림 6).
참고 : 일단 자극되면, 다음 자극 실험은 이전 자극에 의해 유발 된 신경 활동이 다음 실험에 영향을 미치지 않도록 적어도 5 분의 간격 후에 수행되어야합니다.
5. 데이터 분석
- MATLAB 프로그램을 사용하여 획득한 데이터를 로드합니다.
- 스파이크 정렬 알고리즘 "Wave-Clus"44,45를 사용하여 단일 신경 활동을 얻습니다. Eq (1)45에서와 같이 진폭 임계값에 의해 각 채널의 스파이크를 검출한다.
임계값 = 5× 중앙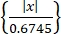 값 (1)
값 (1)
여기서 x는 대역통과 필터링된 신호입니다.- "Wave-Clus"를 설치하려면 자료표의 다운로드 링크를 참조하십시오.
- 그래픽 사용자 인터페이스(GUI)를 열려면 MATLAB의 명령 프롬프트에 wave_clus를 입력합니다.
- 스파이크 감지를 위해 준비된 파일 확장자에 대해 Get_spikes('filename.ext') 함수를 입력합니다. 그런 다음 스파이크 정렬을 위해 Do_clustering('filename_spikes.mat') 을 실행합니다.
- 특정 시간 빈을 사용하여 광 자극 전, 도중 및 후에 정렬 된 스파이크를 계산하십시오. 분석에 0.2초 및 2초 시간 저장소를 사용합니다.
- 각 녹화 채널의 스파이크 수를 플로팅합니다.
참고: 8번의 반복 실험의 결과로부터 데이터의 평균(SEM)의 표준 오차를 갖는 평균을 계산하고 플롯팅하였다.
6. 안락사
- 모든 실험 후에, 이산화탄소(CO2) 흡입에 의해 마우스를 희생시킨다.
- 챔버를 미리 충전하지 않고,CO2 공급 및/또는 누출 없이 투명한 안락사 챔버에 마우스를 놓는다.
- CO2 가스를 켜고, 안락사 챔버 공기의 부피의 30 - 50%의 속도로 공기를 분당 변위시킨다.
참고: 유량계를CO2 가스 실린더에 연결하여 공기 변위율이 분당 안락사 챔버 부피의 30-50%가 되도록 해야 합니다. - 희생 된 마우스가 호흡이 부족하고 눈 색깔이 변했는지 모니터링하십시오.
참고: 안락사에 대한 예상 시간은 보통 10-15분 이내입니다. - 사망 징후를 관찰 한 후, 안락사 챔버에서 마우스를 제거하십시오.
- 안락사 절차를 완료하려면 호흡기 및 심장 마비를 확인하여 사망을 확인하십시오.
결과
옵트로드 시스템은 표적 뉴런을 활성화시키기에 충분한 광력을 제공하기 위해 성공적으로 제조된다. 텅스텐 전극의 미세 정렬은 구멍을 통해 미세 제작 된 실리콘을 통해 달성됩니다. 측정된 광도는 50mA 전류가 인가될 때 광섬유 팁에서 3.6mW/mm2 입니다. 마이크로 렌즈는 광 효율을 3.13dB까지 높였습니다. 광 커플링을 향상시키는 마이크로렌즈 어레이로 인해, 인가된 전류는 마이크로렌즈 ?...
토론
광유전학적 자극 및 전기생리학적 기록의 동시 구축을 위한 시스템의 타당성이 검증되었다(도 6). 광 자극 동안 큰 스파이크는 광 자극과 동시에 발생하는 광전 아티팩트입니다 (그림 6A). 이것은 빨간색 점선 사각형의 파형을 확대 한 뷰에서 분명합니다 (그림 6A). 도 6A에 도시된 바와 같이, 광전기 아티팩트?...
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
본 연구는 한국과학기술정보통신부(NRF-2019M3C1B8090805)가 후원하는 한국연구재단(NRF-2019M3C1B8090805)을 통한 인간증강을 위한 융합기술 R&D 프로그램의 지원을 받았으며, 한국연구재단(MSIT)이 후원하는 한국연구재단(NRF) 보조금(제2019R1A2C1088909호)의 지원을 받았다. 형질전환 생쥐를 친절하게 제공해주신 KAIST 한국생명과학부 이승희 연구실에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
참고문헌
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유