Method Article
Élargir la boîte à outils pour l’imagerie in vivo du transport axonal
Dans cet article
Résumé
À l’aide de souris fluorescentes transgéniques, des protocoles détaillés sont décrits pour évaluer le transport axonal in vivo des endosomes de signalisation et des mitochondries dans les axones moteurs et sensoriels du nerf sciatique intact chez les animaux vivants.
Résumé
Le transport axonal maintient l’homéostasie neuronale en permettant le trafic bidirectionnel de divers organites et cargaisons. Les perturbations du transport axonal ont des conséquences dévastatrices pour les neurones individuels et leurs réseaux, et contribuent à une pléthore de troubles neurologiques. Comme beaucoup de ces conditions impliquent à la fois des mécanismes cellulaires autonomes et non autonomes, et présentent souvent un spectre de pathologie à travers les sous-types neuronaux, des méthodes pour identifier et analyser avec précision les sous-ensembles neuronaux sont impératives.
Cet article détaille les protocoles pour évaluer le transport axonal in vivo des endosomes de signalisation et des mitochondries dans les nerfs sciatiques de souris anesthésiées. Des instructions par étapes sont fournies pour 1) distinguer les neurones moteurs des neurones sensoriels in vivo, in situ et ex vivo en utilisant des souris qui expriment sélectivement des protéines fluorescentes dans les motoneurones cholinergiques; et 2) évaluer séparément ou simultanément le transport axonal in vivo des endosomes de signalisation et des mitochondries. Ces approches intravitales complémentaires facilitent l’imagerie simultanée de différentes cargaisons dans des axones nerveux périphériques distincts pour surveiller quantitativement le transport axonal dans la santé et la maladie.
Introduction
Le système nerveux périphérique (SNP) relie le système nerveux central (SNC) à ses cibles distales, permettant au relais de signaux efférents d’exercer un contrôle moteur et des signaux afférents pour fournir une rétroaction sensorielle. En utilisant la multitude de progrès de la génétique de la souris, les scientifiques ont développé différents modèles murins pour étudier de nombreuses maladies / syndromes affectant le SNP 1,2,3. Comme la plupart des pathologies neurodégénératives sont multifactorielles avec des contributions cellulaires autonomes et non autonomes 4,5, démêler les pathologies spécifiques aux cellules / neurones peut fournir des informations cruciales et nouvelles sur les mécanismes de la maladie.
À cette fin, le développement de souris bactériennes transgéniques à chromosome artificiel (BAC)6 a permis l’expression endogène sélective de protéines fluorescentes dans des sous-ensembles ciblés de neurones. Par exemple, des souris bac-transgéniques sont disponibles, qui expriment la protéine fluorescente verte (GFP) dans les neurones cholinergiques7 ou glycinergiques8, ou une variante de la protéine fluorescente rouge (tdTomato) dans les neurones positifs à la parvalbumine9. Alternativement, l’expression neuronale sélective des protéines fluorescentes peut être obtenue via la technologie Cre-loxP 10. Par exemple, les souches de souris exprimant la Cre-recombinase dans des sous-ensembles de neurones (p. ex., la choline acétyltransférase (ChAT)-Cre) peuvent être élevées avec des souris qui expriment une protéine fluorescente (p. ex., tdTomato ou GFP) à partir d’un locus constitutif (p. ex., Gt(ROSA)26Sor) sous le contrôle d’un répresseur transcriptionnel flanqué de sites loxP11 (p. ex., générant des souris qui expriment tdTomato uniquement dans les neurones cholinergiques). En effet, en utilisant la recombinaison Cre-loxP, des souris transgéniques ont été générées qui expriment la protéine fluorescente jaune dans les axones du tractus corticospinal descendant12.
En outre, les progrès récents dans l’édition de gènes CRISPR/Cas9, tels que ORANGE, permettent le marquage fluorescent de plusieurs protéines neuronales endogènes, avec une expression réalisable à l’échelle nanométrique13. De plus, en combinaison avec des souches de souris exprimant Cre, ORANGE-CAKE peut être utilisé pour marquer plusieurs protéines endogènes dans des neurones individuels13. Alternativement, le traçage neuronal à médiation virale permet également le marquage de sous-ensembles neuronaux et peut être réalisé avec des combinaisons ciblées de sérotypes viraux et / ou de promoteurs spécifiques aux cellules 14,15,16,17.
En plus des méthodes de marquage neuronal, des lignées de souris ont également été conçues pour exprimer des protéines rapporteures ciblant des organites spécifiques, telles que les mitochondries exprimant la protéine fluorescente cyan (Mito.CFP)18 ou les autophagosomes exprimant GFP (LC3.GFP)19. De plus, des lignées de souris ont été conçues pour évaluer la dynamique du calcium spécifiquement dans les neurones (par exemple, Thy1.GCaMP)20,21. Dans l’ensemble, avec l’avancement de tels modèles, de nouvelles applications expérimentales permettent aux scientifiques de poser des questions biologiques et pathologiques plus précises sur le SNC et le SNP.
Le rôle principal des nerfs moteurs périphériques est de transmettre des signaux électriques au muscle squelettique pour provoquer le mouvement. De plus, et se produisant sur des échelles de temps plus longues, des messages neurochimiques et physiologiques sous la forme de divers organites (p. ex., mitochondries, endolysosomes de signalisation) traversent le réseau cytosquelettique de manière unidirectionnelle ou bidirectionnelle pour aider à maintenir l’homéostasie neuronale 22,23,24. Les déficiences du transport axonal ont des conséquences désastreuses sur la santé neuronale et sont liées à de nombreuses maladies neurodéveloppementales et neurodégénératives25. Au niveau moléculaire, les déficiences du transport axonal peuvent perturber les événements physiologiques régulant la signalisation synaptique et la plasticité, la transcription des gènes et la traduction locale dans l’ensemble de l’axone26,27. Bien qu’il existe une multitude d’outils pour étudier ces événements dans les cellules/neurones cultivés28,29, l’évaluation de la dynamique du transport axonal et des événements biologiques liés à l’axonale in vivo est nécessaire pour confirmer des informations clés sur les processus physiologiques et pathologiques30.
Au fil des ans, le laboratoire Schiavo a optimisé les protocoles pour poser diverses questions sur le transport axonal 31,32,33,34,35,36. Ces expériences se sont étendues à partir de la découverte qu’un fragment toxique de neurotoxine tétanique (HCT) marqué par fluorescence est internalisé en terminaisons axonales dans le muscle squelettique par des interactions avec les nidogènes et les polysialogangliosides37. Une fois internalisé, HCT est transporté rétrogradement dans des endosomes de signalisation Rab7 positifs contenant de la neurotrophine qui sont destinés aux corps cellulaires des neurones moteurs et sensoriels 38,39,40,41. En parallèle, les progrès de la technologie d’imagerie ont permis l’analyse en temps réel des faisceaux nerveux périphériques et des axones individuels chez des souris anesthésiées vivantes30. La première incursion dans l’évaluation de la dynamique du transport axonal in vivo en pathologie a révélé des déficiences présymptomatiques dans le transport des endosomes de signalisation et des mitochondries dans le modèle murin SOD1G93A de la sclérose latérale amyotrophique (SLA)35. Il est important de noter qu’il est peu probable que ces défauts représentent simplement des conséquences secondaires de la neurodégénérescence, étant donné la découverte que la perte de motoneurones peut se produire en l’absence de perturbations du transport axonal dans un modèle murin de la maladie de Kennedy42 et un modèle FUS mutant hétérozygote de la SLA43. De tels déficits de transport axonal peuvent être corrigés chez les souris SLA en utilisant des inhibiteurs de kinasesspécifiques 33 ou des récepteurs du facteur de croissance34. De plus, le traitement des neurones avec un bloqueur spécifique de l’histone désacétylase modifie le transport mitochondrial in vivo36. Plus récemment, nous rapportons que la modulation dépendante du BDNF du transport axonal est dérégulée dans des sous-types distincts de motoneurones chez les souris SLA44.
En utilisant une boîte à outils en constante expansion pour évaluer la dynamique du transport axonal28,29, ce protocole vidéo décrit plusieurs applications qui permettront d’approfondir les connaissances sur différents scénarios biologiques et pathologiques. Premièrement, les souris transgéniques qui expriment sélectivement des protéines fluorescentes dans les neurones cholinergiques (c’est-à-dire les motoneurones) sont utilisées pour discriminer les axones moteurs et sensoriels in vivo et ex vivo. Le HCT marqué par fluorescence est ensuite chargé dans des endosomes de signalisation dans trois lignées transgéniques pour différencier la dynamique du transport axonal dans des neurones périphériques distincts. Le protocole expérimental suivant détaille une approche de fluorescence multiplex pour évaluer le transport mitochondrial spécifiquement dans les motoneurones en élevant des souris ChAT.tdTomato avec des souris Mito-CFP. Enfin, des instructions sont fournies sur la façon d’imager simultanément les mitochondries et les endosomes de signalisation dans le même axone in vivo.
Protocole
Toutes les manipulations de souris et les expériences ont été effectuées conformément à la loi sur les animaux (procédures scientifiques) (1986) et ont été approuvées par le comité d’éthique de l’University College London - Queen Square Institute of Neurology.
1. Animaux
- Hébergez tous les animaux dans des cages ventilées individuellement dans un environnement à température et humidité contrôlées et maintenez-les sur un cycle lumière/obscurité de 12 h avec un accès ad libitum à la nourriture et à l’eau.
- Utilisez des souris mâles et femelles des souches transgéniques suivantes : 1) souris hétérozygotes Tg(Chat-EGFP) GH293Gsat/Mmucd, appelées souris ChAT.eGFP ; 2) hétérozygote B6.Cg-Tg(Hlxb9-GFP)1Tmj/J, appelé HB9. Souris GFP; et 3) les souris hétérozygotes B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J, appelées souris Mito.CFP.
- Générez des souris ChAT.tdTomato en croisant des souris homozygotes B6;129S6-Chat tm2(cre)Lowl/J, appelées souris ChAT.Cre, avec des souris homozygotes B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J, appelées souris Rosa26.tdTomato.
- Générez des souris ChAT.tdTomato::Mito.CFP en croisant des souris ChAT.tdTomato hétérozygotes avec des souris hétérozygotes Mito.CFP.
2. Injections intramusculaires de HCT fluorescent
- Préparation préopératoire
- Express HCT (HCT441, résidus 875-1315) fusionné en une étiquette améliorée riche en cystéine dans les bactéries en tant que protéine de fusion glutathion-S-transférase selon 45. Étiquetez HCT avec AlexaFlour555 C2 maleimide31, dialysez-le dans un tampon de dialyse glacé (10 mM HEPES-NaOH, 100 mM NaCl, pH 7,4), congelez-le dans de l’azote liquide et conservez-le à -80 °C. Avant d’effectuer des expériences in vivo , testez d’abord HCT in vitro pour une absorption et un transport réussis dans les neurones primaires.
- Diluer le HCT fluorescent (p. ex. HCT-555) à une concentration finale et expérimentalement constante allant de 2,5 à 10 μg/μL dans une solution saline stérile tamponnée au phosphate (PBS) dans un tube de 0,2 mL. À cette étape, ajoutez plus de composés/facteurs à la solution HCT si nécessaire (p. ex., facteur neurotrophique dérivé du cerveau).
REMARQUE: Le volume final doit être adapté à la taille du ou des muscles d’intérêt. Par exemple, préparez un volume d’injection de 3-4 μL pour le muscle tibialis antérieur (TA) et d’environ 1 μL pour le muscle soléaire plus petit. Maintenir la concentration de travail de HCT entre 2,5 et 10 μg/μL quel que soit le volume final. - Mélanger la solution HCT à l’aide d’une pipette ou d’un vortex et tourner brièvement à basse vitesse à l’aide d’une centrifugeuse de bureau pour recueillir le liquide et éliminer les grosses bulles. Protégez le HCT de la lumière et du transport sur la glace.
- Utilisez une micropipette en verre tiré pour des injections intramusculaires optimales dans des muscles plus petits (par exemple, soleus) ou pour des injections de nerf intrasciatique. Tirez des micropipettes en verre graduées (selon 46) avant la chirurgie.
REMARQUE: Pour permettre le pipetage et restreindre l’écoulement à l’arrière de la micropipette, coupez soigneusement une petite pièce de la pointe pointue à l’aide de pinces fines sous un microscope à disséquer. Prenez soin de jeter l’extrémité cassée dans le bac approprié. - Stériliser et nettoyer tous les outils chirurgicaux avant utilisation.
- Chirurgie-injections intramusculaires
- Préparez-vous à la chirurgie en fixant un drap chirurgical stérile sur un tapis chauffant réglé à 37 ° C. Positionner et focaliser le microscope opératoire. Pour que la chirurgie commence, déballez sur le drap chirurgical les outils chirurgicaux préstérisés, le ruban chirurgical, les cotons-tiges stériles, l’éthanol à 70 % (v/v) dans l’eau, la solution saline stérile, les sutures et une aiguille Hamilton ou des micropipettes en verre tiré.
- Assurez-vous que l’appareil d’anesthésie contient suffisamment d’oxygène et d’isoflurane pendant toute la durée de l’intervention chirurgicale. Dirigez le flux d’anesthésie vers la chambre d’induction et allumez l’appareil d’anesthésie.
- Pour commencer, utilisez un débit d’oxygène de 1-2 L / min et 5% d’isoflurane. Placez la souris dans la chambre d’induction pour initier l’anesthésie. Lorsque le réflexe de redressement est absent, réduisez l’anesthésie à 2-3% d’isoflurane, dirigez le flux d’anesthésie vers l’embout buccal et transférez la souris à l’embout buccal situé dans une zone séparée de l’espace chirurgical.
- Assurez-vous que les réflexes de retrait de la cornée et de la pédale sont absents avant de raser la zone de fourrure recouvrant le ou les muscles à injecter. Une fois terminé, retirez autant de fourrure rasée que possible de la souris à l’aide du côté collant du ruban chirurgical et placez la souris sur une balance pour enregistrer son poids pré-chirurgical.
- Appliquez soigneusement le lubrifiant pour les yeux à l’aide d’un coton-tige et transférez la souris et l’embout buccal dans la zone chirurgicale.
REMARQUE: Essayez de limiter la quantité de fourrure rasée qui est également transférée dans la zone chirurgicale. Utilisez du ruban chirurgical pour fixer la tête à l’embout buccal afin d’empêcher la souris de glisser. À l’aide d’un coton-tige séparé, appliquez de l’éthanol sur la région rasée pour stériliser et réduire la contamination de la fourrure. - Positionnez le corps en fonction du muscle à injecter. Par exemple, pour le TA, placez la souris sur le dos et étirez le membre postérieur à ~10° de la ligne médiane. Alternativement, pour les injections de soleus, placez l’animal sur le côté et étendez le membre postérieur à ~ 45 ° de la ligne médiane. Lorsque le membre postérieur est dans la bonne position, utilisez du ruban adhésif chirurgical sur le pied pour éviter tout mouvement indésirable pendant la chirurgie.
REMARQUE: Les procédures d’injection pour les muscles TA, gastrocnémien et soléaire ont déjà été détaillées32. - Avant de faire une incision, confirmez que l’anesthésie est suffisante en testant le réflexe de retrait de la pédale. Surveillez l’anesthésie en permanence et maintenez-la tout au long de la procédure chirurgicale avec une évaluation régulière de la respiration et du réflexe de sevrage.
- À ce stade, aspirez la solution HCT de travail dans la seringue Hamilton ou la micropipette en verre tiré.
- Faites une petite incision sur le(s) muscle(s) d’intérêt dans la ou les zones qui correspondent aux régions de la plaque d’extrémité du moteur 46,47,48. Percer le fascia externe sur le muscle et injecter lentement le HCT selon 32. Laissez la seringue/micropipette en place pendant 5 à 10 s avant de retirer lentement.
- Fermez les incisions avec 1-2 sutures et transférez la souris dans une cage de récupération isolée. Surveillez la souris après la chirurgie pendant au moins 30 minutes, avant de la renvoyer dans la cage d’accueil. Lorsque la souris s’est rétablie avec succès et que la surveillance post-chirurgicale est terminée, remettez la cage dans des conditions de logement normales.
3. Transport axonal in vivo
- Exposition du nerf sciatique
- Réglez la chambre environnementale du microscope à 37 °C au moins 1 h avant l’imagerie.
- Préparez-vous à exposer le nerf sciatique en disposant le drap chirurgical, les outils, le ruban adhésif, les cotons-tiges stériles, l’éthanol à 70% et la solution saline stérile autour de la zone chirurgicale. Assurez-vous que l’appareil d’anesthésie dispose de réserves suffisantes d’oxygène et d’isoflurane jusqu’à 2 h par souris. Créez un coin à partir d’un parafilm ou d’un ruban invisible en le coupant en un rectangle étroit (par exemple, ~ 1 cm de largeur pour les souris plus grandes) avec une pointe inclinée et placez-le sous le nerf sciatique exposé pour faciliter le processus d’imagerie. Placez la chambre d’induction sur un tapis chauffant et réglez-la à la température corporelle.
REMARQUE: Quatre heures suffisent pour que HCT ait été pris et transporté rétrogradement du site d’injection au nerf sciatique; par conséquent, une seule souris peut être préparée pour une nouvelle anesthésie après cette période. - Dirigez le flux d’anesthésie dans la chambre d’induction, allumez la machine d’anesthésie avec un débit d’oxygène de 1-2 L / min et 3-4% d’isoflurane, et placez la souris dans la chambre d’induction pour initier l’anesthésie.
REMARQUE: Comme l’expérience de transport axonal in vivo est une procédure terminale, il n’est pas nécessaire de lubrifier les yeux. - Lorsque le réflexe de redressement est absent, réduisez l’anesthésie à 2-3% d’isoflurane, dirigez le flux d’anesthésie vers l’embout buccal et transférez la souris à l’embout buccal. Utilisez du ruban chirurgical pour fixer la tête à l’embout buccal, étendez le membre postérieur ciblé à environ 45 ° de la ligne médiane et utilisez du ruban chirurgical sur le pied pour maintenir cette position.
REMARQUE: Une anesthésie réduite est avantageuse à ce stade, car elle peut limiter l’impact des artefacts respiratoires pendant le processus d’imagerie. - Assurez-vous que les réflexes de retrait de la cornée et de la pédale sont absents, puis utilisez des ciseaux pour couper la peau recouvrant le nerf sciatique32 (c.-à-d. une grande zone s’étendant de la moelle épinière centrale au membre postérieur moyen-inférieur). Enlevez le muscle fémoris du biceps sus-jacent, ainsi que toute autre musculature et tissu conjonctif qui se trouve près du nerf sciatique. Évitez d’endommager le nerf sciatique et les vaisseaux sanguins environnants, en particulier ceux situés près de l’aspect latéral de la rotule / aspect proximal de la tête gastrocnémienne latérale.
- Lorsque le nerf sciatique intact est suffisamment exposé, appliquez une solution saline stérile préavertée sur la zone autour du nerf sciatique pour éviter la dessiccation. Utilisez une pince incurvée pour perturber le tissu conjonctif profond et placez le « coin » de parafilm pré-préparé sous le nerf. Une fois terminé, placez du coton imbibé de solution saline sur la zone exposée et déplacez la souris dans la chambre à induction placée sur le dessus du tapis chauffant (réglé à 37 ° C), qui doit toujours être rempli d’isoflurane dans O2.
- In vivo imagerie axonale
- Placez un verre de couverture de 22 x 64 mm sur l’étage de microscope personnalisé et fixez sa position avec du ruban adhésif. Sélectionnez et appliquez de l’huile d’immersion sur l’objectif, puis connectez l’étage du microscope au microscope inversé. Soulevez lentement l’objectif immergé dans l’huile jusqu’à ce que le contact soit établi entre l’huile et le verre de couverture.
REMARQUE: Les objectifs d’immersion dans l’huile DIC Plan-Apochromat 40x, 1,3 ouverture numérique (NA) ou 63x, 1,4 NA DIC Plan-Apochromat peuvent être utilisés pour imager le transport in vivo dans le nerf sciatique. - Déplacez l’embout buccal de l’anesthésique sur la scène du microscope et fixez les tuyaux d’anesthésie avec du ruban adhésif pour éviter toute perturbation de l’anesthésie. Retirez le coton du nerf sciatique et transférez la souris de la chambre d’induction à l’embout buccal, le nerf exposé faisant face à la vitre de couverture. Utilisez du ruban chirurgical pour vous assurer que la tête de la souris est fixée à l’embout buccal et maintenir le niveau d’anesthésie le plus bas et le plus efficace. Soulevez doucement la souris par la queue et ajoutez une solution saline stérile au couvercle près du nerf sciatique exposé pour limiter la dessiccation et faciliter l’imagerie.
REMARQUE: Fermez toutes les portes de la chambre environnementale pour vous assurer que la zone reste à la température du corps. - À l’aide des oculaires, localisez le nerf sciatique, déterminez le point focal optimal et sélectionnez une zone d’intérêt contenant des organites axonaux mobiles.
REMARQUE : Une explication détaillée de ce processus a déjà été décrite32. - Basculez vers le logiciel informatique en cliquant sur le bouton Acquisition (ou équivalent) et sélectionnez un domaine d’intérêt. Utilisez un zoom numérique pour obtenir un grossissement total de >80x et faites pivoter la zone sélectionnée pour visualiser horizontalement les axones (par exemple, une cargaison rétrograde en mouvement de droite à gauche et une cargaison antérograde en mouvement de gauche à droite).
REMARQUE : Les paramètres de directionnalité dépendent de l’utilisateur, mais doivent rester cohérents tout au long des expériences. - Optimisez l’intensité du signal en ajustant des paramètres tels que l’intensité laser (0,2 - 1%), l’ouverture du sténopé (1 UA - max), le gain (Master) (700 - 1000), le décalage numérique (-50 - 0) et le gain numérique (1,0 - 4,0).. Pour réduire l’influence potentielle de la phototoxicité, maintenir l’intensité du laser à ≤ 1% si possible, avec une intensité laser maximale de 2%. Modifiez tous les autres paramètres avant d’ajuster l’intensité du laser pour une détection optimale du signal.
- Cliquez sur la zone Régions (ou équivalent), sélectionnez une région rectangulaire d’intérêt, puis en mode Acquisition (ou équivalent), définissez la taille de l’image sur un minimum de 1024 x 1024 pixels et commencez l’acquisition en accéléré de 100 à 1 000 images.
REMARQUE: La fréquence d’acquisition d’images souhaitée dépend de l’utilisateur (par exemple, le transport peut être évalué avec des fréquences d’images comprises entre 0,1 et 6 s) et peut être ajusté avec des paramètres logiciels, tels que la région d’intérêt, le temps de balayage, la moyenne d’acquisition et la directionnalité laser. Par exemple, pour obtenir une fréquence d’images plus lente, augmentez la hauteur/largeur de la région d’intérêt, acquérez des vitesses de balayage plus lentes, augmentez la moyenne d’acquisition et utilisez la directionnalité laser unique, et vice versa pour une fréquence d’images plus rapide. Le taux d’acquisition d’images doit rester cohérent entre des ensembles de données comparables, car l’imagerie à des fréquences différentes peut entraîner des incohérences. Les cargaisons rapides telles que les endosomes de signalisation nécessitent une fréquence d’images plus rapide (par exemple 0,1-3 s) par rapport aux organites plus lents comme les mitochondries qui peuvent être analysées en utilisant une fréquence plus lente (par exemple 2,5-6 s). - Visez à capturer un minimum de 10 cargaisons mobiles à partir d’un minimum de trois axones par souris.
REMARQUE : Sur la base de calculs de puissance bilatéraux à deux échantillons (avec une puissance standard de 0,8 (1−β) et un taux d’erreur de type I de 5 % (α)), des tailles d’échantillon de 6 à 8 sont suffisantes pour identifier les différences de transport axonal entre les modèles de type sauvage et de maladie35,43. - Une fois l’imagerie terminée, euthanasier la souris immédiatement sous anesthésie (p. ex. luxation cervicale). Les tissus post mortem, tels que les muscles et les nerfs sciatiques, peuvent également être prélevés pour une analyse plus approfondie.
- Placez un verre de couverture de 22 x 64 mm sur l’étage de microscope personnalisé et fixez sa position avec du ruban adhésif. Sélectionnez et appliquez de l’huile d’immersion sur l’objectif, puis connectez l’étage du microscope au microscope inversé. Soulevez lentement l’objectif immergé dans l’huile jusqu’à ce que le contact soit établi entre l’huile et le verre de couverture.
Résultats
Cet article détaille un protocole polyvalent qui élargit la boîte à outils de transport axonal in vivo dans les modèles de rongeurs. La figure 1 montre que les axones des motoneurones peuvent être différenciés à la fois des axones sensoriels et des cellules de Schwann en utilisant des souris transgéniques. La figure 1A illustre l’expression de l’eGFP dans les axones moteurs cholinergiques d’une souris ChAT.eGFP anesthésiée vivante. La figure 1B utilise une autre méthode pour obtenir l’expression de tdTomato dans un nerf fraîchement excisé (c.-à-d. aucun traitement tissulaire supplémentaire) d’une souris ChAT.tdTomato. Par conséquent, l’utilisation de souches transgéniques telles que ChAT.eGFP, ChAT.tdTomato ou Hb9.GFP permet un marquage spécifique des axones moteurs in vivo.
Alternativement, les axones peuvent également être identifiés en injectant des traceurs / marqueurs (par exemple, HCT31,32 ou des virus codant eGFP15) dans les muscles squelettiques. La figure 2 met en évidence une telle application, représentant huit axones ChAT.eGFP positifs exprimant de manière robuste qui contiennent des endosomes de signalisation HCT-555 positifs (flèches blanches), ~ 4 h après l’injection de la sonde dans le muscle TA. En utilisant cette conception expérimentale, nous avons pu identifier les neurones α-moteurs innervant TA, qui sont principalement44 à graisse rapide. Cinq autres axones ChAT.eGFP avec une expression eGFP moins robuste (Figure 2A, astérisques orange) étaient partiellement flous et susceptibles d’être situés légèrement plus profondément dans le nerf sciatique.
De plus, nous avons identifié des endosomes de signalisation HCT-555-positifs dans les axones sensoriels négatifs eGFP (flèches jaunes). En tant que tel, en utilisant ce paradigme expérimental, on peut spécifiquement évaluer et comparer le transport axonal des endosomes de signalisation dans les neurones moteurs par rapport aux neurones sensoriels in vivo. En effet, en utilisant cette souche rapporteure transgénique, nous avons découvert que le transport des endosomes de signalisation dans les axones moteurs ChAT.eGFP positifs est plus rapide que dans les axones sensoriels négatifs ChAT.eGFP, qui peuvent être différenciés de manière fiable en utilisant des largeurs d’axones43.
Nous avons déjà identifié des axones de motoneurones à l’aide de la souris ChAT.eGFP in vivo43. Nous signalons maintenant que HB9. Les souris GFP peuvent également être utilisées pour obtenir l’identification des axones des motoneurones in vivo. En effet, la figure 3 présente une série d’images time-lapse de HB9. Axones GFP contenant des endosomes de signalisation HCT-555 positifs se déplaçant rétrogradement. Notez que, contrairement à l’expression pilotée par ChAT, GFP a un modèle plus ponctué/granulaire dans HB9. Axones GFP; la raison n’est pas claire.
Nous avons déjà décrit comment surveiller la dynamique mitochondriale in vivo dans les nerfs sciatiques via des injections de nerf intrasciatique du colorant ciblant les mitochondries, la tétraméthylrhodamine, l’ester éthylique, le perchlorate (TMRE)32,36. Pour différencier de manière fiable les mitochondries motrices des mitochondries sensorielles, la souris Mito.CFP, qui exprime la CFP sous le promoteurThy1 18, peut être croisée avec des souris transgéniques qui expriment un gène rapporteur fluorescent dans des types neuronaux spécifiques. En effet, en élevant des souris Mito.CFP avec des souris ChAT.tdTomato (appelées ChAT.tdTomato::Mito.CFP), nous avons pu visualiser les mitochondries spécifiquement dans les axones moteurs, comme le montre la figure 4. Dans cet exemple de multiplexe en direct, cinq axones ChAT.tdTomato ont pu être visualisés, dont quatre contiennent des mitochondries CFP positives. De plus, le nœud de Ranvier (flèche blanche dans le panneau iii) a également pu être identifié. De plus, les nœuds de Ranvier sont clairement détectables dans ChAT.eGFP, HB9. Souris GFP et Mito.CFP (non représentées). Ces souches double-transgéniques permettent l’imagerie intravitale en accéléré de souris anesthésiées vivantes pour surveiller le contenu mitochondrial spécifique aux motoneurones et la dynamique du transport axonal.
Enfin, les endosomes de signalisation et les mitochondries peuvent être visualisés simultanément dans les mêmes axones in vivo en injectant HCT dans les muscles de souris Mito.CFP (Figure 5). Des injections intramusculaires de HCT-555 ont été effectuées dans le muscle TA chez une souris Mito.CFP ~ 4 h avant l’imagerie. Les mitochondries (i panels) et les endosomes de signalisation (ii panels) ont été visualisés simultanément dans des axones spécifiques aux muscles (c’est-à-dire des axones innervant l’AT). En effet, on peut observer des organites en mouvement antérograde (triangles jaunes) et rétrogradement (triangles et cercles verts) ainsi que des organites bloqués (triangles et cercles oranges). En utilisant ce paradigme expérimental, on peut évaluer les interactions fonctionnelles complexes entre les mitochondries axonales et les endosomes de signalisation in vivo. Dans l’ensemble, nous démontrons plusieurs approches expérimentales différentes pour évaluer le transport axonal des endosomes de signalisation et / ou des mitochondries, en particulier dans les motoneurones cholinergiques in vivo.
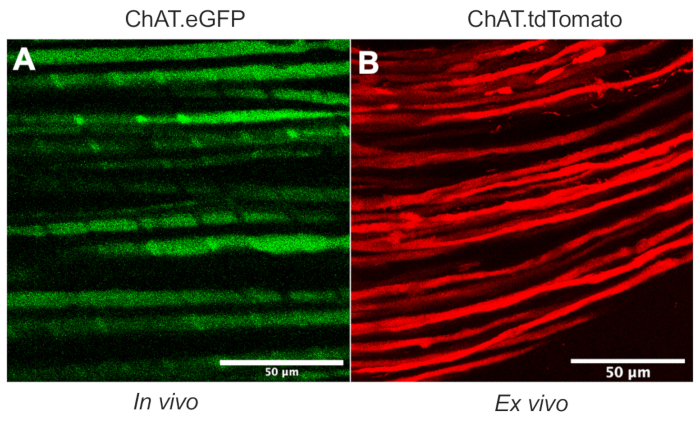
Figure 1 : Axones moteurs du nerf sciatique. (A) Image monoplan représentative d’axones moteurs eGFP positifs obtenue in vivo à partir d’une souris ChAT.eGFP. (B) Image monoplan représentative d’axones moteurs tdTomato-positifs dans un nerf sciatique excisé d’une souris ChAT.tdTomato. Les distinctions dans le calibre des axones résultent de différences d’âge et de taille de souris. Barres d’échelle = 50 μm. Abréviations : eGFP = protéine fluorescente verte améliorée; ChAT = choline acétyltransférase. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Transport axonal in vivo d’endosomes de signalisation dans les neurones moteurs et sensoriels du nerf sciatique vivants d’une souris ChAT.eGFP. (A-C) Images représentatives d’axones cholinergiques exprimant l’eGFP (A) et contenant des endosomes de signalisation HCT-555 positifs (B), et la fusion (C). Les flèches blanches mettent en évidence un axone moteur eGFP positif contenant des endosomes de signalisation HCT-555 positifs, les flèches cyan identifient un axone moteur dépourvu d’endosomes de signalisation HCT-555 positifs, et les flèches jaunes mettent en évidence un axone sensoriel eGFP-négatif transportant des endosomes de signalisation HCT-555 positifs. Les astérisques orange identifient les axones moteurs avec une expression eGFP plus faible. Barre d’échelle = 25 μm. Abréviations : eGFP = protéine fluorescente verte améliorée; ChAT = choline acétyltransférase; HCT-555 = domaine de liaison à la toxine tétanique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
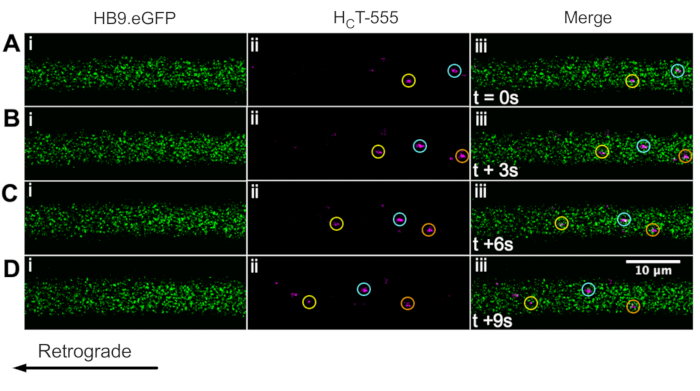
Figure 3 : Série d’images time-lapse représentant le transport axonal in vivo d’endosomes de signalisation dans les motoneurones vivants d’un HB9. Souris GFP. (A-D) Images en accéléré prises toutes les 3 s représentant des axones de motoneurones exprimant une protéine fluorescente verte (i) et contenant des endosomes de signalisation HCT-555 positifs (ii), et la fusion (iii). Chaque cercle de la même couleur identifie le même endosome en mouvement sur différentes images. Le mouvement rétrograde se fait de droite à gauche. Barre d’échelle = 10 μm. Abréviations: GFP = protéine fluorescente verte; HCT-555 = domaine de liaison à la toxine tétanique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
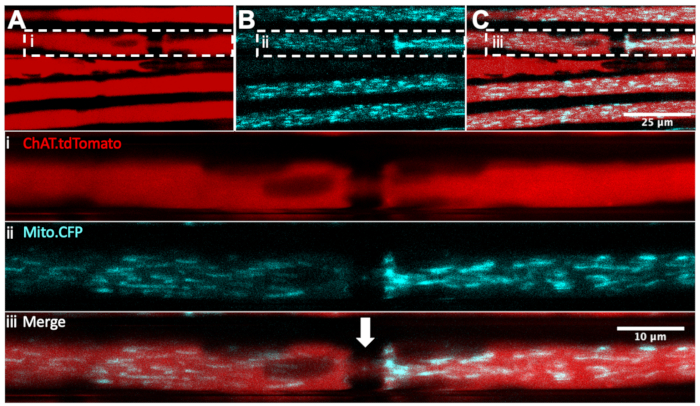
Figure 4 : Transport axonal in vivo des mitochondries dans les motoneurones vivants du nerf sciatique d’un ChAT.tdTomato:: Mito.CFP: souris. (A-C) Images représentatives des axones moteurs tdTomato-positifs (A), contenant des mitochondries CFP positives (B), et la fusion (C). Les images en médaillon i-iii contiennent un grossissement plus élevé de chaque panneau. La flèche blanche représente un nœud suspect de Ranvier. Barres d’échelle = 25 (A-C) et 10 μm (i-iii). Abréviations: ChAT = choline acétyltransférase; CFP = protéine fluorescente cyan. Veuillez cliquer ici pour voir une version agrandie de cette figure.
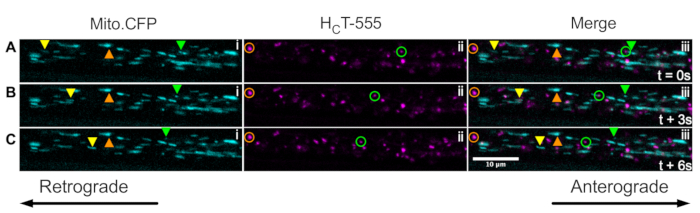
Figure 5 : Série d’images time-lapse représentant le transport axonal in vivo simultané des mitochondries et les endosomes de signalisation dans les motoneurones du nerf sciatique vivants d’une souris Mito.CFP. (A-C) Images time-lapse prises toutes les 3 s représentant le transport axonal des mitochondries (i) et des endosomes de signalisation (ii) dans le même axone du nerf sciatique (iii). Les triangles jaunes identifient les cargaisons en mouvement antérograde, les cercles/triangles verts identifient les cargaisons en mouvement rétrograde et les cercles/triangles orange identifient les cargaisons stationnaires. Le mouvement antérograde est de gauche à droite, tandis que le mouvement rétrograde est dans la direction opposée. Barre d’échelle = 10 μm. Abréviations: HCT-555 = domaine de liaison à la toxine tétanique; CFP = protéine fluorescente cyan. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole détaille les étapes pour évaluer le transport axonal in vivo des endosomes de signalisation et des mitochondries dans les axones intacts du nerf sciatique de la souris. En effet, une configuration expérimentale est fournie qui permet aux utilisateurs de 1) distinguer les neurones moteurs des neurones sensoriels in vivo, in situ et ex vivo en utilisant des souris exprimant des protéines rapporteures fluorescentes exprimées sélectivement dans les motoneurones; 2) évaluer le transport axonal in vivo des endosomes de signalisation spécifiquement dans les axones des motoneurones en utilisant trois souris transgéniques différentes; 3) étudier le transport axonal in vivo des mitochondries spécifiquement dans les axones des motoneurones; et 4) évaluer simultanément la dynamique de transport in vivo des endosomes de signalisation et des mitochondries au sein du même axone. Cette approche a un vaste potentiel pour étudier le transport axonal dans des conditions basales et peut être utilisée pour évaluer les perturbations pathologiques dans différentes maladies affectant les nerfs moteurs et sensoriels périphériques.
En utilisant les paradigmes expérimentaux précédents comme base31,32, nous avons ici de nouvelles façons robustes et détaillées de différencier le transport axonal se produisant dans les neurones moteurs des neurones sensoriels à l’aide de souris rapporteures transgéniques. En utilisant la souris Mito.CFP, cette approche a été développée pour évaluer le transport mitochondrial in vivo en évitant les injections de nerf intrasciatique de TMRE36. Cela permet de contourner les dommages neuronaux possibles et les perturbations dans le transport axonal causés par l’injection intranerve de la sonde. De plus, ce protocole permet de visualiser le transport axonal de plusieurs organites dans les axones moteurs innervant les muscles ayant des propriétés physiologiques distinctes (par exemple, les muscles fatigables à contraction rapide par rapport aux muscles résistants à la fatigue à contraction lente). En tant que tel, la dynamique de l’endosome de signalisation et/ou du transport axonal mitochondrial peut être évaluée dans différents sous-ensembles de neuronesα-moteurs 44. De plus, le transport axonal de ces organites dans des contextes pathologiques peut également être évalué par croisement avec des modèles murins de différentes maladies neurodégénératives 1,2,3.
La boîte à outils de transport axonal est en constante expansion28,29, et des protocoles ex vivo ont été développés pour évaluer la dynamique de transport en utilisant des explants de corne ventrale de souris cultivées49 ou des préparations nerveuses et musculaires de souris excisées50. En outre, le développement de protocoles pour évaluer le transport axonal dans les neurones corticaux51 dérivés de cellules souches pluripotentes humaines induites (hiPSC) ou les motoneurones spinaux dérivés de hiPSC52 a permis d’étudier les neurones humains présentant des mutations pathogènes. De tels protocoles de pointe dans les tissus de souris et les cellules humaines peuvent fournir des informations critiques sur la fonction neuronale, faciliter la découverte pathomécanistique dans les modèles de maladies neurodégénératives et être utilisés pour tester des molécules et des stratégies thérapeutiques.
Plusieurs étapes critiques doivent être suivies pour la mise en œuvre réussie de ces techniques, et certaines notes importantes ont été fournies dans la section du protocole. Les principales exigences pour l’imagerie intravitale sont le microscope confocal inversé avec insert de scène personnalisé et l’équipement pour maintenir l’anesthésie et la température optimale. En effet, un système d’anesthésie mobile spécialisé est nécessaire pour 1) l’induction de l’anesthésie, 2) la dissection / traitement des tissus (c.-à-d. l’exposition du nerf sciatique) et 3) le maintien de l’anesthésie pendant l’imagerie intravitale (comme détaillé précédemment dans 31,32). Surtout lorsque vous utilisez des objectifs de grossissement plus élevés (par exemple, 40x ou 63x), la profondeur de l’anesthésie peut avoir un impact sur la qualité de l’image, car une anesthésie plus profonde induit de grandes respirations « haletantes » qui entraînent des changements fréquents de mise au point. De tels mouvements importants auront sans aucun doute un impact sur les analyses de transport post-imagerie (par exemple, le suivi des cargaisons à l’aide des plugins fidjiens TrackMate53 ou KymoAnalyzer54), car les mouvements respiratoires produisent des artefacts dans des vidéos en accéléré qui peuvent les rendre impropres au suivi automatisé ou nécessiter une évaluation plus longue. De plus, nous avons également observé des artefacts d’imagerie causés par des artères pulsées dans le nerf sciatique, qui ne peuvent être résolus qu’en choisissant une région d’imagerie différente. Le microscope doit être équipé d’une chambre environnementale capable de maintenir une température corporelle constante, car la température et le pH influencent le transport axonal55. En outre, l’application d’analgésiques après la chirurgie doit être évitée, car ils peuvent modifier la dynamique de transport56. Si la conception expérimentale est longitudinale et nécessite une imagerie répétée (p. ex., 57), les protocoles de dissection doivent être ajustés de manière appropriée pour être peu invasifs et peuvent nécessiter une approbation éthique ou de licence supplémentaire.
Certaines considérations expérimentales doivent être gardées à l’esprit. Tout d’abord, la plupart des protocoles détaillés ici impliquent l’utilisation de souris transgéniques qui possèdent des protéines rapporteures fluorescentes dans les mitochondries ou les axones des motoneurones. Chacune de ces lignées de souris doit être élevée et imagée comme hémi-/hétérozygote. Les exceptions, cependant, sont les lignées de souris ChAT.Cre et Rosa26.tdTomato qui peuvent être maintenues séparément en tant qu’homozygotes, la progéniture hémizygote résultante permettant l’expression de tdTomato dans les neurones cholinergiques après la recombinaison Cre-loxP. Lors du croisement de souris hémi-/hétérozygotes transgéniques (p. ex., Mito.CFP) avec d’autres souris hémi-/hétérozygotes transgéniques (p. ex., ChAT.eGFP), il faut examiner attentivement la stratégie de reproduction, car l’obtention du nombre souhaité de descendants double mutant peut prendre beaucoup de temps. De plus, lors de la reproduction de la génération F1 de souris ChAT.Cre et Rosa26.tdTomato (c’est-à-dire ChAT.tdTomato) avec des souches transgéniques supplémentaires (par exemple, Mito.CFP), il faut s’attendre à encore moins de souris porteuses des triples transgènes souhaités. En outre, il faut également tenir compte du chevauchement potentiel des fluorophores lors de la sélection de souris à deux rapporteurs ayant des propriétés de longueur d’onde proches (par exemple, excitation Mito-CFP: 435 nm, émission: 485 nm, élevée avec ChAT.eGFP-excitation: 488 nm, émission: 510 nm), bien qu’il puisse être possible de surmonter ce problème avec le démélange spectral58.
Cette technique a quelques limites à considérer. Dans ce travail et nos protocoles précédents31,32, nous avons montré comment plusieurs marqueurs génétiquement codés et différentes méthodes de coloration peuvent être utilisés pour étiqueter et suivre des organites distincts in vivo. Cependant, toutes les sondes ne conviennent pas à cette approche expérimentale. Nous avons évalué les injections dans l’AT ou le muscle soléaire de la sous-unité bêta de la toxine cholérique (CTB)-488 (0,5-1,5 μg / μL ~ 4 h avant l’imagerie), une sonde couramment utilisée pour marquer les corps cellulaires des motoneurones dans des expériences de traçage rétrograde in vivo 59,60. Cependant, lorsqu’il était injecté seul ou co-injecté avec HCT-555, le marquage CTB-488 était médiocre malgré l’utilisation de concentrations similaires à celles utilisées pour le traçage rétrograde réussi des motoneurones. Ainsi, nous concluons que, bien que le CTB soit un excellent marqueur in vitro des endosomes de signalisation dans les cultures neuronales61, HCT reste la sonde de référence pour identifier les endosomes de signalisation in vivo dans les axones du nerf sciatique.
En utilisant différentes voies, nous avons également testé des sondes couramment utilisées pour le marquage des lysosomes, telles que LysoTracker vert DND-26, et des marqueurs d’hydrolases lysosomales actives, tels que BODIPY-FL-pepstatine A pour Cathepsin D62 et Magic Red pour Cathepsin B, mais sans succès. Nous avons essayé l’administration intramusculaire de BODIPY-FL-pepstatine A (2,5 μg dans le TA ~ 4 h avant l’imagerie), ainsi que l’injection intrasciatique de 2 μL de LysoTracker (10 μM), BODIPY-FL-pepstatine A (10 μM) ou Magic Red (1/10) 30-60 min avant l’imagerie. Malgré ces sondes mettant en évidence le nerf, nous n’avons pas pu trouver d’organites clairement étiquetés. Les sondes se sont accumulées autour des axones, probablement retenues par les cellules de Schwann. Par conséquent, le marquage infructueux des lysosomes peut être dû à une livraison déficiente de la sonde dans les neurones, bien que l’existence de concentrations plus appropriées ne puisse être exclue. Étant donné que le marquage TMRE fonctionne dans des conditions similaires (c.-à-d. injections de nerf intrasciatique), l’intensité du marquage peut dépendre du colorant et doit être testée pour chaque marqueur indépendamment. Cependant, nous concluons que le ciblage in vivo des lysosomes avec ces sondes n’est pas réalisable aux concentrations indiquées ci-dessus.
Les méthodes d’anesthésie peuvent modifier des lectures physiologiques distinctes (p. ex., fonction cochlée63 et électrophysiologie corticale64); cependant, on ignore actuellement si l’anesthésie influence le transport axonal in vivo dans le nerf sciatique. Compte tenu de la réduction de l’activité neuromusculaire sous anesthésie induite par l’isoflurane, il est possible que la cinétique de transport diffère par rapport à l’état d’éveil. Cependant, la seule étude in vivo qui a directement étudié cela a révélé que le transport de vésicules centrales denses dans les projections thalamocorticales ne diffère pas entre les souris anesthésiées et éveillées65. En outre, étant donné que les distinctions dans le transport entre les souris de type sauvage et les souris modèles de maladie sont détectables sous anesthésie35,43, il est clair que l’exposition à l’isoflurane n’empêche pas l’identification des perturbations dans la signalisation du trafic d’endosomes ou de mitochondries.
Ce protocole a d’autres applications potentielles, qui ont été décrites ci-dessous. L’élevage des souris transgéniques décrites dans ce protocole (p. ex., Mito.CFP, ChAT.eGFP) avec des modèles murins de maladie neurodégénérative 1,2,3 permettra des investigations spécifiques au sous-type de neurone et/ou à la cargaison. De plus, les lignées Cre66 récemment développées permettraient également la visualisation de protéines rapporteures fluorescentes dans des populations d’axones sensoriels distinctes. Par exemple, les souris Rosa26.tdTomato peuvent être croisées avec un neuropeptide Y exprimant le récepteur 2 (Npy2r). Cre souris pour activer la fluorescence tdTomato dans les nocicepteurs de fibres A myélinisés67. En outre, le contrôle temporel peut également être obtenu en utilisant des systèmes Cre inductibles (par exemple, le tamoxifène)68. Une autre application potentielle repose sur la disponibilité de souris transgéniques exprimant des protéines rapporteures fluorescentes dans les cellules de Schwann. En effet, les souris S100-GFP69 et PLP-GFP70 permettent l’imagerie in vivo et/ou in situ des cellules de Schwann et ont été à la pointe de la recherche impliquée dans la migration des cellules de Schwann lors de la régénération nerveuse périphérique.
En plus de ces applications et en complément de la souris Mito.CFP est la disponibilité de plusieurs lignées de souris transgéniques qui expriment des protéines fluorescentes dans des organites distincts, tels que les mitochondries et les autophagosomes. Par exemple, l’étude du transport mitochondrial in vivo pourrait être possible avec la souris mito::mKate271 ou la souris mitoDendra photoconvertible57. De plus, le transport in vivo des mitophagosomes peut être possible en utilisant la souris mito-Keima72 sensible au pH et la souris mito-QC73 pour les analyses de mitophagie. En outre, les difficultés de marquage lysosomal que nous avons rencontrées peuvent être surmontées en utilisant des souris exprimant LAMP1-GFP, avec la mise en garde que LAMP1 est également présent dans les organites endocytaires distincts des lysosomes74.
En résumé, nous avons fourni de nouvelles façons d’évaluer le transport axonal in vivo de plusieurs organites dans des axones nerveux périphériques spécifiques provenant de diverses souris transgéniques. L’imagerie simultanée de différents organites sera particulièrement importante, compte tenu des découvertes récentes d’interactions axonales et de co-trafic d’organites tels que les mitochondries et les endosomes75,76. Nous pensons que les méthodes présentées seront utiles pour améliorer la compréhension de la physiologie basale des axones in vivo et démêler d’importants mécanismes pathologiques conduisant à la neurodégénérescence des nerfs périphériques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Nous tenons à remercier Robert M. Brownstone (Queen Square Institute of Neurology, University College London) pour avoir partagé les souris ChAT-eGFP, ChAT.Cre et Rosa26.tdTomato, et Pietro Fratta (Queen Square Institute of Neurology, University College London) pour avoir partagé le HB9. Souris GFP. Nous tenons à remercier Elena R. Rhymes, Charlotte J.P. Kremers et Qiuhan Lang (Queen Square Institute of Neurology, University College London) pour leur lecture critique du manuscrit. Ce travail a été soutenu par une bourse non clinique junior de la Motor Neuron Disease Association (Royaume-Uni) (Tosolini / Oct20 /973-799) (APT), les Wellcome Trust Senior Investigator Awards (107116 / Z / 15 / Z et 223022 / Z / 21 / Z) (GS), une bourse de la Fondation du Uk Dementia Research Institute (GS); et une bourse de développement de carrière du Conseil de recherches médicales (MR/S006990/1) (JNS).
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tube | |||
| 70% (v/v) ethanol in distilled water | |||
| AlexaFlour555 C2 maleimide | ThermoFisher Scientific | A-20346 | Can also use AlexaFlour-488 or -647 Maleimide |
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J | Jackson Laboratory | 7909 | Rosa26.tdTomato mice |
| B6.Cg-Tg(Hlxb9-GFP)1Tmj/J mice | Jackson Laboratory | 5029 | HB9.GFP mice |
| B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J mice | Jackson Laboratory | 7967 | Mito.CFP mice |
| B6;129S6-Chattm2(cre)Lowl/J mice | Jackson Laboratory | 6410 | ChAT.Cre mice |
| Computer with microscope control and image acquisition software | Zeiss | Zen | |
| Cotton swab | |||
| Desktop centrifuge | |||
| Dissecting microscope | |||
| Eye lubricant | |||
| Fine curved forceps | Dumont | ||
| Fine straight forceps | Dumont | ||
| Glass coverslip (22 x 64 mm, thickness no. 1) | |||
| Graduated, glass micropipette with microliter markings and plunger | Drummond Scientific | 5-000-1001-X10 | |
| Hair clippers | |||
| Hamilton microliter syringe (701 N, volume 10 μL, needle size 26 s G, bevel tip, needle L 51 mm) | Merck | 20779 | |
| HcT-441 | N/A | N/A | See Restani et al., 2012 for more details |
| Heating pad | |||
| Immersion oil for fluorescent imaging at 37 °C | |||
| Inverted confocal microscope with environmental chamber | Zeiss | LSM 780 | Most inverted confocals should be adaptable |
| Isoflurane | |||
| Isoflurane vaporizer/anesthesia machine with induction cham-ber and mask stabilizer | |||
| Magic tape | invisible tape | ||
| Micropipette puller | |||
| Parafilm | Parafilm | ||
| Phosphate-buffered saline (PBS): 137 mM NaCl, 10 mM Na2HPO4, 2.7 mM KCl, 1.8 mM KH2PO4–HCl, pH 7.4 | |||
| Recombinant human brain-derived neurotrophic factor (BDNF) | Peprotech | 450-02 | BDNF that can be co-injected with HcT-555 |
| Saline | |||
| Scalpel blade | Dumont | ||
| Small spring scissors | Dumont | ||
| Surgery/operating microscope | |||
| Surgical drape | |||
| Surgical suture | |||
| Surgical tape | |||
| Tg(Chat-EGFP) GH293Gsat/Mmucd mice | MMRRC | 000296-UCD | ChAT.eGFP |
| Vortex mixer |
Références
- Webster, R. G. Animal models of the neuromuscular junction, vitally informative for understanding function and the molecular mechanisms of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (5), 1326 (2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models & Mechanisms. 4 (4), 457-467 (2011).
- De Giorgio, F., Maduro, C., Fisher, E. M. C., Acevedo-Arozena, A. Transgenic and physiological mouse models give insights into different aspects of amyotrophic lateral sclerosis. Disease Models & Mechanisms. 12 (1), 037424 (2019).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. The Journal of Cell Biology. 187 (6), 761-772 (2009).
- Brown, R. H., Al-Chalabi, A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 377 (2), 162-172 (2017).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425 (6961), 917-925 (2003).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiological Genomics. 27 (3), 391-397 (2006).
- Zeilhofer, H. U., et al. Glycinergic neurons expressing enhanced green fluorescent protein in bacterial artificial chromosome transgenic mice. The Journal of Comparative Neurology. 482 (2), 123-141 (2005).
- Kaiser, T., Ting, J. T., Monteiro, P., Feng, G. Transgenic labeling of parvalbumin-expressing neurons with tdTomato. Neuroscience. 321, 236-245 (2016).
- Zheng, B., Sage, M., Sheppeard, E. A., Jurecic, V., Bradley, A. Engineering mouse chromosomes with Cre-loxP: range, efficiency, and somatic applications. Molecular and Cellular Biology. 20 (2), 648-655 (2000).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Bareyre, F. M., Kerschensteiner, M., Misgeld, T., Sanes, J. R. Transgenic labeling of the corticospinal tract for monitoring axonal responses to spinal cord injury. Nature Medicine. 11 (12), 1355-1360 (2005).
- Willems, J., et al. A CRISPR/Cas9-based genome editing toolbox for epitope tagging of endogenous proteins in neurons. PLoS Biology. 18 (4), 3000665 (2020).
- Huh, Y., Oh, M. S., Leblanc, P., Kim, K. -. S. Gene transfer in the nervous system and implications for transsynaptic neuronal tracing. Expert Opinion on Biological Therapy. 10 (5), 763-772 (2010).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: an approach to maximize uptake and transduction of spinal cord motor neurons. Scientific Reports. 6, 33058 (2016).
- Andrews, M. R. Gene therapy in the CNS-one size does not fit all. Gene Therapy. 28 (7-8), 393-395 (2021).
- Kügler, S. Tissue-specific promoters in the CNS. Methods in Molecular Biology. 1382, 81-91 (2016).
- Misgeld, T., Kerschensteiner, M., Bareyre, F. M., Burgess, R. W., Lichtman, J. W. Imaging axonal transport of mitochondria in vivo. Nature Methods. 4 (7), 559-561 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Molecular Biology of the Cell. 15 (3), 1101-1111 (2004).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), 108697 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Maday, S., Twelvetrees, A. E., Moughamian, A. J., Holzbaur, E. L. F. Axonal transport: cargo-specific mechanisms of motility and regulation. Neuron. 84 (2), 292-309 (2014).
- Terenzio, M., Schiavo, G., Fainzilber, M. Compartmentalized signaling in neurons: from cell biology to neuroscience. Neuron. 96 (3), 667-679 (2017).
- Abouward, R., Schiavo, G. Walking the line: mechanisms underlying directional mRNA transport and localisation in neurons and beyond. Cellular and Molecular Life Sciences. 78 (6), 2665-2681 (2021).
- Sleigh, J. N., Rossor, A. M., Fellows, A. D., Tosolini, A. P., Schiavo, G. Axonal transport and neurological disease. Nature Reviews. Neurology. 15 (12), 691-703 (2019).
- Bronfman, F. C., Moya-Alvarado, G. BDNF/TrkB signaling endosomes mediate long-distance dendritic growth by activating CREB/PI3K-mTOR-dependent translation in neuronal cell bodies. BioRxiv. , (2020).
- Nagano, S., Araki, T. Axonal Transport and Local Translation of mRNA in Neurodegenerative Diseases. Frontiers in Molecular Neuroscience. 14, 697973 (2021).
- Boecker, C. A., Olenick, M. A., Gallagher, E. R., Ward, M. E., Holzbaur, E. L. F. ToolBox: Live Imaging of intracellular organelle transport in induced pluripotent stem cell-derived neurons. Traffic. 21 (1), 138-155 (2020).
- Surana, S., et al. The evolution of the axonal transport toolkit. Traffic. 21 (1), 13-33 (2020).
- Sleigh, J. N., Vagnoni, A., Twelvetrees, A. E., Schiavo, G. Methodological advances in imaging intravital axonal transport. F1000Research. 6, 200 (2017).
- Gibbs, K. L., Kalmar, B., Sleigh, J. N., Greensmith, L., Schiavo, G. In vivo imaging of axonal transport in murine motor and sensory neurons. Journal of Neuroscience Methods. 257, 26-33 (2016).
- Sleigh, J. N., Tosolini, A. P., Schiavo, G. In vivo imaging of anterograde and retrograde axonal transport in rodent peripheral nerves. Methods in Molecular Biology. 2143, 271-292 (2020).
- Gibbs, K. L., et al. Inhibiting p38 MAPK alpha rescues axonal retrograde transport defects in a mouse model of ALS. Cell Death & Disease. 9 (6), 596 (2018).
- Fellows, A. D., Rhymes, E. R., Gibbs, K. L., Greensmith, L., Schiavo, G. IGF1R regulates retrograde axonal transport of signalling endosomes in motor neurons. EMBO Reports. 21 (3), 49129 (2020).
- Bilsland, L. G., Sahai, E., Kelly, G., Golding, M., Greensmith, L., Schiavo, G. Deficits in axonal transport precede ALS symptoms in vivo. Proceedings of the National Academy of Sciences of the United States of America. 107 (47), 20523-20528 (2010).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. The Journal of Cell Biology. 218 (6), 1871-1890 (2019).
- Bercsenyi, K., et al. Tetanus toxin entry. Nidogens are therapeutic targets for the prevention of tetanus. Science. 346 (6213), 1118-1123 (2014).
- Deinhardt, K., et al. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293-305 (2006).
- Debaisieux, S., Encheva, V., Chakravarty, P., Snijders, A. P., Schiavo, G. Analysis of signaling endosome composition and dynamics using SILAC in embryonic stem cell-derived neurons. Molecular & Cellular Proteomics. 15 (2), 542-557 (2016).
- Surana, S., et al. The travel diaries of tetanus and botulinum neurotoxins. Toxicon. 147, 58-67 (2018).
- Villarroel-Campos, D., Schiavo, G., Lazo, O. M. The many disguises of the signalling endosome. FEBS Letters. 592 (21), 3615-3632 (2018).
- Malik, B., et al. Absence of disturbed axonal transport in spinal and bulbar muscular atrophy. Human Molecular Genetics. 20 (9), 1776-1786 (2011).
- Sleigh, J. N., et al. Mice carrying ALS mutant TDP-43, but not mutant FUS, display in vivo defects in axonal transport of signaling endosomes. Cell Reports. 30 (11), 3655-3662 (2020).
- Tosolini, A. P., Sleigh, J. N., Surana, S., Rhymes, E. R., Cahalan, S. D., Schiavo, G. modulation of axonal transport is selectively impaired in ALS. BioRxiv. , (2021).
- Restani, L., et al. Botulinum neurotoxins A and E undergo retrograde axonal transport in primary motor neurons. PLoS Pathogens. 8 (12), 1003087 (2012).
- Mohan, R., Tosolini, A. P., Morris, R. Intramuscular injections along the motor end plates: a minimally invasive approach to shuttle tracers directly into motor neurons. Journal of Visualized Experiments: JoVE. (101), e52846 (2015).
- Tosolini, A. P., Mohan, R., Morris, R. Targeting the full length of the motor end plate regions in the mouse forelimb increases the uptake of fluoro-gold into corresponding spinal cord motor neurons. Frontiers in Neurology. 4, 58 (2013).
- Mohan, R., Tosolini, A. P., Morris, R. Targeting the motor end plates in the mouse hindlimb gives access to a greater number of spinal cord motor neurons: an approach to maximize retrograde transport. Neuroscience. 274, 318-330 (2014).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments: JoVE. (159), e60993 (2020).
- Boyer, N. P., Azcorra, M., Jung, P., Brown, A. Imaging and analysis of neurofilament transport in excised mouse tibial nerve. Journal of Visualized Experiments: JoVE. (162), e61264 (2020).
- Mou, Y., Mukte, S., Chai, E., Dein, J., Li, X. -. J. Analyzing mitochondrial transport and morphology in human induced pluripotent stem cell-derived neurons in hereditary spastic paraplegia. Journal of Visualized Experiments: JoVE. (156), e60548 (2020).
- Stoklund Dittlau, K., et al. Generation of human motor units with functional neuromuscular junctions in microfluidic devices. Journal of Visualized Experiments: JoVE. (175), e62959 (2021).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Bohnert, S., Schiavo, G. Tetanus toxin is transported in a novel neuronal compartment characterized by a specialized pH regulation. The Journal of Biological Chemistry. 280 (51), 42336-42344 (2005).
- Kanai, A., et al. Low-concentration lidocaine rapidly inhibits axonal transport in cultured mouse dorsal root ganglion neurons. Anesthesiology. 95 (3), 675-680 (2001).
- Bolea, I., Gan, W. -. B., Manfedi, G., Magrané, J. Imaging of mitochondrial dynamics in motor and sensory axons of living mice. Methods in Enzymology. , 97-110 (2014).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Multispectral live-cell imaging. Current Protocols in Cell Biology. 79 (1), 46 (2018).
- Blum, J. A., et al. Single-cell transcriptomic analysis of the adult mouse spinal cord reveals molecular diversity of autonomic and skeletal motor neurons. Nature Neuroscience. 24 (4), 572-583 (2021).
- Xu, J., et al. An approach to maximize retrograde transport based on the spatial distribution of motor endplates in mouse hindlimb muscles. Frontiers in Cellular Neuroscience. 15, 707982 (2021).
- Wang, T., et al. Flux of signalling endosomes undergoing axonal retrograde transport is encoded by presynaptic activity and TrkB. Nature Communications. 7, 12976 (2016).
- Chen, C. S., Chen, W. N., Zhou, M., Arttamangkul, S., Haugland, R. P. Probing the cathepsin D using a BODIPY FL-pepstatin A: applications in fluorescence polarization and microscopy. Journal of Biochemical and Biophysical Methods. 42 (3), 137-151 (2000).
- Cederholm, J. M. E., et al. Differential actions of isoflurane and ketamine-based anaesthetics on cochlear function in the mouse. Hearing Research. 292 (1-2), 71-79 (2012).
- Michelson, N. J., Kozai, T. D. Y. Isoflurane and ketamine differentially influence spontaneous and evoked laminar electrophysiology in mouse V1. Journal of Neurophysiology. 120 (5), 2232-2245 (2018).
- Knabbe, J., Nassal, J. P., Verhage, M., Kuner, T. Secretory vesicle trafficking in awake and anaesthetized mice: differential speeds in axons versus synapses. The Journal of Physiology. 596 (16), 3759-3773 (2018).
- Gong, S., et al. Targeting Cre recombinase to specific neuron populations with bacterial artificial chromosome constructs. The Journal of Neuroscience. 27 (37), 9817-9823 (2007).
- Arcourt, A., et al. Touch receptor-derived sensory information alleviates acute pain signaling and fine-tunes nociceptive reflex coordination. Neuron. 93 (1), 179-193 (2017).
- Valny, M., Honsa, P., Kirdajova, D., Kamenik, Z., Anderova, M. Tamoxifen in the mouse brain: implications for fate-mapping studies using the tamoxifen-inducible Cre-loxP system. Frontiers in Cellular Neuroscience. 10, 243 (2016).
- Hayashi, A., et al. A double-transgenic mouse used to track migrating Schwann cells and regenerating axons following engraftment of injured nerves. Experimental Neurology. 207 (1), 128-138 (2007).
- Chen, B., Chen, Q., Parkinson, D. B., Dun, X. -. P. Analysis of schwann cell migration and axon regeneration following nerve injury in the sciatic nerve bridge. Frontiers in Molecular Neuroscience. 12, 308 (2019).
- Barrasso, A. P., Tong, X., Poché, R. A. The mito::mKate2 mouse: A far-red fluorescent reporter mouse line for tracking mitochondrial dynamics in vivo. Genesis. 56 (2), (2018).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12 (8), 1576-1587 (2017).
- McWilliams, T. G., et al. mito-QC illuminates mitophagy and mitochondrial architecture in vivo. The Journal of Cell Biology. 214 (3), 333-345 (2016).
- Cheng, X. -. T., et al. Characterization of LAMP1-labeled nondegradative lysosomal and endocytic compartments in neurons. The Journal of Cell Biology. 217 (9), 3127-3139 (2018).
- Cioni, J. -. M., Lin, J. Q., et al. Late Endosomes Act as mRNA Translation Platforms and Sustain Mitochondria in Axons. Cell. 176 (12), 56 (2019).
- Liao, Y. -. C., Fernandopulle, M. S., et al. RNA Granules Hitchhike on Lysosomes for Long-Distance Transport, Using Annexin A11 as a Molecular Tether. Cell. 179 (1), (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon