Method Article
In vitro Évaluation de la régurgitation aortique à l’aide de l’imagerie par résonance magnétique à flux quadridimensionnel
Dans cet article
Résumé
La régurgitation aortique est une maladie cardiaque valvulaire aortique. Ce manuscrit démontre comment l’imagerie par résonance magnétique à flux quadridimensionnel peut évaluer la régurgitation aortique à l’aide de valves cardiaques in vitro imitant la régurgitation aortique.
Résumé
La régurgitation aortique (RA) fait référence au flux sanguin arriéré de l’aorte dans le ventricule gauche (LV) pendant la diastole ventriculaire. Le jet régurgitant issu de la forme complexe est caractérisé par l’écoulement tridimensionnel et le gradient de vitesse élevé, limitant parfois une mesure précise du volume régurgitant à l’aide de l’échocardiographie 2D. L’imagerie par résonance magnétique à flux quadridimensionnel (IRM à flux 4D) récemment développée permet des mesures de débit volumétrique tridimensionnelles, qui peuvent être utilisées pour quantifier avec précision la quantité de régurgitation. Cette étude se concentre sur (i) la fabrication de modèles AR compatibles avec la résonance magnétique (dilatation, perforation et prolapsus) et (ii) l’analyse systématique de la performance de l’IRM à flux 4D dans la quantification AR. Les résultats ont indiqué que la formation des jets avant et arrière au fil du temps dépendait fortement des types d’origine AR. La quantité de biais de volume de régurgitation pour les types de modèles était de -7,04 %, -33,21 %, 6,75 % et 37,04 % par rapport au volume de vérité au sol (48 mL) mesuré à partir du volume de course de la pompe. La plus grande erreur de la fraction de régurgitation était d’environ 12%. Ces résultats indiquent qu’une sélection minutieuse des paramètres d’imagerie est nécessaire lorsque le volume absolu de régurgitation est important. Le fantôme d’écoulement in vitro suggéré peut facilement être modifié pour simuler d’autres maladies valvulaires telles que la sténose aortique ou la valve aortique bicuspide (BAV) et peut être utilisé comme plate-forme standard pour tester différentes séquences d’IRM à l’avenir.
Introduction
La régurgitation aortique (RA) fait référence au flux en arrière de l’aorte dans le ventricule gauche pendant la phase diastolique du ventricule. La RA est généralement classée en dilatation aortique, prolapsus des ventouses, perforation des ventouses, rétraction des ventouses et autres1. La RA chronique peut provoquer une surcharge volumique du LV principalement due à l’hypertrophie et à la dilatation, et éventuellement provoquer sa décompensation2. La RA aiguë est principalement causée par une endocardite infectieuse, une dissection aortique et une rupture traumatique, ce qui entraîne des urgences hémodynamiques2.
Les normes cliniques actuelles pour le diagnostic de la RA sont principalement basées sur l’échocardiographie transthoracique (TTE) ou l’échocardiographie transœsophagienne (TEE)3. Malgré les avantages de l’imagerie en temps réel et du temps d’examen court, la précision de l’échocardiographie dépend fortement de l’opérateur. En particulier pour la mesure du volume régurgitant, la mesure directe du volume régurgitant est limitée car le jet régurgitant se déplace hors du plan de mesure bidimensionnel (2D) en raison du mouvement de la valve aortique. L’estimation indirecte à l’aide de méthodes de surface iso-vitesse proximale (PISA) est souvent utilisée, mais des hypothèses telles que la surface d’orifice circulaire limitent souvent la mesure précise4.
Les directives médicales récentes5 recommandent également la RMR cardiaque (CMR), en particulier pour les patients atteints de RA modérée ou sévère, afin de compenser la limitation de l’échocardiographie en mesurant la masse et la fonction globale du LV. Les paramètres structurels tels que les feuillets aortiques et la taille du LV, ainsi que les paramètres de débit tels que la largeur du jet, la largeur du vena contracta et le volume régurgitant peuvent également être pris en compte de manière exhaustive dans le diagnostic de RA6 . Cependant, le volume de régurgitation aortique estimé avec la fonction globale LV peut échouer, en particulier chez les patients atteints d’autres valvulopathies cardiaques ou shunt.
Alternativement, l’IRM à écoulement 4D a été considérée comme une technique prometteuse qui peut mesurer directement le volume régurgitant avec des informations de vitesse résolues dans le temps dans le volume d’intérêt7. Le mouvement de la vanne en fonction de l’heure peut être facilement suivi et compensé lors de la mesure du volume de débit régurgitant 8,9. En outre, un plan arbitraire perpendiculaire au jet régurgitant peut être positionné rétrospectivement, ce qui augmente la précision de la mesure10. Cependant, comme l’IRM à flux 4D obtient intrinsèquement les informations moyennes spatio-temporelles, la précision de cette technique mérite toujours d’être validée en utilisant des expériences de flux in vitro bien contrôlées.
Cette étude vise à (i) développer une plateforme expérimentale in vitro compatible avec l’IRM qui peut reproduire les différents scénarios cliniques de RA (dilatation, perforation et prolapsus) et (ii) enrichir notre compréhension de la performance de l’IRM à flux 4D en quantifiant différentes RA à ces modèles de RA. De plus, la visualisation hémodynamique 3D et la quantification basées sur l’IRM de flux 4D ont été réalisées selon les différents scénarios cliniques. Ce protocole ne se limite pas à la RA et peut être étendu à d’autres types d’études sur les valvulopathies qui nécessitent une série d’expériences in vitro et une quantification hémodynamique.
Protocole
REMARQUE : Le protocole est en grande partie composé de trois étapes : (1) la fabrication du modèle, (2) l’IRM et la sélection des paramètres, et (3) l’analyse des données. La figure 1 est un organigramme montrant le processus global du protocole.
1. Fabrication du modèle
- Modèle racine aortique
- Comme le montre la figure 2, déterminez les valeurs des paramètres de la racine aortique, tels que le diamètre de la base de la valve et le rayon du sinus. Pour cette expérience, les valeurs étaient DA = 32,24 mm, DO = 26 mm, LB = 8,84 mm, LA = 26 mm, rmin = 16,64 mm, rmax = 21,32 mm.
- Exécutez le logiciel de modélisation 3D en cliquant sur Esquisse > Outils Outils d’esquisse >'esquisse d’image.
REMARQUE: Solidwork est utilisé pour la modélisation 3D dans l’expérience. - Pour créer un modèle de sinus, esquissez des cercles correspondant à rmax et rmin à l’aide de l’outil cercle. Tracez une ligne incurvée du sinus à l’aide de la fonction de courbe libre11, cliquez sur Outil Loft et sélectionnez la zone d’esquisse pour loft.
- Esquissez des cercles supplémentaires en haut et en bas du modèle actuel, cliquez sur Outil d’extrusion, puis sélectionnez les cercles. Définissez les options sur 20 mm vers le bas et 30 mm vers le haut. Faites un modèle hexaèdre de taille 100 mm x 100 mm x 76 mm de la même manière.
- Cliquez sur Combiner l’outil dans Insérer > fonctions > Combiner. Sélectionnez Soustraire dans le gestionnaire immobilier. Sélectionnez le modèle d’hexaèdre et le modèle de sinus. Fabriquez la conception finale en tant que modèle acrylique avec une machine CNC à 5 axes conformément aux instructions du fabricant.
- Cadre de vanne
- Exécutez un logiciel de modélisation 3D et ouvrez une nouvelle esquisse. Dessinez manuellement un carré de 100 mm x 100 mm et un cercle de 25 mm au centre de la base de la vanne. Cliquez sur l’outil Extrusion et réglez la hauteur de la base de la vanne à 5 mm.
- Extruder le cercle d’une hauteur de 23,5 mm et d’une épaisseur de 3 mm d’épaisseur. Divisez le modèle en 12 pièces uniformes à l’aide de l’outil Ligne afin que chaque pièce ait 30°. Sélectionnez trois pièces avec des intervalles de 120° et extrudez avec une hauteur de 16,5 mm pour faire trois piliers.
- Cliquez sur Outil De filet et sélectionnez les piliers. Ajustez le rayon du filet en haut et en bas à 4 mm et 10 mm, respectivement. Enregistrez-le dans un format de fichier STL.
- Imprimez en 3D le cadre de la vanne. Réglez la densité de remplissage à 100% et utilisez de l’acrylonitrile butadiène styrène comme matériau de remplissage. Voir la Figure 3 pour la forme et les dimensions du cadre de la valve aortique.
- Modèle de régurgitation aortique utilisant le polytétrafluoroéthylène expansé (ePTFE)
- Exécutez le logiciel de modélisation 3D et ouvrez une nouvelle esquisse. Tracez une ligne horizontale de 23,24 mm et une ligne verticale de 15 mm en référence à la figure 4A.
REMARQUE: Les paramètres géométriques de la base, de la hauteur et de la longueur du bord libre de la feuillet ont été choisis selon une étude précédente12. - Cliquez sur Outil Arc à 3 points dans le gestionnaire de commandes arc et définissez deux points à chaque extrémité de la ligne horizontale et le dernier point à la fin de la ligne verticale. Extruder l’esquisse d’une épaisseur de 5 mm. Exportez le modèle au format de fichier STL et imprimez-le en 3D.
- Chevauchez la membrane ePTFE en deux couches et dessinez trois bordures de feuillet à des intervalles de 2 mm à l’aide de la feuillet imprimée. Suture le long des lignes dessinées et des bordures latérales à des intervalles de 1 mm avec une suture en polyamide d’un diamètre de 0,1 mm. Suturez la valve ePTFE de haut en bas sur le cadre à des intervalles de 1 mm.
- Coupez le côté extérieur de la membrane et suturez-le les uns avec les autres. Effectuez les trois modifications suivantes pour obtenir trois modèles différents.
- Modèle de dilatation: Réduire le rapport des paramètres de la feuillet conçue à 90%.
- Modèle de perforation: Faites un trou circulaire d’un diamètre de 2 mm à l’aide de ciseaux au centre d’une feuillet.
- Prolapsus: Fixez les deux commissures de la vanne à un trou avec une faible hauteur de poteau.
REMARQUE: La figure 4 montre les matériaux et la méthode de fabrication de la vanne ePTFE. La figure 5 montre les caractéristiques de chaque type de RA.
- Exécutez le logiciel de modélisation 3D et ouvrez une nouvelle esquisse. Tracez une ligne horizontale de 23,24 mm et une ligne verticale de 15 mm en référence à la figure 4A.
2. IRM et sélection des paramètres
- Préparer le système expérimental composé d’un modèle AR, d’un modèle de sinus aortiques, d’une pompe de simulation cardiaque et d’une IRM.
- Placez les modèles d’expérience dans la salle d’IRM et connectez la pompe, le réservoir et les modèles à l’aide d’un tube en silicone de 25 mm (diamètre intérieur). Utilisez une attache de câble de 10 cm de long pour fixer les pièces de connexion afin d’éviter d’éventuelles fuites.
- Utilisez une pompe à piston contrôlée par moteur pour simuler les formes d’onde du flux sanguin aortique afin de générer une forme d’onde d’écoulement physiologique à travers le système de circuit d’écoulement. Utilisez de l’eau comme fluide de travail et fixez des vannes unidirectionnelles à l’entrée et à la sortie pour éviter tout refoulement. Les détails de la pompe à débit peuvent être trouvés dans l’étude précédente23.
- Localisez le modèle dans le champ de vision (FOV) de l’IRM. Effectuez une analyse éclaireuse pour observer les images fantômes dans les vues coronales, axiales et sagittales du moniteur de la console d’exploitation IRM. Cette image est utilisée comme guide pour positionner les séquences d’images suivantes.
- Localisez le plan d’image 2D au centre du modèle d’aorte. Exécutez une imagerie à contraste de phase 2D VENC (Variable Velocity-Encoding Parameter) pour sélectionner la valeur VENC la plus appropriée pour l’IRM à flux 4D.
- Réglez VENC sur une valeur 10 % plus élevée en IRM à flux 4D afin de minimiser l’aliasing de vitesse possible7. Entrez la résolution spatiale souhaitée et la résolution temporelle sur la console IRM. La résolution spatiale et temporelle de l’écoulement aortique est recommandée pour être de 2-3 mm et 20-40 ms, respectivement7. Le tableau 2 présente les paramètres de l’IRM.
- Acquérez des données avec et sans débit en utilisant les 3 types de vannes AR et sans vanne.
3. Analyse des données
- Tri et correction des données
- Copiez les fichiers de données brutes de l’analyseur pour procéder à l’analyse des données. Triez les fichiers dicom en fonction de l’en-tête nommé description de la série à l’aide du logiciel de tri Dicom. Cliquez sur Trier les images dans le logiciel de tri Dicom pour trier les images de phase tridimensionnelle et les images de magnitude dans des dossiers séparés.
- Chargez l’image de magnitude dans le logiciel ITK-snap. Cliquez sur Pinceau dans l’itK-snap et peignez manuellement la région de fluide interne du fantôme à l’aide de l’outil Pinceau. Enregistrez l’image segmentée.
- (Facultatif) Chargez les données d’image de phase obtenues avec le flux activé et désactivé à l’aide de MATLAB. Soustrayez les données avec le flux par les données sans flux pour supprimer les erreurs d’arrière-plan. Répétez cette opération pour chaque direction et cycle cardiaque.
- Calculez la vitesse des données de phase de la matrice 5D (ligne x colonne x tranche x direction x temps) à l’aide d’une équation pixel-vitesse spécifique au fournisseur. En général, l’intensité maximale du pixel correspond à la valeur VENC sélectionnée.
- Visualisation
- Chargez la vitesse de la matrice 5D de l’étape 3.1.4 dans un logiciel d’analyse de visualisation de flux.
REMARQUE: La matrice de vitesse d’entrée peut varier en fonction du logiciel d’analyse. Les utilisateurs d’Ensight doivent suivre le guide de format de boîtier en or Ensight13. - Cliquez sur la pièce Isosurface, modifiez le type de données isosurface en isovolume pour l’analyse 3D en cliquant sur le bouton Isovolume . Faites glisser les données de vitesse dans le gestionnaire de commandes des variables, ajoutez-les à l’isovolume pour vérifier la distribution de vitesse du modèle.
- Cliquez sur Outil Émetteurs de traces de particules dans le menu principal. Cochez l’option avancée pour une analyse plus précise. Sélectionnez la visualisation souhaitée telle que Streamlines ou Pathlines dans la création.
- Pour cette expérience, définissez la valeur suivante : Émettre à partir de l’option = pièce, ID de la pièce = 2, non. des émetteurs = 10000, Direction = +/-. Créez et vérifiez les résultats au fil du temps.
- Cliquez avec le bouton droit sur le modèle Trace de particules , puis cliquez sur Couleur par. Sélectionnez le composant de vitesse pour colorer la ligne de flottaison avec la vitesse.
- Chargez la vitesse de la matrice 5D de l’étape 3.1.4 dans un logiciel d’analyse de visualisation de flux.
- Quantification
- Chargez les données de vitesse (étape 3.1.4) et l’image segmentée (étape 3.1.2) sur MATLAB. Définissez la vitesse en dehors de la région de segmentation sur zéro. Cela peut être facilement effectué en multipliant par éléments les données de matrice segmentées et les données de matrice de vitesse.
- Vérifiez si les données de vitesse ont un encapsulage de phase à l’aide de la fonction Imshow de MATLAB. L’inversion de la direction de la vitesse indique l’enveloppement de phase.
- Découpez le plan souhaité des données de la matrice. Additionnez toutes les données de vitesse dans le plan et multipliez la résolution spatiale pour calculer le débit à travers le plan. Additionnez tous les débits tout au long du cycle cardiaque et multipliez la résolution temporelle pour calculer le volume de l’AVC.
Résultats
Trois classes représentatives de modèles de régurgitation aortique ont été fabriquées, et un boîtier sans valve a été fabriqué à des fins de comparaison (figure 3). Le modèle de dilatation a clairement montré une fermeture incomplète de la feuillet de la valve en raison des folioles de plus petite taille. Un trou a été percé sur l’une des feuillets à l’aide de ciseaux pour imiter le modèle de perforation. Une foliole du modèle de prolapsus semblait plus petite que les deux autres feuillets parce que les deux commissures étaient suturées à une position inférieure à la hauteur d’origine. Il n’y avait pas de différences significatives par rapport à la vue de dessus.
Avec les informations de vitesse 3D acquises au fil du temps à l’aide de l’IRM à flux 4D, des flux normaux et de régurgitation ont été visualisés pendant la systole et la diastole (Figure 6). Le jet avant était droit dans tous les modèles, à l’exception du modèle de perforation. Dans le modèle de perforation, un jet biaisé par la paroi s’est produit pendant la phase de la systole. Le jet régurgitant a montré une vitesse et une forme différentes selon la classification AR. Dans le cas d’une vanne, un flux global vers l’avant et vers l’arrière s’est produit. Le jet régurgitant du modèle de dilatation est sorti du centre et avait tendance à changer de direction au fil du temps. Le jet régurgitant du modèle de perforation et de prolapsus s’est penché vers le mur. La vitesse maximale du jet avant et régurgitant était de 0,28 m/s, -0,29 m/s dans le modèle sans valve, 2,03 m/s, -3,53 m/s dans le modèle de dilatation, 2,52 m/s, -3,13 m/s dans le modèle de perforation et 2,76 m/s, -2,88 m/s dans le modèle prolapsus.
La figure 7 montre le débit de chaque vanne et les volumes avant et régurgitants dans un plan 3D éloigné de la base de la vanne. Les débits ont montré des formes d’onde et des quantités différentes pour chaque modèle. La quantité de volume de régurgitation était de 51,38 mL, 63,94 mL, 44,76 mL et 30,22 mL pour les modèles sans valve, dilatation, perforation et prolapsus, respectivement. Le biais pour le modèle sans valve, dilatation, perforation et prolapsus était de -7,04%, -33,21%, 6,75% et 37,04%, respectivement, par rapport à la vérité au sol (48 mL) mesurée à partir du volume de course de la pompe. Les valeurs en pourcentage positives indiquent une sous-estimation tandis que les valeurs en pourcentage négatives représentent une surestimation. L’erreur de fraction de régurgitation était de -7,78%, -6,00%, 0,33% et -11,18% pour le modèle sans valve, dilatation, perforation et prolapsus, respectivement.
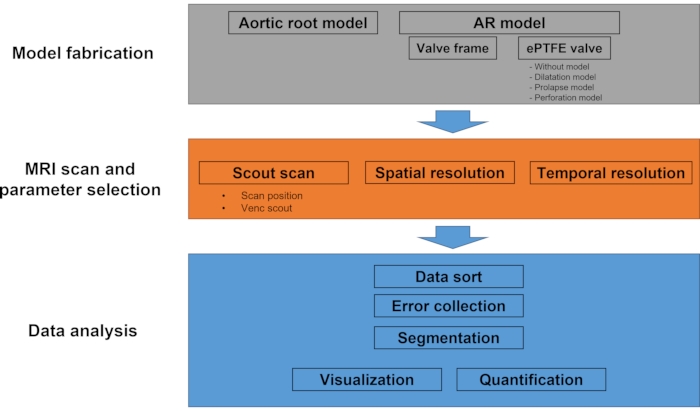
Figure 1 : Diagramme de flux de travail du protocole. Ce protocole expérimental comprend principalement la fabrication de modèles, l’IRM et l’analyse de données. Dans l’étape de fabrication du modèle, le modèle racine aortique externe et quatre types différents de modèle AR (sans valve, dilatation, prolapsus et perforation) sont fabriqués. Au cours de l’IRM, une imagerie scoute suivie d’un balayage multi-VENC et d’une IRM à flux 4D est effectuée. La partie analyse des données comprend le tri des données, la segmentation des images, le calcul de la vitesse, la visualisation et la quantification. Veuillez cliquer ici pour voir une version agrandie de cette figure.
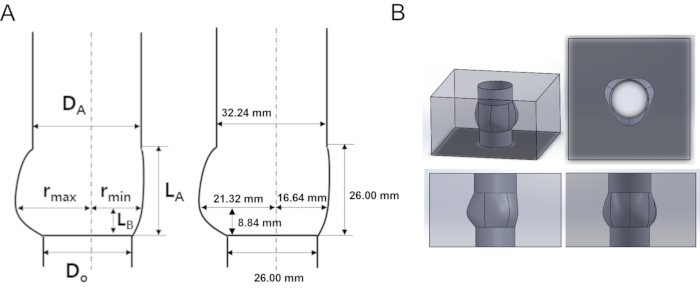
Figure 2 : Modèle acrylique schématique et conçu de la racine aortique (A) Caractérisation géométrique et paramètres de la géométrie de la racine aortique. (B) Modèle 3D racine aortique en vue multidimensionnelle. DA: diamètre de la jonction sinotubulaire (STJ), DO: diamètre de l’anneau, rmax: diamètre maximal du sinus, rmin: diamètre minimal du sinus, LA: hauteur du sinus, LB: hauteur du STJ. Veuillez cliquer ici pour voir une version agrandie de cette figure.
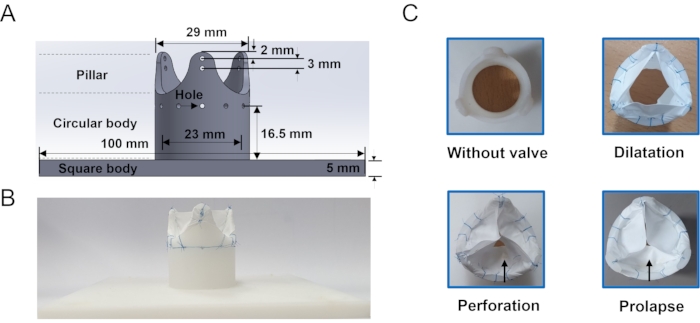
Figure 3 : Cadre et modèle de régurgitation aortique (A) Informations géométriques du cadre de la valve aortique utilisé pour tenir la feuillet. Les trous autour du corps du cadre sont l’endroit où passe la ligne de suture. (B) Exemple de valve suturée à membrane ePTFE. (C) Vue en face des modèles in vitro: sans valve, dilatation, perforation et prolapsus fabriqués dans la présente étude. La flèche indique la cuspide endommagée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
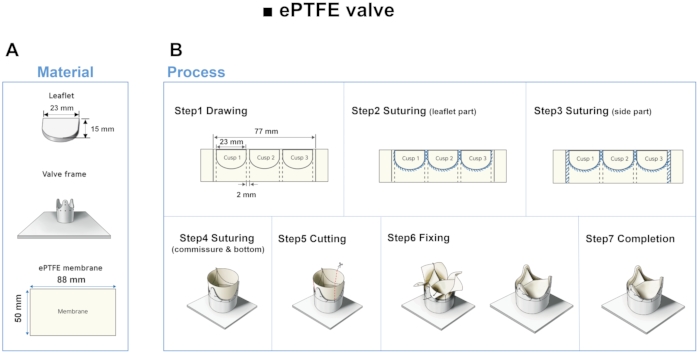
Figure 4: Matériau et étape de fabrication du dépliant ePTFE. (A) À l’aide de dépliants imprimés en 3D comme guide, les dépliants sont fabriqués à l’aide d’une membrane ePTFE. B) Étapes d’étirage, de suture, de découpe et de fixation de la vanne ePTFE. Veuillez cliquer ici pour voir une version agrandie de cette figure.
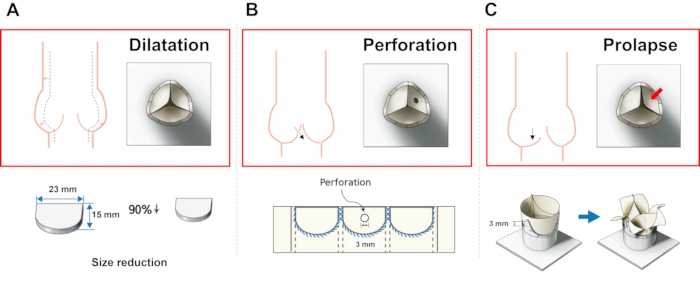
Figure 5: Méthodes de fabrication de différents modèles AR. (A) Modèle de dilatation, (B) Modèle de perforation et (C) Modèle de prolapsus. Veuillez cliquer ici pour voir une version agrandie de cette figure.
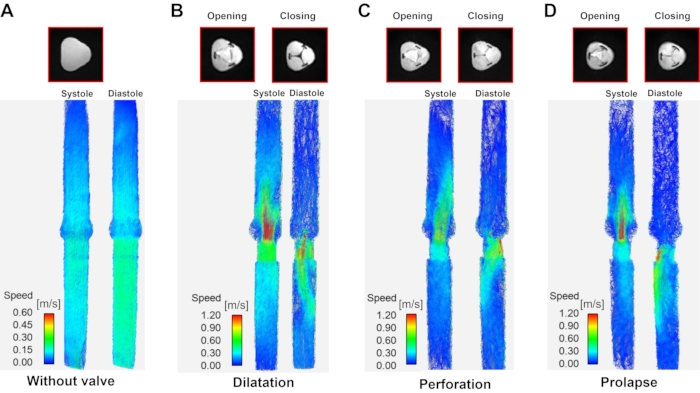
Figure 6 : Rationaliser la visualisation en fonction du type de régurgitation aortique. Une visualisation simplifiée au niveau de la systole (à gauche de chaque panneau) et de la diastole (à droite de chaque panneau) selon le type de régurgitation aortique. (A) Modèle sans valve (l’image diastole/systole est la même en raison de l’absence de valve), (B) dilatation, (C) perforation et (D) prolapsus. Les données sur les systoles et les diastoles ont été prises là où la vitesse d’entrée est la plus élevée et la plus faible pendant le cycle cardiaque. Veuillez cliquer ici pour voir une version agrandie de cette figure.
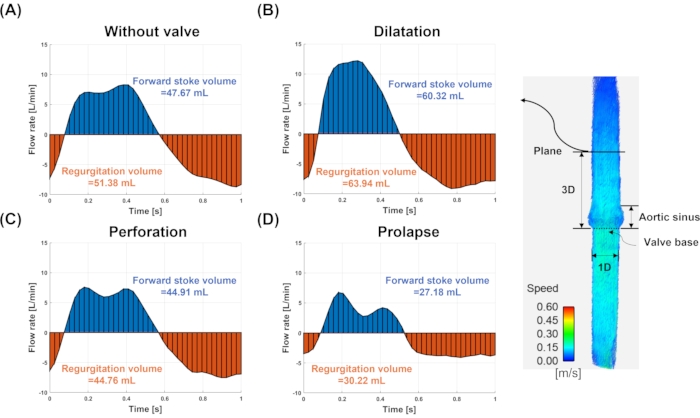
Figure 7 : Débit et volume de course. Le débit et le volume de course pour le modèle (A) sans valve, (B) dilatation, (C) perforation et (D) prolapsus. Le débit et le volume de course sont mesurés au niveau du plan (ligne continue) de trois diamètres en aval de l’anneau de la vanne. Les couleurs bleu et rouge indiquent les flux vers l’avant et régurgitants, respectivement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Ratio (Do= 26 mm) | DA/Do | LA/Do | LB/Do | rmax/Do | rmin/Do |
| 1.24 | 1 | 0.34 | 0.82 | 0.64 |
Tableau 1. Paramètres géométriques de la géométrie de la racine aortique illustrés à la figure 1.
| Résolution temporelle | 0,025 ms/40 phases |
| Résolution spatiale | 2mm x 2mm/0,5 pixel par 1 mm |
| Matrice | 96 x 160 x 26 pixels |
| Épaisseur de la tranche | 2 mm |
| Temps d’écho | 2,54 ms |
| Vitesse d’encodage | 25-330 cm/s |
Tableau 2. Paramètres de séquence IRM 4D Flow in vitro.
Discussion
L’IRM à flux quadridimensionnel a récemment été vérifiée par diverses études ex vivo et in vivo en tant qu’application pour une utilisation clinique de routine14. Comme l’IRM à flux 4D obtient des informations de vitesse 3D sur l’ensemble du cycle cardiaque, une application forte est une quantification directe du volume régurgitant valvulaire, que l’échocardiographie Doppler 2D conventionnelle n’est pas capable de quantifier15. Les expériences in vitro utilisant l’IRM 4D Flow peuvent fournir la vitesse d’écoulement 3D et les paramètres hémodynamiques connexes qui peuvent être utilisés pour étudier la relation entre les maladies cardiovasculaires et l’hémodynamique. Cependant, malgré sa capacité prometteuse, aucune étude systématique sur cette application n’a encore été rapportée. Cela est peut-être dû au manque d’expériences in vitro bien contrôlées qui imitent la régurgitation des valves à trois feuillets.
Les développements récents dans les études in vitro ont fourni des méthodes expérimentales plus précises et réalistes pour accéder à l’hémodynamique pré- et post-valvulaire16,17. Couplé à une vélocimétrie par image de particules (PIV) basée sur une image optique, une mesure et une quantification précises du débit autour de la valve ont été possibles dans des études in vitro antérieures18. Cependant, les champs d’écoulement 3D précis, en particulier pour l’écoulement post-valvulaire, ont été limités en raison du modèle opaque et de la réfraction. D’autre part, les mesures de vitesse 3D à l’aide de l’IRM ont également été limitées, car les composants métalliques ne peuvent pas être utilisés19,20.
Par conséquent, dans cette étude, un protocole pour construire une plate-forme expérimentale de flux compatible MR et hautement modifiable pour reproduire divers scénarios cliniques de maladies valvulaires est introduit. La membrane ePTFE est utilisée pour imiter la valve tricuspide sans composants métalliques car elle a été largement utilisée comme matériau de valve et de greffe vasculaire en raison de sa résistance élevée à la traction et de sa résistance chimique 17,21,22. Sur la base de films ePTFE, trois origines différentes de l’AR ont été reproduites (dilatation, perforation et prolapsus) ainsi qu’un modèle sans valve à des fins de comparaison. La prochaine étape importante de ce protocole expérimental de flux est l’imagerie et la quantification par résonance magnétique. Une pompe à piston contrôlée par moteur qui peut simuler les formes d’onde du flux sanguin aortique est utilisée pour générer une forme d’onde d’écoulement physiologique à travers le système de circuit d’écoulement. Les détails de la pompe à débit peuvent être trouvés dans l’étude précédente23. Comme cette étude vise également à valider la précision de l’IRM de flux 4D dans la quantification de flux, tous les paramètres d’imagerie sont sélectionnés sur la base de l’étude précédente qui résume les paramètres pouvant être utilisés dans la routine clinique24. Comme le système d’IRM comprend des erreurs inhérentes dues à des imperfections telles que les courants de Foucault et la non-linéarité du champ magnétique25, la stratégie de correction de fond est appliquée avant la quantification des données réelles décrite à l’étape 3.1.3.
Le modèle de régurgitation aortique fait à la main suggéré dans cette étude a montré des caractéristiques hémodynamiques similaires du jet régurgitant selon la classification du modèle que les études précédentes ont rapporté26,27. La forme fermée était symétrique et un jet droit se produisait au centre de la valve dans le modèle de dilatation. Un jet excentrique dirigé postérieurement apparaît en raison de dommages à la cuspide dans le modèle de perforation. Un prolapsus partiel de la valve montre un jet dont la direction a été pliée de la coupe du coupable en raison d’une mobilité limitée. Le volume de régurgitation aortique directement mesuré à l’aide de l’IRM à flux 4D a été surestimé dans le modèle sans valve et dilatation, alors qu’il a été largement sous-estimé dans le modèle de prolapsus par rapport à la vérité du sol. Cependant, lorsque la fraction régurgitante a été calculée, le biais le plus important n’était que de 11% dans le modèle du prolapsus. Cela indique fortement que non seulement le débit régurgitant, mais aussi le jet aortique normal ont été affectés par l’IRM. Au stade actuel, les paramètres d’analyse individuels n’étaient pas optimisés pour chaque modèle de RA. Une future étude des paramètres systémiques pourrait améliorer la précision de la mesure du volume des régurgitants. Alternativement, l’utilisation de la fraction régurgitante est plus robuste car elle annule les erreurs inhérentes à l’IRM à flux 4D, mais est également cliniquement plus pertinente que la simple mesure du volume absolu de régurgitant.
En conclusion, cette étude suggère un modèle expérimental de flux in vitro compatible MR qui est hautement modifiable pour simuler divers types de RA. En outre, la précision de la mesure du volume AR à l’aide de l’IRM de débit 4D a été comparée. La limite de cette étude est que le mouvement de la valve aortique n’a pas été simulé, ce qui peut affecter le développement réel du jet régurgitant. En outre, l’effet de volume partiel et la nature de la moyenne temporelle de l’IRM à débit 4D peuvent limiter la précision de la mesure du débit, en particulier compte tenu de la plage dynamique élevée de vitesse dans le jet et ses environs. Par conséquent, une étude systématique plus approfondie des paramètres est nécessaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été soutenue par le Programme de recherche scientifique fondamentale par l’intermédiaire de la Fondation nationale de la recherche de Corée, qui est financé par le ministère de l’Éducation (2021R1I1A3040346, 2020R1A4A1019475, 2021R1C1C1003481 et HI19C0760). Cette étude a également été soutenue par une subvention de recherche 2018 (PoINT) de l’Université nationale de Kangwon.
matériels
| Name | Company | Catalog Number | Comments |
| 3D modeling software(SolidWorks) | Dassault Systèmes SolidWorks Corporation | Waltham, MA, USA | |
| 3D printer | Zortrax S.A. | the construction of a three-dimensional object from a CAD model or a digital 3D model,(zortrax m200 plus, Zortrax S.A.,Olsztyn, Poland) | |
| Dicom sort | Open source software | Jonathan Suever, Software Engineer | |
| Ensight | Ansys | Flow visualization software (Canonsburg, PA, USA). | |
| Expanded Polytetrafluoroethylene(ePTFE) | SANG-A-FRONTEC | Medical membrane (ePTFE,SANG-A-FRONTEC, Incheon, korea) | |
| Itk snap software | Open source software | GNU General Public License, | |
| MATLAB | MathWorks | Natick, MA, USA | |
| MRI | Siemens | 3T, Erlangen, Germany | |
| Scissors | Scanlan International Inc | n43 1765 | 7007-454, Scanlan International Inc., Saint Paul, USA |
| Suture | AILEE | NB530 | Ailee, Polyamide suture, UPS 5-0 |
Références
- Koo, H. J., et al. Functional classification of aortic regurgitation using cardiac computed tomography: comparison with surgical inspection. The International Journal of Cardiovascular Imaging. 34 (8), 1295-1303 (2018).
- Bekeredjian, R., Grayburn, P. A. Valvular heart disease: aortic regurgitation. Circulation. 112 (1), 125-134 (2005).
- Lancellotti, P., et al. European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 1: aortic and pulmonary regurgitation (native valve disease). European Journal of Echocardiography. 11 (3), 223-244 (2010).
- Zo, J. H. Echocardiographic Evaluation of Valvular Regurgitation:Semiquantitation Based on the Color Flow is Enough in Everyday Clinical Practice. Korean Circulation Journal. 29 (10), 1144-1150 (1999).
- Falk, V., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Journal of Cardio-Thoracic Surgery. 52 (4), 616-664 (2017).
- Members, W. C., et al. ACC/AHA guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Journal of the American College of Cardiology. 77 (4), 25(2021).
- Ha, H., Huh, H., Yang, D. H., Kim, N. Quantification of Hemodynamic Parameters Using Four-Dimensional Flow MRI. Journal of the Korean Society of Radiology. 80 (2), 239-258 (2019).
- vander Geest, R. J., Garg, P. Advanced analysis techniques for intra-cardiac flow evaluation from 4D flow MRI. Current Radiology Reports. 4 (7), 38(2016).
- Blanken, C. P., et al. Quantification of mitral valve regurgitation from 4D flow MRI using semiautomated flow tracking. Radiology: Cardiothoracic Imaging. 2 (5), 200004(2020).
- Kim, B. G., et al. Evaluation of aortic regurgitation by using PC MRI: a comparison of the accuracies at different image plane locations. Journal of the Korean Physical Society. 61 (11), 1884-1888 (2012).
- de Tullio, M. D., Pedrizzetti, G., Verzicco, R. On the effect of aortic root geometry on the coronary entry-flow after a bileaflet mechanical heart valve implant: a numerical study. Acta Mechanica. 216 (1), 147-163 (2011).
- Fallahiarezoudar, E., Ahmadipourroudposht, M., Yusof, N. M. Geometric modeling of aortic heart valve. Procedia Manufacturing. 2, 135-140 (2015).
- Computational Engineering International. EnSight User Manual for Version 10.2. Computational Engineering International, Inc. , (2017).
- Garg, P., et al. Comparison of fast acquisition strategies in whole-heart four-dimensional flow cardiac MR: Two-center, 1.5 Tesla, phantom and in vivo validation study. Journal of Magnetic Resonance Imaging. 47 (1), 272-281 (2018).
- Gabbour, M., et al. 4-D flow magnetic resonance imaging: blood flow quantification compared to 2-D phase-contrast magnetic resonance imaging and Doppler echocardiography. Pediatric Radiology. 45 (6), 804-813 (2015).
- Kvitting, J. P. E., et al. et al. In vitro assessment of flow patterns and turbulence intensity in prosthetic heart valves using generalized phase-contrast MRI. Journal of Magnetic Resonance Imaging: An Official Journal of the International Society for Magnetic Resonance in Medicine. 31 (5), 1075-1080 (2010).
- Chang, T. I., et al. In vitro study of trileaflet polytetrafluoroethylene conduit and its valve-in-valve transformation. Interactive Cardiovascular and Thoracic Surgery. 30 (3), 408-416 (2020).
- Kim, D., et al. Comparison of Four-Dimensional Flow Magnetic Resonance Imaging and Particle Image Velocimetry to Quantify Velocity and Turbulence Parameters. Fluids. 6 (8), 277(2021).
- Bai, K., Katz, J. On the refractive index of sodium iodide solutions for index matching in PIV. Experiments in Fluids. 55 (4), 1-6 (2014).
- Hargreaves, B., et al. Metal induced artifacts in MRI. AJR. American Journal of Roentgenology. 197 (3), 547(2011).
- Zhu, G., Ismail, M. B., Nakao, M., Yuan, Q., Yeo, J. H. Numerical and in-vitro experimental assessment of the performance of a novel designed expanded-polytetrafluoroethylene stentless bi-leaflet valve for aortic valve replacement. PloS One. 14 (1), 0210780(2019).
- Ebnesajjad, S. Expanded PTFE applications handbook: Technology, manufacturing and applications. , William Andrew. (2016).
- Kim, J., Lee, Y., Choi, S., Ha, H. Pulsatile flow pump based on an iterative controlled piston pump actuator as an in-vitro cardiovascular flow model. Medical Engineering & Physics. 77, 118-124 (2020).
- Dyverfeldt, P., et al. 4D flow cardiovascular magnetic resonance consensus statement. Journal of Cardiovascular Magnetic Resonance. 17 (1), 1-19 (2015).
- Stankovic, Z., Allen, B. D., Garcia, J., Jarvis, K. B., Markl, M. 4D flow imaging with MRI. Cardiovascular Diagnosis and Therapy. 4 (2), 173(2014).
- Patel, P. A., et al. Aortic regurgitation in acute type-A aortic dissection: a clinical classification for the perioperative echocardiographer in the era of the functional aortic annulus. Journal of Cardiothoracic and Vascular Anesthesia. 32 (1), 586-597 (2018).
- Boodhwani, M., et al. Repair-oriented classification of aortic insufficiency: impact on surgical techniques and clinical outcomes. The Journal of Thoracic and Cardiovascular Surgery. 137 (2), 286-294 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon