Method Article
Évaluation des symptômes des patients atteints de rhinite allergique à l’aide d’une chambre d’exposition aux allergènes
Dans cet article
Résumé
Un protocole de provocation dans une installation de chambre d’exposition aux allergènes (CEA) est présenté. Les AEC se sont avérés être des outils sûrs et efficaces pour l’induction de symptômes allergiques ou comme critère d’évaluation dans les tests d’efficacité de l’immunothérapie allergénique en raison de leur capacité à maintenir des concentrations de particules et des conditions environnementales stables.
Résumé
Les chambres d’exposition aux allergènes (CEA) sont des installations cliniques qui permettent l’exposition des participants à des particules allergènes et non allergènes en suspension dans l’air. Ils fournissent des concentrations de particules stables dans des conditions environnementales contrôlées. Ceci est d’une grande importance à la fois à des fins de diagnostic et pour la surveillance des effets du traitement.
Ici, un protocole et les conditions techniques préalables pour effectuer une provocation allergénique sûre et efficace chez les sujets sensibilisés aux allergènes en suspension dans l’air (c.-à-d. les acariens de la poussière domestique [HDM]) dans l’AEC ALL-MED sont présentés. Avec cette méthode, le déclenchement des symptômes allergiques correspond à une exposition naturelle. Cela peut être utilisé pour un diagnostic d’allergie ou comme critère d’évaluation plausible dans les essais cliniques, en particulier pour l’immunothérapie allergénique (AIT). Un environnement contrôlé (température, humidité et dioxyde de carbone [CO2]) dans la chambre doit être maintenu. Les particules d’allergènes doivent être dispersées uniformément dans l’AEC à des niveaux stables tout au long du défi. Pour cette présentation, des patients atteints de rhinite allergique (RA) sensibles aux allergènes HDM ont été recrutés. Les symptômes de l’EI ont été évalués par les paramètres suivants : score total des symptômes nasaux (TNSS), rhinométrie acoustique (ARM), débit inspiratoire nasal maximal (PNIF) et poids de sécrétion nasale. La sécurité de la procédure a été évaluée par le débit expiratoire de pointe (DEP) et le volume expiratoire maximal dans la première seconde (VEMS1). Les sujets allergiques ont développé des symptômes dans les 120 minutes suivant l’essai. En moyenne, les symptômes les plus intenses sont apparus après 60-90 min et, après avoir atteint un plateau, sont restés stables jusqu’à la fin de l’essai.
Introduction
Les allergies aéroportées deviennent un problème social croissant. Un diagnostic approprié, l’évaluation de l’efficacité de l’immunothérapie spécifique aux allergènes (AIT) et la compréhension des pharmacothérapies sont des points clés pour résoudre ce problème. Cependant, la normalisation de ces procédures nécessite des concentrations d’allergènes stables, des conditions environnementales stables (p. ex. humidité et température) et la capacité de provoquer des signes allergiques de manière reproductible. Les chambres d’exposition aux allergènes (CEA) fournissent des conditions environnementales stables, indépendantes des facteurs externes, et la concentration de particules d’allergènes dispersées est bien contrôlée et stable pendant les défis dans les CEA 1,2.
Le test de provocation aux allergènes est la base du diagnostic des allergies aéroportées, car il fournit des preuves directes de la pertinence clinique d’un allergène spécifique pour les symptômes et la gravité de la maladie allergique. Les diagnostics allergiques classiques comprennent les provocations nasales, conjonctivales et bronchiques 3,4,5. Cependant, le test de provocation aux allergènes dans un AEC semble être le plus proche de l’exposition naturelle aux allergènes6.
Cette étude vise à présenter une méthode sûre et efficace pour défier les participants avec divers allergènes en suspension dans l’air dans un AEC pour déclencher des symptômes allergiques importants correspondant à une exposition naturelle. Cette méthode convient à l’induction des caractéristiques pathologiques des maladies respiratoires, y compris la rhinite allergique et l’asthme, en tant que critère d’évaluation dans les tests d’efficacité de l’EIA et pourrait contribuer et accélérer le développement clinique de traitements pharmacologiques 2,3,7,8,9,10.
Il existe plus d’une douzaine d’AEC dans le monde11. Cependant, les AEC ne sont pas comparables les uns aux autres parce qu’ils sont conçus individuellement, utilisent différents types d’allergènes (p. ex. acarien de la poussière domestique [HDM], pollen de bouleau, pollen de graminées, pollen de chat, d’herbe à poux ou de cèdre japonais) et ont des systèmes de mesure différents pour les particules distribuées 12,13,14,15,16,17,18,19 . Par conséquent, chaque AEC doit être validé pour des allergènes individuels. La validation AEC garantit que la concentration appropriée de l’allergène est sûre et que les symptômes sont induits chez les patients. L’AEC ALL-MED est validé pour les allergènes HDM20.
L’AEC ALL-MED est situé à l’Institut de recherche médicale de Wroclaw, en Pologne. L’établissement peut accueillir confortablement 15 à 20 personnes au cours d’un essai. L’installation se compose d’une pièce d’une superficie de 12 m2, à laquelle on accède par un sas pour empêcher les particules de l’environnement extérieur d’y pénétrer. L’équipement (sièges, murs, etc.) est composé de surfaces non adhésives, accessibles et pouvant être lavées, telles que le cuir écologique, le plastique et le métal. Les chaises sont mobiles, ce qui permet différentes configurations. La fenêtre de visualisation et la communication du microphone permettent une surveillance constante des sujets (Figure 1). L’accumulation de particules est mesurée par un compteur de particules laser (LPC). Les particules peuvent être classées dans différentes plages, y compris 0-20 μm, 20-50 μm et 50-100 μm, et les résultats sont donnés en particules par mètre cube (p / m3) pendant une unité de temps spécifiée (par exemple, chaque minute). Il y a deux salles accessoires à côté de l’AEC, où les patients subissent des tests avant d’entrer dans la chambre. L’équipement de sauvetage se compose d’un défibrillateur et d’autres dispositifs de réanimation logés dans l’établissement. Au moins deux travailleurs de la santé, dont un médecin, sont présents lors de chaque défi.
Protocole
Cet article présente un protocole qui adhère aux directives du Comité de bioéthique de l’Université médicale de Wroclaw en Pologne. Tous les participants étaient juridiquement capables et ont fourni un consentement éclairé écrit pour participer à l’étude. Ils ont également été informés qu’ils avaient la possibilité de se retirer à tout moment sans donner de raison.
1. Nettoyage de l’AEC
REMARQUE: Le nettoyage peut être effectué plus tôt que le jour de l’expérience.
- Passez l’aspirateur sur toutes les surfaces, y compris les meubles et le sol, avec un aspirateur à filtre à particules à haute efficacité (HEPA).
- Nettoyez toutes les surfaces lavables avec une lingette anti-humidité, y compris les meubles, les murs, les fenêtres et le sol.
- Allumez le compresseur, qui fait circuler l’air à travers le système AEC (conduit d’alimentation en allergènes).
- Allumez les ventilateurs de sol et de plafond afin que l’air entrant soit régulièrement mélangé dans des conditions turbulentes.
- Souffler le conduit d’alimentation en allergènes avec de l’air propre pendant 30 minutes en réglant la « longueur d’injection » et la « pause entre les injections » de la station de contrôle de l’alimentation à leurs valeurs maximales.
- Vérifiez la contamination par l’allergène en surveillant le nombre de particules sur le compteur de particules laser (LPC)21.
- Dans le menu principal, appuyez sur Configuration | Échantillon. Utilisez les paramètres suivants : échantillon pendant 1 min, 000 cycles, 0 min de retard, maintien pendant 0 min et unités de mètres cubes (m3).
REMARQUE: Le LPC commencera à compter les particules immédiatement, puis comptera les particules pendant 1 min sans intervalle entre chaque mesure. Le LPC mesurera les échantillons jusqu’à l’arrêt manuel, puis calculera les particules par mètre cube (p/m3). - Dans le menu principal, appuyez sur Configuration | Particules. Sélectionnez toutes les options.
REMARQUE: Le LPC mesurera toutes les particules jusqu’à 100 μm (plage complète). - Lisez le résultat dans le programme informatique (par exemple, LMS Express 7).
REMARQUE: La cabine est propre lorsque le nombre de particules par mètre cube (p / m 3) est inférieur à 50 p / m3 et que les particules sont comprises entre 0 et 100 μm pendant au moins 10 min.
- Dans le menu principal, appuyez sur Configuration | Échantillon. Utilisez les paramètres suivants : échantillon pendant 1 min, 000 cycles, 0 min de retard, maintien pendant 0 min et unités de mètres cubes (m3).
2. Fonctionnement de l’AEC
NOTE: L’atmosphère dans la cabine doit être régulièrement surveillée par un ingénieur, qui établit que les paramètres sont constants pendant l’essai. Les paramètres doivent être stabilisés avant l’entrée des participants.
- Environnement
- Mettez le compresseur sous tension, qui fait circuler l’air dans tout l’AEC.
- Réglez la température à 21 °C ± 0,5 °C sur le système de contrôle de la température (Table des matériaux).
NOTE: La température peut varier entre 18°C et 27°C, si nécessaire. - Allumez les ventilateurs tourbillonnants du sol et du plafond.
- Allumez l’humidificateur de la station de commande de l’alimentation (Tableau des matériaux).
- Réglez le renouvellement d’air par heure (ACH) entre 5 et 20 en réglant le bouton « alimentation en air » de la station de commande d’alimentation sur la position comprise entre 40% et 100%. Mesurez l’humidité relative et la concentration de CO2 à l’aide d’un compteur de qualité de l’air.
REMARQUE: L’air extérieur frais est aspiré via des filtres HEPA. Contrôler la concentration d’humidité relative (généralement de 40 % à 58 %) et de dioxyde de carbone (CO2) (inférieure à 900 parties par million [ppm]). Ajustez l’ACH de manière à ce que l’humidité et le CO2 se situent dans la plage normale. Les valeurs d’humidité et de CO2 sont très sensibles au nombre de participants.
- Réglez la température à 21 °C ± 0,5 °C sur le système de contrôle de la température (Table des matériaux).
- Génération et comptage des particules
NOTE: Des extraits allergènes standardisés et lyophilisés sont utilisés. Les particules sont injectées dans le conduit d’alimentation en air et soufflées dans l’AEC par un alimentateur contrôlé par ordinateur. La concentration en particules peut être ajustée entre 500/m3 et 10 000/m3. Une distribution homogène et spatialement stable des particules est obtenue par mélange turbulent pour s’assurer que les particules allergènes circulent au lieu de tomber et de s’accumuler sur le sol.- Réglez le LPC pour compter les particules pendant 1 min (répétez l’étape 1.6.1).
- Définissez la valeur des particules surveillées dans la plage de 0 à 20 μm. Dans le menu principal, appuyez sur Configuration | Particules. Cochez « 5, 10, 20 μm ». Le LPC mesurera toutes les particules dans la plage de 0 à 20 μm.
REMARQUE: Les particules peuvent être classées en plages, y compris 0-20 μm, 20-50 μm et 50-100 μm, si nécessaire pour surveiller un allergène différent. - Mettez l’allergène dans la mangeoire. Réglez la « longueur d’injection » sur 100 ms (plage de 10 à 200 ms) et la « pause entre les injections » sur 1,5 min (plage de 0,3 à 3,0 min) sur le poste de commande d’alimentation.
REMARQUE: Pour la validation ALL-MED AEC, des corps d’acariens Dermatophagoides pteronyssinus (Dp) séchés et purifiés (Tableau des matériaux) ont été utilisés pour le défi HMD, et 5 000 p / m3 était la concentration optimale20. - Surveillez le nombre de particules (p/m3). Ajustez les deux paramètres de manière continue en modifiant leurs valeurs.
- Une fois chaque essai terminé, téléchargez toutes les données mesurées (p/m3, concentration de CO2 ) de l’ordinateur vers un disque externe. Analysez les données (Figure 2).
3. Mesures de sécurité
- Testez les participants avec un test PCR pour le virus du coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2) 36-24 heures avant leur entrée dans l’AEC. N’autorisez que les participants ayant un résultat PCR négatif à entrer dans l’AEC.
REMARQUE: Cette étape n’est pas obligatoire et dépend des restrictions locales de la maladie à coronavirus 2019 (COVID-19). Les patients en cabine ne portent pas de masque de protection.
4. Examen en cabine et paramètres cliniques
REMARQUE : Pour connaître les critères d’inclusion et d’exclusion, ainsi que les caractéristiques des participants, voir le tableau supplémentaire 1. Les participants ont été exposés à des allergènes HDM à une concentration de 5 000 p/m3 pendant une durée de 120 min, selon la validation de l’ALL-MEDAEC 20.
- Désinfectez les mains des participants avant les examens, car les composants de l’appareil qu’ils touchent peuvent être une source de transmission d’infection. Cette recommandation est essentielle, en particulier lors d’une épidémie ou d’une pandémie de maladie virale.
- Surveiller constamment l’état des participants à travers la fenêtre de visualisation et être en contact vocal via le système de microphone (Table of Materials).
- Avant que le participant n’entre dans le CEA, demandez-lui de mettre une combinaison jetable munie d’une cagoule (tableau des matériaux) pour se prémunir contre l’infiltration de particules non allergènes et la contamination potentielle des vêtements.
- Avant que le participant n’entre dans l’AEC, fournissez-lui une boîte contenant tous les embouts jetables nécessaires à l’instrument à utiliser pendant l’examen : un embout de spirométrie et un bouchon nasal, un masque jetable à écoulement inspiratoire, un embout de débitmètre de pointe (PFM), des embouts ARM, une télécommande pour le questionnaire, un paquet de mouchoirs et un sac en plastique pour les risques biologiques pour la sécrétion nasale.
- Effectuez les critères d’évaluation cliniques en suivant les étapes ci-dessous. Répétez les modèles ARM, PNIF, PERF et FEV1 essais avant l’expérience et après 60 min et 120 min. S’assurer que les participants répondent au sondage TNSS toutes les 30 minutes (Graphique 3). Pour le confort des participants, effectuez les tests individuellement dans une salle adjacente à l’AEC.
REMARQUE: Pour des tests efficaces, demandez aux participants d’entrer dans la cabine à intervalles de 10 minutes. En conséquence, les mesures pour chaque sujet seront prises à différents moments réels, chaque patient passant un total de 120 minutes à l’intérieur de l’AEC. Le décalage horaire permet également aux membres du personnel d’aider et d’interagir avec les participants pendant le processus de test. Au total, l’AEC fonctionne pendant environ 210 min.- Sécrétion nasale (paramètre objectif)
NOTE: Les participants doivent avoir des paquets identiques de mouchoirs et de sacs en plastique. Cela est nécessaire pour comparer les poids.- Demandez aux participants de placer les mouchoirs usagés dans un sac en plastique. Une fois le défi de 2 heures terminé, demandez aux participants de placer les mouchoirs inutilisés dans le même sac. Si nécessaire, fournissez des mouchoirs en papier et des sacs en plastique supplémentaires.
- Ramassez tous les sacs une fois l’essai terminé. Déterminez le poids des sécrétions nasales en pesant les mouchoirs usagés dans les sacs en plastique. Soustrayez le poids des mouchoirs et des sacs de plastique inutilisés de chaque mesure pour obtenir le poids des sécrétions nasales (figure 4A).
- Enquête sur les symptômes nasaux (évaluation subjective)
- Affichez les questions de l’enquête sur l’écran du téléviseur.
- Demandez au patient de s’auto-évaluer avant le défi et toutes les 30 minutes pendant le défi en sélectionnant le numéro sur la télécommande qui correspond à la gravité de chaque symptôme (question). Évaluer les symptômes nasaux en fonction de l’enquête sur le score total des symptômes nasaux (TNSS) (tableau 1).
- Envoyez au participant un courriel avec le questionnaire TNSS. Demandez-leur de remplir le questionnaire à la maison 4 h et 24 h après le défi et de renvoyer les résultats.
- Une fois le défi terminé, téléchargez les réponses et calculez le score total de chaque sondage (Figure 4B).
- Rhinométrie acoustique (ARM) (paramètre objectif)
NOTE: Afin de calculer les différences de section transversale minimale (MCA), toutes les mesures d’un participant doivent être enregistrées dans un seul fichier. Sinon, l’analyse ne sera pas possible.- Effectuez le test trois fois : avant le défi, 60 min après le défi et 120 min après le défi.
- Placez l’extrémité appropriée de la tête du rhinomètre contre la narine (bleu pour la narine gauche). Vérifiez s’il est serré. Demandez au participant de retenir sa respiration pendant 3 secondes, puis commencez le programme.
REMARQUE: En cas de résultat peu clair, répétez le test. - Répétez pour l’autre narine avec l’embout approprié (rouge pour la narine droite).
- Une fois le défi terminé, calculez le MCA (Figure 4C).
- Débit inspiratoire nasal maximal (PNIF) (paramètre objectif)
REMARQUE : Le PNIF mesure directement le débit d’air nasal lors de l’inspiration maximale et détermine le degré d’obstruction nasale.- Effectuez le test trois fois : avant le défi, 60 min après le défi et 120 min après le défi.
- Demandez au participant de dégonfler profondément ses poumons. Ensuite, placez le masque inspiratoire jetable relié au débitmètre sur leur visage et demandez-leur d’inspirer par le nez au maximum (Figure 4D).
- Assurez-vous que le débitmètre inspiratoire est en position horizontale pendant toute la durée de l’essai. Enregistrez la moyenne de la meilleure des trois mesures.
- Débit expiratoire de pointe PEFR (paramètre de sécurité)
REMARQUE: Le DEP est un indicateur fiable de l’adéquation de la ventilation ainsi que de l’obstruction du flux d’air.- Effectuez le test trois fois : avant le défi, 60 min après le défi et 120 min après le défi.
- Demandez au participant de respirer aussi profondément que possible, de mettre ses lèvres autour de l’embout jetable de la matière à débit maximal et d’expirer rapidement et avec force (Figure 4E).
- Enregistrez la moyenne de la meilleure des trois mesures.
- Une fois le défi terminé, fournissez au participant un PFM. Demandez-leur d’effectuer le test à la maison 4 h et 24 h après le défi et de renvoyer les résultats.
- Spirométrie (paramètre pulmonaire de sécurité)
REMARQUE: La spirométrie est effectuée conformément aux normes de la Société respiratoire européenne (ERS)22 pour évaluer la sécurité et surveiller une éventuelle obstruction bronchique23.- Effectuez le test trois fois : avant le défi, 60 min après le défi et 120 min après le défi.
- Avant la mesure, réglez les paramètres sur le spiromètre pour chaque participant : sexe, âge, poids et taille.
- Demandez au participant de s’asseoir et de mettre le bouchon nasal. Ensuite, demandez au participant de placer ses lèvres autour de l’embout jetable du spiromètre et de respirer calmement et prudemment.
- Demandez au participant de prendre une profonde respiration et une forte expiration sans retard inutile, qui ne peut être interrompue que lorsque le spiromètre donne un signal. Répétez 3x.
- Après avoir examiné tous les participants, téléchargez les résultats et notez le volume expiratoire maximal dans la première seconde (VEMS1) (Figure 4F).
- Sécrétion nasale (paramètre objectif)
- Si le bien-être ou les paramètres de sécurité du participant se détériorent considérablement pendant la provocation allergène, arrêtez immédiatement le test.
- Gardez les participants en sécurité et à l’aise après avoir quitté l’installation AEC en leur fournissant des médicaments de secours (si nécessaire).
- Effectuez des appels de suivi de sécurité avec chaque participant 24 heures après le défi.
Résultats
L’environnement AEC a été surveillé tout au long de la durée de l’opération pour le nombre d’allergènes (p / m3), la température, l’humidité et la concentration de CO 2 (figure 2). Les concentrations d’allergènes HDM se sont avérées stables (figure 2A). De plus, un essai dans lequel aucun allergène n’a été distribué est présenté, avec des particules comprises entre 0 et 20 μm et un nombre maximal de particules de 50 p/m3 (Figure 2A). Il y a eu un afflux de particules provenant des participants entrant dans l’AEC, ce qui a entraîné environ 100 p/m3 pour les 15 participants par rapport à une chambre vide. En conséquence, les valeurs mesurées par le LPC au cours de l’essai comprenaient la concentration cible avec un afflux d’environ 100 p/m3.
Les données appariées ont été comparées au test U de Mann-Whitney. Les valeurs ont été considérées comme statistiquement significatives pour tous les tests avec p < 0,05. Des calculs statistiques ont été effectués et des graphiques ont été générés à l’aide d’un programme graphique.
Deux groupes ont été inclus dans l’étude pour montrer la différence entre les résultats positifs et négatifs: huit personnes allergiques au MHH présentant des symptômes de rhinite allergique (RA) et sept personnes témoins en bonne santé (HC) sans allergies. Le tableau supplémentaire 1 présente les critères d’inclusion et d’exclusion, ainsi que les caractéristiques des participants. Les participants ont été exposés au HDM à une concentration de 5 000 p/m3 pendant une durée de 120 min, selon la validation de l’ALL-MEDAEC 20.
Tous les participants ont subi les tests suivants (ARM, PNIF, PERF, spirométrie) et ont répondu aux questions TNSS, et leurs écoulements nasaux ont été recueillis. Le TNSS et le poids de l’écoulement nasal étaient significativement plus élevés chez les personnes AR que chez le groupe SC (figure 4A, B). Le TNSS a atteint les valeurs maximales après 60 minutes d’exposition, puis s’est stabilisé (p < 0,0001). De plus, le poids de la sécrétion nasale était significativement plus élevé dans le groupe AR (p < 0,0001). Une altération de la perméabilité des voies respiratoires a été remarquée dans la rhinométrie acoustique. Le MCA a significativement diminué après la première mesure à 60 min en comparant le groupe AR au groupe HC. À partir de ce moment et jusqu’à la fin du défi, les valeurs sont restées stables (p < 0,001). Cela concorde avec les mesures du PNIF, pour lesquelles une réduction significative a été observée aux mêmes concentrations (p < 0,01) (figure 4C,D).
Le VEMS1 et le DEP ont été mesurés lors de la provocation AEC (Figure 4E,F). De plus, les participants ont mesuré leur DEP à domicile 4 h et 24 h après le défi et ont renvoyé les résultats par la poste. Les valeurs étaient dans la plage normale et sont restées stables pendant le défi et jusqu’à 24 heures par la suite. Aucune différence statistiquement significative n’a été observée entre les sujets allergiques atteints d’EI et les HC, ce qui suggère que l’exposition à l’allergène HDM n’a eu aucun effet sur la fonction pulmonaire dans les deux groupes.
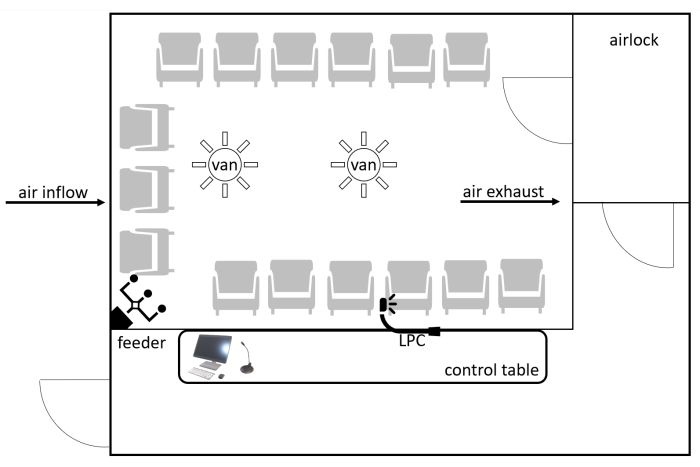
Figure 1 : Schéma de l’AEC. Les participants entrent par le sas. Les particules sont distribuées à travers le système de bouches d’aération par un alimentateur contrôlé par ordinateur. Les conditions AEC (concentration de particules, concentration de CO2, humidité et température) sont constamment surveillées par un LPC. Les participants sont surveillés par la fenêtre et la connexion vocale. Abréviations : AEC = chambre d’exposition aux allergènes; CO2 = dioxyde de carbone; LPC = compteur de particules laser. Veuillez cliquer ici pour voir une version agrandie de cette figure.
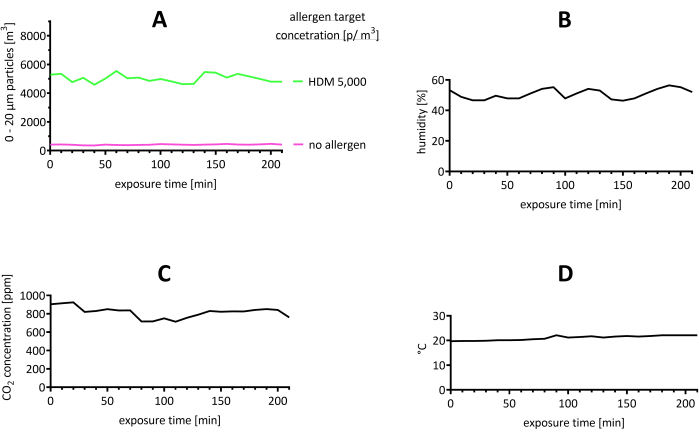
Figure 2 : Résultats représentatifs de la stabilité de l’environnement dans l’AEC pendant l’essai. (A) La concentration de particules a été évaluée et s’est avérée comprise entre 0 et 20 μm par le LPC. La valeur cible pour la concentration d’allergènes HDM était de 5 000 p/m3. À titre de comparaison, un essai dans lequel aucun allergène n’a été utilisé est présenté. (B) L’humidité, (C) la concentration de CO2, et (D) et la température sont indiquées. Abréviations : °C = degrés Celsius; CO2 = dioxyde de carbone; HDM = acariens de la poussière domestique; LPC = compteur de particules laser; m = mètre; min = minute(s); p = particules; ppm = parties par million. Veuillez cliquer ici pour voir une version agrandie de cette figure.
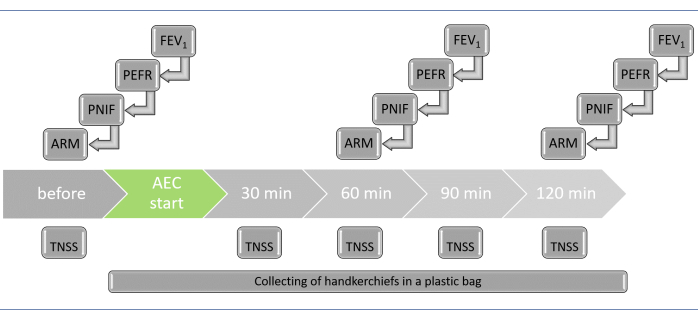
Figure 3 : Liste des tests à effectuer pendant le défi AEC, avec des points temporels (pour chaque participant). Pour assurer l’exécution en temps opportun des tests individuels, les participants doivent entrer dans l’AEC toutes les 10 minutes. En conséquence, le test pour chaque participant sera effectué à différents moments réels. De plus, le décalage horaire permet au personnel d’aider les participants pendant les tests. Abréviations : AEC = chambre d’exposition aux allergènes; ARM = rhinométrie acoustique; VEMS1 = volume expiratoire maximal à la première seconde; DEP = débit expiratoire de pointe; PNIF = débit inspiratoire nasal de pointe; TNSS = score total des symptômes nasaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
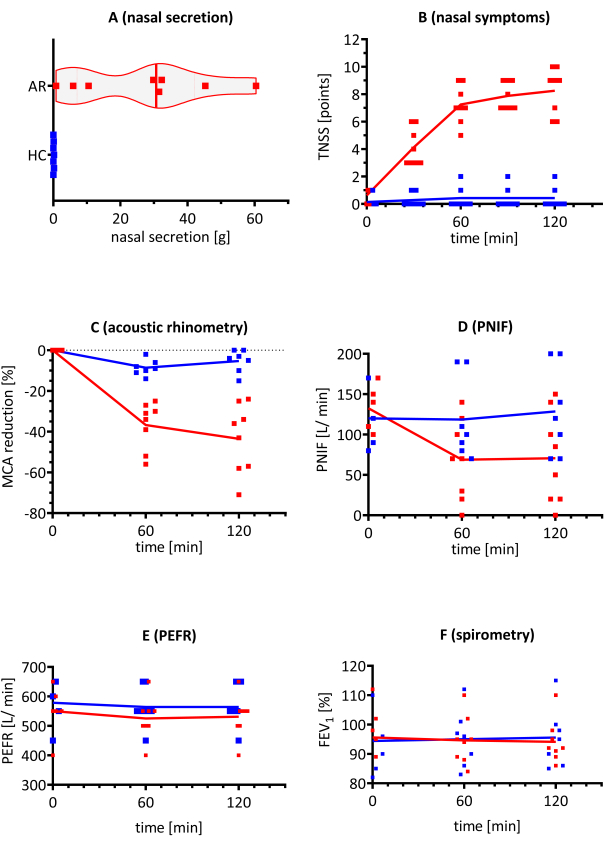
Figure 4 : Résultats représentatifs de différents critères d’évaluation au cours de la provocation par AEC chez les patients atteints d’EI (barres rouges) et de HC (barres bleues). Les sujets allergiques déclenchés par HMD (avec AR) et HC, y compris huit et sept participants, respectivement, ont été exposés à des concentrations d’allergènes HDM de 5 000 p / m3 dans l’AEC. (A) Poids de la sécrétion nasale, (B) symptômes nasaux, (C) MCA dans la rhinométrie acoustique, (D) PNIF, (E) PEFR et (F) FEV1 ont été évalués. Les résultats sont présentés sous forme de répliques individuelles avec la valeur moyenne. Abréviations : AEC = chambre d’exposition aux allergènes; AR = rhinite allergique; VEMS1 = volume expiratoire maximal à la première seconde; SC = témoins en santé; HDM = acariens de la poussière domestique; g = gramme(s); MCA = section transversale minimale; p = particules; DEP = débit expiratoire de pointe; PNIF = débit inspiratoire nasal de pointe; TNSS = score total des symptômes nasaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Symptôme | question affichée sur un écran de télévision | Score TNSS pour chaque symptôme |
| rhinorrhée | Évaluez comment votre nez coule a été en ce moment | 0 = aucun (symptôme complètement absent) |
| obstruction nasale | Évaluez comment votre congestion nasale a été en ce moment | 1 = léger (symptôme présent, mais pas pénible) |
| Éternuer | Évaluez comment vos éternuements ont été en ce moment | 2 = modéré (symptôme pénible, mais tolérable) |
| démangeaisons nasales | Évaluez comment vos démangeaisons nasales ont été en ce moment | 3 = grave (symptôme difficilement tolérable, intensité maximale) |
| 0 - 12 points au total |
Tableau 1 : Symptômes et méthode de score pour TNSS. Un système d’évaluation a été utilisé par les participants pour évaluer quatre symptômes. Les résultats de l’enquête sont présentés sous la forme d’une valeur - un score total pour les quatre questions pour un temps donné (avant l’essai et toutes les 30 minutes de l’essai). Abréviation : TNSS = score total des symptômes nasaux.
Tableau supplémentaire 1 : Critères d’inclusion et d’exclusion de l’étude et caractéristiques des participants inscrits à l’étude. Huit patients présentant des symptômes d’AR, déclenchés par HDM, et sept patients sans symptômes (HC). Abréviations : AR = rhinite allergique; Df = Dermatophagoides farinae; Dp = Dermatophagoides pteronyssinus; F = femelle; HC = contrôle sain; HDM = acariens de la poussière domestique; kU/L = kilo unités/litre; M = mâle; md = diamètre moyen; sIgE = immunoglobuline E spécifique; SPT = test cutané. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Il existe un nombre limité d’installations AEC opérant dans le monde. Une variété d’allergènes ont été testés dans ces installations, les plus courants étant le pollen d’herbe à poux, le pollen de bouleau, le pollen de graminées, le pollen de cèdre japonais et le HDM. Les AEC ne sont pas classés comme médicaments (conformément à la directive 2001/83/CE) ou dispositifs médicaux (conformément à la directive 93/42/CEE relative aux dispositifs médicaux)24. Les CEA sont considérés comme un outil possible pour la mesure des critères d’évaluation primaires dans les études de détermination de la dose conformément aux lignes directrices de l’Agence européenne des médicaments (EMA) pour le développement de produits AIT25,26.
Étapes critiques du protocole
Il est essentiel de fournir des concentrations d’allergènes stables et suffisamment élevées tout au long de l’essai dans l’AEC. La recherche montre que les patients atteints d’EI ne développent pas de symptômes allergiques à de faibles concentrations d’allergènes20. Même des concentrations modérées d’allergènes ne déclenchent pas de symptômes pertinents27. Des concentrations très élevées peuvent provoquer des réactions graves, telles que la bronchoconstriction. Par conséquent, des concentrations optimales et durables d’allergènes sont essentielles à la réussite d’un essai. Étant donné que les CEA varient (comme décrit dans l’introduction), chaque allergène utilisé doit être validé. L’AEC ALL-MED est validé pour l’allergène HDM. Il a été constaté que le critère optimal pour l’évaluation des symptômes était de 120 minutes, car les symptômes atteignaient un plateau après 60-90 min. Le temps de provocation optimal et la concentration d’allergènes ont été sélectionnés en fonction des défis avec différentes concentrations de HMD à différents moments20. Notamment, des symptômes aigus peuvent survenir après une provocation allergène, en particulier une exacerbation de l’asthme.
Selon le protocole, les participants remplissent des enquêtes TNSS à cinq moments de l’essai. Il est essentiel qu’ils ne voient pas leurs réponses précédentes afin d’éviter l’autosuggestion. Par conséquent, si les questionnaires sont remplis sur papier, les questionnaires remplis doivent être recueillis immédiatement.
Modifications et dépannage de la méthode
Différents critères d’évaluation cliniques peuvent être utilisés en fonction du symptôme à observer pendant la provocation (p. ex., le score total des symptômes oculaires [TOSS] pour évaluer la rhinoconjonctivite ou le score des symptômes non nasaux [NNSS] pour l’évaluation du système respiratoire).
La rhinomanométrie pourrait être utilisée comme alternative à la rhinométrie acoustique. Les deux méthodes sont utilisées pour tester objectivement la perméabilité nasale. La rhinomanométrie est un test standard pour les fosses nasales. Il permet une évaluation objective de la perméabilité des voies nasales en mesurant la résistance dans la cavité nasale pendant l’inhalation et l’expiration. La rhinométrie acoustique est l’étude du volume des cavités nasales. La perméabilité de la cavité nasale est évaluée par une onde ultrasonore. Il n’y a pas de données disponibles sur la méthode la plus précise pour les défis AEC28,29.
Une collecte de liquide nasal à partir d’une seule éponge en mousse et des mesures de niveau spécifique d’IgA1, IgA2, IgG, IgG, IgG4 et IgE représentent des tests supplémentaires qui peuvent être effectués pendant la provocationAEC 30,31. Les cellules mononucléées du sang sérique et périphérique (PBMC) peuvent également être collectées pour déterminer davantage les mécanismes moléculaires de l’AIT.
Les patients ne sont pas autorisés à utiliser des médicaments qui peuvent influencer l’apparition des symptômes allergiques. Les classes les plus importantes, ainsi que les délais minimaux entre la dernière dose et la provocation par l’AEC, sont les antihistaminiques (7 jours), les corticostéroïdes inhalés et/ou intranasaux (14 jours); cromolyne inhalée et/ou intranasale (14 jours) et corticostéroïdes systémiques et/ou astémizole (30 jours)18.
Limites de la méthode
Le test de provocation AEC est plus coûteux que les tests de provocation directe (nasale, conjonctivale et bronchique), ce qui signifie qu’il n’est pas utilisé dans la pratique quotidienne. Les AEC diffèrent en termes de sources de l’allergène, de mesure des particules distribuées et de temps d’essai, ce qui rend très difficile la comparaison des études. Lorsque des allergènes HDM ont été utilisés dans l’AEC, différentes sources de matériaux ont été appliquées: Der p 1 et Der f 1, Dp matières fécales contenant principalement Der p1 avec un rapport prédéterminé de 20:1 de Der p 1 à Der p 232, allergène HDM SQ 503 provenant du corps et des matières fécales contenant Der p 1 et Der p 233, et extraits de Dp. Dans l’ALL-MED AEC, des corps d’acariens Dp séchés et purifiés, y compris Der p 1 et Der p 2, ont été utilisés20. Par conséquent, des normes unifiées devraient être introduites à l’avenir afin que les résultats puissent être comparés entre les AEC.
L’importance de la méthode par rapport aux méthodes existantes/alternatives
Les AEC sont une méthode in vivo très utile mais sous-représentée dans le diagnostic des allergies. De plus, en tant que critère d’évaluation des essais cliniques, les AEC montrent une supériorité significative par rapport aux évaluations classiques « sur le terrain ». Il est intéressant d’examiner les corrélations entre les différents critères d’évaluation cliniques, en particulier la similitude des paramètres subjectifs évalués par les patients (TNSS) et des mesures objectives (rhinométrie acoustique, PNIF, écoulement nasal) recueillies par l’investigateur, comme première étape de validation des résultats de l’AEC par rapport à ceux obtenus sur le terrain.
Applications ou orientations futures de la méthode
Les AEC offrent une méthode possible pour la stratification des patients en répondeurs potentiels et non-répondeurs. Cette méthode est très prometteuse pour accélérer les développements cliniques tant en pharmacothérapie qu’en immunothérapie des maladies allergiques34. Ainsi, les AEC ont été l’un des principaux domaines d’intérêt ces dernières années. Les CAE pourraient être utiles dans les études à long terme lorsqu’il n’est pas possible d’évaluer l’exposition naturelle en raison d’un faible nombre d’allergènes.
Déclarations de divulgation
Marek Jutel déclare des honoraires personnels d’ALK-Abello, Allergopharma, Stallergenes, Anergis, Allergy Therapeutics, Leti, HAL, GSK, Novartis, Teva, Takeda et Chiesi. Les autres auteurs n’ont rien à divulguer.
Remerciements
La publication a été préparée dans le cadre d’un projet financé par des fonds accordés par le ministère de la Science et de l’Enseignement supérieur dans le cadre du programme « Initiative régionale d’excellence » pour les années 2019-2022, numéro de projet 016/RID/2018/19, du montant du financement 11 998 121,30 PLN et de la subvention SUB. A020.21.018 de l’Université de médecine de Wroclaw, Pologne.
matériels
| Name | Company | Catalog Number | Comments |
| Allergen exposure chamber (AEC) | custom made | --- | with the air supply duct (with HEPA filters) and allergen blew into the AEC through a computer-controlled feeder |
| Acoustic rhinometer | GM Instruments (Irvine, UK) | A1 clinical/ reseach | with reusable plastic tips, contoured for the right and left nostrils |
| Air humidifier | Ohyama | SHM120D | |
| Air quality meter | AZ Instrument | Green Eye VZ 7798 | termometer, humidity and CO2 meter |
| Air-conditioning | DeLonghi | CKP 20EB | temperature range 18 - 25 °C |
| Ceiling fans | Argos | Manhattan Ceiling Fan - 432/8317 | |
| Computer-controlled feeder station | custom made | --- | with control of "injection length", "break between injections ", “air supply” |
| Disposable coveralls | VWR (Radnor, Pennsylvania, United States) | with hoodies | |
| Floor fans | AEG | TVL 5537, column | |
| Graphing program | GraphPad Software Inc. | Graph Pad Prism, v. 9.4.0 | |
| House dust mite (HDM) | Allergopharma (Reinbek, Germany) | customized order | dried, purified Dermatophagoides pteronyssinus (Dp) mite bodies, stored at 4 °C until use |
| Inspiratory flow meter | Clement Clarke International Ltd. (Harlow, UK) | portable inspiratory flow meter | with the disposable mask (size M), measuring inspiratory flow between 30 - 370 L/ min |
| Laser particle counter (LPC) | Lighthouse Worldwide Solutions (USA) | SOLAIR Boulder Counte | |
| Microphone system | Auna | VHF wireless microphone system | |
| Peak flow matter (PFM) | CareFusion (Basingstoke, UK) | MicroPeak with a standard range of 60 – 900 L/ min | with the disposable paper tips |
| Remote controls for filling questionnaires | Turning Technologies | Pilot TT ResponseCard LT, SAP: G040602A010 | a set of 32 remote controls for TT LT tests |
| Spirometer | Medizintechnik AG (Zurich, Switzerland) | EasyOne 2001, NDD | with the disposable paper tips; the spirometer should meet the ISO 26 782: 2009 standard; daily calibration of the spirometer is required |
| TV screen | Level | Level one 32" | |
| Vacuum | Siemens | extreme silencePower VSQ5X1230 | with the HEPA filters |
Références
- Clark, D., Karpecki, P., Salapatek, A. M., Sheppard, J. D., Brady, T. C. Reproxalap improves signs and symptoms of allergic conjunctivitis in an allergen chamber: A real-world model of allergen exposure. Clinical Ophthalmology. 16, 15-23 (2022).
- Hossenbaccus, L., Steacy, L. M., Walker, T., Ellis, A. K. Utility of environmental exposure unit challenge protocols for the study of allergic rhinitis therapies. Current Allergy and Asthma Reports. 20 (8), 34(2020).
- Hossenbaccus, L., Ellis, A. K. The use of nasal allergen vs allergen exposure chambers to evaluate allergen immunotherapy. Expert Review of Clinical Immunology. 17 (5), 461-470 (2021).
- Schröder, J., Mösges, R. Conjunctival provocation tests: Prediction of seasonal allergy. Current Opinion in Allergy and Clinical Immunology. 18 (5), 393-397 (2018).
- Gauvreau, G. M., et al. Allergen provocation tests in respiratory research: Building on 50 of experience. European Respiratory Journal. 60 (2), 2102782(2022).
- Hohlfeld, J. M., et al. Diagnostic value of outcome measures following allergen exposure in an environmental challenge chamber compared with natural conditions. Clinical and Experimental Allergy. 40 (7), 998-1006 (2010).
- Rösner-Friese, K., Kaul, S., Vieths, S., Pfaar, O. Environmental exposure chambers in allergen immunotherapy trials: Current status and clinical validation needs. The Journal of Allergy and Clinical Immunology. 135 (3), 636-643 (2015).
- Jacobs, R. L., et al. Responses to ragweed pollen in a pollen challenge chamber versus seasonal exposure identify allergic rhinoconjunctivitis endotypes. The Journal of Allergy and Clinical Immunology. 130 (1), 122-127 (2012).
- Khayath, N., et al. Validation of Strasbourg environmental exposure chamber (EEC) ALYATEC® in mite allergic subjects with asthma. Journal of Asthma. 57 (2), 140-148 (2020).
- Bousquet, J., et al. Onset of action of the fixed combination intranasal azelastine-fluticasone propionate in an allergen exposure chamber. The Journal of Allergy and Clinical Immunology: In Practice. 6 (5), 1726-1732 (2018).
- Pfaar, O., et al. Technical standards in allergen exposure chambers worldwide - An EAACI Task Force Report. Allergy. 76 (12), 3589-3612 (2021).
- Rønborg, S. M., Mosbech, H., Poulsen, L. K. Exposure chamber for allergen challenge. A placebo-controlled, double-blind trial in house-dust-mite asthma. Allergy. 52 (8), 821-828 (1997).
- Yang, W. H., et al. Cat allergen exposure in a naturalistic exposure chamber: A prospective observational study in cat-allergic subjects. Clinical and Experimental Allergy. 52 (2), 265-275 (2022).
- Hamasaki, S., et al. Characteristics of the Chiba environmental challenge chamber. Allergology International. 63 (1), 41-50 (2014).
- Okuma, Y., et al. Persistent nasal symptoms and mediator release after continuous pollen exposure in an environmental challenge chamber. Annals of Allergy, Asthma & Immunology. 117 (2), 150-157 (2016).
- Zuberbier, T., et al. Global Allergy and Asthma European Network (GA(2)LEN) European Union Network of Excellence in Allergy and Asthma. Validation of the Global Allergy and Asthma European Network (GA2LEN) chamber for trials in allergy: Innovation of a mobile allergen exposure chamber. Journal of Allergy and Clinical Immunology. 139 (2), 1158-1166 (2017).
- Bergmann, K. C., et al. First evaluation of a symbiotic food supplement in an allergen exposure chamber in birch pollen allergic patients. World Allergy Organization Journal. 14 (1), 100494(2020).
- Ellis, A. K., Steacy, L. M., Hobsbawn, B., Conway, C. E., Walker, T. J. Clinical validation of controlled grass pollen challenge in the Environmental Exposure Unit (EEU). Allergy, Asthma, and Clinical Immunology. 11 (1), 5(2015).
- Day, J. H., Briscoe, M., Widlitz, M. D. Cetirizine, loratadine, or placebo in subjects with seasonal allergic rhinitis: Effects after controlled ragweed pollen challenge in an environmental exposure unit. Journal of Allergy and Clinical Immunology. 101 (5), 638-645 (1998).
- Zemelka-Wiacek, M., Kosowska, A., Winiarska, E., Sobanska, E., Jutel, M. Validated allergen exposure chamber is plausible tool for the assessment of house dust mite-triggered allergic rhinitis. Allergy. 78 (1), 168(2022).
- Lighthouse World Solutions. , Available from: https://www.golighthouse.com (2022).
- Graham, B. L., et al. Standardization of Spirometry 2019 Update. An Official American Thoracic Society and European Respiratory Society Technical Statement. American Journal of Respiratory and Critical Care Medicine. 200 (8), 70-88 (2019).
- Buslau, A., et al. Can we predict allergen-induced asthma in patients with allergic rhinitis. Clinical and Experimental Allergy. 44 (12), 1494-1502 (2014).
- European Medicines Agency. Guideline for clinical development of allergen immunotherapy products CHMP/EWP/18504/2006. European Medicines Agency. , (2006).
- Pfaar, O., et al. Recommendations for the standardization of clinical outcomes used in allergen immunotherapy trials for allergic rhinoconjunctivitis: An EAACI Position Paper. Allergy. 69 (7), 854-867 (2014).
- Committee for Medicinal Products for Human Use (CHMP). Guideline on the clinical development of products for specific immunotherapy for the treatment of allergic diseases. European Medicines Agency. , (2008).
- Krug, N., et al. Validation of an environmental exposure unit for controlled human inhalation studies with grass pollen in patients with seasonal allergic rhinitis. Clinical and Experimental Allergy. 33 (12), 1667-1674 (2003).
- Passali, D., Bellussi, L. Monitoring methods for local nasal immunotherapy. Allergy. 52 (33), 22-25 (1997).
- Keck, T., Wiesmiller, K., Lindemann, J., Rozsasi, A. Acoustic rhinometry in nasal provocation test in perennial allergic rhinitis. European Archives of Oto-rhino-laryngology. 263 (10), 910-916 (2006).
- Shamji, M. H., et al. Differential induction of allergen-specific IgA responses following timothy grass subcutaneous and sublingual immunotherapy. Journal of Allergy and Clinical Immunology. 148 (4), 1061-1071 (2021).
- Thwaites, R. S., et al. Absorption of nasal and bronchial fluids: Precision sampling of the human respiratory mucosa and laboratory processing of samples. Journal of Visualized Experiments. (131), e56413(2018).
- Zieglmayer, P., et al. Clinical validation of a house dust mite environmental challenge chamber model. Journal of Allergy and Clinical Immunology. 140 (1), 266-268 (2017).
- Lueer, K., et al. efficacy and repeatability of a novel house dust mite allergen challenge technique in the Fraunhofer allergen challenge chamber. Allergy. 71 (12), 1693-1700 (2016).
- Pfaar, O., et al. Allergen exposure chambers: Harmonizing current concepts and projecting the needs for the future - An EAACI Position Paper. Allergy. 72 (7), 1035-1042 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon