Method Article
Description d’un modèle porcin de choc hémorragique à volume contrôlé
Dans cet article
Résumé
Cet article vise à fournir aux chercheurs un guide détaillé et accessible pour la mise en place d’un modèle porcin infantile de choc hémorragique.
Résumé
Le choc hémorragique est l’une des principales causes de morbidité et de mortalité chez les patients pédiatriques. L’interprétation des indicateurs cliniques validés chez l’adulte pour guider la réanimation et la comparaison entre les différentes thérapies est difficile chez l’enfant en raison de l’hétérogénéité inhérente à cette population. Par conséquent, par rapport aux adultes, la prise en charge appropriée du choc hémorragique pédiatrique n’est pas encore bien établie. De plus, la rareté des patients pédiatriques présentant un choc hémorragique empêche le développement d’études cliniquement pertinentes. Pour cette raison, un modèle animal pédiatrique expérimental est nécessaire pour étudier les effets de l’hémorragie chez les enfants ainsi que leur réponse à différentes thérapies. Nous présentons un modèle animal infantile de choc hémorragique à volume contrôlé chez de jeunes porcs anesthésiés. L’hémorragie est induite par le prélèvement d’un volume sanguin préalablement calculé, et le porc est ensuite surveillé et réanimé avec différentes thérapies. Nous décrivons ici un modèle précis et hautement reproductible de choc hémorragique chez le porc immature. Le modèle fournit des données hémodynamiques qui caractérisent les mécanismes compensatoires qui sont activés en réponse à une hémorragie sévère.
Introduction
L’hémorragie potentiellement mortelle due à un traumatisme, bien que rare, est la principale cause de décès chez les patients pédiatriques 1,2. D’autres causes de choc hémorragique comprennent la fièvre hémorragique, les saignements gastro-intestinaux, la chirurgie du foie et la chirurgie cardiaque, en particulier lorsque le pontage cardiopulmonaire est utilisé3.
Contrairement à la population adulte, il n’existe pas suffisamment de données sur la prise en charge du choc hémorragique pédiatrique, qui reposent en grande partie sur des avis d’experts ou directement issues de la pratique adulte 2,4. Cependant, la traduction des stratégies de gestion des adultes peut ne pas être appropriée. Par exemple, les indicateurs cliniques validés chez l’adulte sont difficiles à extrapoler aux patients pédiatriques en raison de l’hétérogénéité physiologique présente entre les groupes d’âges différents et des différents schémas de blessures prédominants dans la population pédiatrique. Par conséquent, les critères d’évaluation spécifiques qui déclencheraient une intervention chez le patient pédiatrique ne sont pas bien définis. De plus, il n’y a pas suffisamment de preuves sur les effets délétères que les thérapies actuellement mises en œuvre chez les adultes peuvent avoir sur les enfants 2,4,5.
Compte tenu de tout cela, des recherches plus approfondies sont nécessaires pour établir des seuils de réanimation spécifiques afin d’intervenir rapidement, ainsi que pour mieux déterminer quelles sont les thérapies les plus appropriées pour le choc hémorragique pédiatrique. Cependant, il est difficile de développer des études de qualité et cliniquement pertinentes sur les hémorragies potentiellement mortelles chez les enfants, en raison de la rareté des patients et de l’hétérogénéité déjà mentionnée dans la population pédiatrique, de la période néonatale à l’adolescence.
La pertinence clinique du choc hémorragique, ainsi que les difficultés à réaliser des études cliniques sur des patients pédiatriques, soulignent la nécessité d’évaluations précliniques sur des modèles animaux pour étudier la physiopathologie suite à un choc hémorragique chez l’enfant, ainsi que pour comparer différentes thérapies. Plusieurs modèles animaux ont été largement utilisés dans la recherche pour étudier le choc hémorragique 6,7,8,9. En raison de leurs similitudes anatomiques et physiologiques avec les humains, les porcs sont très appréciés dans la recherche biomédicale. En ce qui concerne les avantages de l’utilisation de modèles infantiles spécifiques, les preuves montrent que l’hémodynamique des porcs immatures, ainsi que les systèmes respiratoire, hématologique et métabolique, sont très comparables à ceux des jeunes humains9. Il s’agit d’une occasion unique de simuler un scénario clinique de choc hémorragique chez l’enfant.
Dans ce modèle, l’hémorragie est induite par le prélèvement d’un volume sanguin préalablement calculé. Par la suite, le porc est surveillé et différents liquides de réanimation sont administrés.
Nous décrivons ici un modèle précis et hautement reproductible de choc hémorragique chez le porc immature. Le modèle fournit des données hémodynamiques qui caractérisent les mécanismes compensatoires activés en réponse à une hémorragie sévère.
Protocole
Les expériences de ce protocole ont été approuvées par le Comité d’éthique institutionnelle pour la recherche animale de l’hôpital universitaire Gregorio Marañón, Madrid, Espagne, et le Conseil de l’agriculture et de l’environnement du gouvernement autonome de Madrid (numéro de permis : 12/0013). Des directives européennes et espagnoles pour les soins éthiques et l’utilisation d’animaux de laboratoire ont été appliquées tout au long de l’étude. Les expériences ont été réalisées dans le département de médecine et de chirurgie expérimentales de l’hôpital universitaire Gregorio Marañón, à Madrid, en Espagne.
NOTE : Le modèle animal choisi était constitué de mini-porcs (Sus scrofa domestica) âgés de 2 à 3 mois (8 à 12 kg) en bonne santé. Les miniporcs sont le résultat d’un croisement de trois races différentes qui les rendent adaptés à la recherche biomédicale. Les animaux sont des lignées presque identiques et sont fournis par un établissement d’élevage spécialement autorisé à Madrid (IMIDRA), qui maintient le maintien de trois lignées génétiques homozygotes dans la pureté. Les animaux mâles et femelles ont été utilisés de manière interchangeable. Les animaux ont été nourris avec un régime porcin standard et observés pendant au moins 2 jours pour s’assurer d’une bonne santé. La nourriture, mais pas l’eau, a été retirée la nuit précédant les procédures pour réduire le risque d’aspiration. Une expérience typique nécessite environ 6 h pour être réalisée, dont 30 min pour l’induction de l’anesthésie et la préparation chirurgicale, 60 min pour l’instrumentation, 30 min pour la récupération, 60 min pour l’induction de l’hémorragie et la stabilisation postérieure, 30 min pour la réanimation et 120 min pour le suivi.
1. Anesthésie, intubation et ventilation mécanique
- Prémédiquer le porc avec une injection intramusculaire de kétamine (10 mg/kg) et d’atropine (0,02 mg/kg) dans la région latérale du cou, derrière l’oreille ou dans la région fémorale postérieure.
REMARQUE : Les médicaments anticholinergiques, tels que l’atropine, sont utiles car les porcs peuvent saliver excessivement sous anesthésie10. D’après notre expérience, cette dose de kétamine est suffisante pour réduire le stress et induit une sédation et une analgésie adéquates chez les porcs sans effets indésirables. Cependant, si l’animal n’est pas correctement sédaté ou si la distance entre le logement et la salle d’opération est longue, une autre dose de kétamine (10 mg/kg) peut être administrée en toute sécurité.
ATTENTION : Des gants sont nécessaires lors de la manipulation d’animaux. - Transportez l’animal sous sédation jusqu’à la salle d’opération et placez-le sur une table d’opération munie d’une couverture chauffante.
- Mesurez la saturation périphérique en oxygène (Sp02) à l’aide d’un capteur fixé à l’oreille du porc et lancez une surveillance électrocardiographique (ECG) continue à trois dérivations.
- Désinfectez la peau avec au moins 3 cycles alternés de gommage à la povidone iodée ou à la chlorhexidine et d’alcool. Insérez un cathéter veineux périphérique (22-24 G) dans la veine de l’oreille. Désinfectez la peau au préalable avec une solution antiseptique.
- Induire l’anesthésie par injection intraveineuse de fentanyl (5 μg/kg), de propofol (4 mg/kg) et d’atracurium (0,5 mg/kg). Une fois que la respiration spontanée disparaît et que l’absence de réflexes est confirmée, placez l’animal en position couchée dorsale et initiez immédiatement la ventilation du masque de sac à main avec un masque pour chien avec une fraction d’oxygène inspiré (Fi02) réglée à 100%.
NOTA : Afin de réduire le risque de prise de conscience accidentelle liée à l’utilisation de bloqueurs neuromusculaires, il convient d’utiliser des agents anesthésiques dont l’efficacité est connue chez les porcs et dont les doses se situent dans la limite supérieure afin d’assurer un niveau adéquat d’anesthésie. De plus, surveillez en permanence les signes cardiovasculaires tels que la fréquence cardiaque, la pression artérielle et la température corporelle, et n’administrez des bloqueurs neuromusculaires que lorsque les réflexes de sevrage sont absents (retrait de la pédale, réflexes palpébraux et tonus de la mâchoire) et que le tonus musculaire est détendu. - Effectuer une intubation endotrachéale. Au moins deux opérateurs sont nécessaires pour cette procédure.
- Assurez-vous que l’équipement de base et les outils chirurgicaux nécessaires à l’intubation endotrachéale sont prêts : gaze d’attache pour ouvrir la bouche et fixer la sonde, laryngoscope vétérinaire avec une lame droite entre 17 et 25 cm de long, sonde endotrachéale commune (ID 4-5), stylet, seringue avec de l’air et ruban adhésif.
- Tirez légèrement sur la langue et maintenez la mâchoire ouverte à l’aide d’une gaze d’attache placée derrière les canines supérieures et inférieures.
- Effectuez une laryngoscopie et, une fois que l’épiglotte est visible, utilisez la pointe du laryngoscope pour presser l’épiglotte vers le haut vers la base de la langue.
REMARQUE : Si l’épiglotte est collée au palais mou, elle peut être déplacée dorsalement avec l’extrémité du tube. L’opérateur 1 effectue l’étape 1.6.2 tandis que l’opérateur 2 effectue l’étape 1.6.3. - Une fois les cordes vocales visualisées, avancez doucement le tube avec une légère rotation dans la trachée.
REMARQUE : Le point le plus étroit de la trachée se trouve au niveau sous-glottique. Si l’insertion du tube est difficile, essayez une légère rotation ou un tube plus petit. - Retirez le stylet et utilisez une seringue de 5 ml pour gonfler le brassard.
- Assurez-vous de la mise en place de la sonde endotrachéale en observant une élévation symétrique de la poitrine, une saturation en oxygène adéquate (95 % à 100 %) et une forme d’onde et une lecture correcte du CO2 (EtCO2) en fin de marée.
ATTENTION : Les porcs sont très sensibles au laryngospasme et à l’œdème de la muqueuse larynx, et une perforation laryngée peut même survenir après plusieurs tentatives d’intubation ou si la sédation est insuffisante10.
- Après confirmation de l’intubation, initier la ventilation mécanique à l’aide d’un ventilateur mécanique avec une fréquence respiratoire de 20 respirations par minute, un volume courant de 8 mL/kg, une FiO2 de 40 % et une pression expiratoire positive de 4 cm H2O. Ajustez la ventilation pour obtenir une pression partielle de dioxyde de carbone (PaCO2) comprise entre 35 et 45 mmHg.
- Maintenir une anesthésie profonde tout au long de l’expérience via une perfusion continue de fentanyl (10 μg/kg/h), de propofol (10 mg/kg/h) et d’atracurium (2 mg/kg/h).
2. Instrumentation
- Préparez la région fémorale pour le cathétérisme vasculaire. Utilisez des bandages pour tirer les jambes vers l’arrière et désinfectez la zone inguinale avec au moins 3 cycles alternés de gommage à la povidone iodée ou à la chlorhexidine et d’alcool.
- Évaluez les vaisseaux fémoraux à l’aide d’une échographie et utilisez la technique Doppler pour faire la distinction entre l’artère et la veine. En fonction de la taille de la veine, insérez un cathéter veineux central français (F) de 5,5 à 7,5 avec trois orifices dans l’une des veines fémorales sous échographie continue et en utilisant la technique de Seldinger11,12.
- Immédiatement après la mise en place d’un cathéter veineux central, connectez un système de transducteur pour mesurer la pression veineuse centrale.
- Assurez-vous qu’un électrolyte avec perfusion de glucose (20 mL/h) est connecté à l’un des orifices centraux de la cathétence centrale et qu’une perfusion de solution saline d’entretien (5 mL/h) est perfusée par l’orifice restant pour éviter l’occlusion du cathéter.
- Utilisez la même technique pour canuler l’artère fémorale opposée avec un cathéter artériel 4 F spécialement conçu pour la surveillance du débit cardiaque. Effectuez un test des gaz du sang pour établir la position correcte du cathéter si la confirmation échographique n’est pas possible.
REMARQUE : En cas de spasme ou d’hématome important, passez à l’artère fémorale controlatérale. - Une fois le cathéter artériel inséré, connectez le fil artériel du système de surveillance du débit cardiaque et le transducteur artériel directement à l’orifice du moniteur. Connectez simultanément l’unité de mesure veineuse du moniteur au transducteur veineux central.
REMARQUE : Le moniteur de débit cardiaque utilisé dans cette expérience est spécifié dans le tableau des matériaux. Pour la configuration, l’étalonnage et les mesures, reportez-vous aux instructions du fabricant13. - Assurez-vous que les transducteurs veineux et artériels sont calibrés à zéro.
- Exposez l’artère carotide interne gauche et la veine jugulaire externe gauche via la technique de coupe.
- Assurez-vous que l’équipement et les outils chirurgicaux nécessaires sont disponibles : scalpel, ciseaux chirurgicaux à bout émoussé, pinces à tissus, petit écarteur tissulaire auto-retentissant, porte-aiguille, échanges chirurgicaux, suture avec aiguille, une canule IV 18 G, une gaine de cathéter 5 F avec un introducteur et un fil guide Seldinger.
- Avec l’animal en position couchée dorsale, désinfectez la peau du cou avec une solution antiseptique.
- Utilisez un scalpel pour faire une incision paratrachéale gauche de ~10 cm, en coupant en deux une ligne entre le manubrium et l’angle de la mâchoire.
- Pour exposer la veine jugulaire externe, disséquez le tissu latéral au SCM et isolez la veine du fascia environnant.
- Après avoir été isolé, utilisez deux sutures en soie non résorbables (USP-0) enroulées autour de la veine pour fixer le vaisseau avant la ponction.
- Inciser la veine à l’aide d’une aiguille de Venflon (18 G). Une fois à l’intérieur de la veine, rétractez l’aiguille et insérez le fil guide dans le tube Venflon.
- Retirez le tube Venflon et insérez la gaine avec l’introducteur (5 F) sur le fil. Après l’insertion, retirez à la fois l’introducteur et le fil.
- Immédiatement après l’insertion, rincer les gaines avec 0,9 % de NaCl (5 mL/h) pour éviter la formation de thrombus.
- Attachez la suture proximale en soie autour de la gaine pour la fixer. Après cela, fixez la poignée de la gaine au SCM et fermez la peau avec des agrafes.
- Après la préparation chirurgicale, laisser les animaux se stabiliser pendant 30 minutes avant d’obtenir les valeurs de surveillance de base et les échantillons de sang.
- Maintenez la température du sang entre 37 et 39 °C à l’aide d’une couverture thermique et d’un chauffe-tête tout au long de l’expérience.
REMARQUE : La température est mesurée à l’aide d’une thermistance située à l’extrémité du cathéter artériel de thermodilution.
3. Surveillance hémodynamique et de perfusion
- Surveillez l’ECG, la saturation périphérique en oxygène, les volumes et les pressions respiratoires et le Fi02.
- Connectez un spiromètre entre la sonde endotrachéale et un moniteur multiparamètre pour mesurer l’EtC02 qualitatif et quantitatif.
REMARQUE : Pour plus d’informations sur le moniteur multiparamètre, reportez-vous à la table des matériaux. - Utilisez la spectroscopie proche infrarouge (NIRS) pour surveiller l’indice d’oxygénation des tissus cérébraux (bTOI) et l’indice d’oxygénation des tissus splanchniques (aTOI). Placez les capteurs sur la peau du front et sur la paroi abdominale antérieure (région sous-hépatique).
REMARQUE : Ne placez pas le capteur cérébral sur la ligne médiane, car il pourrait être contaminé par le sang veineux du sinus sagittal supérieur14. - Connectez la sonde de débit sanguin attachée à l’artère carotide interne à un moniteur de débit pour mesurer le débit sanguin carotidien (CaBF).
- Placez un capteur laser Doppler sur la peau de la paroi abdominale antérieure pour une mesure continue du flux sanguin tissulaire cutané (CuTBF).
REMARQUE : Pour plus d’informations sur les capteurs de débit de soufflage tissulaire carotidien et cutané, voir le tableau des matériaux. - Enregistrez les paramètres suivants au départ et toutes les 30 minutes : température sanguine, volume courant inspiratoire, EtCO2, rythme cardiaque, fréquence cardiaque (FC), pressions artérielle systolique et diastolique, pression artérielle moyenne (MAP), indice de choc (FC/pression artérielle systolique)15, pression veineuse centrale, indice cardiaque (IC), indice de volume diastolique final global (GEDVI), indice de volume d’AVC (SVI), contractilité ventriculaire gauche (Dt/Dpmax), l’indice de résistance vasculaire systémique (SVRI), l’indice d’eau pulmonaire extravasculaire (ELWI), la variation du pouls de pression (PPV), la saturation périphérique de l’hémoglobine, l’indice de saturation veineuse centrale (ScvO2), l’indice d’oxygénation des tissus cérébraux (bTOI) et splanchnique (aTOI) par NIRS, CaBF et CuTBF.
- Pour obtenir les valeurs de l’IC, perfuser 5 mL de solution saline normale à 0,9 % à une température inférieure à 8 °C à travers le cathéter veineux central. Inscrivez la moyenne de deux mesures consécutives.
- Déterminer les profils gazeux du sang artériel et veineux et la concentration de lactate toutes les 30 minutes en prélevant 0,3 mL de sang dans les vaisseaux fémoraux. Effectuer des numérations globulaires complètes, des études de coagulation et de biochimie au départ, après l’induction de l’hémorragie et à la fin de l’expérience.
- Après chaque prise de sang, rincer les lignes avec 0,5 mL d’héparine à 100 UI/mL.
4. Induction d’un choc hémorragique
- Une fois qu’un état d’équilibre est atteint après la collecte des instruments et des données de base, induire un choc hypovolémique en prélevant 30 mL/kg de sang de la veine jugulaire pendant 30 minutes.
- Prévoyez une période de 30 minutes pour la stabilisation. Ne faites pas d’efforts de réanimation pendant cette période pour imiter le retard dans l’arrivée des équipes médicales d’urgence.
5. Perfusion et suivi
- Après la période de stabilisation, perfusez un bolus d’un expanseur de volume ou d’un agent vasoactif sur une période de 30 minutes.
REMARQUE : Des exemples d’expanseurs de volume et d’agents vasoactifs testés sont la solution saline normale, l’albumine hypertonique, l’angiotensine et la terlipressine. Dans cette étude, 30 mL/kg de solution saline normale (NS) (n = 13), 15 mL/kg d’albumine à 5 % plus 3 % de solution saline hypertonique (AHS) (n = 13) ou un seul bolus intraveineux de 15 μg/kg de terlipressine plus 15 mL/kg d’albumine à 5 % plus 3 % de solution saline hypertonique (TAHS) (n = 13) ont été utilisés. - Après la perfusion, suivez l’animal pendant 120 min. Enregistrez les paramètres hémodynamiques et prélevez des échantillons de sang toutes les 30 minutes pour les profils gazeux du sang artériel et veineux et la détermination de la concentration de lactate. Ne faites pas d’efforts de réanimation pendant cette période.
6. Fin de l’expérience et euthanasie
- Une fois l’expérience terminée, utilisez un surdosage de sédatifs (5 μg/kg de fentanyl et 10 mg/kg de propofol) et une injection intraveineuse de chlorure de potassium (2 mEq/kg) pour sacrifier tous les animaux réanimés avec succès.
- Confirmez l’absence de circulation par asystolie ou activité électrique sans pouls sur un écran ECG continu, l’absence de flux pulsatile lors de la surveillance invasive de la pression artérielle et l’absence d’autres signes vitaux.
- Si, au cours de la période de suivi, la pression artérielle descend en dessous de 25 mmHg, sacrifiez l’animal pour éviter d’autres souffrances.
Résultats
Le modèle présenté a été utilisé avec succès dans plusieurs expériences pour étudier les changements macrocirculatoires et microcirculatoires à la suite d’un choc hémorragique et d’une réanimation ultérieure, en comparant différents fluides et médicaments vasoactifs16,17,18,19.
Compte tenu de la réponse au choc, ce modèle a montré de manière cohérente qu’une hémorragie contrôlée produit des changements marqués dans les paramètres hémodynamiques, ainsi que dans la perfusion cérébrale et tissulaire.
Après le retrait de volume, une tachycardie importante et une diminution de la MAP, de l’IC, de l’IVS, des paramètres de volume sanguin (GEDVI et ITBI) et du flux sanguin artériel carotidien, ainsi qu’une augmentation de l’indice de résistance vasculaire systémique, sont détectées (Figure 1 et Figure 2).
En ce qui concerne les paramètres de perfusion systémique, le lactate augmente de manière significative, tandis que ScvO2, CuTBF et bTO diminuent (Figure 3). Les variations de la pression veineuse centrale, Dt/Dpmax et ELW ne sont généralement pas enregistrées.
En ce qui concerne les paramètres de laboratoire, la teneur en hémoglobine et l’hématocrite ne diminuent qu’après l’administration de liquides. La concentration d’albumine diminue et les niveaux de troponine augmentent considérablement après une hémorragie contrôlée. D’autres paramètres, notamment la température centrale, la PaO2, la PaCO2, la saturation artérielle en oxygène, l’EtCO2, les électrolytes et les paramètres de la fonction rénale et hépatique, restent généralement stables.
Outre son utilité dans l’analyse des réponses cardiovasculaires et biochimiques au choc, il a été démontré que ce modèle permet de discriminer avec succès différents fluides de réanimation.
Dans des études antérieures, nous avons cherché à déterminer si, dans un modèle animal infantile de choc hémorragique, l’utilisation d’une perfusion de plus faible volume de liquides hypertoniques - seule ou combinée à différents vasopresseurs - améliorerait les paramètres hémodynamiques et de perfusion globaux par rapport à une solution saline normale.
Comme indiqué précédemment, nous avons constamment observé que la perfusion de fluides hypertoniques produit une réponse similaire à la perfusion de deux fois le volume de liquide isotonique16,17,18.
Plus précisément, l’utilisation d’albumine et de solution saline hypertonique a produit une expansion de volume plus importante et plus longue que la solution saline normale ou la solution saline hypertonique seule, avec des différences significatives de HR, SVI et PPV, et l’absence de chute progressive après l’expansion de volume de la pression artérielle et du GEDVI, comme observé dans les autres groupes (Figure 1 et Figure 2). De plus, nous avons également observé une plus grande amélioration des paramètres de perfusion avec l’albumine hypertonique, représentée par une augmentation plus importante de bTOI et de CaBF, et une diminution plus importante des niveaux de lactate que les autres groupes par rapport au début de l’expansion du fluide (Figure 3). Nous pensons que cette différence pourrait être secondaire à la capacité de l’albumine à augmenter le volume sanguin et à rester plus longtemps dans le compartiment intravasculaire que la solution saline normale. Il est intéressant de noter que nous avons vu que l’ajout d’un seul bolus de terlipressine au début de la réanimation liquidienne a donné des résultats similaires à ceux observés dans le groupe albumine hypertonique, sans aucun bénéfice supplémentaire en termes de paramètres hémodynamiques ou de perfusion17,18.

Figure 1 : Paramètres hémodynamiques. (A) Évolution de la fréquence cardiaque, (B) pression artérielle moyenne, (C) indice cardiaque au départ (t0') et (D) indice de résistance vasculaire systémique au départ (t0'). Tout au long de l’expérience : fin de l’hémorragie contrôlée (Shock30') ; le début de la perfusion, 30 min après la fin de la saignement contrôlée (Res0') ; fin de perfusion (Res30') ; suivi 30 min après la fin de la perfusion (Obs30') ; suivi 60 min après la fin de la perfusion (Obs60') ; suivi 90 min après la fin de la perfusion (Obs90'). (*) Différence significative (p < 0,05) par rapport à la ligne de base, même groupe. (‡) p < 0,05 d’hémorragie, même groupe. (#) p < 0,05 du groupe NS. Abréviations : NS = solution saline normale ; AHS = albumine saline hypertonique ; TAHS = terlipressine plus albumine saline hypertonique. Les données sont présentées sous forme de moyenne et d’écart-type. Cette figure est adaptée avec la permission d’Urbano et al.17. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Paramètres du volume sanguin. (A) Évolution de l’indice de volume d’éjection, (B) variation de la pression du pouls et (C) indice global de volume diastolique final à l’inclusion (t0'). Tout au long de l’expérience : fin de l’hémorragie contrôlée (Shock30') ; début de la perfusion, 30 min après la fin de l’hémorragie contrôlée (Res0') ; fin de perfusion (Res30') ; suivi 30 min après la fin de la perfusion (Obs30') ; suivi 60 min après la fin de la perfusion (Obs60') ; suivi 90 min après la fin de la perfusion (Obs90'). (*) Différence significative (p < 0,05) par rapport à la ligne de base, même groupe. (‡) p < 0,05 d’hémorragie, même groupe. (#) p < 0,05 du groupe NS. Abréviations : NS = solution saline normale ; AHS = albumine saline hypertonique ; TAHS = terlipressine plus albumine saline hypertonique. Les données sont présentées sous forme de moyenne et d’écart-type. Cette figure est adaptée avec la permission d’Urbano et al.17. Veuillez cliquer ici pour voir une version agrandie de cette figure.
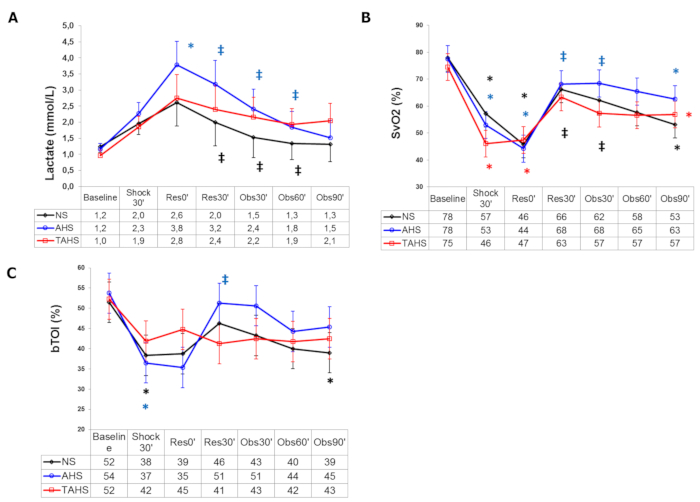
Figure 3 : Paramètres de perfusion systémique : (A) Évolution du lactate dans le sang artériel, (B) saturation en oxygène du sang veineux central et (C) indice d’oxygénation du tissu cérébral au départ (t0'). Tout au long de l’expérience : fin de l’hémorragie contrôlée (Shock30') ; début de la perfusion, 30 min après la fin de l’hémorragie contrôlée (Res0') ; fin de perfusion (Res30') ; suivi 30 min après la fin de la perfusion (Obs30') ; suivi 60 min après la fin de la perfusion (Obs60') ; suivi 90 min après la fin de la perfusion (Obs90'). (*) Différence significative (p < 0,05) par rapport à la ligne de base, même groupe. (‡) p < 0,05 d’hémorragie, même groupe. (#) p < 0,05 du groupe NS. Les données sont présentées sous forme de moyenne et d’écart-type. Cette figure est adaptée avec la permission d’Urbano et al.17. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’exécution d’interventions sur de jeunes porcs peut être complexe et potentiellement mortelle en raison de certaines caractéristiques anatomiques et physiologiques de ces animaux. Pour obtenir des résultats constants et réduire la perte d’animaux, certaines étapes critiques doivent être soigneusement prises en compte. Tout d’abord, il est essentiel d’atteindre un niveau de sédation adéquat pour minimiser la réponse au stress de l’animal, qui, si elle est excessive, peut altérer les résultats en raison de la libération de catécholamines endogènes. Il est également important d’éviter les délais entre l’injection intramusculaire et l’intubation, car les animaux peuvent développer une réponse de stress sévère avec tachycardie et acidose métabolique irréversible qui peut précipiter la fin de l’expérience. Bien que d’autres groupes utilisent des anesthésiques inhalés avec de bons résultats20,21, nous préférons les médicaments par voie intraveineuse, car les sédatifs inhalés ne permettent pas de mesurer les échanges gazeux respiratoires avec la calorimétrie indirecte. D’après notre expérience, une combinaison de propofol et de fentanyl est efficace et a très peu d’effets indésirables. Une gestion minutieuse de la température tout au long de l’expérience est un autre aspect clé du protocole, car les changements rapides de température peuvent affecter considérablement la réponse hémodynamique de l’animal au choc, falsifier les résultats ou finalement conduire à l’échec de l’expérience.
Une autre partie cruciale de l’instrumentation est l’intubation, compte tenu des particularités de l’anatomie porcine et de sa sensibilité au laryngospasme. Par conséquent, la procédure doit être effectuée par au moins un opérateur ayant une expérience préalable, et l’utilisation d’un stylet et d’une relaxation musculaire est conseillée10,22. Le cathétérisme des vaisseaux peut également être difficile en raison de la petite taille des animaux. Pour l’accès fémoral, une ponction guidée par échographie est préférable, car les vaisseaux sont situés profondément, ont généralement de petits diamètres et présentent des trajectoires et des positions différentes22. Pour l’accès cervical, nous utilisons l’accès chirurgical pour permettre la mise en place de la sonde de flux carotidien, mais la technique de l’échographie est également réalisable23,24. La canulation de la veine jugulaire externe est généralement préférée en raison de son diamètre plus large, de son emplacement superficiel et du nombre plus faible de structures environnantes22. Les cathéters doivent être rincés immédiatement après l’insertion avec des solutions salines pour éviter l’occlusion. Nous n’utilisons pas d’héparine pour éviter les altérations de la coagulation. De plus, dans un premier temps, nous avons évité l’administration de perfusions de glucose pour éviter une distorsion potentielle de la réponse hémodynamique par l’administration de liquides supplémentaires, mais nous avons constaté que les animaux développaient une hypoglycémie sévère et précoce. Enfin, même avec l’anesthésie et les techniques moins invasives utilisées de nos jours, l’instrumentation génère une réponse de stress importante chez les animaux, il est donc souhaitable de laisser suffisamment de temps pour la récupération avant d’initier la prélèvement du sang. En ce qui concerne l’induction du choc hémorragique, nous recommandons le retrait de 30 mL/kg, car cela génère une réponse physiopathologique importante avec d’excellents taux de survie. D’après notre expérience, les bébés porcs ne tolèrent pas de grandes quantités de perte de sang et la mortalité est élevée. Le prélèvement progressif du sang est également important, car un retrait rapide peut entraîner une instabilité hémodynamique sévère et la mort prématurée de l’animal.
Bien qu’il existe une grande variété d’espèces et de modèles expérimentaux à la disposition des chercheurs, le modèle idéal de choc hémorragique animal - simple, facilement reproductible et reproduisant fidèlement la situation clinique - représente toujours un défi. De petits modèles animaux, principalement des souris et des rats, sont utilisés pour étudier les mécanismes physiopathologiques du choc. Cependant, leur petite taille complique considérablement la réalisation des procédures chirurgicales et de prélèvement. Les animaux plus gros, tels que les chiens et les porcs, sont plus coûteux et plus complexes à manipuler, mais leur taille et leurs similitudes physiologiques avec les humains les rendent plus adaptés à l’évaluation préclinique des stratégies de traitement. Cependant, l’utilisation de chiens dans le passé et encore aujourd’hui est éthiquement discutable. Ils n’offrent aucun avantage par rapport aux porcs en tant que modèles d’animaux de laboratoire, et leur intelligence et la relation bilatérale spéciale entre les humains et les chiens les placent à une position plus élevée dans l’échelle phylogénétique 6,7,8.
Compte tenu de tout cela, les porcs adultes ont été largement utilisés pour la recherche cardiovasculaire en raison de leurs similitudes avec la physiologie, la taille et l’anatomie de l’homme adulte, qui sont meilleures que la plupart des espèces. Cependant, comme il a été bien établi dans la littérature, il existe des différences significatives entre les patients humains adultes et pédiatriques en termes de système cardiovasculaire, de volume sanguin, de régulation de la température et de réponse au choc 2,3,4. Dans le même temps, les preuves montrent que ces différences s’appliquent également aux porcs, et les porcelets se sont avérés avoir des profils cardiovasculaires, cérébrovasculaires, hématologiques et électrolytiques très similaires à ceux des patients humains pédiatriques 9,25. Enfin, au-delà de ces différences anatomiques et physiologiques entre adultes et nourrissons chez les deux espèces, l’utilisation de modèles animaux infantiles, en particulier de mini-porcs, permet de tester les mêmes dispositifs que ceux utilisés en milieu clinique réel pour le suivi. Dans de nombreux cas, la fiabilité de ces appareils s’est avérée faible en raison d’une simple adaptation des algorithmes, des capteurs ou des balances adultes. Tous ces aspects soulignent l’importance de développer des modèles animaux pédiatriques spécifiques et leur pertinence en termes d’utilité translationnelle dans le cadre clinique pédiatrique.
Outre le type d’animal, il existe trois modèles de base généralement utilisés dans l’étude du choc hémorragique : l’hémorragie contrôlée - soit en volume ou en pression - et l’hémorragie non contrôlée. Le protocole présenté dans cet article décrit un modèle d’hémorragie à volume fixe, dans lequel un volume sanguin fixe, généralement calculé en pourcentage du poids corporel, est prélevé sur une période de temps définie par l’observateur. Au contraire, dans les modèles d’hémorragie à pression fixe, les animaux sont saignés jusqu’à un MAP prédéterminé, qui est ensuite maintenu avec des saignements périodiques ou des perfusions de liquide pendant une période spécifiée, en fonction de l’espèce animale et du degré ou de l’issue du choc. Les modèles de choc hémorragique à volume fixe et à pression fixe permettent d’étudier les changements physiopathologiques induits par le choc dans des conditions contrôlées, offrant un net avantage en termes de reproductibilité et de standardisation. Cependant, leur principale limite est qu’ils ne permettent pas d’étudier les effets de différentes stratégies de réanimation sur les saignements actifs, où la réanimation liquidienne agressive avant le contrôle chirurgical de l’hémorragie est connue pour augmenter les saignements et diminuer la survie, en raison de l’inhibition de la formation du thrombus et de l’augmentation de la pression artérielle moyenne. Des modèles d’hémorragie non contrôlée induits par un traumatisme vasculaire standardisé - écrasement/lacération du foie et de la rate, lésion artérielle ou amputation d’un appendice - ont été suggérés pour mieux refléter la situation clinique, permettant ainsi une meilleure compréhension des effets des différentes stratégies de réanimation liquidienne et d’autres interventions, telles que l’hypothermie et les produits hémostatiques. Cependant, bien qu’ils soient cliniquement les plus pertinents, ces modèles d’hémorragie non contrôlée présentent des inconvénients évidents en termes de standardisation et de reproductibilité. Compte tenu de tout cela, il semble que le modèle idéal n’existe pas, et donc la recherche dans ce domaine doit trouver un équilibre entre la pertinence clinique et la standardisation et la fiabilité expérimentales 6,7,8,9,26.
Le modèle décrit dans cette étude peut offrir de larges applications potentielles dans la recherche cardiovasculaire, telles que l’étude de la dysfonction endothéliale et des altérations de la microcirculation18 pendant le choc, ainsi que la validation de différents systèmes de surveillance hémodynamique. De plus, il peut également être utilisé dans d’autres domaines de recherche, permettant l’étude des réponses endocriniennes ou immunitaires après une hémorragie sévère ainsi que la détermination des effets secondaires de différents fluides et vasopresseurs. Cependant, en ce qui concerne la recherche sur les différentes stratégies de réanimation, il est conseillé d’étudier leurs effets dans des modèles d’hémorragie non contrôlée avant de mettre en œuvre des changements dans le cadre clinique 7,26.
Outre la difficulté d’extrapoler les résultats à la vie réelle, ce modèle présente d’autres limites. Tout d’abord, il existe des variables confondantes liées au dispositif expérimental, telles que l’utilisation d’agents anesthésiques ou de ventilation mécanique, qui peuvent atténuer les réponses physiologiques lors d’un choc et compliquer l’interprétation des résultats. En outre, la réponse au stress de l’instrumentation sur les animaux et le contrôle de la température peuvent affecter la macro et la microcirculation par différents mécanismes. Une autre limite importante de ce modèle, liée aux nécessités expérimentales et à la disponibilité des ressources, est la période d’observation post-traumatique limitée, qui limite encore l’étude des conséquences à long terme du choc hémorragique. De plus, malgré les similitudes physiologiques entre les humains et les porcs, il existe certaines différences entre les espèces qui doivent être prises en compte. Le système de coagulation, par exemple, semble être plus efficace chez les porcs27,28. De plus, les taux plasmatiques de lactate et de succinate diffèrent d’une espèce à l’autre, et les porcs ont une alcalose basale, ce qui peut conduire à une sous-estimation des effets de l’hémorragie sur l’équilibre acido-basique29. Enfin, il est également bien connu que les réponses inflammatoires et immunitaires, ainsi que certains récepteurs vasopresseurs, sont différentes chez le porc9. Les différences spécifiques entre les animaux doivent également être considérées comme des facteurs d’influence. Plusieurs études ont mis en évidence des différences entre les sexes en termes de susceptibilité aux chocs, les femmes ayant un avantage significatif en matière de survie par rapport aux hommes 6,9. Néanmoins, dans les expériences menées dans cette étude, nous utilisons des animaux du même groupe d’âge et ayant un bagage génétique similaire afin de minimiser la variabilité potentielle inhérente aux espèces.
En conclusion, cet article fournit un guide pratique et étape par étape pour la mise en place d’un modèle porcin de choc hémorragique pédiatrique. Par rapport à d’autres modèles existants, il s’agit d’un protocole fiable et facile à suivre avec une large applicabilité dans la recherche biomédicale, soit pour l’investigation des réponses physiopathologiques après une hémorragie sévère, soit pour l’évaluation de différentes stratégies de réanimation.
Déclarations de divulgation
Les auteurs de ce travail n’ont aucun conflit d’intérêts.
Remerciements
Cette étude a été financée par l’Instituto de Salud Carlos III (ISCIII) à travers le projet « PI20/01706 » et co-fondée par l’Union européenne. Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’analyse des données, la décision de publier ou la préparation du manuscrit. Nous tenons à exprimer notre gratitude à tous nos collègues de l’Unité de soins intensifs pédiatriques Gregorio Marañón et de l’Institut expérimental Gregorio Marañón, car sans leur travail, ce projet n’aurait pas été possible.
matériels
| Name | Company | Catalog Number | Comments |
| ADA swabs | Albino Dias de Andrade, S.A. | 300575750400 | Non-woven swabs |
| Alaris SE | Carefusion | N/A | Volumetric infusion pump |
| Atracurium | Aspen Pharma Trading Limited. Dublin, Ireland | N/A | Muscle relaxant |
| Atropine 1 mg/mL | B. Braun | 481377/1013 | |
| Barrier adhesive aperture drape | Mölnlycke | 63621 | |
| BD emerald syringe 5 mL, 10 mL, 20 mL | Becton Dickinson S.A | https://www.bd.com/en-eu/offerings/capabilities/syringes-and-needles/injection-syringes/bd-emerald-3-piece-syringe | various options available |
| BLF21A laser doppler monitor | Transonic Systems Inc. | BLF21A | Skin blood flow monitor |
| BlueSensor NF ECG electrodes | Ambu | NF-50-A/12 | |
| Check-Flo performer introducer set 5Fr | Cook Medical | G12018 | Vascular Sheath |
| Datex ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | M1162897 | Hemodynamic monitor |
| Fentanyl 0.05 mg/mL | Kern Pharma | N/A | Anesthesia |
| GE Vivid S5 | GE Healthcare | S series | Ultrasound machine |
| Introcan Safety 18 G, 22 G, 24 G | B. Braun | Introcan series | Safety intravenous catheter |
| INVOS cerebral/somatic oximetry adult sensors | Medtronic PLC, USA | https://www.medtronic.com/covidien/en-us/products/cerebral-somatic-oximetry/invos-cerebral-somatic-oximetry-adult-sensors.html | |
| INVOS OXIMETER cerebral/somatic | Somanetics | 08-10566 | Regional oxygenation monitor |
| Ketamin 50 mg/mL | Pfizer, S.L. | 47034 | Sedation |
| Leon plus | Heinen + Löwenstein | N/A | Ventilator |
| Life scope VS | Nihon Kohden | N/A | Bedside monitor |
| Miller laryngoscope blade 12″ | Jorgensen Labs, USA | J0449F | Laryngoscope |
| Multi-lumen central venous catheterization set 7 French, 3 lumen, 30 cm | Arrow | CS-14703 | Central venous catheter |
| Nellcor WarmTouch 5300A | Covidien | Thermal blancket | |
| Nitrile gloves | Medihands | KS-ST RT021 | Single use gloves |
| Pediatric SomaSensor INVOS cerebral/somatic | Covidien | https://www.medtronic.com/covidien/en-us/products/cerebral-somatic-oximetry.html | Disposable regional oxygen saturation sensor |
| PICCO monitoring kit | Pulsion Medical Systems | PV8215 | |
| PICCO thermodilution catheter 5F/20 cm | Pulsion Medical Systems | N/A | |
| Propofol Lipoven 10 mg/mL | Fresenius Kabi, Spain | N/A | Anesthesia |
| Pulse contour cardiac output (PiCCO2) | Pulsion Medical Systems | N/A | Hemodynamic monitor |
| Rüsch flexislip | Teleflex Medical | 503700 | Endotracheal tube stylet |
| Softa swabs | B. Braun | 19579 | Alcohol pads |
| Surgical silk sutures USP 0 | Aragó, Barcelona, Spain. | 6245 | |
| TruWave pressure monitoring set | Edwards | T001767A | Pressure monitoring set |
| Ultrasound transmission gel | Ultragel Hungary 2000 Kft. | UC260 |
Références
- Disease Control and Prevention (CDC). Vital signs: Unintentional injury deaths among persons aged 0-19 years-United States, 2000-2009. MMWR. Morbidity and Mortality Weekly Report. 61, 270-276 (2012).
- Russell, R. T., et al. Pediatric traumatic hemorrhagic shock consensus conference recommendations. The Journal of Trauma and Acute Care Surgery. 94, S2-S10 (2023).
- Leonard, J. C., et al. Life-threatening bleeding in children: A prospective observational study. Critical Care Medicine. 49 (11), 1943-1954 (2021).
- Cannon, J. W. Hemorrhagic shock. The New England Journal of Medicine. 378 (4), 370-379 (2018).
- Dehmer, J. J., Adamson, W. T. Massive transfusion and blood product use in the pediatric trauma patient. Seminars in Pediatric Surgery. 19 (4), 286-291 (2010).
- Fülöp, A., Turóczi, Z., Garbaisz, D., Harsányi, L., Szijártó, A. Experimental models of hemorrhagic shock: a review. European Surgical Research. 50 (2), 57-70 (2013).
- Moochhala, S., Wu, J., Lu, J. Hemorrhagic shock: an overview of animal models. Frontiers in Bioscience. 14 (12), 4631-4639 (2009).
- Lomas-Niera, J. L., Perl, M., Chung, C. S., Ayala, A. Shock and hemorrhage: an overview of animal models. Shock. 24, 33-39 (2005).
- Hildebrand, F., Andruszkow, H., Huber-Lang, M., Pape, H. C., van Griensven, M. Combined hemorrhage/trauma models in pigs-current state and future perspectives. Shock. 40 (4), 247-273 (2013).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Leibowitz, A., Oren-Grinberg, A., Matyal, R. Ultrasound guidance for central venous access: Current evidence and clinical recommendations. Journal of Intensive Care Medicine. 35 (3), 303-321 (2020).
- Lockwood, J., Desai, N. Central venous access. British Journal of Hospital Medicine. 80 (8), C114-C119 (2019).
- Operator's Manual PiCCO2. Version 3.1. Pulsion Medical Systems Available from: https://www.manualslib.com/manual/2821743/Pulsion-Picco2.html#manual (2013)
- Acker, S. N., Ross, J. T., Partrick, D. A., Tong, S., Bensard, D. D. Pediatric specific shock index accurately identifies severely injured children. Journal of Pediatric Surgery. 50 (2), 331-334 (2015).
- Urbano, J., et al. Comparison of normal saline, hypertonic saline and hypertonic saline colloid resuscitation fluids in an infant animal model of hypovolemic shock. Resuscitation. 83 (9), 1159-1165 (2012).
- Urbano, J., et al. Comparison of normal saline, hypertonic saline albumin and terlipressin plus hypertonic saline albumin in an infant animal model of hypovolemic shock. PLoS One. 10 (3), e0121678 (2015).
- González, R., et al. Microcirculatory alterations during haemorrhagic shock and after resuscitation in a paediatric animal model. Injury. 47 (2), 335-341 (2016).
- López-Herce, J., Rupérez, M., Sánchez, C., García, C., García, E. Haemodynamic response to acute hypovolaemia, rapid blood volume expansion and adrenaline administration in an infant animal model. Resuscitation. 68 (2), 259-265 (2006).
- Gil-Anton, J., et al. Addition of terlipressin to initial volume resuscitation in a pediatric model of hemorrhagic shock improves hemodynamics and cerebral perfusion. PLoS One. 15 (7), e0235084 (2020).
- Williams, A. M., et al. Complete and partial aortic occlusion for the treatment of hemorrhagic shock in swine. Journal of Visualized Experiments. (138), e58284 (2018).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment, and heart disease research. Lab Animal. 51 (2), 46-67 (2022).
- Chiesa, O. A., et al. Minimally invasive ultrasound-guided technique for central venous catheterization via the external jugular vein in pigs. American Journal of Veterinary Research. 82 (9), 760-769 (2021).
- Anderson, J. H., et al. Ultrasound guided percutaneous common carotid artery access in piglets for intracoronary stem cell infusion. Laboratory Animals. 52 (1), 88-92 (2018).
- Hughes, H. C. Swine in cardiovascular research. Laboratory Animal Science. 36 (4), 348-350 (1986).
- Mayer, A. R., et al. A systematic review of large animal models of combined traumatic brain injury and hemorrhagic shock. Neuroscience and Biobehavioral Reviews. 104, 160-177 (2019).
- Velik-Salchner, C., et al. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thrombosis Research. 117 (5), 597-602 (2006).
- Siller-Matula, J. M., Plasenzotti, R., Spiel, A., Quehenberger, P., Jilma, B. Interspecies differences in coagulation profile. Thrombosis and Haemostasis. 100 (3), 397-404 (2008).
- Reisz, J. A., et al. All animals are equal but some animals are more equal than others: Plasma lactate and succinate in hemorrhagic shock-A comparison in rodents, swine, nonhuman primates, and injured patients. The Journal of Trauma and Acute Care Surgery. 84 (3), 537-541 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon