Method Article
Descrizione di un modello neonato suino di shock emorragico a volume controllato
In questo articolo
Riepilogo
Questo articolo ha lo scopo di fornire ai ricercatori una guida dettagliata e accessibile per impostare un modello suino infantile di shock emorragico.
Abstract
Lo shock emorragico è una delle principali cause di morbilità e mortalità nei pazienti pediatrici. L'interpretazione degli indicatori clinici validati negli adulti per guidare la rianimazione e il confronto tra le diverse terapie è difficile nei bambini a causa dell'eterogeneità intrinseca di questa popolazione. Di conseguenza, rispetto agli adulti, la gestione appropriata dello shock emorragico pediatrico non è ancora ben consolidata. Inoltre, la scarsità di pazienti pediatrici con shock emorragico preclude lo sviluppo di studi clinicamente rilevanti. Per questo motivo, è necessario un modello animale pediatrico sperimentale per studiare gli effetti dell'emorragia nei bambini e la loro risposta alle diverse terapie. Presentiamo un modello animale neonato di shock emorragico a volume controllato in giovani suini anestetizzati . L'emorragia viene indotta prelevando un volume di sangue precedentemente calcolato e il suino viene successivamente monitorato e rianimato con diverse terapie. Qui descriviamo un modello preciso e altamente riproducibile di shock emorragico nei suini immaturi. Il modello fornisce dati emodinamici che caratterizzano i meccanismi compensatori che si attivano in risposta a una grave emorragia.
Introduzione
L'emorragia pericolosa per la vita dovuta a traumi, sebbene rara, è la principale causa di morte nei pazienti pediatrici 1,2. Ulteriori cause di shock emorragico includono febbre emorragica, emorragia gastrointestinale, chirurgia epatica e cardiochirurgia, soprattutto quando viene utilizzato il bypass cardiopolmonare3.
Contrariamente alla popolazione adulta, non ci sono dati sufficienti sulla gestione dello shock emorragico pediatrico, che si basa in gran parte su opinioni di esperti o direttamente tradotte dalla pratica degli adulti 2,4. Tuttavia, la traduzione delle strategie di gestione da parte degli adulti potrebbe non essere appropriata. Ad esempio, gli indicatori clinici validati negli adulti sono difficili da estrapolare ai pazienti pediatrici a causa dell'eterogeneità fisiologica presente tra gruppi di età diverse e dei diversi modelli di lesione predominanti nella popolazione pediatrica. Di conseguenza, gli endpoint specifici che farebbero scattare l'intervento nel paziente pediatrico non sono ben definiti. Inoltre, non ci sono evidenze sufficienti sugli effetti deleteri che le terapie attualmente attuate negli adulti possono avere sui bambini 2,4,5.
Alla luce di tutto ciò, sono necessari ulteriori approfondimenti per stabilire soglie di rianimazione specifiche per un intervento tempestivo, nonché per determinare meglio quali siano le terapie più appropriate per lo shock emorragico pediatrico. Tuttavia, lo sviluppo di studi di qualità e clinicamente rilevanti sull'emorragia pericolosa per la vita nei bambini è difficile, a causa della scarsità di pazienti e della già citata eterogeneità nella popolazione pediatrica dal periodo neonatale fino all'adolescenza.
La rilevanza clinica dello shock emorragico, oltre alle difficoltà nell'esecuzione di studi clinici su pazienti pediatrici, sottolineano la necessità di valutazioni precliniche su modelli animali per studiare la fisiopatologia a seguito di shock emorragico nei bambini, nonché per confrontare diverse terapie. Diversi modelli animali sono stati ampiamente utilizzati nella ricerca per studiare lo shock emorragico 6,7,8,9. A causa delle loro somiglianze anatomiche e fisiologiche con gli esseri umani, i maiali sono molto apprezzati nella ricerca biomedica. Per quanto riguarda i vantaggi dell'utilizzo di specifici modelli infantili, l'evidenza mostra che l'emodinamica dei suini immaturi, così come i sistemi respiratorio, ematologico e metabolico, sono altamente paragonabili a quelli degli esseri umani giovani9. Ciò conferisce un'opportunità unica per simulare uno scenario clinico di shock emorragico nei bambini.
In questo modello, l'emorragia è indotta dal prelievo di un volume di sangue precedentemente calcolato. Successivamente, il maiale viene monitorato e vengono somministrati diversi fluidi per la rianimazione.
Qui descriviamo un modello preciso e altamente riproducibile di shock emorragico nei suini immaturi. Il modello fornisce dati emodinamici che caratterizzano i meccanismi compensatori attivati in risposta a gravi emorragie.
Protocollo
Gli esperimenti di questo protocollo sono stati approvati dal Comitato Etico Istituzionale per la Ricerca Animale dell'Ospedale Universitario Gregorio Marañón, Madrid, Spagna, e dal Consiglio dell'Agricoltura e dell'Ambiente del Governo Autonomo di Madrid (numero di permesso: 12/0013). Le linee guida europee e spagnole per la cura etica e l'uso di animali da esperimento sono state applicate in tutto lo studio. Gli esperimenti sono stati eseguiti presso il Dipartimento di Medicina e Chirurgia Sperimentale dell'Ospedale Universitario Gregorio Marañón, Madrid, Spagna.
NOTA: Il modello animale scelto consisteva in maialini sani di 2-3 mesi (8-12 kg) (Sus scrofa domestica). I minipig sono il risultato di un incrocio di tre razze diverse che li rendono adatti alla ricerca biomedica. Gli animali sono linee quasi identiche e sono forniti da un allevamento specificamente autorizzato a Madrid (IMIDRA), che mantiene in purezza tre linee genetiche omozigoti. Maschi e femmine erano usati in modo intercambiabile. Gli animali sono stati alimentati con una dieta suina standard e osservati per un minimo di 2 giorni per garantire una buona salute. Il cibo, ma non l'acqua, è stato ritirato la notte prima delle procedure per ridurre il rischio di aspirazione. Un esperimento tipico richiede circa 6 ore per essere completato, inclusi 30 minuti per l'induzione dell'anestesia e la preparazione chirurgica, 60 minuti per la strumentazione, 30 minuti per il recupero, 60 minuti per l'induzione dell'emorragia e la stabilizzazione posteriore, 30 minuti per la rianimazione e 120 minuti per il follow-up.
1. Anestesia, intubazione e ventilazione meccanica
- Premedicare il suino con un'iniezione intramuscolare di ketamina (10 mg/kg) e atropina (0,02 mg/kg) nella regione laterale del collo, dietro l'orecchio o nella regione femorale posteriore.
NOTA: I farmaci anticolinergici, come l'atropina, sono utili in quanto i suini possono salivare eccessivamente sotto anestesia10. Nella nostra esperienza, questa dose di ketamina è sufficiente per ridurre lo stress e induce un'adeguata sedazione e analgesia nei suini senza effetti avversi. Tuttavia, se l'animale non è adeguatamente sedato o se la distanza tra la stabulazione e la sala operatoria è lunga, un'altra dose di ketamina (10 mg/kg) può essere somministrata in sicurezza.
ATTENZIONE: I guanti sono necessari quando si maneggiano animali. - Trasportare l'animale sedato in sala operatoria e posizionarlo su un tavolo operatorio dotato di una coperta riscaldante.
- Misurare la saturazione periferica di ossigeno (Sp02) con un sensore agganciato all'orecchio del suino e avviare il monitoraggio elettrocardiografico (ECG) continuo a tre derivazioni.
- Disinfettare la pelle con almeno 3 cicli alternati di scrub allo iodio povidone o alla clorexidina e alcool. Inserire un catetere venoso periferico (22-24 G) nella vena dell'orecchio. Disinfettare preventivamente la pelle con una soluzione antisettica.
- Indurre l'anestesia mediante un'iniezione endovenosa di fentanil (5 μg/kg), propofol (4 mg/kg) e atracurio (0,5 mg/kg). Una volta che la respirazione spontanea scompare e l'assenza di riflessi è confermata, posizionare l'animale in posizione di decubito dorsale e avviare immediatamente la ventilazione della maschera a mano con una maschera per cani con frazione di ossigeno inspirato (Fi02) impostata al 100%.
NOTA: Al fine di ridurre il rischio di consapevolezza accidentale correlata all'uso di bloccanti neuromuscolari, devono essere utilizzati agenti anestetici con efficacia nota nei suini e con dosi al limite superiore per garantire un livello adeguato di anestesia. Inoltre, monitorare continuamente i segni cardiovascolari come la frequenza cardiaca, la pressione sanguigna e la temperatura corporea e somministrare bloccanti neuromuscolari solo quando i riflessi di astinenza sono assenti (ritiro del pedale, riflessi palpebrali e tono della mascella) e il tono muscolare è rilassato. - Eseguire l'intubazione endotracheale. Per questa procedura sono necessari almeno due operatori.
- Assicurarsi che l'attrezzatura di base e gli strumenti chirurgici necessari per l'intubazione endotracheale siano pronti: garza per aprire la bocca e fissare il tubo, laringoscopio veterinario con lama diritta lunga tra 17 e 25 cm, un comune tubo endotracheale (ID 4-5), stiletto, siringa con aria e nastro adesivo.
- Estrarre leggermente la lingua e tenere la mascella aperta utilizzando una garza posizionata dietro i canini superiori e inferiori.
- Eseguire una laringoscopia e, una volta che l'epiglottide è visibile, utilizzare la punta del laringoscopio per premere l'epiglottide verso l'alto verso la base della lingua.
NOTA: Se l'epiglottide è attaccata al palato molle, può essere spostata dorsalmente con la punta del tubo. L'operatore 1 esegue il passaggio 1.6.2 mentre l'operatore 2 esegue il passaggio 1.6.3. - Una volta visualizzate le corde vocali, far avanzare delicatamente il tubo con una leggera rotazione nella trachea.
NOTA: Il punto più stretto della trachea si trova a livello sottoglottico. Se l'inserimento del tubo è difficile, provare una leggera rotazione o un tubo più piccolo. - Rimuovere lo stiletto e utilizzare una siringa da 5 ml per gonfiare il bracciale.
- Garantire il posizionamento del tubo endotracheale osservando l'innalzamento simmetrico del torace, un'adeguata saturazione di ossigeno (95%-100%) e una corretta lettura della forma d'onda e della CO2 (EtCO2) di fine espirazione.
ATTENZIONE: I suini sono molto suscettibili al laringospasmo e all'edema della mucosa della laringe e la perforazione laringea può verificarsi anche dopo diversi tentativi di intubazione o se la sedazione è inadeguata10.
- Dopo aver confermato l'intubazione, avviare la ventilazione meccanica utilizzando un ventilatore meccanico con una frequenza respiratoria di 20 respiri al minuto, un volume corrente di 8 ml/kg, FiO2 del 40% e una pressione positiva di fine espirazione di 4 cm H2O. Regolare la ventilazione per ottenere una pressione parziale di anidride carbonica (PaCO2) compresa tra 35 e 45 mmHg.
- Mantenere l'anestesia profonda per tutta la durata dell'esperimento tramite un'infusione continua di fentanil (10 μg/kg/h), propofol (10 mg/kg/h) e atracurio (2 mg/kg/h).
2. Strumentazione
- Preparare l'area femorale per il cateterismo vascolare. Usa bende per tirare indietro le gambe e disinfettare la zona inguinale con almeno 3 cicli alternati di scrub allo iodio povidone o alla clorexidina e alcol.
- Valutare i vasi femorali con un'ecografia e utilizzare la tecnica Doppler per distinguere tra l'arteria e la vena. A seconda delle dimensioni della vena, inserire un catetere venoso centrale da 5,5-7,5 French (F) con tre porte in una delle vene femorali sotto visione ecografica continua e utilizzando la tecnica Seldinger11,12.
- Subito dopo il posizionamento del catetere venoso centrale, collegare un sistema di trasduttori per misurare la pressione venosa centrale.
- Assicurarsi che un elettrolita con infusione di glucosio (20 mL/h) sia collegato a una delle porte della linea centrale e che un'infusione salina di mantenimento (5 mL/h) sia infusa attraverso la porta rimanente per evitare l'occlusione del catetere.
- Utilizzare la stessa tecnica per incannulare l'arteria femorale opposta con un catetere arterioso 4 F specificamente progettato per il monitoraggio della gittata cardiaca. Eseguire un emogasanalisi per stabilire la posizione corretta del catetere se non è possibile confermare l'ecografia.
NOTA: In caso di spasmo o ematoma significativo, passare all'arteria femorale controlaterale. - Una volta inserito il catetere arterioso, collegare il filo arterioso del sistema di monitoraggio della gittata cardiaca e il trasduttore arterioso direttamente alla porta del monitor. Collegare contemporaneamente l'unità di misura venosa del monitor al trasduttore venoso centrale.
NOTA: Il monitor della gittata cardiaca utilizzato in questo esperimento è specificato nella tabella dei materiali. Per l'impostazione, la calibrazione e le misure, vedere le istruzioni del produttore13. - Assicurarsi che sia il trasduttore venoso che quello arterioso siano calibrati a zero.
- Esporre l'arteria carotide interna sinistra e la vena giugulare esterna sinistra tramite la tecnica di taglio.
- Assicurarsi che siano disponibili l'attrezzatura e gli strumenti chirurgici necessari: bisturi, forbici chirurgiche a punta smussata, pinze per tessuti, piccolo divaricatore tissutale autobloccante, supporto per aghi, scambi chirurgici, sutura con ago, una cannula endovenosa da 18 G, una guaina per catetere 5 F con introduttore e un filo guida Seldinger.
- Con l'animale in posizione di decubito dorsale, disinfettare la pelle del collo con una soluzione antisettica.
- Utilizzare un bisturi per eseguire un'incisione paratracheale sinistra di ~10 cm, dividendo in due una linea tra il manubrio e l'angolo della mascella.
- Per esporre la vena giugulare esterna, sezionare il tessuto lateralmente al SCM e isolare la vena dalla fascia circostante.
- Dopo essere stato isolato, utilizzare due suture di seta non assorbibili (USP-0) avvolte intorno alla vena per fissare il vaso prima della puntura.
- Incidere la vena con un ago Venflon (18 G). Una volta all'interno della vena, ritrarre l'ago e inserire il filo guida attraverso il tubo Venflon.
- Rimuovere il tubo Venflon e inserire la guaina con l'introduttore (5 F) sul filo. Dopo l'inserimento, rimuovere sia l'introduttore che il filo.
- Subito dopo l'inserimento, risciacquare le guaine con NaCl allo 0,9% (5 mL/h) per prevenire la formazione di trombi.
- Legare la sutura di seta prossimale attorno alla guaina per fissarla. Dopodiché, fissare il manico della guaina all'SCM e chiudere la pelle con graffette.
- Dopo la preparazione chirurgica, lasciare stabilizzare gli animali per 30 minuti prima di ottenere i valori di monitoraggio basali e i campioni di sangue.
- Mantenere la temperatura del sangue a 37-39 °C utilizzando una coperta termica e uno scaldavivande per tutta la durata dell'esperimento.
NOTA: La temperatura viene misurata con un termistore situato sulla punta del catetere arterioso per termodiluizione.
3. Monitoraggio emodinamico e di perfusione
- Monitorare l'ECG, la saturazione periferica di ossigeno, i volumi e le pressioni respiratorie e la Fi02.
- Collegare uno spirometro tra il tubo endotracheale e un monitor multiparametrico per misurare l'EtC02 qualitativo e quantitativo.
NOTA: Per ulteriori informazioni sul monitor multiparametrico, vedere la Tabella dei materiali. - Utilizzare la spettroscopia nel vicino infrarosso (NIRS) per monitorare l'indice di ossigenazione del tessuto cerebrale (bTOI) e l'indice di ossigenazione del tessuto splancnico (aTOI). Posizionare i sensori sulla pelle della fronte e sulla parete addominale anteriore (regione sottoepatica).
NOTA: Non posizionare il sensore cerebrale sulla linea mediana, poiché potrebbe essere contaminato dal sangue venoso del seno sagittale superiore14. - Collegare la sonda del flusso sanguigno collegata all'arteria carotide interna a un monitor di flusso per misurare il flusso sanguigno carotideo (CaBF).
- Posizionare un sensore Doppler laser sulla pelle della parete addominale anteriore per la misurazione continua del flusso sanguigno tissutale cutaneo (CuTBF).
NOTA: Per ulteriori informazioni sui sensori di flusso tissulare carotideo e cutaneo, vedere la Tabella dei materiali. - Registrare i seguenti parametri al basale e ogni 30 minuti: temperatura del sangue, volume corrente inspiratorio, EtCO2, ritmo cardiaco, frequenza cardiaca (FC), pressione arteriosa sistolica e diastolica, pressione arteriosa media (MAP), indice di shock (HR/pressione arteriosa sistolica)15, pressione venosa centrale, indice cardiaco (CI), indice del volume diastolico finale globale (GEDVI), indice del volume sistolico (SVI), contrattilità ventricolare sinistra (Dt/Dpmax), indice di resistenza vascolare sistemica (SVRI), indice di acqua polmonare extravascolare (ELWI), variazione dell'impulso pressorio (PPV), saturazione dell'emoglobina periferica, saturazione venosa centrale (ScvO2), indice di ossigenazione dei tessuti cerebrale (bTOI) e splancnica (aTOI) mediante NIRS, CaBF e CuTBF.
- Per ottenere i valori di IC, infondere 5 mL di bolo di soluzione fisiologica normale allo 0,9% a una temperatura inferiore a 8 °C attraverso il catetere venoso centrale. Registrare la media di due misure consecutive.
- Determinare i profili dei gas ematici arteriosi e venosi e la concentrazione di lattato ogni 30 minuti prelevando 0,3 mL di sangue dai vasi femorali. Eseguire l'emocromo completo standard, gli studi di coagulazione e la biochimica al basale, dopo l'induzione dell'emorragia e alla fine dell'esperimento.
- Dopo ogni prelievo di sangue, lavare le linee con 0,5 ml di eparina da 100 UI/mL.
4. Induzione da shock emorragico
- Una volta raggiunto lo stato stazionario dopo la raccolta della strumentazione e dei dati basali, indurre uno shock ipovolemico prelevando 30 ml/kg di sangue dalla vena giugulare in 30 minuti.
- Attendere un periodo di 30 minuti per la stabilizzazione. Non fare sforzi di rianimazione durante questo periodo per emulare il ritardo nell'arrivo delle squadre mediche di emergenza.
5. Infusione e follow-up
- Dopo il periodo di stabilizzazione, infondere un bolo di un espansore volumetrico o di un agente vasoattivo per un periodo di 30 minuti.
NOTA: Esempi di espansori di volume e agenti vasoattivi testati sono la soluzione salina normale, l'albumina ipertonica, l'angiotensina e la terlipressina. In questo studio sono stati utilizzati 30 ml/kg di soluzione fisiologica normale (NS) (n = 13), 15 ml/kg di albumina al 5% più soluzione salina ipertonica (AHS) (n = 13) o un singolo bolo endovenoso di 15 μg/kg di terlipressina più 15 ml/kg di albumina al 5% più soluzione salina ipertonica al 3% (TAHS) (n = 13). - Dopo l'infusione, seguire l'animale per 120 min. Registrare i parametri emodinamici e prelevare campioni di sangue ogni 30 minuti per i profili emogassosi arteriosi e venosi e la determinazione della concentrazione di lattato. Non effettuare tentativi di rianimazione durante questo periodo.
6. Fine dell'esperimento ed eutanasia
- Una volta completato l'esperimento, utilizzare un sedativo da un sovradosaggio (5 μg/kg di fentanil e 10 mg/kg di propofol) e un'iniezione endovenosa di cloruro di potassio (2 mEq/kg) per sacrificare tutti gli animali rianimati con successo.
- Confermare l'assenza di circolazione per asistolia o attività elettrica senza polso su un display ECG continuo, l'assenza di flusso pulsante durante il monitoraggio invasivo della pressione arteriosa e l'assenza di altri segni vitali.
- Se, durante il periodo di follow-up, la pressione arteriosa scende al di sotto di 25 mmHg, sacrificare l'animale per evitare ulteriori sofferenze.
Risultati
Il modello presentato è stato utilizzato con successo in diversi esperimenti per studiare le alterazioni macrocircolatorie e microcircolatorie a seguito di shock emorragico e successiva rianimazione, confrontando diversi fluidi e farmaci vasoattivi16,17,18,19.
Considerando la risposta allo shock, questo modello ha costantemente dimostrato che un'emorragia controllata produce marcati cambiamenti nei parametri emodinamici, così come nella perfusione cerebrale e tissutale.
Dopo la sospensione del volume, si rileva una significativa tachicardia e una diminuzione dei parametri di MAP, CI, SVI, volume ematico (GEDVI e ITBI) e del flusso sanguigno arterioso carotideo, insieme a un aumento dell'indice di resistenza vascolare sistemica (Figura 1 e Figura 2).
Per quanto riguarda i parametri di perfusione sistemica, il lattato aumenta in modo significativo, mentre ScvO2, CuTBF e bTO diminuiscono (Figura 3). Di solito non si registrano variazioni della pressione venosa centrale, Dt/Dpmax e ELW.
Per quanto riguarda i parametri di laboratorio, il contenuto di emoglobina e l'ematocrito non diminuiscono fino a quando non sono stati somministrati i fluidi. La concentrazione di albumina diminuisce e i livelli di troponina aumentano significativamente dopo un'emorragia controllata. Altri parametri, tra cui la temperatura interna, PaO2, PaCO2, saturazione di ossigeno arterioso, EtCO2, elettroliti e parametri di funzionalità renale ed epatica, di solito rimangono stabili.
Oltre alla sua utilità nell'analisi delle risposte cardiovascolari e biochimiche allo shock, questo modello ha dimostrato di discriminare con successo tra diversi fluidi di rianimazione.
In studi precedenti, abbiamo mirato a determinare se, in un modello animale infantile di shock emorragico, l'uso di un'infusione a basso volume di fluidi ipertonici, da sola o combinata con diversi vasopressori, avrebbe migliorato i parametri emodinamici e di perfusione globali rispetto alla soluzione fisiologica normale.
Come riportato in precedenza, abbiamo costantemente osservato che l'infusione di fluidi ipertonici produce una risposta simile all'infusione del doppio del volume di liquido isotonico16,17,18.
Più specificamente, l'uso di albumina più soluzione salina ipertonica ha prodotto un'espansione di volume maggiore e più lunga rispetto alla soluzione salina normale o alla sola soluzione salina ipertonica, con differenze significative in HR, SVI e PPV, e l'assenza di una progressiva diminuzione dopo l'espansione del volume della pressione arteriosa e della GEDVI, come osservato negli altri gruppi (Figura 1 e Figura 2). Inoltre, abbiamo anche osservato un maggiore miglioramento dei parametri di perfusione con l'albumina ipertonica, rappresentato da un maggiore aumento di bTOI e CaBF, e una maggiore diminuzione dei livelli di lattato rispetto agli altri gruppi rispetto all'inizio dell'espansione del fluido (Figura 3). Riteniamo che questa differenza possa essere secondaria alla capacità dell'albumina di aumentare il volume del sangue e rimanere per un periodo di tempo più lungo all'interno del compartimento intravascolare rispetto alla normale soluzione fisiologica. È interessante notare che abbiamo visto che l'aggiunta di un singolo bolo di terlipressina all'inizio della rianimazione con liquidi ha prodotto risultati simili a quelli osservati nel gruppo albumina ipertonica, senza alcun beneficio aggiuntivo in termini di parametri emodinamici o di perfusione17,18.

Figura 1: Parametri emodinamici. (A) Evoluzione della frequenza cardiaca, (B) pressione arteriosa media, (C) indice cardiaco al basale (t0') e (D) indice di resistenza vascolare sistemica al basale (t0'). Nel corso dell'esperimento: fine dell'emorragia controllata (Shock30'); l'inizio dell'infusione, 30 min dopo la fine dell'emorragia controllata (Res0'); fine infusione (Res30'); follow-up 30 min dopo la fine dell'infusione (Obs30'); follow-up 60 min dopo la fine dell'infusione (Obs60'); follow-up 90 min dopo la fine dell'infusione (Obs90'). (*) Differenza significativa (p < 0,05) rispetto al basale, stesso gruppo. (‡) p < 0,05 da emorragia, stesso gruppo. (#) p < 0,05 dal gruppo NS. Abbreviazioni: NS = soluzione salina normale; AHS = albumina salina ipertonica; TAHS = terlipressina più albumina salina ipertonica. I dati sono presentati come media e deviazione standard. Questa figura è adattata con il permesso di Urbano et al.17. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Parametri del volume ematico. (A) Evoluzione dell'indice del volume sistolico, (B) variazione della pressione del polso e (C) indice globale del volume diastolico al basale (t0'). Nel corso dell'esperimento: fine dell'emorragia controllata (Shock30'); inizio dell'infusione, 30 min dopo la fine dell'emorragia controllata (Res0'); fine infusione (Res30'); follow-up 30 min dopo la fine dell'infusione (Obs30'); follow-up 60 min dopo la fine dell'infusione (Obs60'); follow-up 90 min dopo la fine dell'infusione (Obs90'). (*) Differenza significativa (p < 0,05) rispetto al basale, stesso gruppo. (‡) p < 0,05 da emorragia, stesso gruppo. (#) p < 0,05 dal gruppo NS. Abbreviazioni: NS = soluzione salina normale; AHS = albumina salina ipertonica; TAHS = terlipressina più albumina salina ipertonica. I dati sono presentati come media e deviazione standard. Questa figura è adattata con il permesso di Urbano et al.17. Fare clic qui per visualizzare una versione più grande di questa figura.
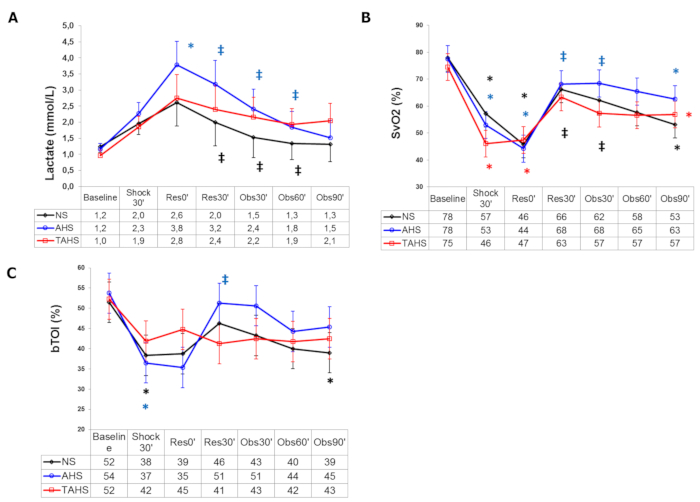
Figura 3: Parametri di perfusione sistemica. (A) Evoluzione del lattato nel sangue arterioso, (B) saturazione di ossigeno nel sangue venoso centrale e (C) indice di ossigenazione del tessuto cerebrale al basale (t0'). Nel corso dell'esperimento: fine dell'emorragia controllata (Shock30'); inizio dell'infusione, 30 min dopo la fine dell'emorragia controllata (Res0'); fine infusione (Res30'); follow-up 30 min dopo la fine dell'infusione (Obs30'); follow-up 60 min dopo la fine dell'infusione (Obs60'); follow-up 90 min dopo la fine dell'infusione (Obs90'). (*) Differenza significativa (p < 0,05) rispetto al basale, stesso gruppo. (‡) p < 0,05 da emorragia, stesso gruppo. (#) p < 0,05 dal gruppo NS. I dati sono presentati come media e deviazione standard. Questa figura è adattata con il permesso di Urbano et al.17. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
L'esecuzione di procedure su suini giovani può essere complessa e potenzialmente pericolosa per la vita a causa di alcune caratteristiche anatomiche e fisiologiche di questi animali. Per ottenere risultati costanti e ridurre la perdita di animali, ci sono alcuni passaggi critici che dovrebbero essere attentamente considerati. In primo luogo, il raggiungimento di un adeguato livello di sedazione è essenziale per ridurre al minimo la risposta allo stress dell'animale, che, se eccessiva, può alterare i risultati a causa del rilascio endogeno di catecolamine. È anche importante evitare ritardi tra l'iniezione intramuscolare e l'intubazione, poiché gli animali possono sviluppare una grave risposta allo stress con tachicardia e acidosi metabolica irreversibile che può far precipitare la fine dell'esperimento. Sebbene altri gruppi utilizzino anestetici per via inalatoria con buoni risultati20,21, noi preferiamo i farmaci per via endovenosa, in quanto i sedativi per via inalatoria non consentono la misurazione dello scambio gassoso respiratorio con calorimetria indiretta. Nella nostra esperienza, una combinazione di propofol e fentanyl è efficace e ha pochissimi effetti avversi. Un'attenta gestione della temperatura durante l'esperimento è un altro aspetto chiave del protocollo, poiché i rapidi cambiamenti di temperatura possono influenzare in modo significativo la risposta emodinamica dell'animale allo shock, falsificando i risultati o portando al fallimento dell'esperimento.
Un'altra parte cruciale della strumentazione è l'intubazione, date le particolarità dell'anatomia dei suini e la loro suscettibilità al laringospasmo. Pertanto, la procedura deve essere eseguita da almeno un operatore con esperienza pregressa ed è consigliabile l'uso di uno stiletto e del rilassamento muscolare10,22. Anche il cateterismo dei vasi sanguigni può essere impegnativo a causa delle piccole dimensioni degli animali. Per l'accesso femorale, è preferibile una puntura guidata dall'ecografia, poiché i vasi si trovano in profondità, di solito hanno diametri piccoli e mostrano percorsi e posizioni diverse22. Per l'accesso cervicale, utilizziamo l'accesso chirurgico per consentire il posizionamento della sonda di flusso carotideo, ma è fattibile anche la tecnica ecografica23,24. L'incannulamento della vena giugulare esterna è solitamente preferito a causa del suo diametro più ampio, della sua posizione superficiale e del minor numero di strutture circostanti22. I cateteri devono essere lavati immediatamente dopo l'inserimento con soluzioni saline per prevenire l'occlusione. Non usiamo l'eparina per evitare alterazioni della coagulazione. Inoltre, inizialmente, abbiamo evitato la somministrazione di infusioni di glucosio per prevenire potenziali distorsioni della risposta emodinamica dovute alla somministrazione di liquidi extra, ma abbiamo scoperto che gli animali sviluppavano ipoglicemia grave e precoce. Infine, anche con l'anestesia e le tecniche meno invasive utilizzate al giorno d'oggi, la strumentazione genera una significativa risposta allo stress negli animali, quindi è auspicabile lasciare abbastanza tempo per il recupero prima di iniziare il prelievo del sangue. Per quanto riguarda l'induzione dello shock emorragico, si consiglia la rimozione di 30 ml/kg, in quanto ciò genera una significativa risposta fisiopatologica con ottimi tassi di sopravvivenza. In base alla nostra esperienza, i suini neonati non tollerano grandi perdite di sangue e la mortalità è elevata. Anche il prelievo graduale del sangue è importante, poiché la rapida rimozione può provocare una grave instabilità emodinamica e la morte prematura dell'animale.
Sebbene ci sia un'ampia varietà di specie e modelli sperimentali a disposizione dei ricercatori, il modello ideale di shock emorragico animale - semplice, facilmente riproducibile e replica accurata della situazione clinica - rappresenta ancora una sfida. Piccoli modelli animali, principalmente topi e ratti, vengono utilizzati per studiare i meccanismi fisiopatologici dello shock. Tuttavia, le loro dimensioni ridotte complicano notevolmente l'esecuzione delle procedure chirurgiche e di campionamento. Gli animali più grandi, come cani e maiali, sono più costosi e complessi da gestire, ma le loro dimensioni e le somiglianze fisiologiche con gli esseri umani li rendono più adatti per la valutazione preclinica delle strategie di trattamento. Tuttavia, l'uso dei cani in passato e ancora oggi è eticamente discutibile. Non offrono alcun vantaggio rispetto ai maiali come modelli animali sperimentali, e la loro intelligenza e la speciale relazione bilaterale tra uomo e cane li collocano in una posizione più elevata nella scala filogenetica 6,7,8.
Alla luce di tutto ciò, i suini adulti sono stati ampiamente utilizzati per la ricerca cardiovascolare a causa delle loro somiglianze con la fisiologia, le dimensioni e l'anatomia umana adulta, che è migliore della maggior parte delle specie. Tuttavia, come è stato ben stabilito in letteratura, ci sono differenze significative tra pazienti umani adulti e pediatrici in termini di sistema cardiovascolare, volume del sangue, regolazione della temperatura e risposta allo shock 2,3,4. Allo stesso tempo, le prove mostrano che queste differenze si applicano anche ai suini e si è scoperto che i suinetti hanno profili cardiovascolari, cerebrovascolari, ematologici ed elettrolitici molto simili a quelli dei pazienti umani pediatrici 9,25. Infine, al di là di queste differenze anatomiche e fisiologiche tra adulti e neonati in entrambe le specie, l'utilizzo di modelli animali infantili, in particolare minipig, offre l'opportunità di testare gli stessi dispositivi che vengono utilizzati in ambito clinico reale per il monitoraggio. In molti casi, l'affidabilità di questi dispositivi si è dimostrata bassa a causa di un semplice adattamento degli algoritmi, dei sensori o delle scale per adulti. Tutti questi aspetti supportano l'importanza di sviluppare specifici modelli animali pediatrici e la loro rilevanza in termini di utilità traslazionale per il setting clinico pediatrico.
Oltre al tipo di animale, ci sono tre modelli di base generalmente utilizzati nello studio dello shock emorragico: emorragia controllata, sia per volume che per pressione, ed emorragia incontrollata. Il protocollo presentato in questo articolo descrive un modello di emorragia a volume fisso, in cui un volume di sangue fisso, solitamente calcolato in base alla percentuale di peso corporeo, viene rimosso in un periodo di tempo impostato dall'osservatore. Al contrario, nei modelli di emorragia a pressione fissa, gli animali vengono dissanguati in una MAP predeterminata, che viene poi mantenuta con sanguinamento periodico o infusioni di liquidi durante un periodo specificato, a seconda della specie animale e del grado o dell'esito dello shock. Sia i modelli di shock emorragico a volume fisso che quelli a pressione fissa consentono lo studio delle alterazioni fisiopatologiche indotte da shock in condizioni controllate, offrendo un chiaro vantaggio in termini di riproducibilità e standardizzazione. Tuttavia, il loro principale limite è che non consentono lo studio degli effetti delle diverse strategie di rianimazione sul sanguinamento attivo, dove è noto che la rianimazione aggressiva con fluidi prima del controllo chirurgico dell'emorragia aumenta il sanguinamento e diminuisce la sopravvivenza, a causa dell'inibizione della formazione del trombo e dell'aumento della pressione arteriosa media. I modelli di emorragia non controllata indotta da un trauma vascolare standardizzato - schiacciamento/lacerazione del fegato e della milza, lesione arteriosa o amputazione di un'appendice - sono stati suggeriti per riflettere meglio la situazione clinica, consentendo così una migliore comprensione degli effetti delle diverse strategie di rianimazione dei fluidi e di altri interventi, come l'ipotermia e i prodotti emostatici. Tuttavia, nonostante siano clinicamente più rilevanti, questi modelli di emorragia incontrollata esercitano alcuni chiari svantaggi in termini di standardizzazione e riproducibilità. Alla luce di tutto ciò, sembra che il modello ideale non esista, e quindi la ricerca in questo campo deve bilanciare la rilevanza clinica con la standardizzazione sperimentale e l'affidabilità 6,7,8,9,26.
Il modello descritto in questo studio può offrire ampie potenziali applicazioni nella ricerca cardiovascolare, come lo studio della disfunzione endoteliale e delle alterazioni del microcircolo18 durante lo shock, nonché la convalida di diversi sistemi di monitoraggio emodinamico. Inoltre, può essere utilizzato anche in altri campi di ricerca, consentendo lo studio delle risposte endocrine o immunitarie dopo una grave emorragia e la determinazione degli effetti collaterali di diversi fluidi e vasopressori. Tuttavia, per quanto riguarda la ricerca sulle diverse strategie di rianimazione, è consigliabile studiarne gli effetti in modelli di emorragia incontrollata prima di implementare cambiamenti in ambito clinico 7,26.
Oltre alla difficoltà di estrapolare i risultati alla vita reale, questo modello ha altri limiti. Per cominciare, ci sono alcune variabili confondenti legate all'impostazione sperimentale, come l'uso di agenti anestetici o la ventilazione meccanica, che possono attenuare le risposte fisiologiche durante lo shock e complicare l'interpretazione dei risultati. Inoltre, la risposta allo stress della strumentazione sugli animali e il controllo della temperatura possono influenzare la macro e microcircolazione attraverso diversi meccanismi. Un altro importante limite di questo modello, legato alle necessità sperimentali e alla disponibilità di risorse, è il limitato periodo di osservazione post-traumatica, che limita ulteriormente lo studio delle conseguenze a lungo termine dello shock emorragico. Inoltre, nonostante le somiglianze fisiologiche tra l'uomo e i maiali, ci sono alcune differenze tra le specie che dovrebbero essere considerate. Il sistema di coagulazione, ad esempio, sembra essere più efficace nei suini27,28. Inoltre, i livelli plasmatici di lattato e succinato differiscono tra le specie e i suini presentano alcalosi basale, che può portare a una sottostima degli effetti dell'emorragia sull'equilibrio acido-base29. Infine, è anche ben noto che le risposte infiammatorie e immunitarie, così come alcuni recettori vasopressori, sono diversi nei suini9. Anche le differenze specifiche degli animali devono essere considerate come fattori di influenza. Diversi studi hanno indicato differenze di genere in termini di suscettibilità allo shock, con le femmine che hanno un significativo vantaggio di sopravvivenza rispetto ai maschi 6,9. Tuttavia, negli esperimenti condotti in questo studio, utilizziamo animali della stessa fascia d'età e con un background genetico simile per ridurre al minimo la potenziale variabilità inerente alle specie.
In conclusione, questo articolo fornisce una guida pratica e passo passo per impostare un modello suino di shock emorragico pediatrico. Rispetto ad altri modelli esistenti, si tratta di un protocollo affidabile e facile da seguire con un'ampia applicabilità nella ricerca biomedica, sia per lo studio delle risposte fisiopatologiche dopo una grave emorragia, sia per la valutazione di diverse strategie di rianimazione.
Divulgazioni
Gli autori di quest'opera non hanno alcun conflitto di interessi.
Riconoscimenti
Questo studio è stato finanziato dall'Instituto de Salud Carlos III (ISCIII) attraverso il progetto "PI20/01706" e co-finanziato dall'Unione Europea. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto. Vorremmo esprimere la nostra gratitudine a tutti i nostri colleghi dell'Unità di Terapia Intensiva Pediatrica Gregorio Marañón e dell'Istituto Sperimentale Gregorio Marañón, perché senza il loro lavoro questo progetto non sarebbe stato possibile.
Materiali
| Name | Company | Catalog Number | Comments |
| ADA swabs | Albino Dias de Andrade, S.A. | 300575750400 | Non-woven swabs |
| Alaris SE | Carefusion | N/A | Volumetric infusion pump |
| Atracurium | Aspen Pharma Trading Limited. Dublin, Ireland | N/A | Muscle relaxant |
| Atropine 1 mg/mL | B. Braun | 481377/1013 | |
| Barrier adhesive aperture drape | Mölnlycke | 63621 | |
| BD emerald syringe 5 mL, 10 mL, 20 mL | Becton Dickinson S.A | https://www.bd.com/en-eu/offerings/capabilities/syringes-and-needles/injection-syringes/bd-emerald-3-piece-syringe | various options available |
| BLF21A laser doppler monitor | Transonic Systems Inc. | BLF21A | Skin blood flow monitor |
| BlueSensor NF ECG electrodes | Ambu | NF-50-A/12 | |
| Check-Flo performer introducer set 5Fr | Cook Medical | G12018 | Vascular Sheath |
| Datex ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | M1162897 | Hemodynamic monitor |
| Fentanyl 0.05 mg/mL | Kern Pharma | N/A | Anesthesia |
| GE Vivid S5 | GE Healthcare | S series | Ultrasound machine |
| Introcan Safety 18 G, 22 G, 24 G | B. Braun | Introcan series | Safety intravenous catheter |
| INVOS cerebral/somatic oximetry adult sensors | Medtronic PLC, USA | https://www.medtronic.com/covidien/en-us/products/cerebral-somatic-oximetry/invos-cerebral-somatic-oximetry-adult-sensors.html | |
| INVOS OXIMETER cerebral/somatic | Somanetics | 08-10566 | Regional oxygenation monitor |
| Ketamin 50 mg/mL | Pfizer, S.L. | 47034 | Sedation |
| Leon plus | Heinen + Löwenstein | N/A | Ventilator |
| Life scope VS | Nihon Kohden | N/A | Bedside monitor |
| Miller laryngoscope blade 12″ | Jorgensen Labs, USA | J0449F | Laryngoscope |
| Multi-lumen central venous catheterization set 7 French, 3 lumen, 30 cm | Arrow | CS-14703 | Central venous catheter |
| Nellcor WarmTouch 5300A | Covidien | Thermal blancket | |
| Nitrile gloves | Medihands | KS-ST RT021 | Single use gloves |
| Pediatric SomaSensor INVOS cerebral/somatic | Covidien | https://www.medtronic.com/covidien/en-us/products/cerebral-somatic-oximetry.html | Disposable regional oxygen saturation sensor |
| PICCO monitoring kit | Pulsion Medical Systems | PV8215 | |
| PICCO thermodilution catheter 5F/20 cm | Pulsion Medical Systems | N/A | |
| Propofol Lipoven 10 mg/mL | Fresenius Kabi, Spain | N/A | Anesthesia |
| Pulse contour cardiac output (PiCCO2) | Pulsion Medical Systems | N/A | Hemodynamic monitor |
| Rüsch flexislip | Teleflex Medical | 503700 | Endotracheal tube stylet |
| Softa swabs | B. Braun | 19579 | Alcohol pads |
| Surgical silk sutures USP 0 | Aragó, Barcelona, Spain. | 6245 | |
| TruWave pressure monitoring set | Edwards | T001767A | Pressure monitoring set |
| Ultrasound transmission gel | Ultragel Hungary 2000 Kft. | UC260 |
Riferimenti
- Disease Control and Prevention (CDC). Vital signs: Unintentional injury deaths among persons aged 0-19 years-United States, 2000-2009. MMWR. Morbidity and Mortality Weekly Report. 61, 270-276 (2012).
- Russell, R. T., et al. Pediatric traumatic hemorrhagic shock consensus conference recommendations. The Journal of Trauma and Acute Care Surgery. 94, S2-S10 (2023).
- Leonard, J. C., et al. Life-threatening bleeding in children: A prospective observational study. Critical Care Medicine. 49 (11), 1943-1954 (2021).
- Cannon, J. W. Hemorrhagic shock. The New England Journal of Medicine. 378 (4), 370-379 (2018).
- Dehmer, J. J., Adamson, W. T. Massive transfusion and blood product use in the pediatric trauma patient. Seminars in Pediatric Surgery. 19 (4), 286-291 (2010).
- Fülöp, A., Turóczi, Z., Garbaisz, D., Harsányi, L., Szijártó, A. Experimental models of hemorrhagic shock: a review. European Surgical Research. 50 (2), 57-70 (2013).
- Moochhala, S., Wu, J., Lu, J. Hemorrhagic shock: an overview of animal models. Frontiers in Bioscience. 14 (12), 4631-4639 (2009).
- Lomas-Niera, J. L., Perl, M., Chung, C. S., Ayala, A. Shock and hemorrhage: an overview of animal models. Shock. 24, 33-39 (2005).
- Hildebrand, F., Andruszkow, H., Huber-Lang, M., Pape, H. C., van Griensven, M. Combined hemorrhage/trauma models in pigs-current state and future perspectives. Shock. 40 (4), 247-273 (2013).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Leibowitz, A., Oren-Grinberg, A., Matyal, R. Ultrasound guidance for central venous access: Current evidence and clinical recommendations. Journal of Intensive Care Medicine. 35 (3), 303-321 (2020).
- Lockwood, J., Desai, N. Central venous access. British Journal of Hospital Medicine. 80 (8), C114-C119 (2019).
- Operator's Manual PiCCO2. Version 3.1. Pulsion Medical Systems Available from: https://www.manualslib.com/manual/2821743/Pulsion-Picco2.html#manual (2013)
- Acker, S. N., Ross, J. T., Partrick, D. A., Tong, S., Bensard, D. D. Pediatric specific shock index accurately identifies severely injured children. Journal of Pediatric Surgery. 50 (2), 331-334 (2015).
- Urbano, J., et al. Comparison of normal saline, hypertonic saline and hypertonic saline colloid resuscitation fluids in an infant animal model of hypovolemic shock. Resuscitation. 83 (9), 1159-1165 (2012).
- Urbano, J., et al. Comparison of normal saline, hypertonic saline albumin and terlipressin plus hypertonic saline albumin in an infant animal model of hypovolemic shock. PLoS One. 10 (3), e0121678 (2015).
- González, R., et al. Microcirculatory alterations during haemorrhagic shock and after resuscitation in a paediatric animal model. Injury. 47 (2), 335-341 (2016).
- López-Herce, J., Rupérez, M., Sánchez, C., García, C., García, E. Haemodynamic response to acute hypovolaemia, rapid blood volume expansion and adrenaline administration in an infant animal model. Resuscitation. 68 (2), 259-265 (2006).
- Gil-Anton, J., et al. Addition of terlipressin to initial volume resuscitation in a pediatric model of hemorrhagic shock improves hemodynamics and cerebral perfusion. PLoS One. 15 (7), e0235084 (2020).
- Williams, A. M., et al. Complete and partial aortic occlusion for the treatment of hemorrhagic shock in swine. Journal of Visualized Experiments. (138), e58284 (2018).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment, and heart disease research. Lab Animal. 51 (2), 46-67 (2022).
- Chiesa, O. A., et al. Minimally invasive ultrasound-guided technique for central venous catheterization via the external jugular vein in pigs. American Journal of Veterinary Research. 82 (9), 760-769 (2021).
- Anderson, J. H., et al. Ultrasound guided percutaneous common carotid artery access in piglets for intracoronary stem cell infusion. Laboratory Animals. 52 (1), 88-92 (2018).
- Hughes, H. C. Swine in cardiovascular research. Laboratory Animal Science. 36 (4), 348-350 (1986).
- Mayer, A. R., et al. A systematic review of large animal models of combined traumatic brain injury and hemorrhagic shock. Neuroscience and Biobehavioral Reviews. 104, 160-177 (2019).
- Velik-Salchner, C., et al. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thrombosis Research. 117 (5), 597-602 (2006).
- Siller-Matula, J. M., Plasenzotti, R., Spiel, A., Quehenberger, P., Jilma, B. Interspecies differences in coagulation profile. Thrombosis and Haemostasis. 100 (3), 397-404 (2008).
- Reisz, J. A., et al. All animals are equal but some animals are more equal than others: Plasma lactate and succinate in hemorrhagic shock-A comparison in rodents, swine, nonhuman primates, and injured patients. The Journal of Trauma and Acute Care Surgery. 84 (3), 537-541 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon